铜的电解精炼 电镀
- 格式:ppt
- 大小:124.50 KB
- 文档页数:12



电镀铜原理
电镀铜原理是利用电化学原理,在铜质基材上通过电解方法沉积一层薄而均匀的铜层。
具体的步骤如下:
1. 准备工作:准备一块纯铜质的阳极和需要镀铜的物体作为阴极。
将两者分别连接到正负极,放置在含有铜离子的电解液中。
2. 铜离子在电解液中:电解液通常是含有铜盐的溶液,如铜硫酸或铜氯化物。
当电流通过电解液时,铜盐分解成铜离子和阴离子。
3. 阴极反应:阴极上的铜离子通过电化学还原反应被还原成纯铜,并沉积在阴极表面。
反应方程式为:Cu2+ + 2e- → Cu。
4. 阳极反应:阳极上同时发生氧化反应,阴离子被氧化成气体(如氧或氯气)。
反应方程式为:2Cl- - 2e- → Cl2 + 2e-。
5. 镀铜过程:经过一定时间的运行,阴极表面积累的铜层逐渐增厚,直到达到所需的厚度。
如果需要更厚的铜层,可以延长电解时间。
6. 电流密度控制:在电镀过程中,控制电流密度非常重要。
适当的电流密度可以确保铜层的均匀和牢固性。
过高的电流密度可能导致铜层不均匀,过低的电流密度可能导致铜层松散容易脱落。
通过以上步骤,就可以在物体表面成功实现电镀铜,使其具备铜的外观和性质。


高二化学选修4 电解原理的应用---电解精炼铜、电镀【学习目标】学会运用电解的原理分析铜的电解精炼;通过学习电镀的内容,了解具有一定特殊性的、另一种电解原理的应用方法,并进一步体会电解对人类社会的重要贡献。
【重点难点】铜的电解精炼和电镀的原理【教学过程】复习: 离子放电顺序;写出用惰性电极电解下列溶液的电极反应式:CuCl2 H2SO4 CuSO42、铜的电解精炼:(粗铜中含Fe、Zn、Ni、Ag、Pt、Au等少量杂质金属)下图为电解法精炼铜的装置,其中阳极为,阴极为,电解质溶液为。
(并标在图上)阳极发生的主要反应为:(杂质Fe、Zn、Ni也发生电极反应:由于Pt、Ag、Au 的金属性比Cu弱且量又少,这三种金属不反应,以单质的形式沉积在底部,得到阳极泥)。
阴极的反应为。
分析电解精炼过程中电解质溶液的变化。
总结:电解精炼装置的构成。
3、电镀【活动·探究】根据电解原理和铜的精炼的操作,利用如下材料:铁制品、铜片、CuSO4溶液、导线、直流电源,试设计一个实验,在铁钉表面镀上一层铜。
思路:铜的精炼中,粗铜为阳极,Cu失电子变成Cu2+,溶液中的Cu2+在阴极得电子,生成Cu单质,即在阴极上析出了铜。
故要在铁制品表面镀铜,可让做阳极,为阴极,溶液为电解质溶液。
画出电镀铜的实验装置图,指出电极和电解质溶液:预测实验现象:写出电极反应式:阳极:阴极:总结: (1)电镀:。
(2)电镀池的构成:。
【小结】电解池、电解精炼池、电镀池的比较【反馈练习】1.下列叙述中不正确的是()A.电解池的阳极上发生氧化反应,阴极上发生还原反应B.不能自发进行的氧化还原反应可通过电解的原理实现C.电镀时,电镀池里的阳极材料发生氧化反应D.电解饱和食盐水时,阳极得到氢氧化钠溶液和氢气2.金属镍有广泛的用途。
粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍,下列叙述正确的是(已知:氧化性Fe2+<Ni2+<Cu2+) ( ) A.阳极发生还原反应,其电极反应式:Ni2++2e-→NiB.电解过程中,阳极质量的减少与阴极质量的增加相等C.电解后,溶液中存在的金属阳离子只有Fe2+和Zn2+D.电解后,电解槽底部的阳极泥中只有Cu和Pt3、下列关于铜电极的叙述正确的是A、铜锌原电池中铜是负极B、用电解法精炼铜时纯铜作阳极C、在镀件上电镀铜时可用金属铜作阳极D、电解稀硫酸制H2、O2时铜作阳极4、将分别盛有熔融的氯化钾、氯化镁、氧化铝的三个电解槽串联 , 在一定条件下通电一段时间后,析出钾、镁、铝的物质的量之比为( )A、1∶2∶3B、3∶2∶1C、6∶3∶1D、6∶3∶25.电解原理在化学工业中有广泛应用。

电镀铜化学实验报告实验目的:通过电解方法制备出铜电镀,并研究电流强度对电镀质量的影响。
实验原理:电镀是利用电解的原理将金属离子还原成金属沉积在电极表面的过程。
在电镀实验中,我们将铜离子溶液作为电解液,利用电解槽中的电流,在阴极上沉积出金属铜。
实验步骤:1. 准备工作:将电解槽、电极、铜离子溶液以及电源连接线等仪器材料准备齐全。
2. 实验装置搭建:将电解槽中铜离子溶液倒入,将阳极和阴极分别置于电解槽中,确保两极不接触。
3. 调节电流强度:打开电源,通过调节电源的电流强度控制旋钮,调整电流强度为1A。
4. 开始电镀:将阴极放入电解槽中,保证铜离子溶液覆盖阴极表面,打开电源,开始电镀。
5. 观察电镀过程:在电镀过程中,观察阴极表面的变化,譬如开始会有一层淡黄色沉淀逐渐变为红铜色。
6. 调节电流强度:重复以上步骤,分别调节电流强度为2A和3A,进行电镀,观察阴极表面的变化。
实验结果:在1A电流强度下电镀,电镀时间为30分钟,阴极表面形成了一层均匀的红铜沉淀。
电镀质量较好。
在2A电流强度下电镀,电镀时间为30分钟,阴极表面形成了一层红铜沉淀,但表面不均匀,有一些凸起和凹陷。
在3A电流强度下电镀,电镀时间为30分钟,阴极表面形成了一层厚厚的红铜沉淀,但表面非常不均匀,有较多的凹陷和坑洞。
实验分析:通过上述实验结果可以看出,电流强度对电镀质量有影响。
在1A电流强度下,电镀质量较好,铜沉淀均匀。
随着电流强度的增加,电镀质量变差,表面变得不均匀,出现凸起和凹陷。
这是因为较低的电流强度有利于离子的均匀分布和沉积,而较高的电流强度则促进了不均匀的沉积。
此外,较高的电流强度会导致阴极温度升高,使电镀质量更加不稳定。
结论:通过本次实验,我们成功制备了铜电镀,并发现电流强度对电镀质量有明显的影响。
较低的电流强度有利于获得均匀的电镀层,而较高的电流强度会使电镀质量变差。
因此,在实际应用中,需要根据所需电镀质量的要求来选择适当的电流强度。
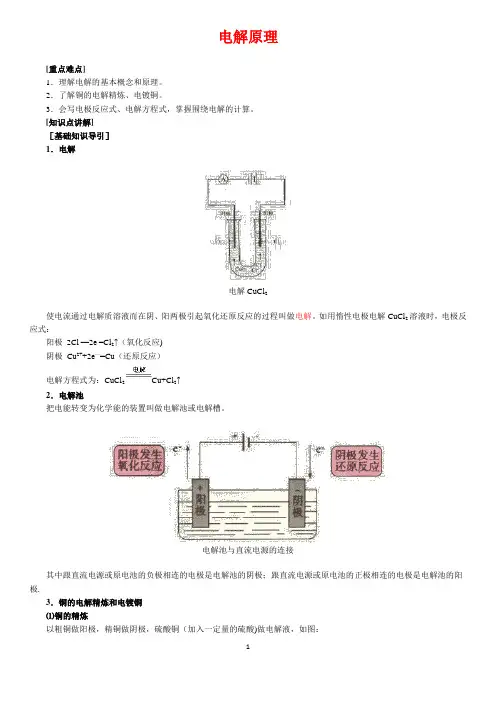
电解原理[重点难点]1.理解电解的基本概念和原理。
2.了解铜的电解精炼、电镀铜。
3.会写电极反应式、电解方程式,掌握围绕电解的计算。
[知识点讲解][基础知识导引]1.电解电解CuCl2使电流通过电解质溶液而在阴、阳两极引起氧化还原反应的过程叫做电解。
如用惰性电极电解CuCl2溶液时,电极反应式:阳极2Cl-—2e-=Cl2↑(氧化反应)阴极Cu2++2e—=Cu(还原反应)电解方程式为:CuCl2Cu+Cl2↑2.电解池把电能转变为化学能的装置叫做电解池或电解槽。
电解池与直流电源的连接其中跟直流电源或原电池的负极相连的电极是电解池的阴极;跟直流电源或原电池的正极相连的电极是电解池的阳极.3.铜的电解精炼和电镀铜⑴铜的精炼以粗铜做阳极,精铜做阴极,硫酸铜(加入一定量的硫酸)做电解液,如图:电解精炼铜原理两极反应式如下:阳极Cu-2e-=Cu2+阴极Cu2++2e—=Cu⑵电镀铜电镀铜和精炼铜的原理是一致的,但阴、阳两极材料略有差别:①精炼铜时,粗铜板作阳极,纯铜片作阴极,用CuSO4溶液(加入一定量的硫酸)作电解液.②电镀铜时,镀层金属(铜片)作阳极,待镀件(铁片)作阴极,用含有镀层金属离子的电解质(CuSO4)配成电镀液。
镀铜[重点难点点拨]一、电解原理1.电解质溶液的导电我们知道,金属导电时,是金属内部的自由电子发生的定向移动,而电解质溶液的导电与金属导电不同.通电前电解质溶液中阴、阳离子在溶液中自由地移动;通电后在电场的作用下,这些自由移动的离子改作定向移动,带负电荷的阴离子由于静电作用向阳极移动,带正电荷的阳离子则向阴极移动,并在两极上发生氧化还原反应。
我们把:借助于电流引起氧化还原反应的装置,也就是把电能转化为化学能的装置叫电解池。
电解池中与直流电源负极相连的电极叫阴极,与直流电源正极相连的电极叫阳极。
物质能否导电是由其内部能否形成定向移动的自由电荷所决定的,对金属就是自由电子,而对电解质溶液就是自由移动的阴阳离子。




第二节电能转化为化学能——电解编撰人:陈修峰审核人:董玉红孙宝玲第3课时铜的电解精炼,铝的冶炼,电镀【教学目标】1.能运用电解的原理分析铜的电解精练。
2.通过学习电镀的内容,使学生了解具有一定特殊性的,另一种电解原理的应用方法,并进一步体会电解对人类社会的重要贡献。
【复习回顾】1、电解池中电子的流向:2、阴阳极上离子的放电顺序:【新知预习】【问题二】铜的电解精炼①粗铜中含有的杂质是②工业上要对粗铜进行电解精炼的原因是③电解法制精铜时,以做阴极,做阳极,做电解液,电极反应式为:阴极:,阳极:。
作为杂质的较活泼金属氧化后的阳离子留在电解液中,比铜不活泼的金属杂质,则沉积在阳极底部,形成泥。
其主要成分是。
【例2】火法炼铜得到的粗铜中含有多种杂质(如锌、金和银等),其性能远不能达到电气工业的要求,工业上常使用电解精炼法将粗铜提纯。
在电解精炼时( )A.精炼时粗铜接电源负极B.精炼时粗铜做阳极C.杂质都将以单质形式沉积到池底D.纯铜片增重2.56g,电路中通过电子的物质的量为0.08 mol【学导结合】【问题三】电镀:①电镀是的过程②电镀的主要目的是③电镀的一般规律:阴极材料为,阳极材料为电镀液为的溶液【例3】.在铁制品上镀上一定厚度的锌层,以下设计方案正确的是A. 锌作阳极,镀件作阴极,溶液含有锌离子B.铂作阴极,镀件作阳极,溶液含有锌离子C. 铁作阳极,镀件作阴极,溶液含有亚铁离子D锌用阴极,镀件作阳极,溶液含有锌离子【例4】活泼金属的冶炼:当电解熔化状态的活泼金属的氧化物、碱和盐时,在阴极得到活泼的金属。
故用于活泼金属的冶炼。
如:①以石墨作电极,电解熔化的氧化铝,可制得铝。
阳极 阴极____________ 总式_____________________②若用石墨作阳极,铁作阴极,电解熔融的NaCI ,可制金属钠。
阳极 阴极 总式:_______________③若用石墨作电极,电解熔融的氯化镁,可制得金属镁。
电解铜设备组成原理及应用电解铜设备是指用于铜电解的设备,主要用于铜的电解精炼和电镀。
电解精炼是利用电解技术将铜阳极电解溶解成离子态,然后通过电流和电解液中的离子发生反应,使铜离子还原成铜金属沉积于阴极上,从而获得纯净的铜金属。
电镀是通过电解沉积将铜金属镀在其他材料表面,以提高材料表面的装饰性、耐腐蚀性和导电性。
电解铜设备主要由以下几部分组成:1. 电解槽:电解槽是进行铜电解的主要设备,一般为长方形或圆筒形的容器,内部分为阴阳极区域。
阳极区域放置铜阳极,阴极区域则放置阴极板,溶液通过液路系统循环进入电解槽,实现电解过程。
2. 电源设备:电源设备是为电解提供直流电流的装置。
电源设备通过对电解槽中的阳极和阴极施加电压和电流,并控制电解过程的参数,如电流强度、电解时间等。
3. 电解液配制系统:电解液是电解铜过程中的重要组成部分,一般是由含铜盐的溶液和辅助剂组成。
电解液配制系统包括电解液的供给、循环、过滤和调整等装置,以保证电解液的质量和稳定性。
4. 温控系统:电解过程中需要保持一定的温度,以控制反应速率和产品质量。
温控系统可以通过控制加热或制冷装置来维持电解液的温度。
5. 控制系统:控制系统用于监测和控制电解过程的各项参数,如温度、电流、电压等。
它可以自动调整动力设备和配电设备,实现电解过程的稳定运行。
电解铜设备的应用主要有以下几个方面:1. 铜电解精炼:电解铜设备在铜精炼工业中得到广泛应用。
通过电解铜设备可以将含杂质的铜阳极溶解成离子态,然后通过电解过程将铜离子还原成纯铜金属。
这种方法可以获得高纯度的铜金属,用于制造电线、电缆、电子元件等领域。
2. 铜电镀:电解铜设备在金属镀膜工业中也有重要应用。
通过电解铜设备可以在其他材料表面上镀一层铜金属,从而提高材料的导电性、耐腐蚀性和装饰性。
铜电镀广泛应用于汽车、家具、电器等领域。
3. 电力设备:电解铜设备在电力设备制造中也有应用。
铜作为优良导电材料,广泛应用于变压器、电机、继电器等电力设备中。
电解精炼铜及电镀教学设计教学主题电解精炼铜及电镀一、教材分析本节教学设计是山东省科学技术出版社出版《化学反应原理》第一章第二节第三课时。
在前两节课学习电解原理和电解饱和食盐水制备氢气、氯气和烧碱的基础上,继续学习活性电极作阳极的电解体系----电解法精炼铜和电镀。
而这种电解体系具有另外的应用价值,使学生进一步体会化学的独特魅力,激发学生对化学更大的学习和研究兴趣。
同时,希望学生在此基础上能够举一反三,理解并设计出更多的应用方法,深刻体会电能转化为化学能的实际意义,牢固树立理论联系实际的学风。
教材知识体系(如图所示)二、学生分析1.学生认知起点及障碍点学生通过前面学习已经知道化学反应过程中能量的转化。
能量的形式有热能、电能、光能等多种。
本节内容前两节课学习电解原理和电解饱和食盐水制备氢气、氯气和烧碱,学生对电解知识和电化学的研究方法和特点有了一定的了解,具备了相应的知识及方法储备,但本课时的教学在内容上,一是换成了活性电极作阳极的电解体系,电极反应原理发生了变化,二是精炼铜和电镀的产品和生活联系紧密,可学生对其原理和生产过程并不熟悉。
2.学生思维发展点首先,可以发展对电解原理的认识,从惰性电极体系到活性电极,对电解原理的认识更加深刻。
其次,可以更深层次的加深对氧化还原反应的认识和理解,借助电解原理原来许多无法完成的化学反应能够实现。
最后,还可以使学生认识到要学会用发展的眼光看问题。
三、教学目标实验设计电镀的化学原理在哪里?请同学们根据面前的实验器材设计实验。
实验方案设计:方案一:方案二:独立思考,小组内交流,并总结出简单易行的实验方案实验探究指导学生分组、分实验方案进行实验探究。
选择至少一个实验方案分组合作完成实验,并填写左侧所示的实验报告表。
使用平板电脑或手机拍摄实验现象并展示交流研讨对学生选择的实验方案、现象和结论进行及时点评、总结。
分组汇报实验方案、现象并总结电镀原理。
板书1.电镀原理①阳极:镀层金属或惰性电极阴极:镀件(即待镀制品)②电镀液:含有镀层金属阳离子的溶液③电极反应(以铁上镀铜为例)阳极:Cu- 2e‾ = Cu2+或 4OH‾ -4e‾ = 2H2O + O2↑阴极:Cu2+ + 2e‾ = Cu交流研讨【投影】1.电镀时,阳极质量的减小与阴极质量的增加是否相等?2. 电镀时,电镀液中的镀层金属离子浓度如何变化?独立思考,小组内交流,并分小组汇报结论:1.若用镀层金属做阳极,阳极质量的减小与阴极质量的增加相等,电镀液中的镀层金属离子浓度不变。
电镀铜和电解精炼铜溶液中铜离子浓度1. 铜的魅力:一触即发铜,这种闪闪发光的金属,简直是个大明星!我们生活中处处可见它的身影,从电线到管道,甚至反映在我们日常用品上。
你知道吗?它可不止是看起来好看,它的电导性和耐腐蚀性可是没得说的,各种行业都离不开它。
说到铜,大家可能会联想到电镀和电解精炼,这俩家伙究竟有什么区别呢?今天就让我们一起拆开这两种工艺,看看它们在铜离子浓度上的差别。
2. 电镀铜,镀吧镀吧2.1 电镀的原理说到电镀,首先得明白它是个怎样的过程。
简单来说,电镀就是用电流把金属离子沉积到一个表面。
想象一下,就像在给金属宝宝“洗澡”,让它变得更亮更酷炫!电镀铜的过程其实不复杂,只需要将铜离子放在电解液中,然后施加电流。
于是,铜离子就像听了号召一样,赶紧跑向目标表面,咕噜咕噜地附着上去,形成一层薄薄的铜膜。
这可不单单是为了让表面好看,电镀还能增加金属的耐蚀性,提高 conductivity,真是一举两得,伐开心吗?2.2 铜离子的浓度之道不过,话说回来,电镀的铜离子浓度也得掌握得当。
太少了,好歹是要镀不成;太多了,反倒容易搞得表面不光滑。
大家知道吗?在电镀铜的过程中,铜离子的浓度一般会维持在1020克每升。
这个浓度就像酿酒的配方,太多太少都不行,得掌握好火候,才能酿出美酒。
想象一下,太稀的酒喝了就像是喝水,太浓的则可能让你头晕目眩,一口难以下咽。
3. 电解精炼铜:一场与杂质的斗争3.1 精炼的意义说完了电镀,我们再来聊聊电解精炼铜。
这玩意儿听上去就带劲,实则是一场与杂质的斗争。
电解精炼就是将粗铜放在电解槽中,用电流把它转化成更纯净的铜。
就像是在为大象进行整容手术一样,去掉多余的杂质,唉,谁让铜的纯度直接影响它的性能呢!经过这个过程,铜的纯度可以提高到99.99%,简直牛得不要不要的!3.2 铜离子浓度的变化不过,电解精炼中的铜离子浓度和电镀可有很大的区别哦。
在电解槽中,铜离子的浓度通常较高,可以达到30克每升甚至更多。
电镀铜与精炼铜的比较下列关于电解精炼铜与电镀的说法正确的是A.电解精炼铜时,将电能转化为化学能,电路中每通过2 mol e−,阳极就会溶解64 g铜B.电解精炼铜时,阳极为粗铜,阴极为精铜,电解过程中电解质溶液不需要更换C.在铁制器皿上镀铝,熔融氧化铝作电解质,铁制器皿作阴极,铝棒作阳极D.电镀过程中电镀液需要不断更换【参考答案】C【试题解析】电解精炼铜时,阳极为粗铜,比铜活泼的金属也会反应,电路中每通过2 mol e−,阳极溶解的铜的质量小于64 g,A项错误。
电解精炼铜时,比铜活泼的金属在阳极也会失去电子,而阴极上铜离子得到电子转化为铜单质,溶液中的铜离子浓度减小,因此在电解精炼过程中,需要更换电解质溶液,B项错误。
在铁制器皿上镀铝,不能用含有铝离子的溶液充当电解质溶液,这样氢离子先得到电子,不能达到镀铝的目的,应用熔融氧化铝作电解质,铁制器皿作阴极,铝棒作阳极,C项正确。
电镀过程的实质是在电能的作用下,将阳极上的金属转移到阴极上,因此电镀液不需要更换,D项错误。
电镀铜与精炼铜的比较电镀铜精炼铜能量转变电能转化为化学能电能转化为化学能阳极材料纯铜粗铜(含锌、银、金等杂质)阴极材料镀件纯铜阳极反应Cu−2e−===Cu2+Zn−2e−===Zn2+Cu−2e−===Cu2+等阴极反应Cu2++2e−===Cu Cu2++2e−===Cu电解质溶液及其变化硫酸铜溶液保持不变反应后硫酸铜溶液中混有Zn2+等,Cu2+浓度减小1.(2019秋·河北省大名县第一中学2019−2020学年高二月考)下列实验装置符合实验目的的是目的粗铜的精炼验证溶液(含酚酞)的产物装置选项 A B目的在铁制品上镀铜构成原电池装置选项 C D2.(2019·吉林省汪清县第六中学高二上学期期末)下列各项关于铜电极的叙述正确的是A.铜锌原电池中铜是负极B.用电解法精炼粗铜时粗铜作阴极C.在镀件上镀铜时可用金属铜作阳极D.电解稀硫酸制H2、O2时铜作阳极3.电解原理在化学工业中有广泛的应用。
第1篇一、引言电镀作为一种表面处理技术,广泛应用于金属材料的表面处理领域。
铜电镀工艺作为电镀技术的重要组成部分,具有广泛的应用前景。
本文将详细介绍铜电镀工艺的基本原理、工艺流程、影响因素及应用领域。
二、基本原理铜电镀工艺是利用电解原理,在金属工件表面沉积一层铜的过程。
在电镀过程中,阳极(铜棒)溶解,铜离子迁移至阴极(工件)表面,并在工件表面还原沉积,形成均匀、致密的铜层。
电镀原理可用以下公式表示:阳极:Cu → Cu2+ + 2e-阴极:Cu2+ + 2e- → Cu三、工艺流程1. 工件预处理工件预处理是电镀工艺的第一步,主要包括清洗、除油、除锈、活化等步骤。
(1)清洗:去除工件表面的灰尘、油污等杂质,保证电镀质量。
(2)除油:采用有机溶剂或碱性溶液去除工件表面的油脂。
(3)除锈:使用酸液去除工件表面的氧化皮、锈蚀等。
(4)活化:在酸性溶液中,使工件表面形成一层活性膜,有利于铜离子的吸附。
2. 电镀液配制根据工件材料和电镀要求,选择合适的电镀液。
常用的铜电镀液有硫酸铜-硫酸溶液、硫酸铜-硫酸-酒石酸钾钠溶液等。
3. 电镀过程将工件放入电镀槽中,接通电源,调整电流密度、温度、时间等参数,使工件表面沉积一层均匀、致密的铜层。
4. 镀层后处理(1)清洗:去除工件表面的电镀液残留物。
(2)钝化:在酸性溶液中,使镀层表面形成一层钝化膜,提高镀层的耐腐蚀性。
(3)干燥:将工件置于干燥箱中,去除镀层表面的水分。
四、影响因素1. 电流密度:电流密度过高,镀层粗糙、不均匀;电流密度过低,镀层薄,耐腐蚀性差。
2. 温度:温度过高,镀层易产生针孔、气泡;温度过低,镀层沉积速度慢,易产生灰暗色。
3. 搅拌:搅拌速度过快,镀层易产生针孔、气泡;搅拌速度过慢,镀层易产生灰暗色。
4. 电镀液成分:电镀液成分比例不合适,镀层质量差。
五、应用领域1. 电子产品:如电子元器件、接插件、印刷电路板等。
2. 汽车零部件:如汽车发动机、变速箱、制动系统等。