电解电镀的电流效率指标
- 格式:doc
- 大小:31.50 KB
- 文档页数:3


电镀基本计算(附录三)1.0 法拉第定律法拉第定律又叫电解定律,是电镀过程遵循的基本定律。
法拉第(Michael Faraday l791-1867)是英国著名的自学成才的科学家,他发现的电解定律至今仍然指导着电沉积技术,是电化学中最基本的定律,从事电镀专业的工作者,都应该熟知这一著名的定律。
它又分为两个子定律,即法拉第第一定律和法拉第第二定律。
(1)法拉第第一定律法拉第的研究表明,在电解过程中,阴极上还原物质析出的量与所通过的电流强度和通电时间成正比。
当我们讨论的是金属的电沉积时,用公式可以表示为:M=KQ=KIt式中M一析出金属的质量;K—比例常数;Q—通过的电量;I—电流强度;t—通电时间。
法拉第第一定律描述的是电能转化为化学能的定性的关系,进一步的研究表明,这种转化有着严格的定量关系,这就是法拉第第二定律所要表述的内容。
(2)法拉第第二定律电解过程中,通过的电量相同,所析出或溶解出的不同物质的物质的量相同。
也可以表述为:电解lmol的物质,所需用的电量都是l个“法拉第”(F),等于96500庫仑,或者26.8 A•h。
1F=26.8A•h=96500庫仑结合第一定律也可以说用相同的电量通过不同的电解质溶液时,在电极上析出(或溶解)的物质与它们的物质的量成正比。
由于现在标准用语中推荐使用摩尔数,也可以用摩尔数来描述这些定理。
所谓摩尔是表示物质的量的单位,每摩尔物质含有阿伏伽德罗常数个微粒。
摩尔简称摩,符号mol。
由于每mol的任何物质所含的原子的数量是一个常数,即6.023 ×1023,这个数被叫作阿伏伽德罗常数。
说明:上面的代号是定律的表达,我推荐的计算用代号见下述。
2.0 电化学常数(C):电化学常数(C)与电镀的电材质有关。
材质名称C--- (G/I-t)式中:G---电镀镀上基体上的量(g)I--电镀使用用电流(A)t---电镀使用时间(h)铜(Cu) 1.186 (二价铜)锌(Zn) 1.2196锡(Sn) 2.214铜(Cu) 2.271 (一价铜)对於合金的电化学常数(C)要按它的组分来计算,下面对黄铜合金示例:例:67.5﹪合金黄铜的电化学常数(C)计算公式:C(Cu-Zn)=1/(Cu﹪/C-Cu -Zn﹪/C-Zn)C(Cu-Zn)=1/(0.675/2.371-0.325/1.2196)=1.8143 g/A-h(克/安培-小时)3.0 钢丝线密度(g):计算公式:g=6.16d²(见结构计算)4.0 镀层重量:命名:δ---镀层厚度(μ) μ=微米d---钢丝直径(mm)W---单位镀层重量(g/Kg)公式:δ=kdwk---镀层材质常数k的计算式为k=γ-s/4γ-cγ-s----基体材料比重γ-c----镀层材料比重下列常数中基体材料为轧制钢,比重采用7.85。


电解铝电流效率1. 介绍电解铝是一种常用的金属生产工艺,可用于生产铝及其合金。
其基本原理是将铝矾土经过电解反应转化为纯铝。
电解铝的电流效率是评估电解过程质量的重要指标。
本文将详细介绍电解铝的电流效率,包括定义、影响因素、提高方法等。
2. 电流效率的定义电解铝的电流效率指的是电解过程中,实际产出的纯铝质量与理论计算的纯铝质量之间的比值。
理论计算的纯铝质量是根据电流、反应时间和铝的电化学当量计算得出的。
电流效率的计算公式如下:电流效率 = (实际产出的纯铝质量 / 理论计算的纯铝质量) × 100%电流效率的数值通常在80%至95%之间,高效率的电解过程意味着更经济高效的铝生产。
3. 影响因素电解铝的电流效率受到多种因素的影响,下面将介绍几个主要的影响因素:3.1 电解质的纯度电解质的纯度对电流效率有显著影响。
电解质中的杂质会导致副反应的产生,从而降低电流效率。
为了提高电解质的纯度,需要加强原料的净化工作,确保电解质中各种杂质的含量达到规定标准。
3.2 电流密度电流密度是指单位面积上的电流量。
电流密度过高会导致电解液中铝离子的浓度降低,从而影响电流效率。
虽然提高电流密度可以增加铝的产量,但过高的电流密度会增加能量消耗和设备磨损,同时增加副反应的可能性。
因此,合理选择电流密度很重要。
3.3 温度温度对电流效率也有一定影响。
一般情况下,提高温度可以提高电解液的电导率,促进电解反应的进行。
但过高的温度会增加电解液的蒸发量和能量消耗,同时也会增加设备的磨损。
因此,需要在合适的温度范围内控制电解过程。
4. 提高电流效率的方法为了提高电解铝的电流效率,可以采取以下方法:4.1 优化电解质配方通过优化电解质的配方,可以减少其中的杂质含量,降低副反应的可能性,提高电流效率。
可以通过改变电解质中的添加剂比例、调整电解质的pH值等方式实现。
4.2 控制电流密度合理选择和控制电流密度,可以使铝离子在电解液中的浓度保持在一个适宜的范围内,提高电流效率。

电镀镍的电流效率
在单位时间、单位面积内电镀镍,电流密度是6A/dm2,当镀速在2丝/时和3.5丝/时的电流效率各为多少?电流密度6A/dm2时,不可能有在2丝/时和3.5丝/时的电镀速度。
电镀镀层厚度的计算方法
1.铜层厚的计算方法镀层厚度微米=电流密度(ASD)X电镀时间(分钟)X0.217
2.镍层厚度的计算方法镀层厚度微米=电流密度(ASD)X电镀时间(分钟)X0.196
3.锡层的计算方法镀层厚度微米=电流密度(ASD)X电镀时间(分钟)X0.491
请问一下滚镀镍镀层发黑,而且低电位不亮,发雾,我是新手不知道是什么是原因,请各位师傅指点一下,谢谢
滚镀镍镀层发黑,请逐步排除以下原因:
1、用电解方法或出杂剂去除槽液中铜、锌、铁等杂质。
2、可能是镀层灼烧,减小电流密度。
3、排除有机杂质污染的可能。
以上问题排除后,少量添加提高走位能力的光剂试试看低区。

文章编号:1001-3849(2008)05-0027-03电镀液的电流效率及其测定方法¹覃奇贤,刘淑兰(天津大学化工学院,天津300072)摘要:电流效率特别是阴极电流效率是电镀液的重要性能之一。
本文介绍了法拉弟定律、电化当量及电流效率的基本概念;电流效率的测定方法;电量计的种类以及电流效率在选择最佳电镀工艺、确定阴极和阳极面积比等方面的应用。
关键词:法拉弟定律;电化当量;电流效率;电量计中图分类号:TQ153文献标识码:BCurrent Efficiencies of Electroplating Bath andMeasurement Method ThereofQIN Q-i x ian,LIU Shu-lan引言研制一种新的电镀工艺并将其应用于生产时,除了给出电镀液的组成及工艺条件外,还需要测定镀层性能及镀液性能,镀液性能如电导率、电流效率、分散能力和深镀能力等,其中阴极电流效率的数值能反映劳动生产率的高低以及电能的消耗情况。
这里应该特别强调的是,不能将电流效率与电镀生产效率相混淆,电流效率是电镀液的性能,它与设备等情况无关。
以下就电镀液电流效率测定的理论依据、电流效率的测定方法包括电量计的使用、测量步骤及计算等做些简单的介绍。
最后介绍一下电流效率的测定在电镀生产中的重要性。
1法拉弟定律111法拉弟定律的导出当外电流通过电镀槽时,自外电路流入阴极的电子将全部参加阴极反应,同时在阳极与电镀液界面又将发生失电子的氧化反应,将与阴极消耗的相同数量的电子输送到外线路,即电流通过阴极与电镀液界面以及阳极与电镀液界面时,发生了电子的消耗和产生的问题,也就是说电流通过电极与溶液界面时发生了得失电子的电化学反应,通过大量实验总结出:参加电化学反应的反应物及形成产物的质量与电极上通过的电量间,存在一定的关系,可以用法拉弟定律来描述。
大量实践证明,当电流通过镀槽时,电极上形成产物的量(或反应物的消耗量)与通过的电流和通电时间成正比,以下式表示m=k I t(1)因为Q=I t所以m=k Q(2)式中:m为电极上形成产物的质量,g;I为电极上通过的电流,A;t为通电时间,h;Q为电极上通过的电量,C或A#h;k为常数,g/h或g/C。
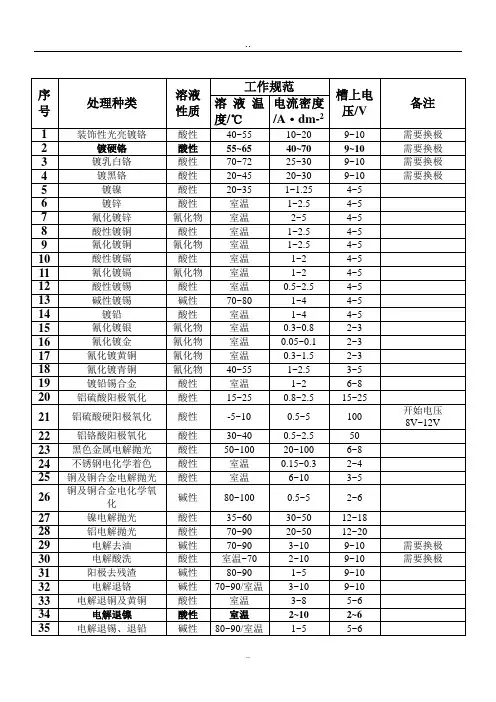

镀锌电解电流电压
镀锌电解是一种常见的电化学过程,其中,待镀件作为阴极,镀覆金属制成阳极,两极分别与直流电源的正极和负极联接。
镀锌液由含有镀覆金属的化合物、导电的盐类、缓冲剂、pH调节剂和添加剂等的水溶液组成。
通电后,镀锌液中的金属离子,在电位差的作
用下移动到阴极上形成镀层。
在镀锌电解过程中,电流和电压的具体数值取决于多种因素,如镀锌液的成分、温度、电流密度、通电时间、搅拌强度等。
一般来说,电流密度在1-50A/dm²之间,电压在5-30V
之间。
然而,这些参数并非固定不变的,而是需要根据实际情况进行调整,以获得最佳的镀层质量和性能。
此外,阳极材料的质量、镀锌液的成分、温度、电流密度、通电时间、搅拌强度、析出的杂质、电源波形等也会影响镀层的质量,需要适时进行控制。
在实际操作中,通常根据实验结果和实际需求,对这些参数进行优化和调整。

电镀工基础知识讲座二3、电流效率电介时,实际析出的物质的重量总是与理论上计算出的重量不一样,实际析出的重量与理论计算出重量之比用百分率表示,称为电流效率,常以“N”表示。
Mη=——————*100% 1*T*C 试中:M——实际析出的物质重量(克)I——电流(安培)T——时间(小时)C——电化当量(克/安培一小时)根据电解定律和电化当量,电流效率的公式,我们可以求出:电解液的电流效率,电镀时间、电镀层的厚度等。
例1通过电流20安培,经2小时在阴极上析出铬之重量为1.8克。
求镀铬的电流效率?设:Mη=—————*100%J*T*C从表查出得铬的电化当量C=0.324克/安培一小时电镀工基本计算常识1、配置10%的氢氧化钠溶液150公斤需氧化钠和水各多少?解:设需氢氧化钠X公斤,则有:X10%=?————*100%150X 0.1=————150需要用水量为:150—15?=135公斤答:需氢氧化钠15公斤,用水135公斤。
4公斤氢氧化钠可配置10%的氢氧化钠溶液多少公斤?解:设4公斤氢氧化钠可配置10%的氢氧化钠溶液Y公斤,则有;410%=———-*100%Y 0.1y=4Y=40公斤答:用4公斤氢氧化钠可配成10%的氢氧化钠溶液40公斤。
2、用10公斤水可配置20%的氢氧化钠溶液多少公斤?解:可配置Z公斤,则有:Z-10 20%=————*100%Z 0.2Z=Z-10 0.2Z-Z=-10 -0.8Z=-10 0.8Z=10 Z=12.5公斤答:10公斤水可配置20%的氢氧化钠溶液12.5公斤。
3、1体积96%的硫酸(比重1.84)溶解于5体积水中,所得的稀硫酸溶液的百分比浓度和比重是多少?解:设体积单位为升,则比重1.84的96%硫酸中含纯硫酸的重量是:1.84*96%=1.7664公斤这1.7664公斤的溶质也就是配成稀硫酸中所含硫酸溶质的重量。
配好后的溶液总重量等于1升96%硫酸的重量加上5生水的重量,即:1.84/5=6.84公斤所得稀硫酸溶液的百分比浓度是:1.7664————*100%=25.8% 6.84比重是:?6.84————?=1.146?答:所得稀硫酸的百分比浓度为25.8?%,比重为1.14。


电镀基本知识1 分散能力:在特定条件下,一定溶液使电极上(通常是阴极)镀层分布比初次电流分布所获得的结果更为均匀的能力。
也称均镀能力。
2 深镀能力:镀液要特定条件下凹槽或深孔处沉积金属镀层的能力。
3 电镀:是在含有某种金属离子的电解液中,将被镀工件作为阴极,通以一定波形的低压直流电.而使金属离子得到电子,不断在阴极沉积为金属的加工过程。
4 电流密度:单位面积电极上通过的电流强度,通常以A/dm2表示。
5 电流效率:电极上通过单位电量时,其一反应形成的产物的实际重量与其电化当量之比,通常以百分数表示。
6 阴极:反应于其上获得电子的电极,即发生还原反应的电极。
7 阳极:能接受反应物所给出电子的电极,即发生氧化反应的电极。
10 阴极性镀层:电极电位的代数值比基体金属大的金属镀层。
11 阳极性镀层:电极电位的代数值比基体金属小的金属镀层。
12 沉积速度:单位时间内零件表面沉积出金属的厚度。
通常以微米/小时表示。
13 活化:使金属表面钝态消失的过程。
14 钝化;在一定环境下使金属表面正常溶解反应受到严重阻碍,并在比较宽的电极电位范围内使金属溶解反应速度降到很低的作用。
15 氢脆:由于浸蚀,除油或电镀等过程中金属或合金吸收氢原子而引起的脆性。
16 PH值:氢离子活度的常用对数的负值。
17 基体材料;能与其上沉积金属或形成膜层的材料。
18 辅助阳极:除了在电镀中正常需要的阳极以外,为了改善被镀制件表面上的电流分布而使用的辅加阳极。
19 辅助阴极:为了消除被镀制件上某些部位由于电力线过于集中而出现的毛刺或烧焦等毛病,在该部位附近另加某种形状的阴极,用以消耗部分电流,这种附加的阴极就是辅助阴极。
20 阴极极化:直流电通过电极时,阴极电位偏离平衡电位向负的方向移动的现象。
21 初次电流分布:在电极极化不存在时,电流在电极表面上的分布。
22 化学钝化;将制件放在含有氧化剂的溶液中处理,使表面形成一层很薄的钝态,保护膜的过程。
电镀常用的计算方法在电镀过程中,涉及到很多参数的计算如电镀的厚度、电镀时间、电流密度、电流效率的计算。
当然电镀面积计算也是非常重要的,为了能确保印制电路板表面与孔内镀层的均匀性和一致性,必须比较精确的计算所有的被镀面积。
目前所采用的面积积分仪(对底片的板面积进行计算)和计算机计算软件的开发,使印制电路板表面与孔内面积更加精确。
但有时还必须采用手工计算方法,下例公式就用得上。
1.镀层厚度的计算公式:(厚度代号:d、单位:微米)d=(C×Dk×t×ηk)/60r2.电镀时间计算公式:(时间代号:t、单位:分钟)t=(60×r×d)/(C×Dk×ηk)3.阴极电流密度计算公式:(代号:、单位:安/分米2)ηk=(60×r×d)/(C×t×Dk)4.阴极电流以效率计算公式:Dk=(60×r×d)/(C×t×Dk)第三章沉铜质量控制方法化学镀铜(Electroless Plating Copper)俗称沉铜。
印制电路板孔金属化技术是印制电路板制造技术的关键之一。
严格控制孔金属化质量是确保最终产品质量的前提,而控制沉铜层的质量却是关键。
日常用的试验控制方法如下:1.化学沉铜速率的测定:使用化学沉铜镀液,对沉铜速率有一定的技术要求。
速率太慢就有可能引起孔壁产生空洞或针孔;而沉铜速率太快,将产生镀层粗糙。
为此,科学的测定沉铜速率是控制沉铜质量的手段之一。
以先灵提供的化学镀薄铜为例,简介沉铜速率测定方法:(1)材料:采用蚀铜后的环氧基材,尺寸为100×100(mm)。
(2)测定步骤:A. 将试样在120-140℃烘1小时,然后使用分析天平称重W1(g);B. 在350-370克/升铬酐和208-228毫升/升硫酸混合液(温度65℃)中腐蚀10分钟,清水洗净;C.在除铬的废液中处理(温度30-40℃)3-5分钟,洗干净;D. 按工艺条件规定进行预浸、活化、还原液中处理;E. 在沉铜液中(温度25℃)沉铜半小时,清洗干净;F. 试件在120-140℃烘1小时至恒重,称重W2(g)。
电镀液的电流效率:阴极电流效率电沉积时,人们希望直流电源所提供至阴极的电子全部用来还原沉积镀层所需的金属组分,即全部用于主反应上。
但实际上,副反应的发生也会消耗电子,即电流的利用率往往达不到百分之百,这就存在一个电流利用效率的问题。
为了表征电流利用率的大小,确定了一个镀液指标参数——电流效率。
常用η表示阴极表示阳极电流效率,均以百分比表示。
阴极电流效率有2种定义:电流效率,ηa(1)通过一定电量时阴极上实际沉积的金属质量与通过相同电量时理论上应沉积的金属质量之比;(2)沉积一定质量的金属时理论上应通入的电量与沉积相同质量的金属时实际消耗的电量之比。
不同价态的金属离子还原为金属原子理论上所需的电量或通过一定电量(常用安培·小时即A.h表示)时理论上应沉积的单金属质量,被称为“电化学当量”,可计算求出,计算结果可从许多电镀书籍或手册的附录中查到。
实际沉积的金属质量可用“增重法”称量得知:增重=镀后试样质量-镀前试样质量。
实际通过的电量用电量计(即库仑计)测量。
经典方法采用“铜库仑计”,它实际上是一个串接于试验槽上、阴极电流效率几乎百分之百的酸性镀铜槽。
用增重法得知其中阴极实际沉积的铜质量,再依Cu2+的电化学当量换算为理论电量。
随着电子技术的发展,目前已可制出精密电量计(也称为“安培·小时计”),用以代替铜库仑计,则测定更为简单。
具体的测定操作及计算方法在许多电镀手册中都可查到,此处不再赘述。
单金属镀层的阴极电流效率的测定与计算比较简单,合金电镀时的测定则较麻烦。
应准确分析镀层合金成分后,分别用不同组分金属的电化学当量单独计算后再综合计算如何测定电镀溶液的电流效率?镀液电流效率的测试通常是采用铜库仑计法。
铜库仑计实际上是一个镀铜电解槽。
它具有电流效率为100%,而电极上的析出物又都能收集起来的特点,并且镀槽中没有漏电现象。
测试的精确度可达到0.1%~0.05%,完全可以满足电沉积工艺的要求。
电镀公式δ=100KDtη/(60γ)(其中δ膜厚μm,K电化学当量g/(A·h),D 电流密度A/dm2,t电镀时间min,η电流效率,γ密度g/cm3,v电镀速率μm /min)。
计算时,首先要把各个参数的单位换算成上述单位,就可以直接代入计算。
其中,K和γ都是从手册上查的,当然也可以在网上查。
由上述公式可得,电镀速率v=δ/t=100KDη/(60γ),该公式可以由电流密度D计算电镀速率v。
变换一下,就可以由电镀速率v计算电流密度D=60γv/(100Kη)。
v和D都知道后,就可以确定电流I和时间t——I=D×S(其中I电流A,D电流密度A/dm2,S面积dm2)t=δ÷v(其中t时间min,δ膜厚μm,v电镀速率μm /min)计算时,η最好不要取100%(可以取小点,如95%),因为实际电镀时,有未估算到的面积(如针尖、导线破漏),这些都相当于降低了效率。
查手册可知,Cu的密度γ=8.92 g/cm3,二价Cu2+的电化学当量K=1.186 g/(A·h) 实例一.要求速率是v=0.5μm /min时,假设η=95%,电流密度D=?D=60γv/(100Kη)=60×8.92×0.5/(100×1.186×95%)=2.375A/dm2实例二.反过来,要求电流密度D=1A/dm2时,假设η=95%,计算速率v=?v=100KDη/(60γ)=100×1.186×1×95%/(60×8.92)=0.2105μm /min(因为v与D成正比,所以记住这个数,可以简易换算,溶液里是二价Cu2+时,v=0.2105D,上次算的0.2216是假设η=100%算的)。
比如,若D=2 A/dm2,则v=0.2105×2=0.4210μm /min再如,若v=0.5μm /min,则D=0.5÷0.2105=2.375A/dm2可以利用公式v/D=100Kη/(60γ)及电化学当量表自己计算出常用金属Au、Ag+、Cu2+、Sn2+、Ni2+的v/D值,记住这些值,就可以简易换算。
电镀液的电流效率电镀液有许多技术性能指标,其中影响大的有阴极电流效率,以及镀液的分散能力与深镀能力。
这三大指标是新工艺研究的必测指标。
如何对镀液性能指标进行测定,一般电镀人员先不必作太深的了解,但应对其含义及其对电镀最终效果的影响有明确认识,只有这样才能运用好工艺,懂得如何正确操作。
本讲主要讨论电流效率问题,也会涉及电极上副反应的害处和某些可利用之处,以及一些工艺的特殊性。
电镀液的电流效率:阴极上的主反应与副反应电镀液的电流效率:阴极电流效率电镀液的电流效率:阳极电流效率阳极电流效率:1.不溶性阳极电镀对于镀铬之类的不溶性阳极电镀,阳极仅起2个作用:(1)提供直流通电回路,形成闭合环路;(2)提供合理的电力线分布。
阳极上无主反应发生,均发生副反应,其主要是析氧反应:40H-一4e-→2H20+02↑。
该副反应因消耗OH-,会使镀液pH下降。
析氧也造成镀液中某些易被氧化的组分被氧化破坏。
多价金属离子在阳极上的局部氧化有时有害,有时又有利。
例如,对于三价铬镀铬而言,只要氧化生成少量六价铬就十分有害,甚至导致阴极上无铬析出。
而Cr3+很容易在铅或铅合金上被氧化为六价铬,故三价铬镀铬不允许采用这类阳极。
六价铬镀铬液中,当三价铬过多时,镀液深镀能力下降,对装饰性套铬十分有害,有时采用小阴极大阳极电解,让部分三价铬在铅合金阳极上氧化为六价铬。
六价铬镀铬液中,Cl-含量过高也很有害,即使采用大电流电解,也只能使大部分Cl-在阳极上呈氯气(Cl2)析出,而不能彻底将其去除。
氯化物体系三价铬镀铬,采用高纯石墨电极时,其上会生成有毒氯气,因此要设置良好的抽风设备。
2可溶性阳极电镀采用可溶性阳极进行电镀时,阳极除了起到上述不溶性阳极的2个作用之外,还具有第3个作用——也是其主要的作用,即溶解提供合适价态的主盐金属离子,以补充其在阴极上还原后的消耗(理想状态为保持平衡),这是可溶性阳极发生的主反应。
例如:氰化镀铜,Cu—e-→Cu+;无氰镀铜,Cu一2e-→Cu2+;酸性镀锡,Sn一2e-→Sn2+:碱性镀锡,Sn一4e-→Sn(IV):镀镍,Ni一2e-→Ni2+:镀金,Au一3e-→Au3+(氰化镀金时为Au—e-→Au+)。