如何配制三氯化铁溶液的介绍
- 格式:doc
- 大小:21.50 KB
- 文档页数:2

盐酸生产三氯化铁的原理盐酸生产三氯化铁的原理是通过将盐酸与铁粉反应生成氯化亚铁,然后通过氧化反应将氯化亚铁转化为三氯化铁。
首先,盐酸(化学式HCl)与铁粉(Fe)反应生成氯化亚铁(FeCl2)。
这个反应可以表示为:2HCl + Fe →FeCl2 + H2在这个反应中,盐酸中的氯离子(Cl-)与铁粉中的铁离子(Fe2+)结合形成氯化亚铁。
同时,氢气(H2)也会生成。
接下来,氯化亚铁需要通过氧化反应转化为三氯化铁(FeCl3)。
这个反应可以通过将氯化亚铁与氧气(O2)反应来实现。
氧气可以通过空气中的氧气供应或者通过外部氧化剂供应。
2FeCl2 + 1/2O2 →FeCl3在这个反应中,氯化亚铁中的铁离子(Fe2+)被氧气氧化为铁离子(Fe3+),从而形成三氯化铁。
整个盐酸生产三氯化铁的过程可以总结为以下反应:2HCl + Fe →FeCl2 + H22FeCl2 + 1/2O2 →FeCl3需要注意的是,这个过程中的反应条件和反应控制非常重要。
首先,反应需要在适当的温度下进行,一般在室温下或者略高于室温。
此外,反应需要在适当的酸度下进行,一般在pH值为1-2之间。
反应容器也需要选择合适的材料,以避免反应物质的腐蚀。
盐酸生产三氯化铁的原理可以通过以下步骤来实现:1. 准备反应容器:选择适当的反应容器,确保其能够承受反应过程中产生的气体和液体。
2. 加入盐酸:将适量的盐酸加入反应容器中。
3. 加入铁粉:将适量的铁粉加入盐酸中,观察反应过程中是否有气体生成。
4. 反应生成氯化亚铁:观察反应过程中是否有氯化亚铁生成,可以通过观察溶液的颜色变化来判断。
5. 加入氧气:如果需要将氯化亚铁转化为三氯化铁,可以通过加入氧气来实现。
可以通过通入空气或者使用外部氧化剂来提供氧气。
6. 反应生成三氯化铁:观察反应过程中是否有三氯化铁生成,可以通过观察溶液的颜色变化来判断。
7. 分离和提取:将反应产物与未反应的物质分离,并提取所需的三氯化铁。

三氯化铁氧化反应的操作及现象三氯化铁氧化反应是一种常见的化学实验,也是一种常用的化学分析方法。
这个实验可以用来检测某些物质的存在,或者确定某些物质的含量。
我们先来看一下这个实验的操作步骤。
实验材料和仪器:1. 三氯化铁(FeCl3):这是一种红色晶体,可溶于水。
2. 某种需要测试的物质:比如维生素C、苯酚等。
3. 试管:用于混合反应物。
4. 称量器具:用来称取试样。
操作步骤:1. 首先,我们需要准备一定浓度的三氯化铁溶液。
可以将适量的三氯化铁固体加入一定量的去离子水中,搅拌溶解,直到溶液呈现出深红色。
2. 取一定量的待测物质样品,并称取准确质量。
将待测物质溶解在适量的去离子水中,得到待测物质溶液。
3. 在试管中加入一定量的三氯化铁溶液,然后再加入待测物质溶液。
注意,加入的体积要适量,以保证反应充分进行。
4. 在混合反应物之后,我们可以观察到一系列现象。
下面我们来看一下这个反应的观察现象和解释:1. 颜色变化:在混合反应物之后,我们可以观察到溶液的颜色发生变化。
通常情况下,由于三氯化铁的存在,溶液会从无色或浅黄色变为深红色。
这是因为三氯化铁在水溶液中呈现红色。
2. 沉淀形成:某些物质在与三氯化铁反应后会生成沉淀。
比如,维生素C在与三氯化铁反应后会生成橙红色的沉淀。
这是因为维生素C是一种还原剂,它可以还原三氯化铁中的铁离子,生成铁离子与维生素C的络合物,从而形成沉淀。
3. 气体生成:在某些情况下,与三氯化铁反应的物质会生成气体。
比如,苯酚在与三氯化铁反应后会生成大量的气泡。
这是因为苯酚可以与三氯化铁发生氧化反应,生成二氧化碳气体。
通过以上观察现象,我们可以判断某种物质是否存在或者确定其含量。
比如,在测定维生素C的含量时,我们可以通过观察橙红色沉淀的形成来判断维生素C的存在与否。
而在测定苯酚的含量时,我们可以通过观察气泡的生成量来确定苯酚的含量。
总结起来,三氯化铁氧化反应是一种常用的化学实验和分析方法。
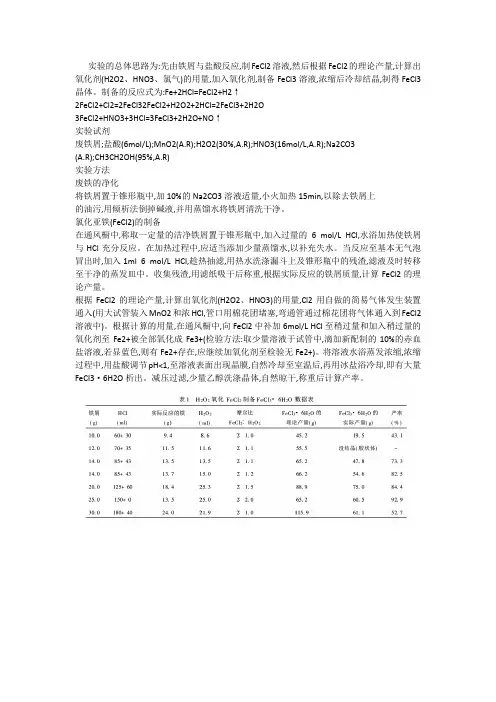
实验的总体思路为:先由铁屑与盐酸反应,制FeCl2溶液,然后根据FeCl2的理论产量,计算出氧化剂(H2O2、HNO3、氯气)的用量,加入氧化剂,制备FeCl3溶液,浓缩后冷却结晶,制得FeCl3晶体。
制备的反应式为:Fe+2HCl=FeCl2+H2↑2FeCl2+Cl2=2FeCl32FeCl2+H2O2+2HCl=2FeCl3+2H2O3FeCl2+HNO3+3HCl=3FeCl3+2H2O+NO↑实验试剂废铁屑;盐酸(6mol/L);MnO2(A.R);H2O2(30%,A.R);HNO3(16mol/L,A.R);Na2CO3(A.R);CH3CH2OH(95%,A.R)实验方法废铁的净化将铁屑置于锥形瓶中,加10%的Na2CO3溶液适量,小火加热15min,以除去铁屑上的油污,用倾析法倒掉碱液,并用蒸馏水将铁屑清洗干净。
氯化亚铁(FeCl2)的制备在通风橱中,称取一定量的洁净铁屑置于锥形瓶中,加入过量的6 mol/L HCl,水浴加热使铁屑与HCl充分反应。
在加热过程中,应适当添加少量蒸馏水,以补充失水。
当反应至基本无气泡冒出时,加入1ml 6 mol/L HCl,趁热抽滤,用热水洗涤漏斗上及锥形瓶中的残渣,滤液及时转移至干净的蒸发皿中。
收集残渣,用滤纸吸干后称重,根据实际反应的铁屑质量,计算FeCl2的理论产量。
根据FeCl2的理论产量,计算出氧化剂(H2O2、HNO3)的用量,Cl2用自做的简易气体发生装置通入(用大试管装入MnO2和浓HCl,管口用棉花团堵塞,弯通管通过棉花团将气体通入到FeCl2溶液中)。
根据计算的用量,在通风橱中,向FeCl2中补加6mol/L HCl至稍过量和加入稍过量的氧化剂至Fe2+被全部氧化成Fe3+(检验方法:取少量溶液于试管中,滴加新配制的10%的赤血盐溶液,若显蓝色,则有Fe2+存在,应继续加氧化剂至检验无Fe2+)。
将溶液水浴蒸发浓缩,浓缩过程中,用盐酸调节pH<1,至溶液表面出现晶膜,自然冷却至室温后,再用冰盐浴冷却,即有大量FeCl3·6H2O析出。


三氯化铁溶液配制
三氯化铁溶液的配制是一个重要的实验,它可以用来做一些化学实验,比如检测水中的氯离子含量。
下面介绍如何配制三氯化铁溶液。
首先,准备好所需的原料,包括三氯化铁粉末、纯净水和容器。
将三氯化铁粉末放入容器中,然后加入纯净水,搅拌均匀,直到三氯化铁粉末完全溶解。
接下来,将溶液过滤,以去除悬浮物,然后将溶液置于室温下,放置一段时间,使溶液中的气泡慢慢消散,最后将溶液稀释至所需浓度。
最后,将溶液置于室温下,放置一段时间,使溶液中的气泡慢慢消散,最后将溶液稀释至所需浓度。
以上就是三氯化铁溶液的配制方法,它非常简单,但是要注意安全,不要将三氯化铁粉末接触皮肤,以免发生意外。
此外,在配制过程中,要注意控制溶液的浓度,以确保实验的准确性。


如何配制三氯化铁溶液的介绍如何配制三氯化铁溶液的介绍在自己制作印制电路板时,要用三氯化铁溶液来腐蚀电路板。
现在三氯化铁大部分是固体状态。
要配成腐蚀电路板的溶液,可按质量大小配比:用35%的三氯化铁加65%的水配制。
三氯化铁的浓度并不是很严格的,浓度大的溶液腐蚀速度快一点,浓度小的溶液腐蚀速度慢一点。
腐蚀电路板时三氯化铁的溶液最好在30~50℃,最高不要超过65℃。
腐蚀时可用竹夹子夹住电路板在三氯化铁溶液中辊动以增快腐蚀速度,一般情况下15~30min电路板即可腐蚀好。
配置好的三氯化铁溶液可多次使用,但发现溶液中沉淀较多时,就应重新配置二氯化铁溶液。
蚀刻液再生印制电路板(PCB)加工的典型工艺采用"图形电镀法"。
即先在板子外层需保留的铜箔部分上(是电路的图形部分)预镀一层铅锡抗蚀层,然后用化学方式将其余的铜箔腐蚀掉,称为蚀刻。
在蚀刻过程中,板面上的铜被[Cu(NH3)4]2+络离子氧化,其蚀刻反应如下:Cu(NH3)4Cl2+Cu →2Cu(NH3)2Cl 所生成的[Cu(NH3)2]1+为Cu1+的络离子,不具有蚀刻能力。
在有过量NH3和Cl-的情况下,能很快地被空气中的O2所氧化,生成具有蚀刻能力的[Cu(NH3)4]2+络离子,其再生反应如下:2Cu(NH3)2Cl+2NH4Cl+2NH3+1/2 O2 →2Cu(NH3)4Cl 2+H2O从上述反应可看出,每蚀刻1克分子铜需要消耗2克分子氨和2克分子氯化铵。
因此,在蚀刻过程中,随着铜的溶解,要不断补加氨水和氯化铵,因而蚀刻槽母液会不断增加。
由于所生成的[Cu(NH3)2]1+为Cu1+的络离子,不具有蚀刻能力,所以必须排除部分母液,增加新的子液(子液不含铜离子)来满足蚀刻要求。
蚀刻液再生:实际上是印制电路板(PCB)蚀刻线上排出的蚀刻母液采用封闭式循环系统,经蚀刻液再生循环设备将其中的铜离子萃取出来再返回生产线的过程。


无水三氯化铁试剂一、简介无水三氯化铁试剂是一种常用的化学试剂,其化学式为FeCl3,分子量为162.2。
它是一种无水物,通常以浅棕色固体或结晶形式存在。
无水三氯化铁试剂具有强氧化性和强酸性,在有机合成、分析化学和生物化学等领域广泛应用。
二、制备方法无水三氯化铁试剂可以通过以下两种方法制备:1. 直接合成法:将铁粉与氯气在高温下反应,生成三氯化铁蒸汽,然后在冷却器中收集并凝固。
2. 水合三氯化铁脱水法:先制备水合三氯化铁(FeCl3·6H2O),然后经过加热脱去其结晶中的水分,得到无水三氯化铁。
三、性质1. 物理性质:无水三氯化铁为浅棕色固体或结晶形式存在。
它易潮解,在空气中吸收湿度而变得潮湿。
2. 化学性质:无水三氯化铁具有强酸性和强氧化性。
它可以与许多物质反应,如与水反应生成水合三氯化铁,与金属反应生成对应的金属三氯化物等。
3. 溶解性:无水三氯化铁在水中溶解度较大,可以形成各种浓度的溶液。
在有机溶剂中也有一定的溶解度,如在乙醇中可以形成深红色的溶液。
四、应用1. 有机合成:无水三氯化铁是一种重要的有机合成试剂,常用于芳香族化合物的卤代反应、烷基化反应、烷基苯环取代反应等。
2. 分析化学:无水三氯化铁通常用作分析试剂,可以检测某些离子和分子。
例如,在酸性条件下加入硝酸银试剂可以检测出卤素离子。
3. 生物化学:无水三氯化铁在生物学研究中也有一定的应用。
例如,在DNA凝胶电泳实验中,它可以作为DNA片段可视化的染色剂。
五、安全注意事项1. 无水三氯化铁具有强酸性和强氧化性,在使用过程中需要注意避免与皮肤、眼睛等接触,避免吸入其气体或粉尘。
2. 在储存和运输过程中,无水三氯化铁需要密封保存,避免与水分或有机物质接触。
3. 在使用过程中应注意加入试剂的顺序和量,避免发生意外反应和事故。
六、结论无水三氯化铁试剂是一种重要的化学试剂,在有机合成、分析化学和生物化学等领域广泛应用。
它具有强酸性和强氧化性,在使用过程中需要注意安全。

材料三氯化铁腐蚀实验操作
1 制备试样:将待测材料加工成50mm*25mm*2mm的试样,先用100#砂纸将表面粗磨平整,再用500#号砂纸水磨,冲洗干净,用丙酮除油,烘干后称重,精确到0.001克,放于干燥箱内备用。
2 配制腐蚀液:用优级纯盐酸和蒸馏水配制成0.05mol/L的盐酸溶液,称取100g三氯化铁溶于900ml0.05mol/L盐酸溶液中,配制成6%的三氯化铁溶液。
3 实验步骤:往1000ml实验烧杯内移入600ml氯化铁溶液,将烧杯放入恒温槽中,使温度保持在22±2℃和50±2℃,将支架放入烧杯,试样放置在支架上。
在烧杯上盖上盖子,静置72小时。
4 称重:将试样取出,用水冲洗干净,在流水中用尼龙涮将腐蚀产物清洗干净,浸泡在丙酮中5分钟,然后烘干称量,精确到0.001克。
5 实验分析:。
不锈钢三氯化铁点腐蚀试验实验原理引言:不锈钢是一种具有优异抗腐蚀性能的金属材料,然而在某些特殊环境下,如含氯离子的溶液中,不锈钢仍然会遭受腐蚀。
为了更好地了解不锈钢在不同条件下的耐腐蚀性能,科学家们开展了许多研究,其中之一就是不锈钢三氯化铁点腐蚀试验。
实验原理:不锈钢三氯化铁点腐蚀试验是一种定性和定量评估不锈钢耐腐蚀性能的实验方法。
其原理主要基于以下两个方面:三氯化铁作为一种常见的强氧化剂,可以与金属表面的铁离子发生反应,形成易溶于水的铁离子络合物,从而造成金属腐蚀;不锈钢作为一种含铬合金,可以通过氧化铬形成致密的氧化膜,防止金属进一步腐蚀。
实验步骤:1.样品制备:将不锈钢样品切割成适当尺寸的试片,保证试片表面光洁且没有明显的划伤或污染。
2.试片清洗:使用去离子水和洗涤剂清洗试片表面,以去除表面的杂质和污垢,并用酒精擦拭干净。
3.试液配制:将三氯化铁固体溶解在适量的水中,制备不同浓度的三氯化铁溶液。
4.试片浸泡:将试片分别放置在不同浓度的三氯化铁溶液中,浸泡一定时间,一般为24小时。
5.观察和评估:取出试片,用清水冲洗干净,并观察试片表面的腐蚀情况。
可以通过目测、显微镜观察或者测量腐蚀深度等方法进行评估。
结果分析:根据试片表面的腐蚀情况,可以对不锈钢在不同条件下的耐腐蚀性能进行评估。
通常,腐蚀程度越轻微,说明不锈钢的耐腐蚀性能越好;反之,腐蚀程度越严重,说明不锈钢的耐腐蚀性能越差。
影响因素:不锈钢三氯化铁点腐蚀试验的结果受到多种因素的影响,包括试液浓度、浸泡时间、试片表面质量等。
通常情况下,为了获得准确的实验结果,需要控制这些因素,并进行多次试验取平均值。
应用领域:不锈钢三氯化铁点腐蚀试验广泛应用于不锈钢材料的研究和开发过程中。
通过评估不同合金成分、加工工艺、表面处理等因素对不锈钢耐腐蚀性能的影响,可以指导材料选择和工程设计,提高不锈钢的耐腐蚀性能。
总结:不锈钢三氯化铁点腐蚀试验是一种常用的评估不锈钢耐腐蚀性能的实验方法。
三氯化铁技术参数三氯化铁是一种常用的无机化合物,化学式为FeCl3。
它是一种具有重要应用价值的化学品,广泛应用于水处理、电子材料、染料工业等领域。
本文将从三氯化铁的物理性质、化学性质、制备方法以及应用领域等方面进行详细介绍。
一、物理性质三氯化铁是一种固体物质,常温下为暗红色结晶或结晶性粉末。
它具有较强的吸湿性,能够吸收空气中的水分,并迅速溶解形成溶液。
三氯化铁的溶液呈棕红色,具有刺激性气味。
在高温下,三氯化铁会分解产生氯化氢气体。
二、化学性质1. 水解反应:三氯化铁与水反应生成氯化铁酸:FeCl3 + 3H2O → Fe(OH)3 + 3HCl2. 氧化性:三氯化铁具有较强的氧化性,可以将某些物质氧化为高价态或氧化为其他化合物。
3. 还原性:三氯化铁可以被还原为亚铁盐,如FeCl2。
三、制备方法三氯化铁的制备方法有多种,常见的方法包括直接氯化法、间接氯化法和湿法氧化法。
1. 直接氯化法:将金属铁或铁粉与氯气在高温下反应得到三氯化铁。
2. 间接氯化法:将金属铁或铁粉与氯化亚砜反应制得氯化铁酸铁,再与氯化钠反应生成三氯化铁。
3. 湿法氧化法:将铁片或铁粉加入浓硝酸中搅拌,再加入稀盐酸和过饱和氯化钠溶液,过滤得到三氯化铁。
四、应用领域1. 水处理:三氯化铁是一种常用的净水剂,可用于去除水中的重金属离子、有机物和浊度物质。
它能够与水中的污染物发生化学反应,形成不溶性沉淀物,从而实现水质净化的目的。
2. 电子材料:三氯化铁在电子材料制备中起到重要作用。
它可以用作电路板上的蚀刻剂,用于蚀刻铜箔表面,形成电路图案。
3. 染料工业:三氯化铁是染料工业中的一种常用试剂,可用于染料的合成和媒染过程中的催化剂。
4. 医药领域:三氯化铁在医药领域中有一定的应用,可用于制备铁剂、止血剂和抗感染药物等。
5. 其他应用:三氯化铁还可用于金属表面处理、催化剂制备以及研究领域的实验试剂等。
三氯化铁是一种重要的无机化合物,具有丰富的应用领域。
三氯化铁溶液的配制
一、实验原理
三氯化铁溶液是把金属三氯化铁稀释到某种浓度的溶液中。
溶液中的三氯化铁离子有以下的作用:1)残留阴离子交换;2)反应两种离子,从而形成不溶于水的沉淀物;3)以微细的形式参与氧化和还原反应。
二、实验材料
1.纯净水:含氯量小于5mg/L;
2.三氯化铁:重量约为100g;
3.酸化剂:硝酸或硫酸亦可。
三、实验步骤
1.将三氯化铁放入容器中,加入足量的纯净水,加热至90℃;
2.加入硝酸或硫酸,稀释至可接受的浓度,如需要更密度的溶液,可先冷却再稀释;
3.将稀释后的溶液进行滤过,以去除混入的大量铁锈;
4.经过滤过的溶液置于容器中,再次加入硝酸或硫酸,直至其pH值在5~9之间;
5.根据所需浓度加入稀释水,搅拌均匀,过滤,得到所需浓度的三氯化铁溶液。
四、实验安全事项
1.应湿润操作,以防止细小粒子粘附;
2.热水不要过热,以防止烫伤;
3.应当避免接触硝酸或硫酸;
4.实验完毕后,应当收集和处理酸液,放置于安全的地方;
5.实验过程中应注意贮存安全,不得用手接触,防止人体过敏。
北京雷根生物技术有限公司 酸性三氯化铁试剂简介:氯化铁(Ferric chloride)又称三氯化铁,化学式为FeCl3,分子量为162.2,CAS 号为7705-08-0,用于金属蚀刻、污水处理、氧化剂等。
Leagene 酸性三氯化铁试剂又称Fouchet 试剂,由无水氯化铁、弱酸、去离子水组成,多用于尿胆红素定性实验,其原理是用硫酸钡吸附尿中胆红素后,滴加酸性三氯化铁试剂,使胆红素氧化成胆绿素而呈绿色反应。
该试剂仅用于科研领域,不适用于临床诊断。
组成:操作步骤(仅供参考):1、 试管法:取尿液,加入氯化钡溶液,混匀,此时会出现白色的硫酸钡沉淀。
低速离心数分钟,弃上清,加Fouchet Reagent 数滴,呈绿色或蓝绿色为阳性。
2、 氯化钡试纸法:①氯化钡试纸制备:将滤纸裁剪成10mm ×80mm 大小纸条,浸泡于饱和氯化钡溶液数分钟后,室温或37℃温箱内待干,储存于密闭瓶子内。
②将氯化钡试纸条的一端浸入尿液5~10s(浸入部分至少大于50mm),取出试纸条,平铺于吸水纸上。
③在试纸条浸没尿液的部位上滴Fouchet Reagent ,呈绿色或蓝色为阳性,色泽深浅与胆红素含量成正比。
注意事项:1、胆红素在阳光下易分解,留尿后应及时检查。
2、加入过量的Fouchet Reagent 会呈黄色而不显绿色,出现假阴性。
3、本法灵敏度可达0.9μmol/L 或0.05mg/dl 胆红素。
4、为了您的安全和健康,请穿实验服并戴一次性手套操作。
有效期: 6个月有效。
编号 名称 TC0009 Storage Fouchet Reagent 100ml RT 避光 使用说明书 1份。
如何配制三氯化铁溶液的介绍
在自己制作印制电路板时,要用三氯化铁溶液来腐蚀电路板。
现在三氯化铁大部分是固体状态。
要配成腐蚀电路板的溶液,可按质量大小配比:用35%的三氯化铁加65%的水配制。
三氯化铁的浓度并不是很严格的,浓度大的溶液腐蚀速度快一点,浓度小的溶液腐蚀速度慢一点。
腐蚀电路板时三氯化铁的溶液最好在30~50℃,最高不要超过65℃。
腐蚀时可用竹夹子夹住电路板在三氯化铁溶液中辊动以增快腐蚀速度,一般情况下15~30min电路板即可腐蚀好。
配置好的三氯化铁溶液可多次使用,但发现溶液中沉淀较多时,就应重新配置二氯化铁溶液。
蚀刻液再生
印制电路板(PCB)加工的典型工艺采用"图形电镀法"。
即先在板子外层需保留的铜箔部分上(是电路的图形部分)预镀一层铅锡抗蚀层,然后用化学方式将其余的铜箔腐蚀掉,称为蚀刻。
在蚀刻过程中,板面上的铜被[Cu(NH3)4]2+络离子氧化,其蚀刻反应如下:Cu(NH3)4Cl2+Cu →2Cu(NH3)2Cl 所生成的[Cu(NH3)2]1+为Cu1+的络离子,不具有蚀刻能力。
在有过量NH3和Cl-的情况下,能很快地被空气中的O2所氧化,生成具有蚀刻能力的[Cu(NH3)4]2+络离子,其再生反应如下:
2Cu(NH3)2Cl+2NH4Cl+2NH3+1/2 O2 →2Cu(NH3)4Cl 2+H2O
从上述反应可看出,每蚀刻1克分子铜需要消耗2克分子氨和2克分子氯化铵。
因此,在蚀刻过程中,随着铜的溶解,要不断补加氨水和氯化铵,因而蚀刻槽母液会不断增加。
由于所生成的[Cu(NH3)2]1+为Cu1+的络离子,不具有蚀刻能力,所以必须排除部分母液,增加新的子液(子液不含铜离子)来满足蚀刻要求。
蚀刻液再生:实际上是印制电路板(PCB)蚀刻线上排出的蚀刻母液采用封闭式循环系统,经蚀刻液再生循环设备将其中的铜离子萃取出来再返回生产线的过程。