新人教版高一化学氨硝酸硫酸知识点
- 格式:doc
- 大小:13.01 KB
- 文档页数:3



第四节氨硝酸硫酸氨气的泄漏事件2007年1月25日下午1点10分左右,大兴区正大大发熟食厂冷冻车间的氨气管道突然泄漏,外泄的液态氨瞬间挥发成白色气柱冲出来。
空气中弥漫着一股浓烈的刺激性气味,进入厂区呼吸都感到困难.厂区内寒气逼人。
刺鼻的味道也弥漫到了附近的林校路上。
…消防员利用喷雾水枪稀释空气中的氨,地上的水流已经结成了厚厚的一层冰。
上在的材料告诉我们些关于氨的什么性质?你能将它们一一找出来吗?一、氨1.氨的物理性质:氨是一种色、有气味的气体,密度比空气,溶于水,在常温下,1体积水大约可溶解体积氨气。
易液化(-33.5℃),液氨常作制冷剂。
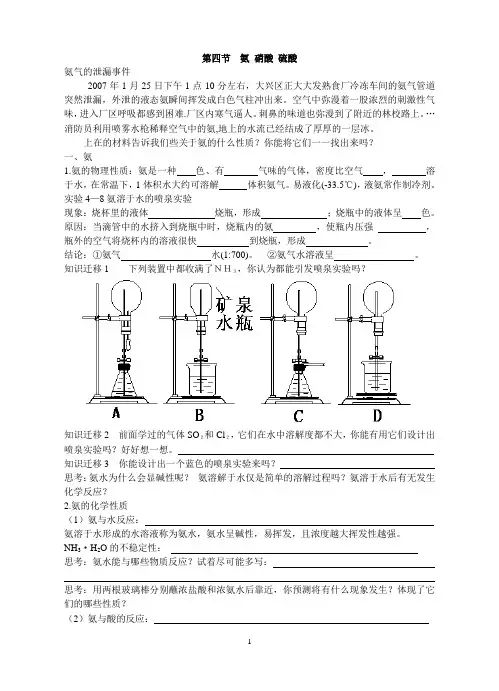
实验4—8氨溶于水的喷泉实验现象:烧杯里的液体烧瓶,形成;烧瓶中的液体呈色。
原因:当滴管中的水挤入到烧瓶中时,烧瓶内的氨,使瓶内压强,瓶外的空气将烧杯内的溶液很快到烧瓶,形成。
结论:①氨气水(1:700)。
②氨气水溶液呈。
知识迁移1 下列装置中都收满了NH3,你认为都能引发喷泉实验吗?知识迁移2 前面学过的气体SO2和Cl2,它们在水中溶解度都不大,你能有用它们设计出喷泉实验吗?好好想一想。
知识迁移3 你能设计出一个蓝色的喷泉实验来吗?思考:氨水为什么会显碱性呢?氨溶解于水仅是简单的溶解过程吗?氨溶于水后有无发生化学反应?2.氨的化学性质(1)氨与水反应:氨溶于水形成的水溶液称为氨水,氨水呈碱性,易挥发,且浓度越大挥发性越强。
NH3·H2O的不稳定性:思考:氨水能与哪些物质反应?试着尽可能多写:思考:用两根玻璃棒分别蘸浓盐酸和浓氨水后靠近,你预测将有什么现象发生?体现了它们的哪些性质?(2)氨与酸的反应:氨与酸反应生成铵盐。
铵盐又叫铵态氮肥。
思考:有一位农民看到自己买的一袋碳酸氢铵化肥受了潮,就在太阳底下晒,等他下午去取时,发现少了许多,是谁偷了他的氮肥?铵盐可以做氮肥体现了铵盐的什么物理性质?铵盐的性质①铵盐都易溶于水②铵盐受热易分解NH4HCO3受热:NH4Cl受热:③铵盐与碱反应(NH4)2SO4 + NaOH:实质:(离子方程式)NH4HCO3 + NaOH:实质:(离子方程式)一切铵盐的共同性质,实验室可利用这个性质来检验NH4+的存在。


第四节氨、硝酸、硫酸一、氨气、氨水与铵盐的性质1、氨气的物理性质:无色有刺激性气味的气体,密度比空气小,易溶于水,水溶液呈碱性。
2、氨气的化学性质:○1与水反应:○2与酸反应:○3实验室制法:○4工业制法:(条件:高温、高压、催化剂)3、氨水成分:4、铵盐:物理性质:铵盐都是无色晶体,能溶于水化学性质:○1氯化铵分解:○2碳酸氢铵分解:○3与碱反应:【习题一】(2017春•鼓楼区期中)下列叙述中,正确的是()A.氨水显碱性B.铵盐不易溶于水C.氨气可以用浓硫酸进行干燥D.NH3+HCl═NH4Cl属于氧化还原反应【考点】氨的化学性质.【专题】氮族元素.【分析】A.一水合氨是弱碱;B.铵盐都易溶于水;C.氨气能与硫酸反应;D.存在化合价的变化的反应属于氧化还原反应.【解答】解:A.一水合氨是弱碱,存在NH3•H2O⇌NH4++OH-,所以氨水显碱性,故A正确;B.铵盐都易溶于水,故B错误;C.氨气能与硫酸反应,氨气不可以用浓硫酸进行干燥,故C错误;D.NH3+HCl═NH4Cl中不存在化合价的变化,不属于氧化还原反应,故D错误。
故选:A。
【习题二】(2017春•怀仁县校级期中)下列有关氨水的叙述中不正确的是()A.氨水中含有NH4+、OH-、H+三种离子B.氨水就是液氨C.氨水中含有NH3•H2O、NH3 和H2O三种分子D.氨水显碱性【考点】氨的化学性质.【专题】氮族元素.【分析】氨水中存在:NH3+H2O⇌NH3•H2O⇌NH4++OH-以及H2O⇌OH-+H+,以此解答该题.【解答】解:氨水中存在:NH3+H2O⇌NH3•H2O⇌NH4++OH-以及H2O⇌OH-+H+,则氨水中含有NH4+、OH-、H+三种离子,NH3•H2O、NH3 和HO三种分子,溶液呈碱性,氨水为混合物,液氨为纯净物,故选:B。
【习题三】(2017春•杨浦区校级期中)下列关于铵盐的叙述:①铵盐中氮元素化合价都是-3价;②铵盐都是晶体,都易溶于水;③铵盐与碱共热放出氨气;④铵盐都不能与酸反应;⑤铵盐都易分解.其中正确的是()A.①②③ B.②③④ C.③④⑤ D.②③⑤【考点】铵盐的性质。

专题01 氨气硫酸硝酸(上册知识回顾)1、什么叫氮的固定?有哪些方式?自然固氮的化学方程式?2、氨水的成分:三分子、三离子;氨水的主要成分,计算时,氨水的溶质以通入的为准,氨水的浓度越大密度反而越。
氨气溶于水后呈弱碱性且能使酚酞溶液,有关的方程式,氨水和液氨是同一种吗?3、氨气与酸反应的实质是(离子方程式)。
分别蘸取浓盐酸、浓氨水的两棒玻璃棒靠近,立即产生大量(填现象),化学方程式______________________________________。
分别蘸取浓硝酸、浓氨水的两棒玻璃棒靠近,立即产生大量(填现象),化学方程式______________________________________。
4、氨气与浓硫酸在空气中(能或不能)产生白烟;用稀硫酸吸收多余的氨气时要(填方法), 氨气不能用浓硫酸原因(化学反应方程式)5、玻璃棒蘸取浓氨水可查氯气管道是否漏气,氧化剂是,还原剂是,物质的量之比为;若有少量氯气泄漏则产生(填现象),化学方程式______________________________________。
若有大量氯气泄漏则产生(填现象),化学方程式______________________________________。
6、氨气在铂催化剂作用下氧化的化学反应方程式7、氨气在纯氧中燃烧的化学反应方程式8、侯氏制碱中的碱指的是(物质的名称)。
侯氏制碱法中向饱和食盐水中先通入,再通入,溶液中产生(填现象),过滤、洗涤、干燥后,对滤渣进行加热即得。
请写出相关反应的化学方程式:______________________________________。
9、氨气通入灼热的氧化铜的现象,化学方程式(单线桥法)______________________________________。
为消除氮氧化物污染,可通氨气处理,请写出相关反应的化学方程式:10、工业上制氨气的化学方程式实验室用氯化铵固体与消石灰制氨气的化学方程式实验室将浓氨水滴入生石灰中快速制氨气的化学方程式11、铵盐受热均易,(填:能或不能或不一定)产生氨气,请写出氯化铵、碳酸铵、碳酸氢铵受热分解的化学方程式______________________________________。

硫酸、硝酸和氨一、教学目标二、1.知识与技能。
(1)掌握浓硫酸、硝酸的性质;了解氨的物理性质,掌握氨的化学性质;了解铵盐的性质。
(2)了解硫酸、硝酸的用途。
2.过程与方法。
通过学生分组讨论、实验探究,培养学生分析问题、解决问题能力、实验操作的能力。
3.情感态度与价值观。
(1)使学生体会化学对环保的重要意义,培养学生关注社会的意识和责任感。
(2)通过对问题的讨论、实验的探究,培养学生积极思考、勇于探究的精神。
二、教学重点与难点重点:浓硫酸、硝酸的氧化性,氨的化学性质。
难点:浓硫酸、硝酸的氧化性。
三、教材分析硫酸、硝酸是硫、氮元素的最高价氧化物的水化物,是重要的含氧酸,氨是氮的氢化物。
在硫、氮元素的知识体系中,比较重要的是氧化物和含氧酸。
硫酸、硝酸既有酸的一些通性,又有它们自己的特性。
氨也有大多数非金属元素的氢化物所具有的性质。
该节的主干知识有两点:(1)浓硫酸、硝酸的强氧化性,它们能与绝大多数金属反应,反应的特点是浓硫酸、硝酸中的硫、氮元素被还原,生成硫的氧化物和氮的氧化物。
(2)铵的水溶液呈碱性,因此容易与酸反应生成盐。
本节课的主要学习内容:(1)能从化合价的变化理解浓硫酸、硝酸的氧化性。
(2)知道冷的浓硫酸、浓硝酸与铁、铝的钝化作用。
(3)学会氨气的实验室制取、收集、检验方法。
(4)掌握铵盐的性质。
(5)学会NH4+的检验方法。
四、教学思路(1)通过回忆酸的通性,引出浓硫酸、硝酸的强氧化性,设计实验验证这一性质。
(2)通过设疑,探究氨易溶于水,设计实验逐步引出氨的性质。
五、教学过程[第一课时]从酸的氧化性分类的角度回顾盐酸、硫酸、硝酸的特性。
[思考与交流]从元素组成的角度将H2SO4、HNO3、HCl分类。
共同点:有氢元素,在水溶液中电离时产生H+HCl==H++Cl-H2SO4==2H++SO42-讨论:实验室里用金属与酸反应制氢气时,往往用稀硫酸或盐酸,而不用浓硫酸或硝酸?从分子组成上认识浓硫酸与稀硫酸。


氨、硝酸、硫酸是化学常见的三种物质,它们在生活和工业中都有广泛的应用。
本文将以步骤思维的方式,介绍氨、硝酸和硫酸的基本知识点。
第一步:了解氨氨(NH3)是一种无色气体,具有刺激性气味。
它在自然界中存在于空气中、水中和土壤中。
氨可以通过工业生产或者自然的生物过程产生。
在工业上,氨通常是通过哈伯-博什过程合成的,该过程将氮气与氢气在高温、高压和催化剂的作用下反应生成氨。
氨是一种重要的化学原料,被广泛用于制造肥料、塑料、药物和清洁剂等。
第二步:认识硝酸硝酸(HNO3)是一种无色液体,具有强烈的腐蚀性。
它是一种强酸,可以与金属和非金属产生反应。
硝酸可以通过硝化反应制备,硝化反应是指有机物或无机物与硝酸发生反应,生成相应的硝基化合物。
硝酸是一种重要的化学品,在农业、药品制造、炸药制造等领域有着广泛的应用。
第三步:了解硫酸硫酸(H2SO4)是一种无色、无臭的液体,具有强烈的腐蚀性。
硫酸是一种二元强酸,可以与金属和非金属产生反应。
硫酸可以通过硫氧化反应制备,硫氧化反应是指硫或硫化物与氧气或过氧化氢反应生成硫酸。
硫酸是一种重要的化学品,广泛应用于电池制造、肥料制造、纺织业、制药业等。
第四步:氨、硝酸和硫酸的应用氨、硝酸和硫酸作为化学品,在生活和工业中有着广泛的应用。
氨被用于制造化肥,提供植物所需的氮元素;硝酸则被用于制造肥料和炸药;硫酸则可用于制造肥料、染料和药品。
此外,氨、硝酸和硫酸还被用于水处理过程中。
氨在水处理中可以作为一种去除氯气和氯胺的消毒剂。
硝酸则可以用于去除水中的重金属离子。
硫酸可用于调节水的酸度和碱度。
第五步:安全注意事项由于氨、硝酸和硫酸都具有腐蚀性和刺激性,使用时需要注意安全。
在操作这些化学品时,应戴上防护手套、护目镜和防护服,避免皮肤和眼睛的接触。
同时,在储存和处理这些化学品时,应遵循相关的安全操作规程,确保安全使用。
结论本文介绍了氨、硝酸和硫酸的基本知识点。
我们了解到氨是一种重要的化学原料,用于制造肥料和药物等;硝酸是一种强酸,广泛应用于农业和炸药制造等;硫酸则是一种重要的化学品,用于电池制造和制药业等。

新人教版高一化学必修1重点:氨、硝酸、硫酸嘀嗒嘀嗒,时钟欢乐地走过假期的每一天;叮咚叮咚,新学期的门铃已经悄然响起。
学校已敞开温暖的怀抱,欢迎同学们的到来!一起来看看新人教版高一化学必修1重点!问题一、实验室用铵盐与碱反应制备氨气,可以选用哪些常见的铵盐和碱?解答:常见的铵盐可以选用氯化铵或硫酸铵,不能选用碳酸铵、碳酸氢铵和硝酸铵,原因是碳酸铵等产生杂质气体。
常见的碱选用氢氧化钙,不能选用氢氧化钠,原因是主要考虑NaOH在高温下对玻璃的腐蚀性强,同时容易板结,不利于氨气的逸出。
问题二、为什么不能用氯化铵加热分解来制备氨气呢?解答:是因为氯化铵分解产生的氯化氢和氨气是直接混合的气体,离开加热部位后,气体温度降低后又会化合成氯化铵固体,实际效果相当于氯化铵升华之后在别的位置再凝华一般,到最后基本没有气体出来。
如果为了避免上述现象发生而提高反应温度从而被迫采用固体加热装置的话,氯化铵分解速度会很快,产生大量气体,容易引起试管爆裂,而且会引起严重倒吸。
基于以上原因,所以实验室不用氯化铵加热分解来制备氨气。
问题三、收集氨气试管口棉花的作用?解答:防止氨气与空气对流,以缩短收集氨气的时间。
问题四、工业上制硝酸,为什么不是把氮气直接氧化成一氧化氮,而是把氮气先变成氨气再氧化成一氧化氮呢?解答:氮气氧化成一氧化氮的条件是高温或放电,放电不容易实现,而高温是需要2019 ℃以上的温度,会消耗大量的能量,所以制备硝酸不采用直接氧化成一氧化氮而采用先氨化再氧化的方法。
问题五、浓硫酸的吸水是物理变化还是化学变化?解答:浓硫酸的吸水作用,指的是浓硫酸分子跟水分子强烈结合,生成一系列稳定的水合物,并放出大量的热:H2SO4+ nH2O == H2SO4·nH2O,故浓硫酸吸水的过程是化学变化的过程,吸水性是浓硫酸的化学性质。
问题六、如何区分浓硫酸的吸水性和脱水性?结晶水合物被浓硫酸夺去水体现浓硫酸的什么性质?解答:浓硫酸的吸水作用,指的是浓硫酸分子跟水分子强烈结合(这里所指的水包括一般的游离态水(如空气中的水),和某些结晶水合物(如CuSO4·5H2O、Na2CO3·10H2O)中的水)的过程。
新人教版高一化学氨硝酸硫酸知识点
氨(Ammonia,即阿摩尼亚),或称“氨气”,氮和氢的化合物,分子式为NH?,是一种无色气体,有强烈的刺激气味……接下来我们大家一起了解新人教版高一化学氨硝酸
硫酸知识点。
新人教版高一化学氨硝酸硫酸知识点2019
一、氨
(1)氮的固定
a:定义:将游离态的氮转变为氮的化合物叫做氮的固定
b.分类:放电
①自然固氮:高能固氮:N2+O2====2NO
生物固氮:豆科植物的根瘤菌固氮
②人工固氮:2N2+3H2
2NH3(条件:高温高压、催化剂)
(2)氨的分子式NH3,结构式,电子式,空间构型为三角锥形。
(3)氨是无色气体,有刺激性气味,极易溶于水,氨的水溶液叫氨水。
氨易液化。
(4)醮有浓盐酸的玻璃棒与醮有浓氨水的玻璃棒靠近,其现象为产生白烟,将浓盐酸改为
浓硝酸还会出现相同的现象。
(5)氨的化学性质
A 氨跟水的反应
氨溶于水时发生的化学反应为NH3+H2O=NH3?H2O =NH4++OH-,氨水的成份有NH3、H2O、NH3·H2O、NH4+、OH-,由于NH3·H2O 发生微弱电离,使氨水显碱性。
B 氨跟酸的反应
NH3+ HCl= NH4Cl 2NH3+H2SO4= (NH4)2SO4 NH3+HNO3= NH4 NO3 C 氨的氧化反应
加热
4NH3+O2=======4NO+6H2O 催化剂
二、铵盐
由铵根离子和酸根离子构成的化合物叫铵盐
(1)NH4+的电子式。
结构式,空间构型为正四面体形。
(2)铵盐都是离子化合物,都是晶体,都易溶于水
(3)铵盐受热都易分解,
①NH4Cl NH3↑+HCl↑。
②NH4HCO3NH3↑+H2O+CO2↑。
(4)铵盐与碱反应,写下列化学方程式:
①NH4Cl溶液与NaOH溶液混和NH4Cl+NaOH=NH3?H2O+NaCl。
②NH4Cl固体与熟石灰共热
Ca(OH)2(s)+2NH4Cl(s)=====2NH3↑+2H2O+CaCl2(实验室制氨气)。
三、氨气的制法:
1、工业制法2N2
+3H2
2、实验室制法
△ 2NH3(条件:高温高压、催化剂)
(1)原理:Ca(OH)2(s)+2NH4Cl(s) 2NH3↑+2H2O+CaCl2
(2)药品:NH4Cl固体与熟石灰(Ca(OH)2)
(3)装置:∵固+固气
∴使用大试管、单孔胶塞、导管、酒精灯、铁架台等。
(4)净化干燥:使用碱石灰,不能用CaCl2
(5)收集: NH3极易溶于水,比空气轻,用向下排空气法。
(6)验满:湿润的红色石蕊试纸变蓝色或蘸有浓盐酸的玻璃棒产生白烟
(7)处尾:用水吸收(注意防止倒吸)
新人教版高一化学氨硝酸硫酸知识点到这里就结束了,希望同学们的成绩能够更上一层楼。