(完整word版)高一化学《必修一》方程式总结,推荐文档
- 格式:doc
- 大小:194.01 KB
- 文档页数:7

必修一化学方程式以及离子方程式1、硫酸根离子的检验:BaCl2 + Na2SO4 = BaSO4↓+ 2NaCl SO42-+ Ba2+ == BaSO4↓2、碳酸根离子的检验:CaCl2 + Na2CO3 = CaCO3↓ + 2NaCl CO32-+ Ca2+== CaCO3↓3、碳酸钠与盐酸反应:Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑ CO32-+ 2H+== CO2↑+ H2O 4、铝与硝酸铜溶液反应:2Al+3Cu(NO3)2= 2Al(NO3)3+ 3Cu 2Al+3Cu2+= 2Al3++ 3Cu5、钠在空气中燃烧(黄色的火焰)2Na +O2Na2O2钠块在空气中变暗4Na+O2=2Na2ONa2O在空气中加热(变黄)2Na2O+O2△2Na2O26、钠与水反应(浮、熔、游、响、红)2Na +2H2O =2 NaOH +H2↑2Na +2H2O =2Na++2OH-+H2 ↑7、过氧化钠与水的反应(放热反应、Na2O2是强氧化剂,用于漂白)2Na2O2+2H2O =4NaOH +O2↑2Na2O2+2H2O =4Na++4OH-+O2↑碱性氧化物Na2O与水的反应Na2O+H2O=2NaOH8、过氧化钠可用在呼吸面具和潜水艇中作为氧气来源,原因是:2Na2O2+2CO2=2Na2CO3+O29、苏打(纯碱)与盐酸反应①盐酸中滴加纯碱溶液Na2CO3+2HCl =2NaCl+H2O+CO2↑CO32-+2H+=H2O +CO2↑②纯碱溶液中滴加盐酸,至过量Na2CO3+HCl =NaHCO3+NaCl CO32-+H+=HCO3-NaHCO3+HCl=NaCl+H2O+CO2↑ HCO3-+H+=H2O +CO2↑10、小苏打受热分解2NaHCO3△Na2CO3+H2O +CO2 ↑11、固体氢氧化钠和碳酸氢钠混合物在密闭容器中加热NaHCO3+NaOH △Na2CO3+H2OHCO3-+OH -=H2O +CO32-(若是溶液中反应有离子方程式)12、铝箔在氧气中剧烈燃烧4Al +3O2点燃2Al2O313、铝片与稀盐酸反应2Al +6HCl =2AlCl3+3H2↑2Al +6H+=2Al3++3H2↑14、铝与氢氧化钠溶液反应2Al+2NaOH +2H2O =2NaAlO2-+3H2↑2Al +2OH -+2H2O =2AlO2-+3H2↑15、铝与三氧化二铁高温下反应(铝热反应)2Al +Fe2O3高温2Fe +Al2O316、氧化铝溶于氢氧化钠溶液Al2O3+2NaOH 2NaAlO2+H2OAl2O3+2OH -=2AlO2-+H2O17、硫酸铝溶液中滴过量氨水Al2(SO4)3+6NH3·H2O=2Al(OH)3↓+3(NH4)2SO4Al3++3 NH3·H2O =Al(OH)3↓+3NH4+18、①氢氧化铝溶液中加盐酸Al(OH)3+3HCl =AlCl3+3H2OAl(OH)3+3H+=Al3++3H2O②Al(OH)3与NaOH溶液反应Al(OH)3+NaOH NaAlO2+2 H2OAl(OH)3+OH-=AlO2-+2 H2O19、高温下铁与水反应3Fe +4H2O(g) 高温Fe3O4+4H220、铁与盐酸反应Fe +2HCl =FeCl2+H2↑ Fe +2H+=Fe2++H2↑21、氧化铁溶于盐酸中Fe2O3+6HCl =2FeCl3+3H2OFe2O3+6H+=2Fe3++3H2O22、氯化铁中滴入氢氧化钠溶液(红褐色沉淀)FeCl3+3NaOH =Fe(OH)3↓+3NaClFe3++3OH -=Fe(OH)3↓23、氢氧化亚铁在空气中被氧化(白色沉淀变为红褐色沉淀)4Fe (OH)2+O2+2H2O =4Fe (OH)324、氯化亚铁溶液中通入氯气2FeCl2+Cl2=2FeCl3 2 Fe2++Cl2=2 Fe3++2Cl-25、氯化铁溶液中加入铁粉2FeCl3+Fe =3FeCl2 2Fe3++Fe =3Fe2+26、用KSCN检验Fe3+的存在离子方程式Fe3++3SCN-= Fe (SCN)3 (血红色)27、工业制单质硅(碳在高温下还原二氧化硅)SiO2+2C 高温Si +2CO↑28、二氧化硅与氢氧化钠反应SiO2+2NaOH =Na2SiO3+H2O(常温下强碱缓慢腐蚀玻璃)SiO2+2OH -=SiO32-+H2O29、硅与氧气反应Si(粉)+O2△SiO230、硅与氢氧化钠溶液反应Si+2NaOH+H2O=Na2SiO3+2H2↑Si + 2OH-+ H2O == SiO32-+ 2H2↑31、制玻璃SiO2+Na2CO3高温Na2SiO3+CO2 SiO2+CaCO3高温CaSiO3+CO2 32、氯气和非金属反应Cl2 +H22HCl (或光照)3Cl2 +2P2PCl3Cl2 +PCl3PCl533、氯气和金属反应3Cl2 +2Fe2FeCl3Cl2 +2Na2NaClCl2+Cu CuCl234、强氧化性:Cl2 +2FeCl2=2FeCl3Cl2 + 2Fe2+ == 2Fe3+ + 2Cl-Cl2+2NaBr =Br2+2NaCl Cl2+2Br-=Br2+2Cl-Cl2 + 2KI =2KCl + I2Cl2 + 2I-== 2Cl-+ I235、氯气溶于水Cl2+H2O=HCl +HClO Cl2+H2O ==Cl-+H++HClO光照2HClO 2HCl +O2↑36、氯气和二氧化硫Cl2+SO2 +2H2O=H2SO4 +2HCl37、制漂白液:Cl2+2NaOH=NaCl+NaClO+H2O38、制漂粉精、漂白粉2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O39、漂白粉变质Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO40、氮气和氢气反应(工业合成氨)N2+3H2催化剂高温高压2NH341、氮气和氧气放电下反应(雷雨发庄稼)N2+O2 2NO2NO +O22NO242、二氧化氮溶于水3NO2+H2O 2HNO3+NO3NO2+H2O 2H++2NO3-+NO43、NH3+HCl=NH4Cl(白烟)44、HNO3与Fe的反应Al、Fe遇冷浓HNO3、浓硫酸钝化(常温)Fe与浓HNO3加热Fe+6HNO3△Fe(NO3)3+3NO2↑+3H2O45、Fe与稀HNO3反应Fe+4HNO3(过量)=Fe(NO3)3+NO↑+2H2O3Fe(过量)+8HNO3=3Fe(NO3)2+2NO↑+4H2O 46、氨气的实验室制法:2NH4Cl + Ca(OH)2△CaCl2 + NH3↑ + H2O47、4HNO34NO2↑+O2↑+2H2O48、4HNO3(浓)+C △CO2↑+4NO2↑+2H2O49、4HNO3(浓)+Cu=Cu(NO3)2+2NO2↑+2H24H++ 2NO3-+ Cu == Cu2+ + 2NO2↑+ 2H2O8 HNO3(稀)+3Cu=3Cu(NO3)2+2NO↑+4H2O8H+ +2NO3-+ 3Cu == 3Cu2++ 2NO↑+ 4H2O 50、NO2、O2的混合气通入水中无剩余气体4NO2+O2+2H2O =4 HNO351、NO 、O2的混合气通入水中无剩余气体放电4NO+3O2+2H2O =4 HNO352、氨的催化氧化4NH3+5O24NO +6H2O53、碳酸氢铵受热分解NH4HCO3△NH3↑+H2O↑ +CO2↑54、用浓盐酸检验氨气(白烟生成)HCl +NH3=NH4Cl55、硫酸铵溶液与氢氧化钠溶液混合加热(NH4)2SO4+2NaOH△3↑+Na2SO4+2H2ONH4++OH -△NH3↑+H2O56、硝酸铵溶液与氢氧化钠溶液混合(不加热)NH4NO3+NaOH =NH3·H2O +NaNO3NH4++OH-=NH3·H2O57、硫及其化合物的化学性质:S+H2△H2S S+Fe△FeSS+2Cu△Cu2S S+O2点燃SO23S+6NaOH△2S+Na2SO3+3H2O3S + 6OH-△2S2-+ SO32-+ 3H2OSO2 + 2H2S=3S+2H2O SO2+H2O=H2SO32NaOH+SO2(少量)=Na2SO3+H2O SO2 + 2OH-== SO32-+ H2O NaOH+SO2(足量)=NaHSO3SO2 + OH-== HSO3-2SO2+O2催化剂2SO3加热2H2SO4(浓)+C△2↑+2SO2↑+2H2O2H2SO4(浓)+Cu△4+SO2↑+2H2ONa2SO3+H2SO4 = Na2SO4+ SO2↑+ H2O SO32-+ 2H+ == SO2↑+ H2O。

高一化学《必修一》方程式(按章节归纳)第一、二章:1、硫酸根离子的检验 :BaCI 2 + Na 2SO 4 = BaS04 J + 2NaCI2、碳酸根离子的检验:CaCl 2 + Na 2CO 3 = CaC03 J + 2NaCI3、 银离子的检验: CI + Ag = AgCI J高温4、 木炭还原氧化铜:2CuO + C 2Cu + CO 2? 6. 镁在二氧化碳中燃烧 第三章: 一、钠1、钠在空气中燃烧(黄色的火焰) :2Na + O 2 亠■ Na 2O 22、 钠块在空气中变暗 :4Na + O 2= 2Na 2O3、 Na 2O 在空气中加热(变黄):2Na 2O +2Na 2O 24、 金属锂在空气中燃烧 :4Li + O 2 2Li 2O5、钠与水反应(浮、熔、游、响、红)2Na + 2H 2O = 2NaOH + H 2 ? 2Na + 2H 2O、Na 2O 、Na 2O 2的相关反应:1、 碱性氧化物 Na 2O 与水的反应 :Na 2O + H 20 = 2NaOH2、 过氧化钠与水的反应(放热反应、 Na 2O 2是强氧化剂,可用于漂白)2Na 2O 2 + 2H 2O = 4NaOH + O 2 ? 2Na 2O 2 + 2H 2O = 4Na ++ 4OH 「+ O 2T3、 碱性氧化物 Na 2O 与CO 2的反应 Na 2O + CO 2 = Na 2CO 34、 过氧化钠可用在呼吸面具和潜水艇中作为氧气来源(供氧剂) ,原因是:2Na 2O 2 + 2CO 2 = 2Na 2CO 3 + O 25、 Na 2O + SO 2 = Na 2SO 3 Na 2O 2 + SO 2 = Na 2SO 46、 Na 2O + 2HCI = 2NaCI + H 2O7、 2Na 2O 2 + 4 HCI = 4 NaCI + 2 H 2O + O 2 ?三、NaHCO 3 与 Na 2CO 33、若是氢氧化钠和碳酸氢钠溶液中反应有离子方程式:5、铁片与硫酸铜溶液反应Fe + CuSO 4 = FeSO 4 + Cu点燃2Mg + CO 2 2MgO + C1、小苏打受热分解:△2NaHCO 3 =Na 2CO 3 + H 2O + CO 2 ?2、固体氢氧化钠和碳酸氢钠混合物在密闭容器中加热 △NaHCO 3 + NaOH W2CO 3 + H 2ONaHCO3 + NaOH = W2CO3 + H2OHCO3「+ OH「= H2O + CO324、向NaOH 溶液中通入少量CO2 : 2NaOH + CO 2 = Na2CO3 + H2O5、继续通入过量CO2 : Na2CO3 + CO2 + H2O = 2 NaHCO 3总反应方程式:NaOH + CO 2 = NaHCO 36、 苏打(纯碱)与盐酸反应: ① 盐酸中滴加纯碱溶液Na 2CO 3 + 2HCl = 2NaCl + H 2O + CO 2 f CO 32一 + 2H += H 2O + CO 2 f② 纯碱溶液中滴加盐酸,至过量 Na 2CO 3 + HCl = NaHCO 3 + NaCl CO 32 一 + H += HCO 3「NaHCO 3+ HCl = NaCl + H 2O + CO 2 fHCO 3H += 出0 + CO 2 f7、 (1)Na 2CO 3溶液、NaHCO 3溶液与 Ca(OH )2反应:Na 2CO 3 + Ca(OH )2 = CaCO 3j+ 2 NaOHNaHCO 3 + Ca(OH) 2 (多)= CaCO 3 J+ NaOH + H 2O 2NaHCO 3 + Ca(OH )2 (少)= CaCO 3j+ Na 2CO 3 + 2H 2O 8、 Na 2CO 3溶液、NaHCO 3溶液与 CaCl 2 反应:Na 2CO 3 + CaCl 2 = CaCO 3 J+ 2 Na ClNaHCO 3溶液与 CaCl 2不反应; 四、铝点燃1、 铝与氯气反应:2AI + 3C12 2AICI 32、 铝片与稀盐酸反应 2AI + 6HCI = 2AICI 3 + 3H 2f 2AI + 6H = 2AI 3 + 3H 2 f3、 铝与氢氧化钠溶液反应2AI + 2NaOH + 2H 2O = 2NaAIO 2 + 3H 2f (只有 H 2O 作氧化剂) 2AI + 2OH 一 + 2H 2O = 2AIO 2一 + 3H 2f△电解4、 4AI + 3O 2^=2Al 2O 3 电解熔融的氧化铝: 2AI 2O 34AI + 3O 2 f高温5、 铝与氧化铁高温下反应【铝热反应】 :2AI + Fe 2O 32Fe + AI 2O 3△6、 不稳定性:2AI(OH) 3 AI 2O 3 + 3H 2O7、 硫酸铝溶液中滴过量氨水【实验室制备 AI(OH) 3】Al 2(SO 4)3 + 6NH 3 H 2O==错误!未找到引用源。

高一必修1化学方程式总结(汇编3篇)1.高一必修1化学方程式总结第1篇二氧化硅和硅酸必记方程式一二氧化硅二氧化碳的性质(1)与H2O反应 CO2+H2OH2CO3(2)与碱液反应CO2少量: CO2+2NaOH===Na2CO3+H2OCO2足量: CO2+NaOH===NaHCO3(3)与碱性氧化物反应CO2+Na2O=== Na2CO3CaO+CO2===CaCO3(4)与盐反应CO2+Na2CO3+H2O =2NaHCO3二氧化硅的性质(1)与碱液反应 SiO2+2NaOH===Na2SiO3+H2O(2)与碱性氧化物反应 CaO+SiO2高温=====CaSiO3(4)与酸反应只与氢氟酸反应:SiO2+4HF===SiF4↑+2H2O(5)与盐反应SiO2+Na2CO3高温Na2SiO3+CO2↑SiO2+CaCO3高温CaSiO3+CO2↑(6) 2C+SiO2高温=====Si+2CO↑二硅酸硅酸的制备:(1)Na2SiO3溶液与盐酸反应:Na2SiO3+2HCl===H2SiO3↓+2NaCl。
(2)将CO2通入Na2SiO3溶液中:Na2SiO3+CO2+H2O===H2SiO3↓+Na2CO3。
硅酸加热分解H2SiO3△=====SiO2+H2O2.高一必修1化学方程式总结第2篇第四章第四节硫酸和硝酸的氧化性一浓硫酸的特性【课堂导学1】一、浓硫酸的特性将一瓶浓硫酸敞口放置在空气中,其质量的变化是增大,变化的原因是浓硫酸能吸收空气中的水蒸气。
若将一瓶浓盐酸(或浓硝酸)敞口放置在空气中,其质量的变化是减小,原因是浓盐酸(或浓硝酸)易挥发,溶质减少。
将一定量的蔗糖放入小烧杯中,加入浓硫酸,观察到的现象是白色蔗糖变黑、体积膨胀,变成疏松多孔的海绵状的炭,并放出有刺激性气味的气体,发生反应的化学方程式是C12H22O11浓硫酸――→12C+11H2O。
【归纳总结1】浓硫酸的特性(1)吸水性:浓硫酸可以吸收空气或其他气体中的水蒸气、混在固体中的湿存水、结晶水合物中的结晶水。
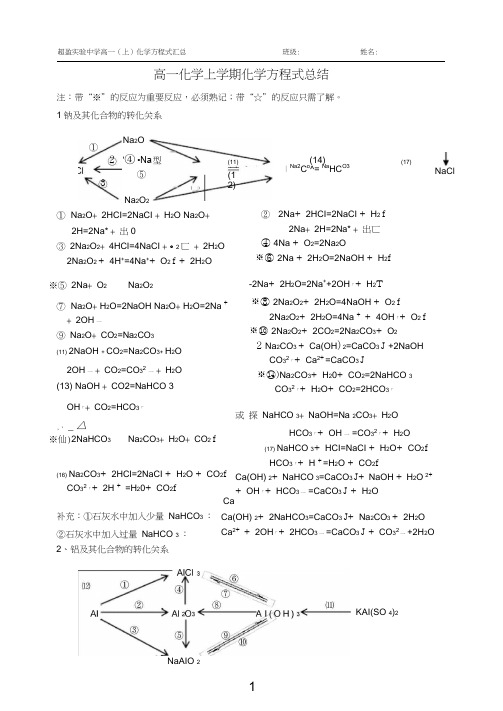
高一化学上学期化学方程式总结注:带“※”的反应为重要反应,必须熟记;带“☆”的反应只需了解。
1钠及其化合物的转化关系① Na 2O + 2HCI=2NaCI + H 2O Na 2O +2H=2Na* + 出0③ 2Na 2O 2+ 4HCI=4NaCI +。
2匸 + 2H 2O 2Na 2O 2 + 4H +=4Na ++ O 2 f + 2H 2O※⑤ 2Na + O 2 Na 2O 2⑦ Na 2O + H 2O=2NaOH Na 2O + H 2O=2Na + + 2OH 一⑨ Na 2O + CO 2=Na 2CO 3(11) 2NaOH + CO 2=Na 2CO 3+ H 2O2OH 一 + CO 2=CO 32 一 + H 2O (13) NaOH + CO2=NaHCO 3 OH 「+ CO 2=HCO 3「,、 _△※仙)2NaHCO 3Na 2CO 3+ H 2O + CO 2 f(16) Na 2CO 3+ 2HCI=2NaCI + H 2O + CO 2f CO 32「+ 2H + =H 20+ CO 2f 补充:①石灰水中加入少量 NaHCO 3 : ②石灰水中加入过量 NaHCO 3 :② 2Na + 2HCI=2NaCI + H 2 f2Na + 2H=2Na* + 出匸④ 4Na + O 2=2Na 2O※⑥ 2Na + 2H 2O=2NaOH + H 2f-2Na + 2H 2O=2Na ++2OH 「+ H 2T※⑧ 2Na 2O 2+ 2H 2O=4NaOH + O 2 f2Na 2O 2+ 2H 2O=4Na + + 4OH 「+ O 2 f※⑩ 2Na 2O 2+ 2CO 2=2Na 2CO 3+ O 22 Na 2CO3 + Ca(OH )2=CaCO 3 J +2NaOHCO 32「+ Ca 2+=CaCO 3 J※⑭)Na 2CO 3+ H 20+ CO 2=2NaHCO 3CO 32「+ H 2O + CO 2=2HCO 3「或 探 NaHCO 3+ NaOH=Na 2CO 3+ H 2OHCO 3「+ OH 一 =CO 32「+ H 2O(17) NaHCO 3+ HCI=NaCI + H 2O + CO 2fHCO 3「+ H +=H 2O + CO 2fCa(OH) 2+ NaHCO 3=CaCO 3 J+ NaOH + H 2O 2++ OH 「+ HCO 3一 =CaCO 3 J + H 2O3①2 Na 2O'④ •Na 型 ⑤ Na 2O 2(11)(12)(14)INa2C o^= Na HC O3(17)NaCl2、铝及其化合物的转化关系KAI(SO 4)2NaAIO 2CaCa(OH) 2+ 2NaHCO 3=CaCO 3 J+ Na 2CO 3 + 2H 2O Ca 2+ + 2OH 「+ 2HCO 3一 =CaCO 3 J + CO 32一 +2H 2O① 2AI + 6HCI=2AICI 3+ 3H2f2AI + 6H +=2AI 3+ + 3H2?※③ 2AI + 2Na0H + 2H2O=2NaAIO 2+ 3H2 f 2AI + 20H「+ 2H2O=2AIO 2「+ 3H2?※⑤ AI 2O3 + 2NaOH=2NaAIO 2+ H2O AI 2O3+ 2OH一=2AIO 2「+ H2O⑦AI(OH) 3 + 3HCI=AICI 3+ 3H2O④ AI 2O3 +6HCI=2AICI 3+ 3H2O AI2O3+ 6H =2AI3+3H2O⑥ AICI 3+ 3NH3 H2O=AI(OH) 3 J + 3NH 4CI AI3+ + 3NH 3 H2O = AI(OH) 3 J+ 3NH 4+△⑧2AI(OH) 3 Al 2O3+ 3H2OAI(OH) 3 + 3H +=AI 3++ 3H2O☆⑨ NaAIO2+ HCI + H2O =AI(OH) 3J + NaCI 或NaAIO 2 + 2H2O+ CO2=AI(OH) 3J+ NaHCO3 AIO2 + H + H2O=AI(OH) 3 J AIO2 + 2H2O+ CO2=AI(OH) 3J + HCO 3※⑩ AI(OH) 3+ NaOH = NaAIO 2+ 2H2O ☆(□) AI3++ 3H2O^=AI(OH) 3胶体+ 3H + AI(OH) 3+ OH 一= AIO2「+ 2H2O 明矶净水(12)AICI 3+ 4NaOH = NaAIO 2+ 3NaCI + 2H2O AI3 ++ 4OH「= AIO 2「+ 2H2O3、铁及其化合物的转化关系③Fe+ 2HCI=FeCI 2+ H2f_ Fe+ 2H +=Fe2+ + 出 f※⑤ 2FeCI2+ CI2 = 2FeCl32Fe2++ CI2 = 2Fe3++ 2C「⑦ FeCI2+ 2NaOH = Fe(OH) 2 J + 2NaCI Fe2++ 2OH 一= Fe(OH) 2 J※⑨ 4Fe(OH)2+ O2 + 2H2O = 4Fe(OH) 3 白色沉淀迅速变成灰绿色,最后变成红褐色(ll)Fe(OH)3 + 3HCI = FeCI 3+ 3H2OFe(OH) 3 + 3H += Fe3+ + 3H 2O3 Fe2O3 + 6HCI = 2FeCI 3+ 3H2OFe2O3 + 6H = 2Fe3+ 3出0咼温3Fe+4H2O(g) Fe3O4+ 4H 2点燃④2Fe+ 3CI2 2FeCI3※⑥ Fe+ 2FeCI3 = 3FeCl2Fe+ 2Fe3 = 3Fe2⑧ Fe(OH)2+ 2HCI = FeCI 2+ 2H 20Fe(OH)2 + 2H += Fe2+ + 2H2O ⑩ FeCI3+ 3NaOH = Fe(OH) 3 J + 3NaCIFe3+ + 30H「= Fe(OH) 3 JFe3++ 3出0=^ Fe(0H)3 胶体+ 3H +(净水)△Fe3O4 - °FeFe(SCN)3^^⑦FeCI2飞⑥FeCb W⑩(11)Fe(OH)2Fe(OH) 3 一2'> Fe2O3(13)② 4AI + 302 2AI 2O3① Fe3O4 + 4CO △3Fe+ 4CO2点燃或3Fe+ 2O2 Fe3O422Fe(OH)3 ^=Fe2O3+ 3H2OFe3 + + 3SCN「= Fe(SCN)3※⑭)FeCI3+ 3KSCN = Fe(SCN) 3 + 3KCI※⑦ Na 2SiO 3 + H 2O +CO 2=H 2SiO 3 J+ Na 2CO 3或 Na 2SiO 3 + 2H 2O + 2CO 2=H 2SiO 3 J+ 2NaHCO 3 SiO 32「+ H 2O + CO 2=H 2SiO 3 J + CO 32一或 SiO 32「+ 2H 2O + 2CO 2=H 2SiO 3 J + 2HCO 3「H 2SQ 3+ 2OH = SiO 32 + 2H 2O5、氯及其化合物的转化关系※⑩ Ca(ClO)2+ H 2O + CO 2 = CaCO 3 J + 2HClO 或 Ca(ClO )2 + 2HCl = CaCl 2+ 2HClO Ca 2 + 2ClO + H 2O + CO 2= CaCO 3 J + 2HClO 或 ClO + H = HClOCO 2: Ca(ClO) 2+ 2H 2O + 2CO 2 = Ca(HCO 3)2+ 2HClO ClO 「+ H 2O + CO 2 = HCO 3「+ HClO△① Si + O 2 ^=SiO 24、硅及其化合物的转化关系Si SiF 4咼温②SiO 2 + 2C Si + 2CO f※③ SiO 2 + 4HF = SiF 4f + 2H 2O (刻蚀玻璃)④Si + 4HF = SiF 4f+ 2H 2 f※⑥ SiO 2 + 2NaOH = Na 2SQ 3+ H 2O SiO 2+ 20H = SiO 32 + H 2O 高温木 jSi°2+ Na 2CO 3:Na 2SiO 3+ CO 2 f 咼温SiO 2+ CaO CaSiO 3咼温SiO 2+ CaCO 3CaSiO 3+ CO 2※⑦ Na 2SiO 3+ 2HCl = H 2SQ 3 J+ 2NaCl"一 SiO 32「+ 2H += H 2SQ 3 J ⑧H 2SQ 3+ 2NaOH = Na 2SQ 3 + 2H 2O△⑨ H 2SQ 3 H 2O + SiO 2HClHClO ・⑩Ca(ClO) 2NaClOCuCl 2 ―FeCl 3※⑥ Cl 2+ H 2O = HCl + HClO CI 2+ H 2O = H + + C 「+ HClO 点燃① 2Fe + 3Cl 22FeCl 3 点燃② Cu + Cl 2CuCl 2③ 2FeCl 3 + Cu = 2FeCl 2 + CuCl 22Fe 3 + Cu = 2Fe 2 + Cu 2点燃④ H 2 + Cl 22HCl或光照 △※⑤ MnO 2+ 4HCl(浓)^= MnCl 2+ Cl 2f + 2H 2O Mn O 2+ 4H + + 2C 「=^ Mn 2++ Cb f + 2H 2O 光照 ※⑦ 2HClO 2HCl + O 2f光照+—+※⑧ Cl 2+ 2NaOH = NaCl + NaClO + H 2O※⑨ 2Cl 2+ 2Ca(OH )2 = CaCl 2 + Ca(ClO )2+ 2H 2OCl 2+ 2OH 「= C 「+ ClO 「+ H 2O工业制漂白粉漂白粉的漂白原理 向漂白粉溶液中通入过量的Cl 2⑧ ⑤ ■④6、硫及其化合物的转化关系⑨Cu① VS ----------- S02② 卜点燃① S + 02 S02卢 H 2SO 4A⑧氯水 ④ S03+ H 2O = H 2SO 4 △⑤ SO 2 + CaO^=CaSO 3®SO 3 + CaO = CaSO 4S03 + Ca (0H )2 = CaS04+ H 2OL S02 + Ca (OH ) 2 = CaS03 J+ H 2O SO 2 + Ca 2++ 20H_=CaS03j + H 2O一 △⑦ 2CaSO 3+ 02 2CaSO 4—△※⑧ S02 + CI 2+ 2H 2O = H 2SO 4+ 2HCI ※⑨ Cu + 2H 2SO 4(浓) CuS04+ SO 2 f+ 2H 2O△+ -Cu + 2H 2SO 4(浓)=Cu 2 +SO 42 +S02f+ 2H 2O 2 一 一S02 + CI 2 + 2H 2O = 4H + SO 42 + 2CI△※⑩ C + 2H 2SO 4(浓) C02f + 2SO 2T 7、氮及其化合物的转化关系2H 2O※①N 2+ 02 咼温或放电-2N0 ※② 2N0 + 02 = 2NO 2※③ 3NO 2+ H 2O = 2HN0 3+ NO 3NO 2+H 2O =2H + + 2NO 3 一+ NO以上三个反应为“雷雨发庄稼”原理 扩展反应有:4NO 2+ 02 + 2H 2O = 4HN0 34N0 + 302+ 2H 2O = 4HN0 3※④ Cu + 4HNO 3(浓)=Cu (NO 3)2 + 2NO 2T + 2H 2O Cu + 4H ++ 2NO 3 一 =Cu 2+ + 2NO 2T + 2H 2O或 C + 4HNO 3(浓)^= CO 2T+ 2NO 2T + 2H 2O上面两个反应主要用于气体溶于水时的计算光照 4NO 2f + 02 f + 2H 2O 4HNO 3 ※⑤ 3Cu + 8HNO 3(稀)=3Cu (NO 3)2 + 2NO f + 4H 2O 3Cu + 8H + + 2NO 3一 =3Cu 2++ 2NO f + 4H 2O ⑦ NH 3+ HCI = NH 4CI NH 3+ H = NH?(水溶液中)氨气与酸均能反应生成铵盐,且与挥发性酸(如浓HCI 、浓HNO 3)相遇时空气中有白烟△ 浓硝酸见光易变黄的原因 催化剂⑥N 2+ 3H 2・高温高压'2NH 3 合成氨反应是人工固氮的主要途径 △ ⑧NH 4CI ^^NH 3f + HCl f 补充:NH 4HCO 3 = NH 3 f +H 2O+CO 2T 铵盐受热都易分解,但并不是所有的铵盐 都分解出氨气,如 NH 4NO 3、(NH 4)2SO 4 + - △NH 4 + OH NH 3f + H 2O※⑧ NH 4CI + NaOH ^=NaCI + NH 3f + H 2O所有的铵盐都能与碱作用放岀氨气,可利用此反应鉴别铵离子。

人教版《化学必修1》化学方程式归纳一、铝及其化合物1.铝与氧气的反应:4Al + 3O2 2Al2O32.铝与氧化铁反应(铝热反应):2Al + Fe2O3高温2Fe + Al2O33.铝和稀盐酸:2Al + 6HCl = 2AlCl3+ 3H2↑离子方程式:2Al + 6H+= 2Al3++ 3H2↑4.铝和NaOH溶液:2Al+2NaOH+2H2O=2NaAlO2+3H2↑离子方程式:2Al+2OH-+2H2O=2AlO2-+3H2↑5.氧化铝和稀硫酸:Al2O3+3H2SO4=Al2(SO4)3+3H2O_离子方程式:Al2O3+6H+=2Al3++3H2O6.氧化铝和NaOH溶液:Al2O3 + 2NaOH = 2NaAlO2 +H2O离子方程式:Al2O3 + 2OH-=2AlO2-+H2O7.氢氧化铝和盐酸:Al(OH)3+3HCl = AlCl3+3H2O离子方程式:Al(OH)3+3H+= Al3++3H2O8.氢氧化铝和NaOH溶液:Al(OH)3+NaOH =NaAlO2+2H2O离子方程式:Al(OH)3+OH-= AlO2-+2H2O9.氢氧化铝受热分解:_2Al(OH)3Al2O3+3H2O _10.硫酸铝与氨水反应:Al2(SO4)3+6NH3·H2O=2Al(OH)3↓+3(NH4)2SO4离子方程式:_ Al3++3NH3·H2O=Al(OH)3↓+3NH4+_______11.AlCl3溶液中加入少量NaOH溶液:AlCl3+3NaOH=A l(O H)3↓+3NaClAlCl3溶液中加入过量NaOH溶液:AlCl3 + 4NaOH = NaAlO2 + 3NaCl+2H2O12.往偏铝酸钠溶液中通入少量CO2:2NaAlO2+3H2O+CO2=2A l(O H)3↓+Na2CO3往偏铝酸钠溶液中通入足量CO2:NaAlO2+2H2O+CO2=A l(O H)3↓+NaHCO313.电解氧化铝: 2Al2O3 4Al+3O2↑二、钠及其化合物1.钠与氧气:常温:4Na+O2=2Na2O 点燃:2Na + O2 Na2O22.钠与水反应:_2Na + 2H2O =2NaOH + H2↑_离子方程式:2Na + 2H2O =2Na++2OH- + H2↑3.钠与硫酸反应:2Na +H2SO4= Na2SO4+H2↑4.氧化钠与水反应:Na2O+H2O=2NaOH5.过氧化钠与二氧化碳反应:2Na2O2 + 2CO2 = 2Na2CO3 +O2↑6.过氧化钠与水反应:2Na2O2+2H2O =4NaOH+O2↑离子方程式:2Na2O2+2H2O=4Na++4OH-+O2↑7.NaOH溶液中通入少量CO2:2NaOH+CO2= Na2CO3+H2O 离子方程式:2OH-+CO2= CO32-+H2ONaOH溶液中通入过量CO2:NaOH+CO2= NaHCO3 离子方程式:_ OH-+CO2= HCO3-_____8.①向碳酸钠溶液滴入少量稀盐酸: Na2CO3 + HCl = NaHCO3 + NaCl向稀盐酸滴入少量碳酸钠溶液: Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑②除去碳酸氢钠溶液中混有的碳酸钠: Na2CO3 + H2O +CO2 =2NaHCO3③碳酸钠与氢氧化钙: Na2CO3 + Ca(OH)2=CaCO3↓ + 2NaOH④碳酸氢钠与盐酸: NaHCO3+HCl=NaCl+H2O+CO2↑⑤少量碳酸氢钠溶液滴入氢氧化钙溶液中: NaHCO3+ Ca(OH)2=CaCO3↓ + NaOH+ H2O少量氢氧化钙溶液滴入碳酸氢钠溶液中: 2NaHCO3+ Ca(OH)2=CaCO3↓ + Na2CO3 +2H2O⑥除去碳酸钠溶液中的碳酸氢钠: NaHCO3 + NaOH Na2CO3 + H2O⑦除去碳酸钠固体中的碳酸氢钠: 2NaHCO3 Na2CO3 + H2O +CO2 ↑⑧鉴别碳酸钠和碳酸氢钠溶液: Na2CO3 + CaCl2=CaCO3↓ + 2NaCl三、硅及其化合物1.硅与氧气加热:Si+O2SiO2 硅与氟气:_ Si+2F2=SiF4 __2.硅单质与氢氟酸反应:Si+4HF=SiF4+2H23.硅与氢氧化钠溶液反应:Si+2NaOH+H2O=Na2SiO3+2H2↑ 4.二氧化硅与氢氟酸反应:_4HF+SiO2=SiF4↑+2H2O _5.二氧化硅与氧化钙高温反应:SiO2+CaO 高温CaSiO3__6.二氧化硅与氢氧化钠溶液反应:SiO2+ 2NaOH = Na2SiO3 + H2O __7.二氧化硅与碳反应:_ SiO2 + 2C高温Si + 2CO↑_8.硅酸钠与盐酸反应:_ Na2SiO3+2HCl=H2SiO3↓+2 NaCl__离子方程式:SiO32-+2H+=H2SiO3↓9.往硅酸钠溶液中通入二氧化碳:_ Na2SiO3 +CO2+H2O == H2SiO3↓+ Na2CO3_10.二氧化硅与纯碱反应:SiO2+Na2CO3高温Na2SiO3+CO2↑_11.二氧化硅与石灰石反应:_ SiO2+CaCO3高温CaSiO3+CO2↑_12.加热硅酸:H2SiO3SiO2+H2O四、铁及其化合物1.铁与氧气反应:3Fe + 2O2Fe3O4铁与硫反应:Fe + S FeS2.铁与盐酸反应:Fe + 2HCl = FeCl2 + H2↑离子方程式:Fe + 2H+ = Fe2+ + H2↑_铁与CuSO4溶液:Fe+CuSO4=FeSO4+Cu离子方程式:Fe+Cu2+=Fe2++Cu_3.铁和水蒸气:_3Fe + 4H2O(g) 高温Fe3O4 + 4H2_4.氧化亚铁与盐酸反应:FeO+2HCl=FeCl2+H2O 离子方程式:FeO+2H+=Fe2++H2O _5.氧化铁与盐酸反应:_ Fe2O3+6HCl=2FeCl3+3H2O离子方程式:Fe2O3+6H+=2Fe3++3H2O_6.CO还原氧化铁:_ Fe2O3 + 3CO 高温2Fe + 3CO2_7.氯化铁与氢氧化钠溶液:FeCl3+3NaOH = Fe(OH)3↓+3NaCl_离子方程式:Fe3++3OH-= Fe(OH)3↓8.硫酸亚铁与氢氧化钠溶液:FeSO4+2NaOH=Fe(OH)2↓+Na2SO4离子方程式:Fe2++2OH-= Fe(OH)2↓9.氢氧化铁加热分解:__2Fe(OH)3Fe2O3+3H2O_____10.氢氧化亚铁被氧化成氢氧化铁:4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3 _11.除去FeCl2中的FeCl3:2FeCl3 + Fe = 3FeCl2 _离子方程式:2Fe3+ + Fe = 3Fe2+_12.FeCl2和Cl2反应:_2FeCl2+ Cl2= 2FeCl3_离子方程式:_2Fe2++ Cl2= 2Fe3++2Cl-13.FeCl3和Cu反应:2FeCl3+Cu=2FeCl2+CuCl2_离子方程式:2Fe3++Cu=2Fe2++Cu2+14.氯化铁与硫氰化钾溶液反应:_ Fe3+ + 3SCN- = Fe(SCN)3 ___五、氯及其化合物1.实验室制氯气:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O_离子方程式:MnO2+4H++2Cl- Mn2++Cl2↑+2H2O2.钠在氯气中燃烧:_2Na+Cl2 2NaCl _铁在氯气中燃烧:2Fe+3Cl2 2FeCl3_铜在氯气中燃烧:Cu + Cl2 CuCl2氢气在氯气中燃烧:H2 + Cl2 2HCl _3.氯气和水反应:Cl2 + H2O = HCl + HClO 离子方程式:Cl2 + H2O = H++Cl- + HClO4.次氯酸光照分解:_2HClO 2HCl + O2↑_5.氯水中通入二氧化硫:Cl2+SO2+2H2O=H2SO4+2HCl离子方程式:Cl2+SO2+2H2O=4H++SO42-+2Cl-6.氯气与氢氧化钠溶液:Cl2+2NaOH=NaCl+NaClO+H2O离子方程式:Cl2+2OH-=Cl-+ClO-+H2O7.工业生产漂白粉:_2Ca(OH)2 + 2Cl2=Ca(ClO)2 + CaCl2 + 2H2O _8.漂白粉漂白原理:_ Ca(ClO)2 + CO2 + H2O =CaCO3↓ + 2HClO _9.向漂白粉溶液中加入稀盐酸:Ca(ClO)2 + 2HCl=CaCl2 + 2HClO10.氯气通入溴化钾溶液:Cl2 + 2KBr = Br2 + 2KCl离子方程式:Cl2 + 2Br- = Br2 + 2Cl-氯气通入碘化钾溶液:Cl2 + 2KI = I2 + 2KCl 离子方程式:_ Cl2 + 2I- = I2 +2Cl-溴水和碘化钾溶液反应:Br2 +2KI = I2+2KBr 离子方程式:Br2 +2I- = I2+2Br-11.氯化钠和硝酸银溶液:AgNO3 + NaCl =AgCl↓ + NaNO3离子方程式:Ag++Cl-=AgCl↓溴化钠和硝酸银溶液:AgNO3 + NaBr=AgBr↓ + NaNO3离子方程式:Ag++Br-=AgBr↓_碘化钠和硝酸银溶液:AgNO3 + NaI =AgI↓ + NaNO3离子方程式:Ag++I-=AgI↓_六、氮及其化合物1.氮气和氧气反应:_ N2+ O 2 2NO _2.工业合成氨:_ N2 + 3H2催化剂高温高压2NH3_3.一氧化氮与氧气反应:2NO + O2= 2NO2 _4.NO2溶于水:_3NO2+ H2O = 2HNO3 + NO _5.氨气溶于水: NH3 + H2O NH3·H2O氨水显弱碱性(电离方程式):NH3·H2ONH4+ + OH-6.浓氨水受热分解_ NH3·H2O △NH3↑+H2O __7.氨气和氯化氢:_ HCl + NH3 = NH4Cl _8.氨的催化氧化_4NH3+5O2 4NO + 6H2O _9.氯化铵受热分解: _ NH4Cl NH3+HCl _10.碳酸氢铵受热分解:_ NH4HCO3NH3↑+ H2O↑ + CO2↑_11.硝酸铵和NaOH:NH4NO3 + NaOH NaNO3 + NH3↑+H2O _离子方程式:NH4++ OH-NH3↑+H2O12.实验室制氨气:_2NH4Cl + Ca(OH)2CaCl2 + 2NH3↑ + 2H2O13.浓硝酸与铜反应:4HNO3(浓)+Cu Cu(NO3)2+2NO2↑+2H2O离子方程式:4H++2NO3-+Cu Cu2++2NO2↑+2H2O14.稀硝酸与铜反应:8HNO3(稀)+3Cu 3Cu(NO3)2+2NO↑+4H2O离子方程式:8H++2NO3-+3Cu 3Cu2++2NO↑+4H2O15.硝酸见光分解:_4HNO3=4NO2↑+O2↑+2H2O(见光或受热分解)_16.NH4+的检验离子方程式:NH4++ OH-NH3↑+H2O17.NO2、O2混合气通入水中无剩余气体:4NO2+ O2 + 2H2O = 4HNO318.NO、O2混合通入水中无剩余气体:4NO+ 3O2 + 2H2O = 4HNO3放电七、硫及其化合物1.硫在空气中燃烧:_ S+O2SO2__硫与氢气加热: S+H2H2S2.二氧化硫与水:_ SO2+H2O H2SO3_二氧化硫与氧化钙:_ SO2+CaO=CaSO3_少量SO2与氢氧化钠:_2NaOH+SO2=Na2SO3+H2O _离子方程式:_2OH-+SO2= SO32-+H2O_过量SO2与氢氧化钠:_ NaOH+SO2=NaHSO3_离子方程式:_ OH-+SO2= HSO3-_3.SO2通入过量的澄清石灰水: Ca(OH)2+SO2=CaSO3↓+H2O过量的SO2通入澄清石灰水: Ca(OH)2+2SO2=Ca(HSO3)24.二氧化硫与硫化氢:SO2 + 2H2S=3S↓+2H2O5.SO2的催化氧化:__2SO2 + O2催化剂加热2SO3_6.亚硫酸钠和硫酸反应:_ Na2SO3+H2SO4=Na2SO4 +SO2↑+H2O __7.Na2SO3与氧气反应:_2Na2SO3+O2=2Na2SO4_8.三氧化硫和水反应:_ SO3+H2O=H2SO4_9.三氧化硫与氧化钙:__ SO3+CaO= CaSO4_10.三氧化硫与氢氧化钙:_ Ca(OH)2+SO3=CaSO4↓+H2O _11.铜与浓硫酸反应:_ Cu + 2H2SO4 (浓)CuSO4 + 2H2O+SO2 ↑_12.碳与浓硫酸反应:_ C + 2H2SO4(浓) 2H2O+CO2↑+2SO2↑_必修1化学方程式总结1、硫酸根离子的检验: BaCl2 + Na2SO4 = BaSO4↓+ 2NaCl2、碳酸根离子的检验: CaCl2 + Na2CO3 = CaCO3↓ + 2NaCl3、碳酸钠与盐酸反应: Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑4、木炭还原氧化铜: 2CuO + C 高温2Cu + CO2↑5、铁片与硫酸铜溶液反应: Fe + CuSO4 = FeSO4 + Cu6、氯化钙与碳酸钠溶液反应:CaCl2 + Na2CO3 = CaCO3↓+ 2NaCl7、钠在空气中燃烧:2Na + O2 △Na2O2钠与氧气反应:4Na + O2 = 2Na2O8、过氧化钠与水反应:2Na2O2 + 2H2O = 4NaOH + O2↑9、过氧化钠与二氧化碳反应:2Na2O2 + 2CO2 = 2Na2CO3 + O210、钠与水反应:2Na + 2H2O = 2NaOH + H2↑11、铁与水蒸气反应:3Fe + 4H2O(g) = F3O4 + 4H2↑12、铝与氢氧化钠溶液反应:2Al + 2NaOH + 2H2O = 2NaAlO2 + 3H2↑13、氧化钙与水反应:CaO + H2O = Ca(OH)214、氧化铁与盐酸反应:Fe2O3 + 6HCl = 2FeCl3 + 3H2O15、氧化铝与盐酸反应:Al2O3 + 6HCl = 2AlCl3 + 3H2O16、氧化铝与氢氧化钠溶液反应:Al2O3 + 2NaOH = 2NaAlO2 + H2O17、氯化铁与氢氧化钠溶液反应:FeCl3 + 3NaOH = Fe(OH)3↓+ 3NaCl18、硫酸亚铁与氢氧化钠溶液反应:FeSO4 + 2NaOH = Fe(OH)2↓+ Na2SO419、氢氧化亚铁被氧化成氢氧化铁:4Fe(OH)2 + 2H2O + O2 = 4Fe(OH)320、氢氧化铁加热分解:2Fe(OH)3 △Fe2O3 + 3H2O↑21、实验室制取氢氧化铝:Al2(SO4)3 + 6NH3•H2O = 2Al(OH)3↓ + 3(NH3)2SO422、氢氧化铝与盐酸反应:Al(OH)3 + 3HCl = AlCl3 + 3H2O23、氢氧化铝与氢氧化钠溶液反应:Al(OH)3 + NaOH = NaAlO2 + 2H2O24、氢氧化铝加热分解:2Al(OH)3 △Al2O3 + 3H2O25、三氯化铁溶液与铁粉反应:2FeCl3 + Fe = 3FeCl226、氯化亚铁中通入氯气:2FeCl2 + Cl2 = 2FeCl327、二氧化硅与氢氟酸反应:SiO2 + 4HF = SiF4 + 2H2O硅单质与氢氟酸反应:Si + 4HF = SiF4 + 2H2↑28、二氧化硅与氧化钙高温反应:SiO2 + CaO 高温CaSiO329、二氧化硅与氢氧化钠溶液反应:SiO2 + 2NaOH = Na2SiO3 + H2O30、往硅酸钠溶液中通入二氧化碳:Na2SiO3 + CO2 + H2O = Na2CO3 + H2SiO3↓31、硅酸钠与盐酸反应:Na2SiO3 + 2HCl = 2NaCl + H2SiO3↓32、氯气与金属铁反应:2Fe + 3Cl2 点燃2FeCl333、氯气与金属铜反应:Cu + Cl2 点燃CuCl234、氯气与金属钠反应:2Na + Cl2 点燃2NaCl35、氯气与水反应:Cl2 + H2O = HCl + HClO36、次氯酸光照分解:2HClO 光照2HCl + O2↑37、氯气与氢氧化钠溶液反应:Cl2 + 2NaOH = NaCl + NaClO + H2O38、氯气与消石灰反应:2Cl2 + 2Ca(OH)2 = CaCl2 + Ca(ClO)2 + 2H2O。

高一化学方程式总结一.钠:(1).Na在空气中与O2:4Na + O2 = 2Na2O(白色)(2).Na在O2中燃烧:2Na + O2Na2O2(淡黄色)(3).Na与S:2Na + S = Na2S(研磨即爆炸)(4).Na与Cl2:2Na + Cl22NaCl(5).Na与H2O:2Na + 2H2O = 2NaOH + H2↑ (2Na + 2H2O = 2Na+ + 2OH- + H2↑)(6).Na与HCl:2Na + 2HCl = 2NaCl + H2↑ (2Na + 2H+ =2Na+ + H2↑ )(7).Na与CuSO4溶液:2Na + 2H2O + CuSO4 = Na2SO4+ Cu(OH)2↓ + H2↑(8).Na与FeCl3溶液:6Na + 6H2O + 2FeCl3 = 6NaCl + 2Fe(OH)3↓ + 3H2↑(9).Na2O与H2O:Na2O + H2O = 2NaOH(10).Na2O与CO2:Na2O + CO2= Na2CO3(11).Na2O2与H2O:2Na2O2 + 2H2O = 4NaOH + O2↑(2Na2O2 + 2H2O = 4Na+ + 4OH- + O2↑)(12).Na2O2与CO2:2Na2O2 + 2CO2 = 2Na2CO3 + O2(供氧)(13).Na2CO3与HCl:Na2CO3 +2HCl = 2NaCl + H2O +CO2↑(互滴鉴别)(CO32- + 2H+ = H2O + CO2↑)(14).NaHCO3与HCl:NaHCO3 + HCl = NaCl + H2O + CO2↑(HCO3- + H+ = H2O + CO2↑)(15).NaHCO3与NaOH:NaHCO3 +NaOH=Na2CO3 + H2O (HCO3- + OH- = CO32- + H2O)(16).Na2CO3与H2O 与CO2 :Na2CO3 + H2O + CO2 =2NaHCO3(鉴别、除杂)(CO32- + H2O + CO2 = 2HCO3-)(17).NaHCO3 分解:2NaHCO3Na2CO3+H2O+ CO2↑(18).NaOH与CO2 (少量):2NaOH + CO2 (少量) = Na2CO3 + H2O (2OH-+ CO2 (少量) = CO32- + H2O)(19).NaOH 与CO2(过量):NaOH + CO2(过量)= NaHCO3(OH -+ CO2(过量)= HCO3-)二.铝:(1).Al与6HCl:2Al+6HCl=2AlCl3+3H2↑(同H2SO4)(2Al+6H+ =2Al3+ + 3H2↑ )(2).Al 与NaOH 与H2O:2Al + 2NaOH + 2H2O = 2NaAlO2 + 3H2↑(2Al + 2OH- + 2H2O = 2AlO2- + 3H2↑)(3).Al2O3与HCl:Al2O3 + 6HCl = 2AlCl3 + 3H2O(Al2O3 + 6H+ =2Al3+ + 3H2O)(4).Al2O3与NaOH:Al2O3+2NaOH=2NaAlO2+H2O(Al2O3 + 2OH- = 2AlO2- + H2O )(5).Al(OH)3与HCl:Al(OH)3 + 3HCl = AlCl3 + 3H2O(Al(OH)3 + 3H+ = Al3+ + 3H2O)(6).Al(OH)3与NaOH:Al(OH)3+NaOH=NaAlO2+2H2O (Al(OH)3 + OH- = AlO2- + 2H2O)(7).2Al(OH)3Al2O3 + 3H2O(8).AlCl3与NH3·H2O:AlCl3 + 3NH3·H2O = Al(OH)3↓ + 3NH4Cl (Al3+ + 3NH3·H2O = Al(OH)3↓ + 3NH4+)(9).NaAlO2与HCl与H2O:NaAlO2+HCl+H2O=NaCl+Al(OH)3↓ (AlO2- + H+ +H2O = Al(OH)3↓ )(10).NaAlO2 与CO2(少量)与H2O:2NaAlO2 + CO2(少量)+3H2O=2Al(OH)3↓+Na2CO3(12).AlO2- + CO2(少量)+ 3H2O = 2Al(OH)3↓ + CO32-)(11).NaAlO2与CO2(过量)与2H2O:NaAlO2+CO2(过量)+2H2O=Al(OH)3↓+NaHCO3(AlO2- + CO2(过量) + 2H2O = Al(OH)3↓ + HCO3-)(12).Al 与O2 :4Al + 3O2 = 2Al2O3三.铁:(1).Fe与O2:3Fe+2O2Fe3O4(2).Al2O3电解:2Al2O34Al+3O2↑(3).Fe与H2O(g)高温:3Fe+4H2O(g)Fe3O4+4H2(4).FeCl3 + Fe :2FeCl3 + Fe = 3FeCl2(2Fe3+ + Fe = 3Fe2+)(5).FeCl2+Cl2:2FeCl2+Cl2=2FeCl3(2Fe2+ + Cl2 = 2Fe3++2Cl-)(6).FeCl3与Cu:2FeCl3 + Cu = 2FeCl2 + CuCl2(用于雕刻铜线路板) (2Fe3+ + Cu = 2Fe2++ Cu2+)(7).FeO与HCl:FeO+ 2HCl = FeCl2 + H2O(同H2SO4)(FeO+2H+=Fe2+ +H2O )(8).Fe2O3 与HCl :Fe2O3 + 6HCl = 2FeCl3 + 3H2O(同H2SO4)(Fe2O3 + 6H+=2Fe3+ + 3H2O)(9).Fe3O4 与HCl:Fe3O4 + 8HCl = 2FeCl3 + FeCl2 +4H2O(同H2SO4)(Fe3O4 + 8H+=Fe2+ +2Fe3+ +4H2O)(10).FeSO4与NaOH:FeSO4 + 2NaOH=Fe(OH)2↓ +Na2SO4(Fe2+ + 2OH-=Fe(OH)2↓)(11).FeCl3与NaOH:FeCl3 + 3NaOH=Fe(OH)3 ↓+ 3NaCl (Fe3+ + 3OH-=Fe(OH)3 ↓)(12).Fe(OH)2 与H2O 与O2:4Fe(OH)2 + 2H2O + O2 =4Fe(OH)3 (白色沉淀→灰绿色沉淀→红褐色沉淀)(13).Fe(OH)2与HCl.Fe(OH)2+2HCl==FeCl2+2H2O(Fe(OH)2 + 2H+=Fe2+ + 2H2O)(14).Fe(OH)3与HCl:Fe(OH)3+3HCl==FeCl3+3H2O(Fe(OH)3 + 3H+ = Fe3+ + 3H2O)(15).Fe(OH)3加热:2Fe(OH)3Fe2O3 + 3H2O(16).FeCl3与KSCN:FeCl3+3KSCN==Fe(SCN)3+3KCl(Fe3++ 3SCN- = Fe(SCN)3)(红色溶液,用于鉴别Fe3+) (17).FeCl3与H2S(少量):2FeCl3 + H2S(少量) = 2FeCl2 + 2HCl + S↓ (18).FeCl3与KI:2FeCl3 + 2KI = 2FeCl2 + 2KCl + I2↓(19).FeCl3与H2O:FeCl3+3H2O Fe(OH)3(胶体)+3HCl (20).C与H2O:C+H2O CO+H2 (生成水煤气)四.硅:(1)Si与NaOH与H2O:Si + 2NaOH + H2O = Na2SiO3 +2H2↑ (Si+2OH-+H2O= SiO32- + 2H2↑)(2)Si与HF:Si+ 4HF = SiF4 + 2H2↑(3)Si与F2:Si+ 2F2 = SiF4(4)Si与O2:Si+O2SiO2 (研细的硅与纯氧)(5)Si 与C:Si + C SiC(6)C与SiO2:2C+ SiO22CO↑+Si(工业制粗硅)(7)Cl2:与Si:2Cl2+Si= SiCl4(8)SiCl4 与H2:SiCl4 +2H2=Si+4HCl(粗硅提纯)(9)SiO2 与NaOH:SiO2 + 2NaOH = Na2SiO3 + H2O(SiO2 + 2OH- = SiO32-+ H2O )(10)CaO与SiO2::CaO+SiO2CaSiO3(11)SiO2 与HF:SiO2 + 4HF = SiF4 + 2H2O(12)Na2SiO3 与HCl:Na2SiO3 +2HCl=2NaCl+H2SiO3↓(13)Na2SiO3 与H2O与CO2:Na2SiO3 + H2O+CO2 =Na2CO3 + H2SiO3↓(强酸制弱酸)(14)Na2SiO3与H2O与CO2 (过量):Na2SiO3 + H2O+ 2CO2 (过量) = 2NaHCO3+H2SiO3↓(15)SiO2与Na2CO3:SiO2 + Na2CO3Na2SiO3+ CO2↑ (16)SiO2 与CaCO3:SiO2 + CaCO3CaSiO3+ CO2↑(工业制玻璃)(17)H2SiO3与NaOH:H2SiO3 + 2NaOH == Na2SiO3 +2H2O(18)H2SiO3分解:H2SiO3 SiO2 + H2O五.氯:(1)Cu与Cl2:Cu+Cl2CuCl2 (棕黄色烟)(2)Cl2与Fe:3Cl2+2Fe2FeCl3(棕黄色烟) (高价产物)(3)Na 与Cl2 :2Na + Cl2 2NaCl (白烟)(4)Cl2 与H2:Cl2 +H22HCl (燃烧苍白色火焰,光照会爆炸)(5)Cl2 与P:3Cl2 + 2P 2PCl3 (液体)(6)Cl2 与P:5Cl2 + 2P 2PCl5(固体) (白色烟雾)(7)Cl2与H2O:Cl2+H2O HCl+HClO (新制氯水成分三分子H2O,Cl2,HClO四离子H+,Cl-,ClO-,OH-)(8)Cl2 与2NaOH:Cl2 + 2NaOH = NaCl + NaClO + H2O(9)Cl2与Ca(OH)2:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O (工业制漂白粉)(10)漂白粉的漂白原理Ca(ClO)2与H2O与CO2(少量) :Ca(ClO)2+H2O+ CO2(少量) = CaCO3↓+2HClO (强酸制弱酸)(11)漂白粉的失效原理Ca(ClO)2与H2O与CO2(少量):Ca(ClO)2+H2O+CO2(少量) = CaCO3↓+ 2HClO2HClO2HCl+O2↑(12)FeCl2与Cl2:2FeCl2 + Cl2 = 2FeCl3(13)NaBr 与Cl2:2NaBr + Cl2 == 2NaCl + Br2(2Br - + Cl2 == 2Cl- + Br2)(14)KI + Cl2:2KI + Cl2 == 2KCl + I2(2I- + Cl2 == 2Cl- + I2)(15)实验室制备氯气MnO2与HCl(浓):MnO2 + 4HCl(浓) MnCl2+Cl2↑+2H2O (MnO2+ 4H+ + 2Cl-Mn2+ + Cl2↑ + 2H2O)(16)NaX与AgNO3:NaX+AgNO3=AgX↓+NaNO3(X=Cl,Br,I)(沉淀不溶于HNO3,根据沉淀颜色鉴别卤离子)(17)NaCl 与AgNO3:NaCl + AgNO3 = AgCl↓ + NaNO3 (白色沉淀)(18)NaBr 与AgNO3:NaBr + AgNO3 = AgBr↓ + NaNO3 (浅黄色沉淀)(19)KI 与AgNO3:KI +AgNO3 = AgI↓ + KNO3 (黄色沉淀)六.硫:(1)Na 与S加热:2Na + S Na2S(2)Fe与S:Fe+S FeS(3)Cu与S:2Cu+S Cu2S (低价产物)(4)H2与S:H2 + S H2S(5)S 与O2:S + O2 SO2(6)S 与NaOH:3S + 6NaOH 2Na2S + Na2SO3 + 3H2O (3S + 6OH-2S2- + SO32- + 3H2O)(7)SO2:与H2O:SO2+H2O H2SO3(注意“可逆反应”的定义)(8)NaOH与SO2 (少量):2NaOH+ SO2 (少量) = Na2SO3 + H2O(9)NaOH与SO2(过量):NaOH+ SO2(过量)= NaHSO3(10)Ca(OH)2 与SO2 (少量) :Ca(OH)2 + SO2 (少量) =CaSO3↓+ H2O(11)Ca(OH)2 与SO2(过量):Ca(OH)2 + SO2(过量)=Ca(HSO3)2(12)CaO与SO2:CaO+ SO2 = CaSO3(13)SO2与O2:2SO2+O2 2SO3(14)Cl2与SO2:Cl2+SO2 +2H2O=H2SO4+2HCl (同Br2、I2) (Cl2+SO2 +2H2O= 4H+ + SO42- + 2Cl-)(15)H2S 与SO2:2H2S + SO2= 2H2O + 3S↓(16)SO3与H2O:SO3+H2O=H2SO4(17)CaO与SO3:CaO+ SO3 = CaSO4(18)H2S 与O2(少量):2H2S + O2(少量) 2H2O+2S (19)H2S + O2(足量):2H2S + 3O2(足量) 2H2O + 2SO2(20)FeS 与HCl:FeS + 2HCl = H2S↑ + FeCl2(同H2SO4,实验室制备H2S)(21)FeS2与O2:4FeS2+11O22Fe2O3 + 8SO2(22)SO3与H2O:SO3+H2O=H2SO4(工业制硫酸)七.氮(1)N2与H2:N2+3H22NH3(工业合成氨)(2)N2与O2:N2+O22NO(3)N2 与Mg:N2 + 3Mg Mg3N2(4)NO 与O2:2NO + O2 = 2NO2(5)2NO 2 N2O4(6)NO2与H2O:3NO2+H2O = 2HNO3+NO(7)NO与3O2与2H2O:NO+3O2+2H2O=4HNO3(8)NO2与O2与H2O:4NO2+O2+2H2O=4HNO3(9)Na2SO3与H2SO4:Na2SO3+H2SO4=Na2SO4+SO2 +H2O (实验室制备SO2)(10)Na2SO3 + O2:2Na2SO3 + O2 = 2Na2SO4(11)SO2(少量) 与NH3 与H2O: SO2(少量) + 2NH3 + H2O = (NH4)2SO3(12)NH3+H2O NH3·H2O NH4++OH-(13)NH3 与HCl :NH3 + HCl = NH4Cl(白烟)(14)NH3 与HNO3:NH3 + HNO3 = NH4NO3(白烟)(15)NH3 与H2SO4:2NH3 + H2SO4 = (NH4)2SO4(16)NH3与O2:4NH3+5O2 4NO+6H2O(17)NO + O2:2NO + O2 = 2NO2(18)NO2+H2O:3NO2+H2O=2HNO3+NO(工业制硝酸)(19)NH4Cl受热分解:NH4Cl NH3↑+HCl↑(20)NH4HCO3受热分解:NH4HCO3NH3↑+ H2O +CO2↑(21)(NH4)2SO4与NaOH:(NH4)2SO4 + 2NaOHNa2SO4 + 2NH3↑+ 2H2O (用于检验NH4+)(22)NH4Cl 与Ca(OH)2:2NH4Cl + Ca(OH)2CaCl2 + 2NH3↑+2H2O(实验室制氨气)八.硫酸(1)H2SO4(浓) 与Cu:2H2SO4(浓) + Cu CuSO4 + 2H2O + SO2↑(2)H2SO4(浓) 与Zn:2H2SO4(浓) +Zn = ZnSO4 + 2H2O + SO2↑(3)H2SO4(浓) 与Fe(少量):6H2SO4(浓) + 2FeFe2(SO4)3 + 6H2O + 3SO2↑ (Fe少量)(4)H2SO4(浓) 与C:2H2SO4(浓) + C CO2↑ + 2H2O + 2SO2↑(5)H2SO4(浓) 与S:2H2SO4(浓) + S 2H2O + 3SO2↑(6)H2S + H2SO4(浓):H2S + H2SO4(浓)= S↓+ SO2↑+ 2H2O(7)HBr + H2SO4(浓):2HBr + H2SO4(浓)= Br2 + SO2↑+ 2H2O(8)HNO3遇光分解:4HNO3 4NO2↑+ O2↑+ 2H2O(硝酸显黄色的原因)(9)Cu与HNO3(浓)Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O(Cu + 4H+ + 2NO3- = Cu2+ + 2NO2↑+ 2H2O)(10)HNO3(稀)与Cu:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O(3Cu + 8H+ + 2NO3- = 3Cu2+ + 2NO↑+ 4H2O)(11)HNO3(浓)与Fe:6HNO3(浓) + Fe Fe(NO3 )3+ 3H2O + 3NO2↑(12)HNO3(稀)与Fe(足量):8HNO3(稀) + 3Fe(足量)= 3Fe(NO3)2+2NO↑+4H2O(13)HNO3(稀)与Fe(少量):4HNO3(稀) + Fe(少量)= Fe(NO3)3 + NO↑ + 2H2O(14)C与HNO3(浓):C + 4HNO3(浓) CO2↑+ 4NO2↑+ 2H2O。
人教版《化学必修1》化学方程式归纳、钠及其化合物1. 钠与氧气:常温:4Na+O= 2Na2O 点燃:2Na + O2 - Na zQ2. 钠与水反应:_2Na + 2H 2O = 2NaOH + H2 f _离子方程式:2Na + 2H2O = 2Na* + 20H + H 2 f3. 钠与硫酸反应:2Na +H2SQ = Na2SQ+Hd4. 氧化钠与水反应:NaaO+HO= 2NaOH5. 过氧化钠与二氧化碳反应:2Na2Q + 2CO 2 = 2Na 2CO +O2 f6. 过氧化钠与水反应:2N3Q+2H2O =4NaOH+O f 离子方程式:2Na2Q+2HO=4N扌+ 4OH+Q f7. NaOH溶液中通入少量CO: 2NaOH+CO Na z CO+HO 离子方程式:2OH+CO= CQ2「+HONaOH溶液中通入过量CO: NaOH+CO NaHCO 离子方程式:_ OH +CO= HCQ「_8. ①向碳酸钠溶液滴入少量稀盐酸:Na 2CO + HCI = NaHCO 3 + NaCI _______________向稀盐酸滴入少量碳酸钠溶液:Na 2CO + 2HCI = 2NaCI + H 2O + CO2 f ______________________②除去碳酸氢钠溶液中混有的碳酸钠:Na 2CO + H2O +CO =2NaHCO_________________③碳酸钠与氢氧化钙: ____ Na 2CO + Ca(OH) 2 = CaCOj + 2NaOH _______________④碳酸氢钠与盐酸:NaHCO 3+HCI= NaCI+HO+CO ____________________⑤少量碳酸氢钠溶液滴入氢氧化钙溶液中:NaHCQ+ Ca(OH)2 = CaCOj + NaOH+ H2O少量氢氧化钙溶液滴入碳酸氢钠溶液中:2NaHCQ+ Ca(OH)2 = CaCOj + Na 2CO + 2H 2O⑥除去碳酸钠溶液中的碳酸氢钠:NaHCO 3+ NaOH 二 W2CO + H 2O⑦除去碳酸钠固体中的碳酸氢钠:2NaHCQ Na z CO + H 2O +CQ f _________________⑧鉴别碳酸钠和碳酸氢钠溶液:Na 2CO + CaCI 2 = CaCOj + 2NaCI ______________、铝及其化合物1. 铝与氧气的反应:4AI + 3O 22AI 2Q高温2. 铝与氧化铁反应(铝热反应):2AI + Fe 2Q 2Fe + Al 2Q3. 铝和稀盐酸:2AI + 6HCI = 2AICI 3 + 3H 2 f 离子方程式:2AI + 6H + = 2AI 3+ + 3H 2 f4. 铝和NaOH溶液:2AI+2NaOH+2HO=2NaAIO+3H f 离子方程式: 2AI+2OH +2H2O=2AIQ_+3H f5. 氧化铝和稀硫酸:Al 2Q+3HSQ= Al 2(SO4)3+3HO 离子方程式: Al 2Q+6』=2AI 3*+3H2O6. 氧化铝和NaOH溶液:AI2Q + 2NaOH错误!未找到引用源。
高一化学《必修一》方程式(按章节归纳)1、硫酸根离子的检验:BaCI2 + Na2SO4 = BaS04 J + 2NaCI2、碳酸根离子的检验:CaCI2 + Na2CO3 = CaC03 J + 2NaCI3、银离子的检验:CI 一+ Ag += AgCI J咼温4、木炭还原氧化铜:2CuO + C 2Cu + C02 f5、铁片与硫酸铜溶液反应:Fe + CuS04 = FeS04 + Cu占燃6. 镁在二氧化碳中燃烧:2Mg + CQ 2Mg0 + C第三章:、钠1、钠在空气中燃烧(黄色的火焰):2Na + 02点燃Na z Q2、钠块在空气中变暗:4Na+ 0a= 2Na203、Na20在空气中加热(变黄):2Naa0+ Q^= 2N&Q4、金属锂在空气中燃烧:4Li + 02 2Li 205、钠与水反应(浮、熔、游、响、红)2Na + 2H2O = 2Na0H+ H2 f2Na + 2H2O = 2Na+ + 20H「+ H2 f二、NazO、N Q Q的相关反应:1、碱性氧化物N&0与水的反应:N Q0+ HLO= 2NaOH2、过氧化钠与水的反应(放热反应、Na^Q是强氧化剂,可用于漂白)2N@Q + 2H2O = 4NaOH + O2 f2N&Q + 2H2O = 4Na + + 40H「+ O f3、碱性氧化物N Q0与C0的反应N@0 + CQ = Na2C04、过氧化钠可用在呼吸面具和潜水艇中作为氧气来源(供氧剂),原因是:2Na 20 + 2CO2 = 2Na2CO + 025、Na 2。
+ SO2 = Na2SO Na 20 + SO2 = Na2SQ6、Na20 + 2HCI = 2NaCI + H2O7、2NaaQ + 4 HCI = 4 NaCI + 2 H 2O + O2 f三、NaHCO与Na2CO32、固体氢氧化钠和碳酸氢钠混合物在密闭容器中加热△NaHCO + NaOH Na z CO + H 2O3、若是氢氧化钠和碳酸氢钠溶液中反应有离子方程式:4、向 NaOH 溶液中通入少量 CO : 2NaOH + CO = Na 2CO + H 2O5、继续通入过量 CO : NaCO + CO 2 + H 2O = 2 NaHCO 3总反应方程式:NaOH + CQ = NaHCO 3 6、苏打(纯碱)与盐酸反应: ①盐酸中滴加纯碱溶液N&CO + 2HCl = 2NaCl + H 2O + CO f ②纯碱溶液中滴加盐酸,至过量 NazCO + HCl = NaHCO + NaCl CONaHC 硏 HCl = NaCl + H 2O + COfHCO 3— + H + = H 2O + CO f7、⑴Na2CO3溶液、NaHCO 溶液与Ca(OH )2反应:Na2CO3 + Ca(OH )2 = CaCO3j + 2 NaOH NaHCO + Ca(OH )2(多)=CaCO3j + NaOH + H 2O 2NaHCO + Ca(OH )2 (少) = CaCO3j+ Na2CO3 + 2HO 8 Na2CO3溶液、NaHCO 溶液与 CaCb 反应:Na2CO3 + CaCl 2 = CaCO3j + 2 Na Cl NaHCO 溶液与CaCl 2不反应;四、铝占燃1、 铝与氯气反应:2AI + 3C1 2 2AICI 32、 铝片与稀盐酸反应2AI + 6HCI = 2AICI 3 + 3H 2f 2AI + 6H + 3、 铝与氢氧化钠溶液反应2AI + 2NaOH + 2HO = 2NaAIO 2 + 3H4 2AI + 2OH — + 2HzO = 2AIO 2— + 3H 2 f1、小苏打受热分解: 2NaHCONa z CG + H 2O + CO fNaHCO + NaOH = Na z CO + H 2O — — 2HCO 3 + OH = H 2O + CO 3 CO 32— + 2H + = H 2O + CO 2T3+ H + = HCQ电解4、4AI + 302 2AI 2Q 电解熔融的氧化铝: 2AI 2Q4AI + 302 f高温5、铝与三氧化二铁高温下反应【铝热反应】 :2AI + Fe 2O 3 2Fe + Al 2Q6、不稳定性: △2AI(QH) 3AI 2Q + 3H 2Q7、硫酸铝溶液中滴过量氨水【实验室制备AI(OH) 3] AI 2(SO 4)3 + 6NH ・ HO 错误!未找到引用源。
铭叔精华品牌系列の告别版★-----高一化学方程式汇总必修1一、金属的化学性质1.钠在空气中变暗:4Na + O2 = 2Na2O (常温)2.钠在空气中燃烧(黄色火焰):2Na + O2△ Na2O2 (艳色反应)3.钠与水反应(浮、熔、游、响、红):2Na+ 2H2O= 2NaOH+ H2↑4.钠与盐酸反应:2Na+2HCl = 2NaCl+H2↑5.钠与CuSO4溶液反应: 2Na + 2H2O+ CuSO4= Na2SO4+Cu(OH)2↓+ H2↑6.钠在氯气中燃烧(产生白烟):2Na+Cl2 ===== 2NaCl7.钠与硫的反应(爆炸):2Na+S ===== Na2S8.铝箔在氧气中剧烈燃烧: 4Al+3O2====2Al2O39.铝与盐酸反应: 2Al+6HCl=2AlCl3+3H2↑10.铝与氢氧化钠溶液反应:2Al+ 2NaOH+ 2H2O=2NaAlO2+ 3H2↑11.铁在氧气中燃烧: 3Fe +2O2==== Fe3O412.高温下铁与水蒸气反应: 3Fe + 4H2O(g) △ Fe3O4 + 4H2二、钠的重要化合物13.氧化钠与水反应:Na2O+H2O=2NaOH14.氧化钠与二氧化碳反应:Na2O+ CO2= Na2CO315.氧化钠与盐酸反应:Na2O+ 2HCl= 2NaCl+ H2O16.过氧化钠与水反应:2Na2O2+ 2H2O= 4NaOH+ O2↑17. 过氧化钠与二氧化碳反应:2Na2O2+ 2CO2=2Na2CO3+ O218. 过氧化钠与盐酸反应:2Na2O2+4HCl= 4NaCl+2H2O+O2↑19. 碳酸钠与足量盐酸反应:Na2CO3+2HCl=2NaCl+H2O+CO2↑20.碳酸钠与少量盐酸反应:Na2CO3+HCl =NaHCO3+NaCl21.碳酸氢钠与盐酸反应:NaHCO3+HCl=NaCl+H2O+CO2↑22.碳酸氢钠与氢氧化钠反应:NaHCO3+NaOH = Na2CO3+ H2O23.向饱和碳酸钠溶液中通入CO2气体会析出晶体: Na2CO3+ CO2+ H2O = 2NaHCO324.碳酸氢钠受热分解:2NaHCO3△Na2CO3+H2O +CO2 ↑点燃研磨点燃点燃三、铝的重要化合物25.氧化铝是两性氧化物:(1)与盐酸反应:Al 2O 3+6HCl= 2AlCl 3+3 H 2O(2)与NaOH 溶液反应:Al 2O 3+ 2NaOH= 2NaAlO 2+H 2O26.氢氧化铝是两性氢氧化物:(1)与盐酸反应:Al(OH)3+3HCl=AlCl 3+3H 2O(1)与NaOH 溶液反应:Al(OH)3+ NaOH=NaAlO 2+2H 2O27.实验室制A l (O H )3:Al 2(SO 4)3 +6NH 3·H 2O=2Al(OH)3↓+3(NH 4)2SO 428.氢氧化铝加热分解:2Al (OH)3△Al 2O 3+ 3H 2O29.往AlCl 3溶液中逐滴加入NaOH 溶液至刚好生成沉淀: 3NaOH+ AlCl 3=Al (OH)3↓+3NaCl继续加入NaOH 溶液至沉淀溶解: NaOH +Al (OH)3=NaAlO 2+2H 2O30.往NaAlO2溶液中加入稀盐酸至刚好生成沉淀:HCl+NaAlO 2+H 2O= Al (OH)3↓+ NaCl继续加入稀盐酸至沉淀溶解:3HCl+ Al (OH)3= AlCl 3+3H 2O31. 向偏铝酸盐溶液中通入过量CO 2:CO 2+AlO 2-+2H 2O=Al(OH)3↓+HCO 3-四、铁的重要化合物附加:氢氧化铁胶体的制备:FeCl 3 + H 2O(沸水) == Fe(OH)3 + HCl32.氯化铁与氢氧化钠溶液反应:FeCl 3 + 3NaOH = Fe(OH)3 ↓+3NaCl33.硫酸亚铁与氢氧化钠溶液反应:2NaOH+ FeSO 4=Fe(OH)2↓+ Na 2SO 434.氢氧化亚铁在空气中变质:4Fe(OH)2+O 2+2H 2O=4Fe(OH)335.氢氧化铁受热分解:2Fe(OH)3 △Fe 2O 3+3H 2O36.氯化铁溶液中加入铁粉:Fe+ 2FeCl 3=3 FeCl 2 37.氯化亚铁溶液中加入氯水:Cl 2+2FeCl 2=2FeCl 338. 氧化铁与盐酸反应:Fe 2O 3+ 6HCl= 2FeCl 3+3H 2O39. 氧化亚铁与盐酸反应:FeO+2HCl=FeCl 2+H 2O40. 氢氧化铁与盐酸反应:Fe(OH)3+ 3HCl= FeCl 3+3H 2O41. 氢氧化亚铁与盐酸反应:Fe(OH)2+ 2HCl= FeCl 2+2H 2O42.氯化铁溶液中加入铜粉:Cu+2FeCl 3 =2FeCl 2 +CuCl 2第四章43. 二氧化硅与氢氟酸反应(雕刻玻璃) SiO 2 + 4HF = SiF 4↑ + 2H 2O44. 硅单质与氢氟酸反应:Si + 4HF = SiF 4 + 2H2↑45. 二氧化硅与氧化钙高温反应 SiO 2+ CaO == CaSiO 346. 二氧化硅与氢氧化钠溶液反应:SiO 2 + 2NaOH = Na 2SiO 3 + H 2O高温 加热47. 单质硅与氢氧化钠溶液反应: Si + 2NaOH + H 2O = Na 2SiO 3 +2H 2↑48. 硅酸的制备 Na 2SiO 3 + 2HCl == H 2SiO 3(胶体) + 2NaCl49. 硅酸钠溶液通入CO 2制得胶体 Na 2SiO 3 + CO 2 + H 2O == H 2SiO 3(胶体)+Na 2CO 350. 高纯硅的制备:①二氧化硅与碳高温下反应制粗硅: SiO 2 + 2C == Si + 2CO↑②粗硅的提纯:Si + 2Cl 2 == SiCl 4 ;SiCl 4 + 2H 2 == Si + 4HCl51. 金属铁在氯气中燃烧 3Cl 2 + 2Fe == 2FeCl 352. 金属钠在氯气中燃烧: 2Na + Cl 2 点燃 2NaCl53. 养金鱼晒水两条方程式 H 2O + Cl 2 == HCl + HClO 2HClO ==== 2HCl + O 2↑54. 氯气的实验室制法 MnO 2 + 4HCl(浓) △ MnCl 2 + 2H 2O + C12 ↑55. 氯气通入澄清石灰水 2Cl 2 + 2Ca(OH)2 = Ca(ClO)2 + CaCl 2 + 2H 2O56. 漂白粉原理(失效原因): Ca(ClO)2 + CO 2 + H 2O = CaCO 3↓ + HClO57. 二氧化硫与水反应 SO 2+H 2OH 2SO 358. 二氧化硫与氢氧化钙溶液反应 SO 2 + Ca(OH)2 ==CaSO 3↓+ H 2O59. 工业制硫酸: ①二氧化硫与氧气反应 2SO 2+O 2 2SO 3 ②三氧化硫与水反应 SO 3+H 2O == H 2SO 460. 等体积的SO 2和Cl 2通入水中 Cl 2+SO 2+2H 2O == H 2SO 4 +2HCl61. SO 2通入氢硫酸溶液中 2H 2S +SO 2 == 2H 2O + 3S↓62. 实验室制备SO 2 Na 2SO 3 + H 2SO 4 == Na 2SO 4 + H 2O + SO 2↑ 63. “雷雨发庄稼”涉及到的三条方程式 N 2 + O 2 ==== 2NO2NO + O 2 == 2NO 2 3 NO 2 + H 2O ==2HNO 3 + NO64. NO 2和氧气4:1比例通入水中完全变成硝酸:4NO 2 + O 2 + 2H 2O = 4HNO 365. NO 和氧气4:3比例通入水中完全变成硝酸: 4NO + 3O 2 + 2H 2O = 4HNO 366. 氨气与水反应 NH 3 + H 2ONH 3·H 2O67. 氨水受热分解:NH 3·H 2O △ NH 3↑ + H 2O68. 氨气催化氧化(工业制硝酸) 4NH 3 + 5O 2 == 4NO + 6H 2O69. 工业合成氨 N 2 + 3H 2 2NH 3 70. 氨气实验室制法 2NH 4Cl + Ca(OH)2 + 2NH 3↑+ 2H 2O71. 氨气与氯化氢反应产生白烟:NH 3 + HCl = NH 4Cl72. 碳酸氢氨受热分解:NH 4HCO 3 △ NH 3↑ + H 2O↑ + CO 2↑光照 催化剂 △放电或高温 催化剂 高温高压高温 点燃73. 硝酸铵与氢氧化钠反应:NH4 + NaOH △ NH3↑ + NaNO3 + H2O74. 氯化铵受热分解NH4Cl == NH3↑+ HCl↑75. 氯气与氢气反应:Cl2 + H2点燃2HCl76. 硫酸铵与氢氧化钠反应:(NH4)2SO4 + 2NaOH △ 2NH3↑ + Na2SO4 + 2H2O77. 浓硫酸与铜反应:Cu + 2H2SO4(浓) △ CuSO4 + 2H2O + SO2↑78. 浓硫酸与木炭反应:C + 2H2SO4(浓) △ CO2↑+ 2SO2↑ + 2H2O79. 浓硝酸与铜反应:Cu + 4HNO3(浓) = Cu(NO3)2 + 2H2O + 2NO2↑80. 稀硝酸与铜反应:3Cu + 8HNO3(稀) △ 3Cu(NO3)2 + 4H2O + 2NO↑必修2第一章1. 锂在空气中燃烧:4Li + O2△2Li2O2. 钠在空气中燃烧:2Na + O2△Na2O23. 钠与水反应:2Na + 2H2O = 2NaOH + H2↑4. 钾与水反应:2K + 2H2O = 2KOH + H2↑5. 镁与沸水反应:Mg+2H2O(沸水) △Mg(OH)2+H2↑Al与HCl反应: 2Al+6HCl===2AlCl3+3H2↑Mg与HCl反应: Mg+2 HCl 错误!未找到引用源。
无机化学方程式1、碱金属(ⅠA 族)1 钠在氧气中燃烧〈淡黄色固体〉2Na+O 2Na 2O 2点燃或△2 钠与空气中的氧气发生反应 4Na+O 22Na 2O 〈白色固体〉3 钠和硫的化合 〈爆炸〉2Na+SNa 2S 研磨4 钠在氯气中燃烧 2Na+Cl 22NaCl 点燃5 钠与水的反应2Na+2H 2O2NaOH+H 点燃6 钠投入硫酸铜溶液的反应实质 Na 2SO 4+Cu(OH)2NaOH+CuSO 4蓝色絮状沉淀7 氧化钠与水反应 Na 2O+H 2O 2NaOH 8 氧化钠与盐酸反应 Na 2O+2HCl 2NaCl+H 2O 9氧化钠与二氧化碳反应Na 2O+CO 2Na 2CO 310 过氧化钠与水反应 2Na 2O 2+2H 2O 4NaOH+O 2 11 过氧化钠与盐酸反应 2Na 2O 2+4HCl4NaCl+2H 2O+O12 过氧化钠与二氧化碳反应 2Na 2O 2+2CO 22Na 2CO 3+O 213 碳酸钠与盐酸反应 Na 2CO 3+2HCl 2NaCl+H 2O+CO 214 碳酸钠与氢氧化钙反应 Na 2CO 3+Ca(OH)22NaOH+CaCO15 碳酸钠与氯化钙反应 Na 2CO 3+CaCl 22NaCl+CaCO 316 碳酸钠与硫酸铝反应 3Na 2CO 3+Al 2(SO 4)3+3H 2O 3Na 2SO 4+2Al(OH) +3CO 217 碳酸氢钠与盐酸反应NaHCO 3+HCl NaCl+H 2O+CO 218 碳酸氢钠与过量氢氧化钙反应 NaHCO 3+Ca(OH)2NaOH+H 2O+CaCO19 碳酸氢钠与少量氢氧化钙反应 2NaHCO 3+Ca(OH)2Na 2CO 3+2H 2O+CaCO 320 碳酸氢钠与硫酸铝反应 6NaHCO 3+Al 2(SO 4)33Na 2SO 4+2Al(OH)3 +6CO 221 碳酸氢钠受热分解2NaHCO 3Na 2CO 3+H 2O+CO 2△22 碳酸钠与二氧化碳和水反应2NaHCO 3Na 2CO 3+H 2O+CO 22、其它几种重要的金属(镁、铝、铁、铜)1 镁在氯气中燃烧 Mg+Cl 2MgCl 2点燃2 镁与氮气的反应3Mg+N 2Mg 3N 2△3 镁与水的反应 Mg+2H 2OMg(OH)2+H △4 镁与盐酸的反应 Mg+2HCl MgCl 2+H 25 镁在二氧化碳中燃烧 2Mg+CO 22MgO+C 点燃6 镁跟氯化氨反应Mg+2NH 4ClMgCl 2+2NH +H 27 氢氧化镁与盐酸反应MgCl 2+2H 2O Mg(OH)2+2HCl 8 氢氧化镁受热分解 MgO+H 2O Mg(OH)2△9 电解熔融的氯化镁 MgCl 2Mg+Cl 2电解10 氧化镁与热水的反应 MgO+H 2OMg(OH)2△11 氧化镁与二氧化碳的反应 MgO+CO 2MgCO 3 12 氧化镁与盐酸的反应 MgO+2HClMgCl 2+H 2O13 氮化镁与水的反应 Mg 3N 2+6H 2O 3Mg(OH) +2NH 3 14 氯化镁和氢氧化钠的反应MgCl 2+2NaOH Mg(OH) +2NaCl15 氯化镁与碳酸钠的反应 MgCl 2+Na 2CO 3MgCO 3 +2NaCl16 碳酸镁受热分解 MgCO 3MgO+CO 2△17 碳酸镁与碳酸反应MgCO 3+CO 2+H 2O Mg(HCO 3)218 碳酸镁和盐酸反应MgCO 3+2HClMgCl 2+CO 2 +H 2O19 碳酸氢镁与盐酸的反应 Mg(HCO 3)2+2HCl MgCl 2+2CO 2 2O20 碳酸氢镁受热分解△Mg(HCO 3)2MgCO +CO 2 2O21 碳酸氢镁与氢氧化钙的反应 Mg(HCO 3)2+2Ca(OH)2Mg(OH) +2CaCO 3 2O22 铝与氧气反应 4Al+3O 22Al 2O 3 23 铝与硫的反应2Al+3SAl 2S 3△24 铝与水的反应 2Al+6H 2O2Al(OH)3+3H △25 铝与盐酸的反应 2Al+6HCl2AlCl 3+3H26 铝与氢氧化钠反应2Al+2NaOH+2H 2O 2NaAlO 2+3H27 铝与三氧化二铁反应(铝热反应) 2Al+Fe 2O 32Fe+Al 2O 3高温28 氧化铝与盐酸的反应 Al 2O 3+6HCl 2AlCl 3+3H 2O 29 氧化铝与氢氧化钠的反应 Al 2O 3+2NaOH 2NaAlO 2+H 2O 30 氢氧化铝与盐酸的反应 Al(OH)3+3HCl AlCl 3+3H 2O 31 氢氧化铝与氢氧化钠的反应 Al(OH)3+NaOH NaAlO 2+2H 2O32 氢氧化铝受热分解2Al(OH)3Al 2O 3+3H 2O △33 氯化铝与足量氢氧化钠的反应 AlCl 3+4NaOHNaAlO 2+3NaCl+2H 2O34 氯化铝与足量氨水的反应 AlCl 3+3NH 3·H 2OAl(OH) +3NH 4Cl35 偏铝酸钠与足量盐酸的反应 NaAlO 2+4HClAlCl 3+NaCl+2H 2O36 偏铝酸钠与少量碳酸的反应 2NaAlO 2+3H 2O+CO 22Al(OH) +Na 2CO 337 偏铝酸钠与过量碳酸的反应 NaAlO 2+2H 2O+CO 2Al(OH) +NaHC O 338 氯化铝与偏铝酸钠的反应 AlCl 3+3NaAlO 2+6H 2O 4Al(OH)3 +3NaCl39 铁在氧气中燃烧 〈黑色固体〉3Fe+2O 2Fe 3O 4点燃Fe 3O 4即Fe 2O 3 FeO ,铁既为+3价,也为+2价·40 铁在氯气中燃烧 2Fe+3Cl 22FeCl 3点燃41 铁与足量浓硝酸的反应 △Fe+6HNO 3(浓)Fe(NO 3)3+3NO 2 +3H 2O42 铁与足量稀硝酸的反应Ⅰ △Fe+4HNO 3(稀)Fe(NO 3)3+NO +2H 2O43 铁与足量稀硝酸的反应Ⅱ △8Fe+30HNO 3(稀)8Fe(NO 3)3+3N 2O +15H 2O44 铁与足量稀硝酸的反应Ⅲ △10Fe+36HNO 3(稀)10Fe(NO 3)3+3N 2 +18H 2O45 铁与足量稀硝酸的反应Ⅳ △8Fe+30HNO 3(稀)8Fe(NO 3)3+3NH 4NO 3+9H 2O46 铁与少量稀硝酸的反应 3Fe+8HNO 3(稀)3Fe(NO 3)2+2NO +4H 2O47 铁与浓硫酸共热的反应2Fe+6H 2SO 4(浓)Fe 2(SO 4)3+3SO 2 +6H 2O△48 铁和硫的反应 Fe+S FeS △49 铁和碘的反应Fe+I 2FeI 2△50 铁与盐酸的反应 Fe+2HCl FeCl 2+H51 铁与硫酸铜溶液的反应 Fe+CuSO 4 FeSO 4+Cu 〈湿法冶金术〉蓝色溶液浅绿色溶液52 铁与水蒸气的的反应 3Fe+4H 2O (g)Fe 3O 4+4H高温53 氧化亚铁与盐酸的反应 FeO+2HClFeCl 2+H 2O54 氧化亚铁与硝酸的反应 3FeO+10HNO 33Fe(NO 3)3+NO +5H 2O55 氧化亚铁与碘化氢的反应 FeO+2HI FeI 2+H 2O 56 氧化铁与盐酸的反应 Fe 2O 3+6HCl2FeCl 3+3H 2O57 氧化铁与硝酸的反应 Fe 2O 3+6HNO 32Fe(NO 3)3+3H 2O58 氧化铁与碘化氢的反应 Fe 2O 3+6HI2FeI 2+I +3H 2O59 四氧化三铁与盐酸的反应Fe 3O 4+8HCl 2FeCl 3+FeCl 2+4H 2O 60 氢气还原氧化亚铁 FeO+H 2Fe+H 2O △61 一氧化碳还原氧化铁 Fe 2O 3+3CO 2Fe+3CO 2△62 铝与四氧化三铁的反应 3Fe 3O 4+8Al 9Fe+4Al 2O 3△63 氧化亚铁在空气中加热的反应 6FeO+O 22Fe 3O 4△64 氢氧化亚铁与盐酸的反应Fe(OH)2+2HClFeCl 2+2H 2O65 氢氧化亚铁与硝酸的反应 3Fe(OH)2+10HNO 33Fe(NO 3)3+NO +8H 2O66 氢氧化亚铁与碘化氢的反应Fe(OH)2+2HI FeI 2+2H 2O 67 氢氧化铁与盐酸的反应 Fe(OH)3+3HCl FeCl 3+3H 2O68 氢氧化铁与硝酸的反应 2Fe(OH)3+6HNO 32Fe(NO 3)3 +6H 2O69 氢氧化铁与碘化氢的反应 2Fe(OH)3+6HI2FeI 2+I +6H 2O70 氢氧化亚铁在空气中的氧化 4Fe(OH)2+O 2+2H 2O 4Fe(OH)371 氢氧化铁受热分解2Fe(OH)3Fe 2O 3+3H 2O△72 氯化亚铁与氢氧化钠的反应 FeCl 2+2NaOH Fe(OH)2 +2NaCl白色73 氯化铁与氢氧化钠的反应 FeCl 3+3NaOHFe(OH) +3NaCl红褐色74 Fe 3+遇到SCN -显血红色 Fe 3++SCN -Fe(SCN)2+血红色75 氯化铁与铁单质的反应 FeCl 3+Fe 2FeCl 2 76 氯化亚铁与氯气的反应 2FeCl 2+Cl 22FeCl 3 77 氯化铁与锌的反应 3Zn+2FeCl 33ZnCl 2+2Fe 78 电解氧化铝 2Al 2O 34Al+3O 2电解79 电解熔融的氯化钠2NaCl2Na+Cl 电解80 氯化铁与碳酸钠溶液的反应 2FeCl 3+3Na 2CO 3+3H 2O6NaCl+2Fe(OH) +3CO 281 碱式碳酸铜受热分解 Cu 2(OH)2CO 3△2CuO+CO +H 2O铜绿,绿色粉末82 铜在空气中氧化 Cu 2(OH)2CO 32Cu+O 2+CO 2+H 2O83 铜和硫的反应 2Cu+SCu 2S △84 氧化铜高温分解 4CuO2Cu 2O+O高温85 氢气还原氧化铜 H 2+CuO Cu+H 2O△黑色粉末红色粉末86 铁与氧化铜的反应 Fe+CuOCu+FeO 高温87 铜与氧气的反应 2Cu+O 22CuO △88 硫化亚铜与浓硫酸反应 Cu 2S+2H 2SO 4(浓,热)CuSO 4+CuS+SO +2H 2O89 氢氧化铜受热分解 △Cu(OH)2CuO+H 2O90 铜与浓硫酸的反应 △Cu+2H 2SO 4(浓)CuSO 4+SO +2H 2O91 铜与氧气和硫酸的反应 △2Cu+O 2+2H 2SO 42CuSO 4+2H 2O92 铜与氧气和盐酸的反应 △2Cu+O 2+4HCl2CuCl 2+2H 2O93 铜与浓硝酸的反应 Cu+4HNO 3(浓)Cu(NO 3)2+2NO +2H 2O94 铜与稀硝酸的反应 3Cu+8HNO 3(稀)3Cu(NO 3)2+2NO +4H 2O95 氢氧化铜与盐酸的反应Cu(OH)2+2HClCuCl 2+2H 2O96 硝酸铜受热分解 2Cu(NO 3)22CuO+4NO +O 2△97 氧化铜与盐酸的反应 CuO+2HClCuCl 2+H 2O98 硫化铜与浓硫酸的反应 CuS+4H 2SO 4(浓,热)CuSO 4+4SO 2 +4H 2O99 硫化亚铜与氧气的反应△2Cu 2S+3O 22Cu 2O+2SO 23、卤族元素(ⅦA 族)1 铜在氯气中燃烧 Cu+Cl 2CuCl 2点燃2 氢气在氯气中燃烧 H 2+Cl 22HCl 点燃或光照〈光照爆炸〉3磷在氯气中燃烧 2P+3Cl 22PCl 3点燃(液)PCl 3+Cl 2PCl 5(固)〈白色烟雾〉4 氯气与水的反应 Cl 2+H 2OHCl+HClO5 次氯酸光照分解 2HClO2HCl+O 2光照6 氯气与氢氧化钙的反应 2Cl 2+2Ca(OH)2CaCl 2+Ca(ClO)2+2H 2O7次氯酸钙与稀盐酸的反应 Ca(ClO)2+2HCl2HClO+CaCl 2〈漂白原理〉8 次氯酸钙与碳酸的反应 Ca(ClO)2+CO 2+H 2O 2HClO+CaCO 9氯气与硫化氢的反应Cl 2+H 2S〈氧化性:Cl 2>S 〉10 氯气与碘化钾的反应 Cl 2+2KI2KCl+I 2〈用来检验氯气〉11 氯气与亚硫酸钠溶液的反应Cl 2+Na 2SO 3+H 2O2HCl+Na 2SO 412 浓盐酸与二氧化锰共热制氯气 4HCl (浓)+MnO 2MnCl 2+2H 2O+Cl △13 浓盐酸与高锰酸钾共热制氯气△16HCl (浓)+2KMnO 42KCl 2+2MnCl 2+8H 2O+5Cl 214 电解饱和食盐水2NaCl+2H 2O2NaOH+H 2 +Cl 2电解〈Cl 2工业制法〉15 氢氧化钠吸收氯气的反应原理 Cl 2+2NaO H NaCl+NaClO+H 2O16 氯化氢的实验室制法(不加热)NaCl+H 2SO 4(浓)NaHSO 4+HCl17 将上面反应加热到500℃~600℃ △NaCl+NaHSO 4Na 2SO 4 18 氯化氢的实验室制法(加热) △2NaCl+H 2SO 4(浓)Na 2SO 4+2HCl19 检验氯化氢气体的反应原理HCl+NH 3NH 4Cl 〈产生白烟〉20 Cl -与Ag +的反应 Ag ++Cl -AgCl 〈白色沉淀〉21 Br -与Ag +的反应 Ag ++Br -AgBr 〈浅黄色沉淀〉22 I -与Ag +的反应 Ag ++I -AgI 〈黄色沉淀〉23 氯气与次氯酸钠的反应 Cl 2+4NaClO4NaCl+2ClO 224 工业上制取二氧化氯 2NaClO 3+Na 2SO 3+H 2SO 42Na 2SO 4+2ClO 2 +H 2O25 氯气与亚硫酸的反应 Cl 2+H 2SO 3+H 2O H 2SO 4+2HCl26 氟气与氢气的反应 F 2+H 22HF 〈冷暗处爆炸〉27 氯气与氢气的反应 H 2+Cl 22HCl 点燃或光照〈光照爆炸〉28 溴与氢气的反应 〈500℃时缓慢反应〉Br 2+H 22HBr △29 碘与氢气的反应〈可逆反应〉I 2+H △30 卤素与水的反应(F 2除外) 〈 X=Cl 、Br 、I 〉X 2+H 2O HX+HXO 31 氟气与水的反应 2F 2+2H 2O 4HF+O 232 卤素与钠的反应 〈 X=F 、Cl 、Br 、I 〉X 2+2Na2NaX33 氟气与氯化钠的反应 F 2+2NaClCl 2+2NaF34 氯气与溴化钠的反应 Cl 2+2NaBrBr 2+2NaCl35 溴与碘化钾的反应Br 2+2KII 2+2KBr4、氧族元素(ⅥA 族)1 硫在氧气中燃烧 S+O 2SO 2点燃〈刺激气味气体、有毒〉2 硫在氢气中燃烧 S+H 2H 2S 点燃3 黑火药的反应原理 S+2KNO 3+3CK 2S+N 2 +3CO 24 银和臭氧的反应6Ag+O 33Ag 2O5 臭氧能使湿润的碘化钾试纸变色 O 3+2KI+H 2O 2KOH+I 2+O 26臭氧的不稳定性2O 33O 27 氧气在放电时的反应 放电2O 33O 28 二氧化硫与双氧水的反应 SO 2+H 2O 2H 2SO 49实验室制备硫化氢的反应原理FeS+2HClH 2S +FeCl 210 硫化氢受热分解H 2SH 2+S △11 硫化氢与足量氧气的反应 点燃2H 2S+3O 22H 2O+2SO 212 硫化氢与少量氧气的反应 点燃2H 2S+O 22H 2O+2S13 硫化氢与二氧化硫的反应 2H 2S+SO 22H 214 硫化氢与氯气的反应H 2S+Cl 2〈反应在水溶液中进行〉15 硫化氢与溴的反应H 2S+Br 2S +2HBr16 氢硫酸久置后变质的反应原理 2H 2S+O 22H 2O+2S17 二氧化硫的实验室制法 Na 2SO 3+H 2SO 4Na 2SO 4+H 2O+SO 218 二氧化硫与水的反应 SO 2+H 2O2SO 319 二氧化硫与氧气的反应 △2SO 2+O 2320 二氧化硫与氯水的反应 SO 2+Cl 2+2H 2O 2HCl+H 2SO 4 21 二氧化硫与溴水的反应SO 2+Br 2+2H 2O2HBr+H 2SO 422 二氧化硫与足量氢氧化钠的反应 SO 2+2NaOH Na 2SO 3+H 2O 23 二氧化硫与少量氢氧化钠的反应 SO 2+NaOH NaHSO 3 24 二氧化硫与氧化钙的反应SO 2+CaO CaSO 325 二氧化硫与碳酸钠的反应 SO 2+Na 2CO 3Na 2SO 3+CO 2 26 二氧化硫与碳酸氢钠的反应SO 2+2NaHCO 3Na 2SO 3+2CO 2+H 2O27 二氧化硫使澄清石灰水变浑浊 SO 2+Ca(OH)2CaSO 3 +H 2O28 上面反应继续通二氧化硫CaSO 3+SO 2+H 2OCa(HSO 3)229 二氧化硫与氨水的反应 SO 2+2NH 3·H 2O(NH 4)2SO 3+H 2O30 亚硫酸铵与硫酸的反应(NH 4)2SO 3+H 2SO 4(NH 4)2SO 4+SO 2 +H 2O31 三氧化硫与水的反应 SO 3+H 2O H 2SO 432 三氧化硫与氢氧化钠的反应 SO 3+2NaOH Na 2SO 4+H 2O 33 三氧化硫与氧化钙的反应 SO 3+CaOCaSO 434 浓硫酸与铜的反应 2H 2SO 4(浓)+Cu CuSO 4+SO +2H 2O △35 浓硫酸与碳的反应 2H 2SO 4(浓)+C CO 2 +2SO 2 +2H 2O36 浓硫酸与硫化氢的反应 H 2SO 4(浓)+H 2S S +SO +2H 2O37 浓硫酸与溴化氢的反应 H 2SO 4(浓)+2HBr Br 2+SO 2 +2H 2O38 浓硫酸与过量碘化氢的反应 H 2SO 4(浓)+8HI 4I 2+H 2S +4H 2O39 浓硫酸与少量碘化氢的反应H 2SO 4(浓)+2HII 2+SO +2H 2O5、氮族元素(ⅤA 族)1 氮气与氢气反应合成氨气 N 2+3H 3催化剂2 氮气与氧气的反应 N 2+O 22NO 放电3 一氧化氮与氧气的反应 2NO+O 22NO 24 二氧化氮与水的反应3NO 2+H 2O2HNO 3+NO 5 五氧化二磷与热水反应制备磷酸 P 2O 5+3H 2O (热)2H 3PO 46 五氧化二磷与热水反应制备焦磷酸 P 2O 5+2H 2O (热)H 4P 2O 77 五氧化二磷与冷水反应制备偏磷酸 P 2O 5+H 2O (冷)2HPO 38 氨气与氧气的反应9氨气与氧化铜的反应2NH 3+3CuO 3Cu+N +3H 2O 10 氨气与一氧化氮的反应 △催化剂4NH 3+6NO5N 2+6H 2O11 氨气与二氧化氮的反应 △催化剂8NH 3+6NO 27N 2+12H 2O12 氨气的实验室制法 △2NH 4Cl+Ca(OH)2CaCl 2+2H 2O+2NH 13 氨水与氧化钙的反应2NH 3·H 2O+CaO Ca(OH)2+2NH 3 +H 2O14 氯化氨受热分解 △NH 4ClHCl +NH 315 碳酸氢铵受热分解 △NH 4HCO 3CO +NH +H 2O16 硫酸氨与氢氧化钠的反应△(NH 4)2SO 4+2NaOH Na 2SO 4+2NH 3 +2H 2O17 硝酸氨与氢氧化钠的反应 △NH 4NO 3+NaOHNaNO 3+NH +H 2O18 硝酸受热或光照分解 △4HNO 32H 2O+4NO +O 或光照19 二氧化氮与氧气和水的反应4HNO 32H 2O+4NO 2+O 220 氧化铜与硝酸的反应 CuO+2HNO 3Cu(NO 3)2+H 2O21 铜与浓硝酸的反应 Cu+4HNO 3(浓)Cu(NO 3)2+2NO +2H 2O22 铜与稀硝酸的反应 3Cu+8HNO 3(稀)3Cu(NO 3)2+2NO +4H 2O23 银与浓硝酸的反应Ag+2HNO 3(浓)AgNO 3+NO +H 2O24 银与稀硝酸的反应 3Ag+4HNO 3(稀)3AgNO 3+NO +2H 2O25 碳与浓硝酸的反应 C+4HNO 3(浓)4NO 2 2 +2H 2O△26 硫与浓硝酸的反应 S+6HNO 3(浓)H 2SO 4+6NO 2 +2H 2O△27 锌与浓硝酸的反应 Zn+4HNO 3(浓)Zn(NO 3)2+2NO +2H 2O28 锌与稀硝酸的反应Ⅰ 3Zn+8HNO 3(稀)3Zn(NO 3)2+2NO +4H 2O29 锌与稀硝酸的反应Ⅱ 4Zn+10HNO 3(稀)4Zn(NO 3)2+N 2O +5H 2O30 锌与极稀硝酸的反应 4Zn+10HNO 3(极稀)4Zn(NO 3)2+NH 4NO 3+3H 2O31 硝酸钠与浓硫酸的反应△H 2SO 4(浓)+NaNO 3NaHSO 4+HNO 36、碳族元素(ⅣA 族)1 硅在氧气中加热的反应 Si+O 2SiO 2△2硅与氟气的反应 Si+2F 2SiF 4△3 硅与氯气的反应 Si+2Cl 2SiCl 4高温4硅与氟化氢的反应Si+4HFSiF 4+2H 25 硅与氢氧化钠的反应 Si+2NaOH+H 2O Na 2SiO 3+2H 26 二氧化硅与碳的反应Ⅰ 高温〈此反应只能生成CO ,不能生成CO 2〉2C+SiO 2Si+2CO7 二氧化硅与碳的反应Ⅱ 高温〈同上,此反应只能生成CO 〉3C+SiO 2SiC+2CO 8 二氧化硅与氟化氢的反应 SiO 2+4HFSiF 4+2H 2O9二氧化硅与氢氧化钠的反应SiO 2+2NaOH Na 2SiO 3+H 2O10 二氧化硅与碳酸钠的反应 高温SiO 2+Na 2CO 3Na 2SiO 3+CO 211 二氧化硅与碳酸钙的反应 高温SiO 2+CaCO 3CaSiO 3+CO12 二氧化硅与氧化钙的反应 高温SiO 2+CaOCaSiO 313 硅酸的生成原理 SiO 3-+2H +H 2SiO 〈白色沉淀〉14 原硅酸的生成原理 SiO 3-+2H ++H 2O H 4SiO 4〈白色沉淀〉15 碳与氧化钙的反应 高温3C+CaO CaC 216 一氧化碳与水的反应高温CO+H 2OCO 2+H 2催化剂。
高一化学《必修一》方程式总结第一、二章:1、硫酸根离子的检验: BaCl2 + Na2SO4 = BaSO4↓+ 2NaCl2、碳酸根离子的检验: CaCl2 + Na2CO3 = CaCO3↓ + 2NaCl3、银离子的检验:Cl -+ Ag += AgCl ↓4、木炭还原氧化铜: 2CuO + C 高温2Cu + CO2↑5、铁片与硫酸铜溶液反应: Fe + CuSO4 = FeSO4 + Cu6. 镁在二氧化碳中燃烧: 2Mg +CO2点燃2MgO +C第三章:一、钠1、钠在空气中燃烧(黄色的火焰):2Na +O2Na2O22、钠块在空气中变暗:4Na+O2=2Na2O3、Na2O在空气中加热(变黄):2Na2O+O2△2O24、金属锂在空气中燃烧:4Li +O2△2Li2O5、钠与水反应(浮、熔、游、响、红)2Na +2H2O =2NaOH+H2↑2Na +2H2O =2Na++2OH -+H2 ↑Na2O 、Na2O2的相关反应:6、碱性氧化物Na2O与水的反应:Na2O+H2O=2NaOH7、过氧化钠与水的反应(放热反应、Na2O2是强氧化剂,可用于漂白)2Na2O2+2H2O =4NaOH +O2↑2Na2O2+2H2O =4Na++4OH -+O2↑8、碱性氧化物Na2O与CO2的反应Na2O +CO2=Na2CO39、过氧化钠可用在呼吸面具和潜水艇中作为氧气来源(供氧剂),原因是:2Na2O2+2CO2=2Na2CO3+O210、Na2O +SO2=Na2SO3Na2O2+SO3=Na2SO411、Na2O +2HCl =2NaCl +H2O12、2Na2O2+4 HCl =4 NaCl +2 H2O +O2↑14、小苏打受热分解:2NaHCO3△Na2CO3+H2O +CO2 ↑15、固体氢氧化钠和碳酸氢钠混合物在密闭容器中加热NaHCO3+NaOH △Na2CO3+H2O16、若是氢氧化钠和碳酸氢钠溶液中反应有离子方程式:NaHCO3+NaOH =Na2CO3+H2O HCO3-+OH -=H2O +CO32-17、向NaOH溶液中通入少量CO2 :2NaOH + CO2 = Na2CO3 + H2O18、继续通入过量CO2 :Na2CO3 + CO2 + H2O = 2 NaHCO3总反应方程式:NaOH + CO2 = NaHCO319、苏打(纯碱)与盐酸反应:①盐酸中滴加纯碱溶液Na2CO3+2HCl =2NaCl +H2O +CO2↑CO32-+2H+=H2O +CO2↑②纯碱溶液中滴加盐酸,至过量Na2CO3+HCl =NaHCO3+NaCl CO32-+H+=HCO3-NaHCO3+HCl=NaCl+H2O+CO2↑HCO3-+H+=H2O +CO2↑20、(1)Na2CO3溶液、NaHCO3溶液与Ca(OH)2反应:Na2CO3 +Ca(OH)2 =CaCO3↓+2 NaOHNaHCO3+Ca(OH)2(多)=CaCO3↓+NaOH +H2O2NaHCO3+Ca(OH)2(少)=CaCO3↓+Na2CO3+2H2O21、Na2CO3溶液、NaHCO3溶液与CaCl2反应:Na2CO3 +CaCl2 =CaCO3↓+2 Na ClNaHCO3溶液与CaCl2 不反应;二、经典Al三角:有关反应有:22、铝与氯气反应:2Al +3Cl2点燃2AlCl323、铝片与稀盐酸反应2Al +6HCl =2AlCl3+3H2↑2Al +6H+=2Al3++3H2↑24、铝与氢氧化钠溶液反应2Al+2NaOH +2H2O =2NaAlO2+3H2↑2Al +2OH -+2H2O =2AlO2-+3H2↑25、4Al +3O2△2Al2O3 电解熔融的氧化铝:2Al2O3 4Al +3O2↑26、铝与三氧化二铁高温下反应【铝热反应】:2Al +Fe2O3高温2Fe +Al2O327、不稳定性:2Al(OH)3 △Al2O3 +3H2O28、硫酸铝溶液中滴过量氨水【实验室制备Al(OH)3】Al2(SO4)3+6NH3·H2O=2Al(OH)3↓+3(NH4)2SO4Al3++3 NH3·H2O =Al(OH)3↓+3NH4+29、向NaAlO2 溶液中通入CO22NaAlO2 +CO2+3H2O =2Al(OH)3↓+Na2CO32AlO2-+CO2+3H2O =2Al(OH)3↓+CO32-30、氧化铝溶于氢氧化钠溶液Al2O3+2NaOH 2NaAlO2+H2O Al2O3+2OH -=2AlO2-+H2O 31、氧化铝溶于盐酸:Al2O3+6HCl =2AlCl3+3 H2O Al2O3+6H+=2Al3++3 H2O32、Al(OH)3溶液中加盐酸:Al(OH)3+3HCl =AlCl3+3H2O Al(OH)3+3H+=Al3++3H2O 33、Al(OH)3与NaOH溶液反应:Al(OH)3+NaOH NaAlO2+2 H2O Al(OH)3+OH-=AlO2-+2 H2O电解34、铝盐、偏铝酸盐反应生成Al(OH)3 3AlO2-+Al3++6H2O =4 Al(OH)3↓三. 铁及其重要化合物:35、铁与硫加热反应Fe +S FeS36、铁与氧气加热反应3Fe+2O2Fe3O437= 铁在氯气中加热反应2Fe+3Cl22FeCl338、高温下铁与水蒸气反应:3Fe +4H2O(g)高温Fe3O4+4H239、铁与盐酸反应:Fe +2HCl =FeCl2+H2↑Fe +2H+=Fe2++H2↑铁的氧化物FeO 、Fe2O3、Fe3O4溶于盐酸中:40、FeO +2HCl =FeCl2+H2O FeO +2H+=Fe2++H2O41、Fe2O3+6HCl =2FeCl3+3H2O Fe2O3+6H+=2Fe3++3H2O42、Fe3O4+8HCl =FeCl2+2FeCl3+4H2O Fe3O4+8H+=Fe2++2Fe3++4 H2O Fe(OH)2、Fe(OH)3的制备:43、FeSO4+2NaOH =Fe(OH)2↓+Na2SO4 Fe2++2OH -=Fe(OH)2↓氯化铁中滴入氢氧化钠溶液(红褐色沉淀)44、FeCl3+3NaOH =Fe(OH)3↓+3NaCl Fe3++3OH -=Fe(OH)3↓氢氧化亚铁在空气中被氧化(白色絮状沉淀迅速变成灰绿色,最后变为红褐色沉淀)45、4Fe (OH)2+O2+2H2O =4Fe (OH)346、不稳定性:2Fe(OH)3 △Fe2O3 +3H2OFe2+、Fe3+之间的转化:47、氯化亚铁溶液中通入氯气(或者加氯水)2FeCl2+Cl2=2FeCl3 2 Fe2++Cl2=2 Fe3++2Cl-48、氯化铁溶液中加入铁粉:2FeCl3+Fe =3FeCl2 2Fe3++Fe =3Fe2+49、用KSCN检验Fe3+的存在:离子方程式:Fe3++3SCN-= Fe (SCN)3(血红色)50、印刷电路板:2FeCl3+Cu =2FeCl2 +CuCl2第四章:一、无机非金属材料的主角——硅(1)工业制单质硅(碳在高温下还原二氧化硅):SiO2+2C 高温Si +2CO↑(硅单质的实验室制法,粗硅的制取)(2)硅单质与氢氟酸、Si +4HF = SiF4↑+ 2H2↑(3)硅单质与NaOH溶液反应:Si + 2NaOH + H2O = Na2SiO3 +2H2↑2、Si及其化合物:(一)二氧化硅(4)二氧化硅与氢氧化钠反应SiO2+2NaOH =Na2SiO3+H2O SiO2+2OH -=SiO32-+H2O(5)二氧化硅与氧化钙高温反应:SiO2 + CaO 高温CaSiO3(6)二氧化硅与氢氟酸反应:SiO2 + 4HF = SiF4↑+ 2 H2O(二)硅酸(H2SiO3)(7)往硅酸钠溶液中通入二氧化碳:Na2SiO3 + CO2 + H2O = Na2CO3 + H2SiO3↓(8)硅酸钠与盐酸反应:Na2SiO3 + 2HCl = 2NaCl + H2SiO3(胶体)(9)硅酸受热分解:H2SiO3△SiO2+H2O(10)工业制玻璃原理:SiO2 + Na2CO3高温Na2SiO3 + CO2↑SiO2 + Ca CO3高温Ca SiO3 + CO2↑二、富集在海水中的元素——氯(一)氯气(11)氯气实验室制法:(仪器:分液漏斗,圆底烧瓶)MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O MnO2+4H++2Cl-Mn2++Cl2↑+2H2O2、氯气性质:A、金属和氯气的反应:(12)铜丝在氯气中剧烈燃烧(棕色烟):Cu +Cl2点燃CuCl2之后加水,可由绿色溶液(浓)得到蓝色溶液(稀)(13)氯气和金属钠反应:2Na +Cl2点燃2NaCl(14)铁在氯气中剧烈燃烧:2Fe +3Cl2点燃3FeCl3(15)氢气在氯气中燃烧(苍白色火焰):H2+Cl2点燃2HCl(16)氟气与氢气反应(黑暗处即可爆炸):H2+F2=2HFB、氯气与水反应(17)氯气溶于水(新制氯水中含H+、Cl -、ClO -、OH-、Cl2、HClO、H2O)Cl2+H2O =HCl +HClO Cl2+H2O =H++Cl -+HClO新制氯水注入盛溴化钠溶液的试管中(18)Cl2+2NaBr =Br2+2NaCl Cl2+2Br-=Br2+2Cl-(19)Cl2+2NaI =2NaCl +I2Cl2+2I-=I2 +2Cl-(20)次氯酸见光分解(强氧化剂、杀菌消毒,漂白剂):2HClO 2HCl +O2↑C、氯气和碱和的反应:(21)工业制漂白粉的原理:2Ca(OH)2 +2Cl2=Ca(ClO)2+CaCl2+2H2O2Ca(OH)2 +2Cl2=2Ca2++2ClO-+2Cl -+2H2O(22)漂白粉长期置露在空气中失效的原理:Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO 2HClO HCl +O2↑Ca2++2ClO-+CO2+H2O =CaCO3↓+2HClO(23)制漂白液(或氯气尾气处理):Cl2 +2NaOH = NaCl + NaClO + H2O三、硫和氮的化合物:(24)硫与非金属:S + O2点燃SO2 H2+ S △H2S(25)硫与金属:Fe + S △FeS 2Cu + S△Cu2S(26)二氧化硫与水反应:SO2 + H2O H2SO3(27)二氧化硫与碱性氧化物反应:SO2 + CaO = CaSO3(28)二氧化硫与碱反应:SO2 + 2NaOH = Na2SO3 + H2O SO2 + Ca(OH)2 = CaSO3↓+ H2O (29)二氧化硫与硫化氢气体反应:2H2S +SO2 = 3S↓+ 2H2O(30)二氧化硫通入氯水中:SO2+ Cl2+ 2H2O = 2HCl + H2SO4(Cl2可换作Br2、I2)(31)二氧化硫被O2氧化:2SO2 + O22SO3(32)三氧化硫与水反应:SO3 + H2O = H2SO4(33)三氧化硫与碱反应:SO3 + Ca(OH)2 = CaSO4↓+ H2O(34)工业合成氨:N2+3H2催化剂高温高压2NH3催化剂光照光照△(35)氨的催化氧化:4NH 3+5O24NO +6H2O(36)NH3在水中的反应:NH3 + H2O NH3• H2O NH4++ OH-(37)氨水受热分解:NH3•H2O △NH3↑+ H2O(38)实验室制取氨气:2NH4Cl + Ca(OH)2△CaCl2 + 2NH3↑+ 2H2O(39)碳酸氢铵受热分解:NH4HCO3△NH3↑+H2O↑+CO2↑(40)用浓盐酸检验氨气(白烟生成):HCl +NH3=NH4Cl(41)氯化铵受热分解:NH4Cl △NH3↑+ HCl↑(42)硫酸铵溶液与氢氧化钠溶液混合加(NH4)2SO4+2NaOH △2NH3↑+Na2SO4+2H2O NH4++ OH -△NH3↑+ H2O(43)硝酸铵溶液与氢氧化钠溶液混合(不加热)(检验NH4+的方法)NH4NO3+NaOH =NH3↑+H2O +NaNO3 NH4++OH-=NH3↑+H2O (44)氮气和氧气放电下反应(雷雨发庄稼)N2+O2 2NO 2NO +O22NO2(45)二氧化氮溶于水:3NO2+H2O 2HNO3+NO3NO2+H2O 2H++2NO3-+NO(46)NO2、O2的混合气通入水中无剩余气体:4NO2+O2+2H2O =4 HNO3(47)NO 、O2的混合气通入水中无剩余气体:4NO+3O2+2H2O =4 HNO3(48)NO、NO2的回收:NO2 + NO + 2NaOH = 2Na NO2+H2O5、浓硫酸、HNO3与Cu反应:Al、Fe遇浓HNO3、浓硫酸钝化(常温)(49)Cu与浓HNO3加热:Cu+4HNO3(浓)=Cu(NO3)2 +2NO2↑+2H2O (50)Cu与稀HNO3反应:3Cu+8HNO3(稀)=3Cu(NO3)2 +2NO↑+4H2O (51)铜与浓硫酸反应:Cu+2H2SO4 (浓)CuSO4 +2H2O+SO2 ↑(52)浓硫酸与木炭反应:C+2H2SO4(浓)2H2O+CO2↑+2SO2↑(53)浓硝酸与木炭反应:C+4HNO3(浓)2H2O+CO2↑+4NO2↑放电。