03第3章_单烯烃
- 格式:ppt
- 大小:2.47 MB
- 文档页数:81


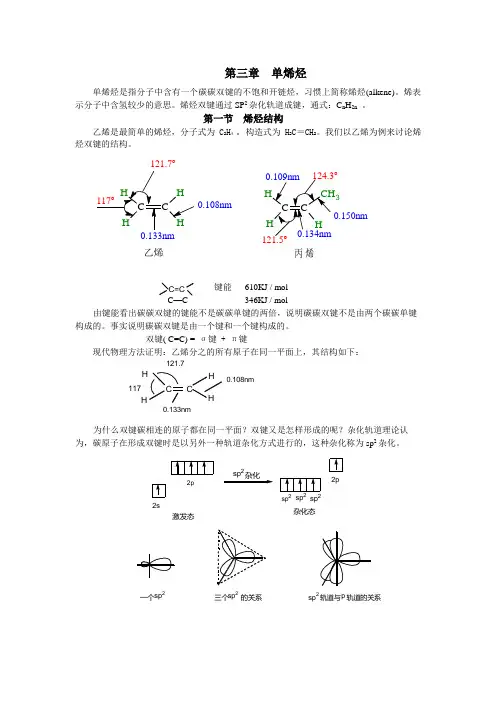
第三章 单烯烃单烯烃是指分子中含有一个碳碳双键的不饱和开链烃,习惯上简称烯烃(alkene)。
烯表示分子中含氢较少的意思。
烯烃双键通过SP 2杂化轨道成键,通式:C n H 2n 。
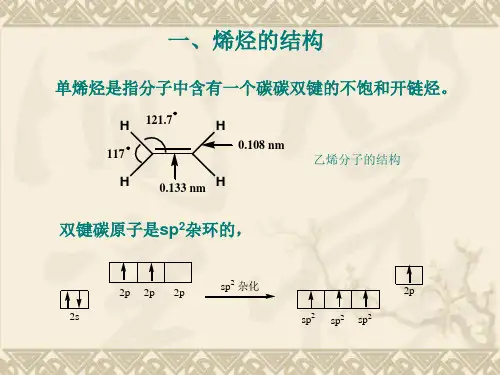
第一节 烯烃结构乙烯是最简单的烯烃,分子式为C 2H 4 。
构造式为H 2C =CH 2。
我们以乙烯为例来讨论烯烃双键的结构。
H3乙烯丙烯o0.108nm0.150nmo键能 610KJ / mol—346KJ / mol由键能看出碳碳双键的键能不是碳碳单键的两倍,说明碳碳双键不是由两个碳碳单键构成的。
事实说明碳碳双键是由一个键和一个键构成的。
双键( C=C) = σ键 + π键现代物理方法证明:乙烯分之的所有原子在同一平面上,其结构如下:为什么双键碳相连的原子都在同一平面?双键又是怎样形成的呢?杂化轨道理论认为,碳原子在形成双键时是以另外一种轨道杂化方式进行的,这种杂化称为sp 2杂化。
0.108nm 0.133nm117°121.7°一个sp 2三个 的关系sp 2轨道与 轨道的关系p sp 2sp 2sp sp 22p2s 2p杂化2杂化态激发态sp 2杂化乙烯分子的形成π键键能 = 双键键能 — 碳碳单键键能= 610.9KJ / mol – 347.3 KJ / mol =263.6KJ / mol 其它烯烃的双键,也都是由一个σ键和一个π键组成的。
碳碳双键是烯烃的官能团,碳碳双键是由一个碳碳σ单键和一个碳碳π键组成,具有刚性,不能绕碳碳双键自由旋转。
形成双键的两个碳原子为sp 2杂化,它们各用一个sp 2杂化轨道“头碰头”重叠形成C-C σ键;每个碳原子余下的两个sp 2轨道分别与其它原子或基团结合形成两个σ单键;这样而形成的五个σ键均处于同一平面上,两个碳原子各剩余一个未参与杂化的P 轨道,并垂直于该平面,且互相平行,从而侧面重叠形成π键。
所以碳碳双键相当于由一个C-C σ单键和一个C-C π键组成,平均键能为610.9 KJ ·mol -1, 其中C-C σ键的平均键能为347.3 KJ ·mol -1,π键的键能为263.6 KJ ·mol -1,π键能较σ键小。






