元素及化合物的性质word资料28页
- 格式:doc
- 大小:101.50 KB
- 文档页数:28

一、钠及其化合物 1、钠得化学性质(1)与非金属单质反应O 2⎩⎪⎨⎪⎧常温:4Na +O 2===2Na 2O 白色点燃:2Na +O 2=====点燃Na 2O 2淡黄色(2)与H 2O 反应:2Na +2H 2O===2NaOH +H 2↑(3)与酸溶液反应(如HCl):2Na +2HCl===2NaCl +H 2↑ (4)与盐反应 ①与熔融盐反应如:4Na +TiCl 4=====高温4NaCl +TiNa +KCl=====高温NaCl +K↑(制取金属钾,因为钾得沸点比钠得低,使钾成为蒸气而逸出) ②与盐溶液反应(钠先与水反应,生成得氢氧化钠再与盐溶液反应)如:2Na +2NH 4Cl===2NaCl +H 2↑+2NH 3↑ 2Na +CuSO 4+2H 2O===Na 2SO 4+H 2↑+Cu(OH)2↓ (5)与某些有机物反应如:2Na +2CH 3CH 2OH ―→2CH 3CH 2ONa +H 2↑ 2Na +2CH 3COOH ―→2CH 3COONa +H 2↑2. 氧化钠与过氧化钠3. 碳酸钠与碳酸氢钠Na 2CO 3①CO 2+H 2O ②少量盐酸 固加热/液NaOH NaHCO 31.镁与铝单质得性质 (1)镁得化学性质①与非金属单质反应(O 2、N 2、Cl 2)2Mg +O 2=====点燃2MgO(产生耀眼得白光)3Mg +N 2=====点燃Mg 3N 2 Mg +Cl 2=====点燃MgCl 2②与水(反应): Mg +2H 2O=====△Mg(OH)2+H 2↑ ③与酸反应:Mg +2H +===Mg 2++H 2↑ ④与盐反应:Mg +Cu 2+===Mg 2++Cu⑤与CO 2反应:2Mg +CO 2=====点燃2MgO +C⑥工业炼镁:MgCl 2=====通电熔融Mg +Cl 2↑(2)铝得化学性质①与非金属单质反应(O 2、Cl 2、S)2Al +3Cl 2=====△2AlCl 32Al +3S=====△Al 2S 3(水溶液不存在) ②与酸反应③与碱反应:2Al +2OH -+2H 2O===2AlO -2+3H 2↑ ④与盐反应:Al +3Ag +===Al 3++3Ag ⑤与氧化物反应(铝热反应)2Al +Fe 2O 3=====高温2Fe +Al 2O 3 4Al +3MnO 2=====高温3Mn +2Al 2O 3Cr 2O 3+2Al=====高温2Cr +Al 2O 3 ⑥工业炼铝:2Al 2O 3=====通电熔融4Al +3O 2↑3、铝得主要化合物4、“铝三角”间得转化关系(1)Al3++3OH-===Al(OH)3↓或Al3++3NH3·H2O===Al(OH)3↓+3NH+4(2)Al(OH)3+OH-===AlO-2+2H2O(3)Al3++4OH-===AlO-2+2H2O(4)AlO-2+H++H2O===Al(OH)3↓或AlO-2+CO2+2H2O===Al(OH)3↓+HCO-3(5)Al(OH)3+3H+===Al3++3H2O(6)AlO-2+4H+===Al3++2H2O三、铁与铜1.铁得氧化物得比较化学式FeO Fe2O3Fe3O4俗称—铁红磁性氧化铁色态黑色粉末红棕色粉末黑色晶体价态+2 +3 1/3正2价,2/3正3价水溶性不溶不溶不溶与酸得反应FeO+2H+===Fe2++H2O遇氧化性酸生成Fe3+盐Fe2O3+6H+===2Fe3++3H2OFe3O4+8H+===Fe2++2Fe3++4H2O与CO得反应高温FexOy+yCO===xFe+yCO22.Fe2+与Fe3+ 得比较Fe2+Fe3+水合离子颜色浅绿色棕黄色氧化还原性既有氧化性,又有还原性只有氧化性水解性Fe2+ +2H2O←→Fe(OH)2+2H+Fe3+ +3H2O←→Fe(OH)3+3H+与碱得反应Fe2+ +2OH—=== Fe(OH)2↓Fe3+ +3OH—=== Fe(OH)3↓3.Fe(OH)2与Fe(OH)3得比较Fe(OH)2Fe(OH)3颜色状态白色固体红褐色固体水溶性不溶不溶稳定性易氧化为Fe(OH)3,空气中加热得不到FeO 较稳定:∆Fe(OH)3== Fe2O3+3H2O与酸得反应Fe(OH)2+2H+=== Fe2+ +3H2O Fe(OH)3+3H+=== Fe3+ +3H2O 制法在隔绝O2得条件下Fe2+与碱反应Fe3+与碱反应4、铁三角:点燃注:(1)一般就是指Zn 、Al 、CO 、 H 2、 等还原剂。

元素及化合物的性质一、钠及化合物的性质1、4Na+O2===2Na2O 常温反应,活泼金属2、2Na2O+O2===2Na2O2黄色火焰,有浅黄色固体3、2Na+O2===Na2O2加热,氧为-1价,黄色火焰,有浅黄色固体4、2Na+2H2O===2NaOH+H2浮、熔、游、红5、4Na+TiCl4(熔融)===4NaCl+Ti 强还原剂6、Na2O+H2O===2NaOH 碱性氧化物性质7、2Na2O2+2H2O===4NaOH+O2 强氧化剂8、Na2O+CO2===Na2CO3碱性氧化物性质9、2Na2O2+2CO2===2Na2CO3+O2作供氧剂10、Na2O+2HCl===2NaCl+H2O 碱性氧化物性质11、2Na2O2+4HCl===4NaCl+2H2O+O212、NaHCO3+HCl===NaCl+H2O+CO2 小苏打比苏打更剧烈13、2NaHCO3===Na2CO3+H2O+CO2小苏打不稳定二、铝及化合物的性质14、2Al+3Cl2===2AlCl3活泼金属15、4Al+3O2===2Al2O3 (钝化)活泼金属16、2Al+Fe2O3===Al2O3+2Fe 铝热反应17、2Al+6HCl===2AlCl3+3H2铝的金属性18、2Al+3H2SO4===Al2(SO4)3+3H2铝的金属性19、2Al+2NaOH+2H2O===2NaAlO2+3H2 铝的非金属性20、Al2O3+3H2SO4===Al2(SO4)3+3H2O (Al2O3是两性氧化物:)21、Al2O3+2NaOH===2NaAlO2+H2O) (Al2O3是两性氧化物:)22、NaOH+Al(OH)3===NaAlO2+2H2O Al(OH)3是两性氢氧化物:23、2Al(OH)3===Al2O3+3H2O 不稳定24、Al(OH)3+3HCl=== AlCl3+3H2O Al(OH)3是两性氢氧化物25、AlCl3+3NH3·H2O===Al(OH)3↓+3NH4Cl 白色胶状沉淀,制氢氧化铝最佳三、铁及化合物的性质26、3Fe+4H2O(g)===Fe3O4+4H227、Fe+2HCl===FeCl2+H2铁的金属性一般28、Fe+CuCl2===FeCl2+Cu 铁的金属性29、Fe3O4+4H2===3Fe+4H2O (制还原铁粉)30、FeO+2HCl===FeCl2+3H2O 碱性氧化物性质31、Fe2O3+6HCl===2FeCl3+3H2O 碱性氧化物性质32、Fe3O4+8HCl===FeCl2+2FeCl3+4H2O33、2Fe(OH)3===Fe2O3+3H2O 不稳定34、2FeCl3+Fe===3FeCl2氧化性35、2FeCl3+Cu===2FeCl2+CuCl2氧化性36、FeCl3+3NH3·H2O===Fe(OH)3↓+3NH4Cl 红褐色色沉淀37、4Fe(OH)2+O2+2H2O===4Fe(OH)3 白色沉淀很快变成灰白色最后变成红褐色38、2FeCl2+Cl2===2FeCl3 (在水溶液中不需加热) 亚铁的还原性39、FeCl3+3KSCN==Fe(SCN)3+3KCl(血红色,用于Fe3+的特性检验)四、硅及化合物的性质40、2C+SiO2===Si+2CO (制得粗硅)41、Si(粗)+2Cl2===SiCl442、(SiCl4+2H2===Si(纯)+4HCl) 硅提纯43、Si(粉)+O2===SiO2和碳的性质相似44、Si+C===SiC(金刚砂)45、Si+2NaOH+H2O===Na2SiO3+2H2和铝的性质相似46、SiO2+CaO===CaSiO3酸性氧化物性质47、SiO2+2NaOH===Na2SiO3+H2O 酸性氧化物性质 (常温下强碱缓慢腐蚀玻璃)48、SiO2+Na2CO3===Na2SiO3+CO2工业制玻璃49、SiO2+CaCO3===CaSiO3+CO2 工业制玻璃50、Na2SiO3+CO2+H2O====H2SiO3+ Na2CO3水玻璃在空气中变质51、H4SiO4===H2SiO3+H2O 原硅酸制硅胶五、氯及化合物的性质52、Cl2 +H2 ===2HCl 苍白色火焰,有白雾53、3Cl2 +2P===2PCl3有白雾54、Cl2 +PCl3 ===PCl5有白烟55、Cl2 +2Na===2NaCl 有白烟56、3Cl2 +2Fe===2FeCl3 有棕色烟57、Cl2+Cu===CuCl2有棕黄色烟58、2Cl2+2NaBr===2NaCl+Br2溶液有无色变橙色59、Cl2 +2NaI ===2NaCl+I2溶液有无色变红棕色60、Cl2 +Na2S===2NaCl+S 溶液有浅黄色浑浊61、Cl2 +H2S===2HCl+S 溶液有浅黄色浑浊62、Cl2+SO2 +2H2O===H2SO4 +2HCl 氯水的强氧化性,二氧化硫的还原性63、4HCl(浓)+MnO2===MnCl2+Cl2+2H2O 实验室制氯气64、16HCl+2KMnO4===2KCl+2MnCl2+5Cl2+8H2O实验室制氯气65、2NaOH+Cl2===NaCl+NaClO+H2O 制漂白液66、2Cl2+2Ca(OH)2====CaCl2+Ca(ClO)2+2H2O制漂白粉67、2FeCl3+H2S===2FeCl2+2HCl+S 溶液由红棕色变浅绿色,有浅黄色浑浊68、2FeCl3+2KI===2FeCl2+2KCl+I269、2FeCl2+Cl2===2FeCl3 浅绿色变红棕色70、MgCl2+2NH3.H2O===Mg(OH)2+NH4Cl 白色沉淀六、硫及化合物的性质71、S+H2===H2S72、S+Fe===FeS 硫的氧化性较弱73、S+2Cu===Cu2S 硫的氧化性较弱74、3S+2Al===Al2S375、S+O2===SO2硫的还原性76、S+6HNO3(浓)===H2SO4+6NO2+2H2O 硫的还原性77、3S+4 HNO3(稀)===3SO2+4NO+2H2O 硫的还原性78、2H2S+3O2(足量)===2SO2+2H2O 硫化氢的还原性79、2H2S+O2(少量)===2S+2H2O80、2H2S+SO2===3S+2H2O81、H2S+H2SO4(浓)===S+SO2+2H2O 硫化氢的还原性82、3H2S+2HNO(稀)===3S+2NO+4H2O 硫化氢的还原性83、SO2+(NH4)2SO3+H2O===2NH4HSO3(这是硫酸厂回收SO2的反应.先用氨水吸收SO2, 再用H2SO4处理:84、2NH4HSO3+H2SO4===(NH4)2SO4+2H2O+2SO2。

元素与化合物的性质元素和化合物是化学研究中的两个重要概念。
元素是由同一种类型的原子组成的物质,化合物是由不同类型的原子通过化学键结合形成的物质。
元素和化合物拥有不同的性质,这些性质在理解和研究化学反应以及物质变化中起着至关重要的作用。
一、元素的性质元素是构成一切物质的基本单位,具有独特的性质。
元素的性质主要包括原子质量、原子半径、电子亲和能、离子化能等。
1. 原子质量:原子质量是元素的重要物理性质之一。
它代表了一个元素中原子的平均质量。
原子质量由质子和中子的质量组成,其中质子数目就是该元素的原子序数。
例如,氢的原子质量为1,氧的原子质量为16。
2. 原子半径:原子半径是指原子核与外层电子轨道的最外层电子之间的距离。
原子半径与元素周期表中的位置相关,一般来说,原子半径随着原子序数的增加而增加。
例如,钠的原子半径比锂的原子半径更大。
3. 电子亲和能:电子亲和能是指一个原子在气态中接受一个电子形成负离子时释放的能量。
电子亲和能可以衡量一个原子对外层电子的吸引力。
一般来说,电子亲和能越高,元素越容易接受电子形成负离子。
4. 离子化能:离子化能是指一个原子在气态中失去一个电子形成正离子时需要吸收的能量。
离子化能可以衡量一个原子外层电子的稳定性。
一般来说,离子化能越高,元素越难以失去电子形成正离子。
二、化合物的性质化合物是由不同类型的原子通过化学键结合而成的。
化合物的性质主要包括物理性质和化学性质。
1. 物理性质:化合物的物理性质指的是其在物质变化时不改变物质化学组成的性质。
这些性质包括熔点、沸点、密度、颜色等。
例如,水的熔点为0°C,沸点为100°C。
2. 化学性质:化合物的化学性质指的是其在化学反应中发生变化的性质。
这些性质包括与其他物质发生反应的能力、与酸或碱反应的性质以及氧化还原反应的性质等。
例如,氢氧化钠溶于水会产生氢氧化钠水溶液,通过与酸反应可以中和酸性物质。
化合物的性质与其中原子的种类、数目以及它们之间的化学键的类型和强度密切相关。

元素与化合物的性质在化学领域,元素与化合物是两个基本概念。
元素是组成物质的基本构成单位,而化合物则是由两个或更多元素以固定比例结合而成的物质。
它们在性质上有一些显著的区别,下面将对这些性质进行详细探讨。
一、元素的性质元素是自然界中最基本的物质单位,不可再分。
所有的物质都由不同种类的元素组成。
元素的性质取决于元素的原子结构和化学性质。
1. 原子结构特性:每个元素都由原子组成,原子由质子、中子和电子构成。
质子和中子位于原子核中,而电子则环绕在核外。
元素的原子序数表示了其质子数,决定了元素的化学特性。
2. 物理性质:元素的物理性质包括颜色、状态、密度、熔点和沸点等。
例如,金属元素通常呈固态,在常温下具有良好的导电和导热性能,而非金属元素则常常是气体或固体。
3. 化学性质:每个元素都具有特定的化学性质和反应规律。
元素可与其他元素组成化合物,也可以与自身形成同种元素的化合物。
例如,氧气(O2)是由两个氧原子组成的氧气分子。
二、化合物的性质化合物是由两个或多个元素以一定比例组成的纯物质。
化合物的性质与其组成元素之间的化学键和化学键的类型有关。
下面将就化合物性质的表现进行具体说明。
1. 稳定性:化合物通常比元素更为稳定。
这是由于化合物中的元素通过形成化学键而变得相对稳定。
在化学反应中,化合物常常需要具备足够的能量才能发生分解或转化为其他物质。
2. 物理性质:化合物的物理性质如熔点、沸点和颜色等,取决于其分子或晶格结构。
不同化合物之间的物理性质也各不相同。
3. 化学性质:化合物在化学反应中呈现出特定的性质。
通过化学反应,化合物可以被分解成元素或与其他物质发生反应。
化合物的化学性质取决于其中元素的性质以及它们组成的化学键类型。
总结:元素和化合物在性质上存在着明显的差异。
元素是构成物质的基本单位,其性质取决于原子结构和化学性质。
化合物是两个或更多元素以一定比例结合而成的物质,其性质由组成元素和化学键类型决定。
了解元素和化合物的性质有助于我们深入理解物质的行为和化学反应的规律,为进一步的研究和应用提供基础。


初中化学元素化合物化学性质归纳一、单质1.金属单质⑴金属与O2反应生成金属氧化物⑵金属与酸反应生成金属与 H2⑶金属与盐溶液反应生成金属与盐2.非金属单质⑴氧气(O2)①O2与非金属反应生成非金属氧化物②O2与金属反应生成金属氧化物③O2与化合物反应生成氧化物⑵氢气(H2)①可燃性(H2和O2点燃生成水)②还原性(H2与金属氧化物反应生成金属和 H2O)⑶碳(C)①可燃性(C在充足的O2中燃烧生成C O2,在不充足的O2中燃烧生成C O)②还原性(C和金属氧化物高温反应生成金属和C O2,C和C O2高温反应生成C O)③常温下性质稳定二、氧化物1.金属氧化物⑴金属氧化物与还原剂反应生成金属和 H2O或C O2⑵金属氧化物与酸反应生成盐和 H2O⑶C a O与 H2O反应生成C a(O H)22.非金属氧化物⑴水(H2O)①H2O通电分解生成 H2和O2②H2O与C O2反应 H2C O3③H2O与C a O反应生成C a(O H)2⑵二氧化碳(CO2)①“三不”:不能燃烧、不能支持燃烧、不能供给呼吸②C O2与 H2O反应 H2C O3③C O2与碱溶液反应生成盐和 H2O④氧化性(C O2与C高温反应生成C O)⑶一氧化碳(CO)①可燃性(C O与O2点燃生成C O2)②还原性(C O与金属氧化物反应生成金属和C O2)③毒性三、酸1.酸与指示剂作用2.酸与金属反应生成盐和 H23.酸与金属氧化物反应生成盐和 H2O4.酸与碱反应生成盐和 H2O5.酸与盐反应生成酸和盐四、碱1.碱与指示剂作用2.碱与非金属氧化物反应生成盐和 HO2 3.碱与酸反应生成盐和水4.碱与盐反应生成碱和盐五、盐1.盐与金属反应生成盐和金属2.盐与酸反应生成盐和酸3.盐与碱反应生成盐和碱4.盐与盐反应生成盐和盐。
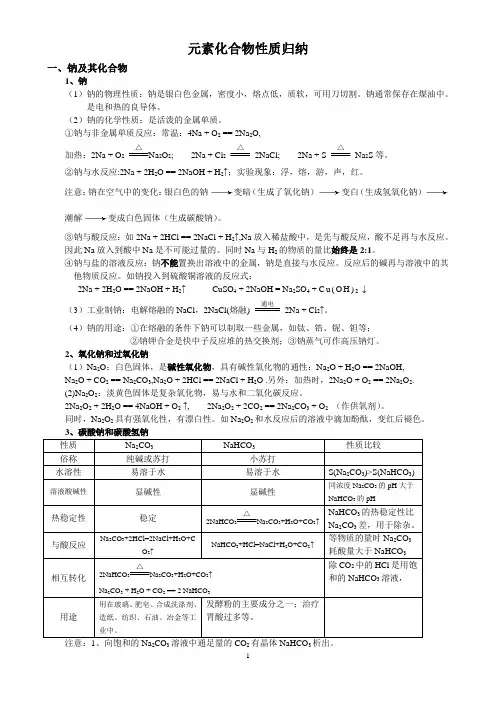
元素化合物性质归纳一、钠及其化合物1、钠(1)钠的物理性质:钠是银白色金属,密度小,熔点低,质软,可用刀切割。
钠通常保存在煤油中。
是电和热的良导体。
(2)钠的化学性质:是活泼的金属单质。
①钠与非金属单质反应:常温:4Na + O2 == 2Na2O,加热:2Na + O2△2O2; 2Na + Cl2△2NaCl; 2Na + S△Na2S等。
②钠与水反应:2Na + 2H2O == 2NaOH + H2↑;实验现象:浮,熔,游,声,红。
注意:钠在空气中的变化:银白色的钠变暗(生成了氧化钠)变白(生成氢氧化钠)潮解变成白色固体(生成碳酸钠)。
③钠与酸反应:如2Na + 2HCl == 2NaCl + H2↑,Na放入稀盐酸中,是先与酸反应,酸不足再与水反应。
因此Na放入到酸中Na是不可能过量的。
同时Na与H2的物质的量比始终是2:1。
④钠与盐的溶液反应:钠不能置换出溶液中的金属,钠是直接与水反应。
反应后的碱再与溶液中的其他物质反应。
如钠投入到硫酸铜溶液的反应式:2Na + 2H2O == 2NaOH + H2↑CuSO4 + 2NaOH = Na2SO4 + C u(O H)2↓(3)工业制钠:电解熔融的NaCl,2NaCl(熔融) 通电2Na + Cl2↑。
(4)钠的用途:①在熔融的条件下钠可以制取一些金属,如钛、锆、铌、钽等;②钠钾合金是快中子反应堆的热交换剂;③钠蒸气可作高压钠灯。
2、氧化钠和过氧化钠(1)Na2O:白色固体,是碱性氧化物,具有碱性氧化物的通性:Na2O + H2O == 2NaOH,Na2O + CO2 == Na2CO3,Na2O + 2HCl == 2NaCl + H2O .另外:加热时,2Na2O + O2 == 2Na2O2. (2)Na2O2:淡黄色固体是复杂氧化物,易与水和二氧化碳反应。
2Na2O2 + 2H2O == 4NaOH + O2↑, 2Na2O2 + 2CO2 == 2Na2CO3 + O2(作供氧剂)。
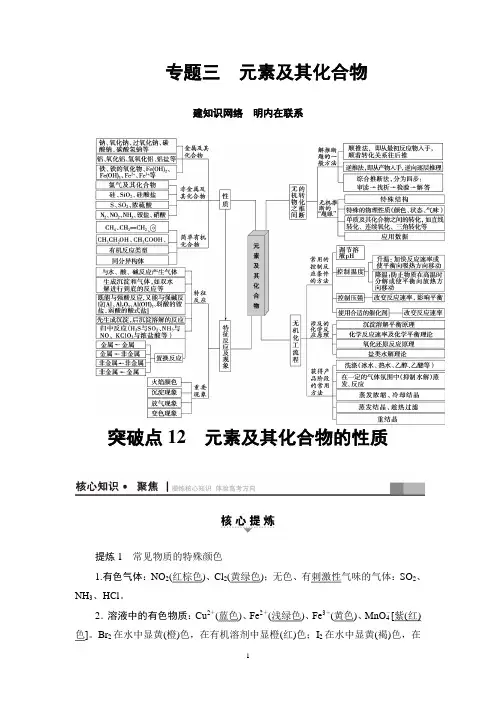
专题三元素及其化合物建知识网络明内在联系突破点12元素及其化合物的性质提炼1常见物质的特殊颜色1.有色气体:NO2(红棕色)、Cl2(黄绿色);无色、有刺激性气味的气体:SO2、NH3、HCl。
2.溶液中的有色物质:Cu2+(蓝色)、Fe2+(浅绿色)、Fe3+(黄色)、MnO-4[紫(红)色]。
Br2在水中显黄(橙)色,在有机溶剂中显橙(红)色;I2在水中显黄(褐)色,在有机溶剂中显紫(红)色。
3.有色固体:(淡)黄(棕)色固体:Na 2O 2、S 、FeS 2、FeCl 3;黑色固体:MnO 2、C 、CuO 、FeO 、Fe 3O 4;紫(黑)色固体:KMnO 4、I 2;(紫)红色固体:Cu 。
4.有色沉淀:(1)白色沉淀:H 2SiO 3、AgCl 、BaSO 4(不溶于酸)、BaSO 3、Mg(OH)2、Al(OH)3、BaCO 3、CaCO 3、CaSO 4、MgCO 3等;(2)红褐色沉淀:Fe(OH)3;(3)蓝色沉淀:Cu(OH)2;(4)黑(褐)色沉淀:CuS 、FeS ;(5)砖红色沉淀:Cu 2O 。
提炼2 特征反应1.产生气体 (1)与酸反应产生气体金属+HCl(或稀H 2SO 4)―→H 2↑; 金属+H 2SO 4(浓)―→SO 2↑; 金属+HNO 3(稀)―→NO ↑; 金属+HNO 3(浓)―→NO 2↑;C +2H 2SO 4(浓)=====△CO 2↑+2SO 2↑+2H 2O ; C +4HNO 3(浓)=====△CO 2↑+4NO 2↑+2H 2O ;CO 2-3(HCO -3)+H +―→CO 2↑+H 2O ; S 2-(HS -)+H +―→H 2S ↑;SO 2-3(HSO -3)+H +―→SO 2↑+H 2O 。
(2)与碱反应产生气体2Al +2NaOH +2H 2O===2NaAlO 2+3H 2↑; NH +4+OH -=====△NH 3↑+H 2O 。


元素及化合物的性质元素是组成物质的基本单位,化合物由两种或更多种元素以一定的比例按化学方式结合而成。
每种元素和化合物都有自己独特的性质。
在本文中,我们将讨论元素和化合物的一些常见性质。
元素的性质主要包括物理性质和化学性质。
物理性质:1.密度:元素的密度是指单位体积的质量。
元素的密度可以用来比较不同元素的重量。
2.熔点和沸点:熔点是指物质从固态转变为液态的温度,沸点是指物质从液态转变为气态的温度。
不同元素的熔点和沸点各不相同。
3.电导率:电导率是指物质导电的能力。
金属元素通常具有良好的导电性能,而非金属元素通常具有较差的导电性能。
4.热导率:热导率是指物质传导热能的能力。
金属元素通常具有较好的热导率,传热速度较快。
化学性质:1.反应性:元素的反应性是指元素与其他物质发生化学反应的倾向。
一些元素具有很高的反应性,例如钠和氟,而其他元素则具有较低的反应性。
2.氧化还原能力:元素的氧化还原能力是指元素在化学反应中接受或失去电子的能力。
一些元素具有较强的氧化还原能力,例如氧气和氯气。
3.酸碱性:元素可以显示酸性、中性或碱性。
酸性物质具有低pH值,碱性物质具有高pH值,而中性物质具有中间的pH值。
4.可燃性:一些元素具有可燃性,可以在适当的条件下燃烧或爆炸。
例如,氢气和氧气的混合物可以形成易燃的爆炸物。
化合物的性质主要包括组成、稳定性和化学性质。
组成:化合物由两种或更多种不同元素以固定的比例结合而成。
化合物的性质受到其组成元素的影响。
稳定性:化合物的稳定性取决于其成键方式和成键能力。
共价化合物中的原子通过共用电子对结合在一起,离子化合物中的原子通过电荷引力结合在一起。
离子化合物通常比共价化合物更稳定。
化学性质:1.化学反应:化合物可以与其他物质发生化学反应。
这些反应可以导致化合物的分解或生成新的化合物。
2.反应活性:化合物的反应活性取决于其结构和成键方式。
一些化合物具有很高的反应活性,可以轻易与其他物质发生反应,而其他化合物则具有较低的反应活性。
元素化合物的化学性质归纳编写:陈应护一、钠的化学性质1、与O2反应:常温:____________________________________ (_______色固体);点燃或加热:____________________________________ (_______色固体);2、与Cl2反应:____________________________________;3、与水反应:____________________________________4、与酸反应:非常剧烈,以致爆炸;____________________________________5、与盐溶液反应:可认为是先与盐溶液中的水反应,然后再发生复分解反应(其实质都是先于溶液中的H+反应)。
________________________________________________________________________二、Cl2的化学性质1、与金属反应____________________________________(白烟);____________________________________ (棕黄色烟,加少量水显绿色,冲稀后变蓝色);____________________________________ (棕红色烟,加少量水显棕黄色)2、与非金属反应____________________________________ (白雾)。
纯净的H2可在Cl2中燃烧,发出苍白色火焰。
HCl (溶解度1∶500)溶于水成为盐酸.3、与水反应:____________________________________4、与碱反应:____________________________________(该反应可用于Cl2的尾气处理);工业上用Cl2与石灰乳作用制漂白粉:____________________________________5、与盐溶液的置换反应:____________________________________(该反应常用作Cl2的检验);____________________________________氯水的成分和性质(1)氯水的成分氯水是氯气的水溶液,通常情况下为浅黄色溶液,氯水中只有部分Cl2与水反应,其化学方程式为:____________________________________新制的氯水中含___________________________等分子和________________________等离子。
第五章 元素及化合物的性质实验十九 碱金属和碱土金属一、目的要求1. 比较碱金属、碱土金属的活泼性。
2. 比较碱土金属氢氧化物及其盐类溶解度。
3. 了解碱金属和碱土金属离子的定性鉴定方法。
二、仪器和药品仪器:离心机,试管,烧杯,坩埚,漏斗,镊子,钴玻璃片药品:HCl(2 mol·L -1,6 mol·L -1),HNO 3(6 mol·L -1),H 2SO 4(2 mol·L -1),HAc(2 mol·L -1),NaOH(2 mol·L -1),NH 4Cl(2 mol·L -1),Na 2CO 3(0.1 mol·L -1),LiCl(0.1 mol·L -1),NaF(0.1 mol·L -1),Na 2CO 3(0.1 mol·L -1),Na 2HPO 4(0.1 mol·L -1),MgCl 2(0.1 mol·L -1),CaCl 2(0.1 mol·L -1),BaCl 2(0.1 mol·L -1),Na 2SO 4(0.5 mol·L -1),CaSO 4(饱和),(NH 4)2C 2O 4(饱和),(NH 4)2CO 3(0.5 mol·L -1),K 2CrO 4(0.1 mol·L -1),K[Sb(OH)6] (饱和),NaHC 4H 4O 6(饱和),NH 3·H 2O -NH 4Cl 缓冲液(浓度各为1 mol·L -1),HAc -NH 4Ac 缓冲液(浓度各为1 mol·L -1),Na +,K +,Ca 2+,Sr 2+,Ba 2+试液(10 g·L -1),pH 试纸,Na(s),K(s),Mg(s),Ca(s),铂丝 三、实验内容1. 碱金属、碱土金属活泼性的比较1) 金属钠和氧的反应 用镊子夹取一小块(绿豆大小)金属钠,用滤纸吸干其表面的煤油,切去表面氧化膜,放入干燥的坩埚中加热。
当钠刚开始燃烧时,停止加热,观察反应现象及产物的颜色和状态。
2) 观察镁条在空气中燃烧 取一小段镁条,用砂纸除去表面的氧化膜。
点燃,观察燃烧情况和所得产物。
3) 钠、钾、镁、钙与水的反应 分别取一小块金属钠和金属钾,用滤纸吸干其表面煤油,放入两个盛有1/4体积水的250 mL 烧杯中,并用合适大小的漏斗盖好,观察反应情况。
检验反应后水溶液的酸碱性。
(安全提示:金属钾在空气中易自燃,与水反应剧烈。
)取一段擦干净的镁条,投入盛有蒸馏水的试管中,观察反应情况。
水浴加热,反应是否明显?检验反应后水溶液的酸碱性。
取一小块金属钙置于试管中,加入少量水,观察现象,检验水溶液的酸碱性。
2. 碱土金属氢氧化物溶解性的比较在3支试管中分别加入1 mL 0.1mol·L -1 MgCl 2,CaCl 2和BaCl 2溶液,然后加入等体积新配制的2 mol·L -1 NaOH 溶液,观察沉淀的生成。
根据沉淀的多少,比较这三种氢氧化物的溶解性。
3. 碱金属微溶盐的生成和性质1) 锂盐 取少量0.1 mol·L -1 LiCl 溶液分别与0.1 mol·L -1 NaF ,Na 2CO 3,Na 2HPO 4溶液反应,观察现象,写出反应式。
2) 钠盐 取少量0.1 mol·L -1 NaCl 溶液,加入饱和K[Sb(OH)6]溶液,放置数分钟,若无晶体析出,可用玻璃棒擦试管内壁,观察产物的颜色和状态,写出反应式。
3) 钾盐 取少量0.1 mol·L -1 KCl 溶液,加入1 mL 饱和酒石酸氢钠(NaHC 4H 4O 6)溶液,观察产物的颜色和状态,写出反应的方程式。
1) 硫酸盐溶解度的比较 在3支试管中,分别加入1 mL 0.1 mol·L-1的MgCl 2,CaCl 2和BaCl 2溶液,然后各加入1 mL 0.5 mol·L -1Na 2SO 4溶液,观察沉淀是否生成?分离出沉淀,试验其在6 mo l·L -1 HNO 3中的溶解性。
另取2支试管,分别加入1 mL 0.1 mol·L -1的MgCl 2和BaCl 2溶液,然后各加入0.5 mL 饱和CaSO 4溶液,又有何现象?写出反应方程式,并比较MgSO 4,CaSO 4和BaSO 4的溶解度大小。
2) 镁、钙和钡的碳酸盐的生成和性质(1) 在3支试管中,分别加入0.5 mL 0.1 mol·L -1的MgCl 2,CaCl 2和BaCl 2溶液,再各加入0.5 mL 0.1 mol·L -1 Na 2CO 3溶液,稍加热,观察现象。
试验产物与2 mol·L -1NH 4Cl 溶液的作用,写出反应式。
(2) 在分别盛有0.5 mL 0.1 mol·L -1的MgCl 2,CaCl 2和BaCl 2溶液的3支试管中,各加入0.5 mL NH 3·H 2O -NH 4Cl 缓冲溶液(pH=9),然后各加入0.5 mL 0.5 mol·L -1 (NH 4)2CO 3溶液。
稍加热,观察现象。
试指出Mg 2+与Ca 2+、Ba 2+的分离条件。
3) 钙和钡的铬酸盐的生成和性质(1) 在2支试管中,各加入0.5 mL 0.1 mol·L -1的CaCl 2和BaCl 2溶液,再各加入0.5 mL 0.1 mol·L -1 K 2CrO 4溶液,观察现象。
试验产物分别与2 mol·L -1 HAc 、HCl 溶液的作用。
写出反应式。
(2) 在2支试管中,各加入0.5 mL 0.1 mol·L -1的CaCl 2和BaCl 2溶液,再各加入0.5 mL HAc -NH 4Ac 缓冲溶液,然后分别滴加0.5 mL 0.1 mol·L -1 K 2CrO 4溶液,观察现象。
试指出Ca 2+和Ba 2+的分离条件。
分别向0.5 mL 0.1 mol·L -1的MgCl 2,CaCl 2和BaCl 2溶液中滴加0.5 mL 饱和(NH 4)2C 2O 4溶液,制得的沉淀经离心分离后再分别与2 mol·L -1HAc 、HCl 溶液作用,观察现象。
5. 钾、钠、钙、锶和钡的盐的焰色反应取一根铂丝(尖端弯成环状),先将铂丝反复浸于纯的6 mol·L -1 HCl 中后在煤气灯的氧化焰上灼烧,直至火焰不再呈现任何颜色。
然后用洁净的铂丝蘸取Na +试液在氧化焰中灼烧,观察火焰的颜色。
用与上面相同的操作,分别观察钾、钙、锶和钡等盐溶液的焰色反应。
每进行一种溶液的焰色反应之前,都必须用上述的清洁法把铂丝处理干净。
观察钾盐的焰色反应时,微量的Na +所产生的黄色火焰会遮蔽K +所显示的浅紫色火焰,故需通过蓝色的钴玻璃片观察K +的火焰,因为蓝色玻璃能够吸收黄色光。
四、思考题1. 钠和镁的标准电极电势相差不大(分别为-2.71V 和-2.37V),为什么两者与水反应的激烈程度却大不不同?2. 如何解释镁、钙、钡的氢氧化物和碳酸盐的溶解度大小的递变规律?3. 用碳酸盐分离Mg 2+和Ca 2+或铬酸盐分离Ca 2+和Ba 2+时,分别使用了NH 3·H 2O -NH 4Cl 或HAc -NH 4Ac 缓冲溶液。
试指出这两种缓冲溶液在这些离子分离中的作用。
实验二十 卤族和氧族元素一、目的要求1. 了解卤素及其含氧酸盐的氧化性和卤离子还原性强弱的变化规律。
2. 了解卤素的歧化反应。
3. 了解过氧化氢的制备,性质及不同氧化态硫的化合物的性质。
二、仪器和药品仪器:离心机,离心管,坩埚,滴管,玻璃棒药品: H 2SO 4(3 mol·L -1,浓),NH 3·H 2O(浓),NaOH(2 mol·L -1),HCl(2 mol·L -1,浓),KBr(0.1 mol·L -1,s),KI(0.1 mol·L -1,s),KClO 3(s),KIO 3(0.1 mol·L -1),KBrO 3(s),K 2CrO 4(0.1 mol·L -1),Na 2S 2O 3(0.1 mol·L -1),AgNO 3(0.1 mol·L -1),Pb(NO 3)2(0.1 mol·L -1),Na 2SO 3(0.1 mol·L -1),H 2O 2(3 %),SnCl 2(0.5 mol·L -1),Mn 2+试液(10 mg ·mL -1),硫代乙酰胺(5 %),氨水,溴水,碘水,CCl 4,NaCl(s),I 2(s),Na 2O 2(s),MnO 2(s),硫粉,K 2S 2O 8(s)、淀粉碘化钾试纸,醋酸铅试纸,pH 试纸 三、实验内容1. 卤族氧化性的比较 1) 氯和溴的氧化性的比较在1 mL 1 mol·L -1 KBr 溶液中,逐滴加入氯水,振荡,有何现象?再加入0.5 mL CCl 4,充分振荡,又有何现象?氯和溴的氧化性哪个较强?2) 溴和碘的氧化性比较在1 mol·L -1 KI 溶液中,逐滴加入溴水,振荡,有何现象?再加入0.5 mL CCl 4,充分振荡,又有何现象?比较上面两个实验,总结氯、溴和碘的氧化性的变化规律,并用电对的电极电势予以说明。
2. 卤素离子还原性的比较1) 往盛有少量(近似绿豆大小)氯化钠固体的试管中加入 1 mL浓H2SO4,有何现象?用玻璃棒蘸一些浓NH3· H2O移近管口以检验气体产物。
2) 往盛有少量溴化钾固体的试管中加入1 mL浓H2SO4,又有何现象?用湿的淀粉碘化钾试纸检验气体产物。
3) 往盛有少量碘化钾固体的试管中加入1 mL浓H2SO4,又有何现象?用湿的醋酸铅试纸检验产物。
写出以上三个实验反应式并加以解释。
说明氯、溴、和碘离子的还原性强弱的变化规律。
3. 卤素的歧化反应1) 在一支小试管中加入5滴溴水,观察颜色,然后滴加数滴2 mol·L-1 NaOH溶液,振荡,观察现象。
待溶液褪色后再滴加2 mol·L-1HCl溶液至酸性,溶液颜色有何变化?2) 另取一支试管,用碘水代替溴水,重复上述实验,观察并解释所看到的实验现象。
4. 卤酸盐的氧化性1) 氯酸盐的氧化性(1) 取少量KClO3晶体于试管中,加入少许浓盐酸(可稍微加热),注意逸出气体的气味,检验气体产物,写出反应式,并作出解释。