气体摩尔体积学案
- 格式:doc
- 大小:255.00 KB
- 文档页数:5

《气体摩尔体积》学案【学习目标】1.通过阅读资料、微观模型、搭建宏观模型理解影响物质体积的因素2.通过阅读教材、类比迁移认识新的物理量:气体摩尔体积3.通过阅读科学史和实验探究理解气体体积的决定性因素,深化对气体摩尔体积内涵的理解4.通过课堂练习巩固气体摩尔体积概念内涵,并建立物质的量与气体体积计算的模型【学习过程】学习任务一、初步了解影响物质的体积因素【活动1】如何建立物质的量与物质体积之间的关系?【活动2】结合“资料和微观模型”认识物质体积与状态有关阅读资料:(表格一)同种物质“固-液-气”状态的微观结构模型【活动3】搭建立方体,从宏观层面认识物质体积的影响因素现有篮球,乒乓球各若干个,现在用两种球搭建立方体,比一比体积的大小?初探结论:学习任务二、探讨决定气体体积的因素【活动4】阅读教材P52“思考与讨论”在一定条件下,1 mol不同物质的体积如下表所示,观察分析表中的数据,你能得出哪些结论?与同学讨论:(表格二)1mol气体0 ℃、101 kPa时的体积/L1 mol液体20 ℃时体积/cm3 1 mol固体20 ℃时体积/cm3H222.4 H2O 18.0 Fe 7.12 O222.4 H2SO453.6 Al 10.0 发现1:_________________________________________________________发现2:_________________________________________________________发现3:_________________________________________________________1.【小结2】结论1:1 mol固态或液态物质体积取决于__________________结论2:1 mol气态物质的体积取决于____________________________2.引入气体摩尔体积概念气体摩尔体积:(1)定义:_____________________________所占的体积。

1.3.2 气体摩尔体积 【学习目标】 1.了解物质的聚集状态2.理解气体摩尔体积的定义及相关计算。
3.理解阿伏加德罗定律及其推论,并且能够进行相关的计算。
4.会计算(混合)气体密度和(平均)摩尔质量。
【基础知识】一、影响物质体积的决定因素【注意】气体的体积不但与物质的量有关,而且与温度和压强有关,描述或判断一定物质的量的气体的体积时,必须指明相关的温度和压强。
二、气体摩尔体积1.气体摩尔体积(1)概念:在一定的温度和压强下,单位物质的量的气体所占的体积。
(2)符号:V m 。
(3)单位:L ·mol -1和m 3·mol -1。
(4)物质的量、气体的体积与气体摩尔体积之间的关系:n =mV V 。
2.标准状况下气体的摩尔体积:(1)标准状况的含义:温度为0℃、压强为101kPa 。
(2)标准状况下气体的摩尔体积约为22.4L ·mol -1。
三、阿伏加德罗定律1.内容:在同温同压下,相同体积的任何气体都含有相同数目的分子。
2.内容总结:“三同”定“一同”3.判断正误(1)1mol 不同的固体物质,体积大小不相同,主要原因是粒子大小不同( )。
提示:√。
固体物质的体积主要取决于构成粒子的大小和粒子数目的多少。
(2)通常状况下的气体摩尔体积约为22.4L ( )。
提示:×。
气体摩尔体积的单位为L·mol-1,且通常状况下气体摩尔体积也不是22.4L·mol-1。
(3)标准状况下,36g水的体积约为44.8L。
()。
提示:×。
水在标准状况下不是气体。
(4)1mol任何气体所含分子数都相等,体积也都约为22.4L。
()。
提示:×。
没有给出气体所处的条件,因此无法判断气体的体积。
【考点剖析】考点一:气体摩尔体积的概念及影响因素例1.(2021·无锡高一检测)下列说法正确的是()。
A.0.5molH2所占的体积为11.2LB.标准状况下,6.02×1023个分子所占的体积约是22.4LC.标准状况下,1mol酒精的体积约为22.4LD.标准状况下,28gN2体积约是22.4L【解析】选D。
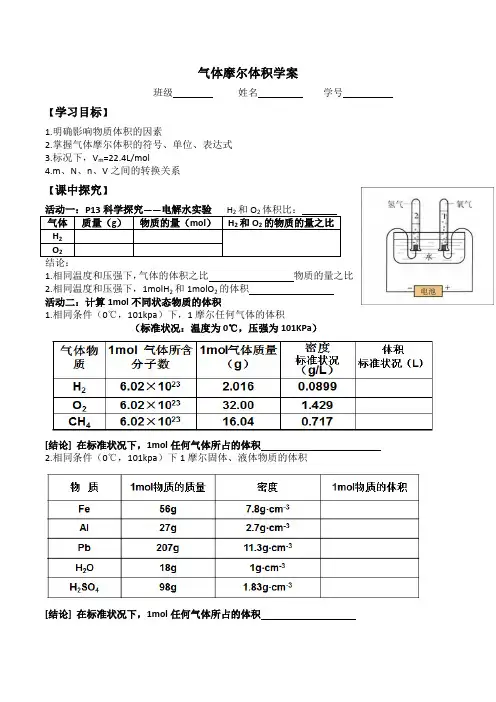
气体摩尔体积学案班级姓名学号【学习目标】1.明确影响物质体积的因素2.掌握气体摩尔体积的符号、单位、表达式3.标况下,V m=22.4L/mol4.m、N、n、V之间的转换关系【课中探究】1.相同温度和压强下,气体的体积之比物质的量之比2.相同温度和压强下,1molH2和1molO2的体积活动二:计算1mol不同状态物质的体积1.相同条件(0℃,101kpa)下,1摩尔任何气体的体积(标准状况:温度为0℃,压强为101KPa)[结论] 在标准状况下,1mol任何气体所占的体积2.相同条件(0℃,101kpa)下1摩尔固体、液体物质的体积[结论] 在标准状况下,1mol任何气体所占的体积活动三:从微观角度分析,物质的体积由哪些因素决定。
(小组讨论)相同条件下:活动四:分析温度和压强对气体体积的影响1.温度结论:原因:2.压强结论:原因:活动五:进一步理解气体摩尔体积活动六:巩固练习练习一:1.1mol气体的体积约为22.4L。
2.标准状况,1mol任何物质的体积都约是22.4L。
3.标准状况下,1molO2和N2混合气体的体积约为22.4L。
4.标准状况下,气体的摩尔体积都是22.4L。
学以致用(温馨提示1m3=1000L)同学们,我们最近在学习物质的量和摩尔质量,今天老师发现我家门上贴了一张上半年天然气的用量表,经计算我家平均一月使用2.24m³(标况下)的天然气,查阅资料民用天然气98%都是甲烷(CH4),如果这2.24m³都是甲烷,请同学们帮我计算这2.24m³甲烷的质量。
练习二:1.标准状况下,0.5 mol H2占有的体积约是2.标准状况下,8gO2的体积约是3.标准状况下,11.2LN2中含有的N2的分子数是活动七:总结m、n、N、V计算关系。

气体摩尔体积学案一、课前自学及基础回顾1.密度的计算公式____________。
2.物质的体积大小决定于_________.__________._________。
3.气体分子间距离_______(大于或小于)分子本身的体积,约为____倍。
4.标准状况是指____ ℃,______kPa。
5.气体摩尔体积:定义___________________________________表达式_______________, 单位_________,标准状况下数值______二、课堂互动及知识网络1.请分析课本P22表1-3-1的有关数据2.为什么同温同压1 mol任何气体的体积相同?3.两种不同气体的体积相同则___相同。
提高:_______________(阿佛加德罗定律)4.温度.压强对气体分子间距离怎样影响:三、课堂反馈例1.判断下列说法是否正确()1.温度为0℃,压强为505kPa时,CO2的气体摩尔体积为22.4mol/L。
2.标准状况下,一定量的任何气体体积约为22.4L。
3.标准状况下,1 mol H2O的体积约为22.4L。
4.当温度高于0℃时,1 mol任何气体体积都大于22.4L。
5.1 mol CO和1 mol CO2所含分子数相同,体积也相同。
例2.标准状况下,1 mol O2所占的体积约为______L。
1 mol H2所占的体积约为______L。
那么1 mol O2.N2.H2的混合气体,所占体积约为_____L。
四、基础练习1.同温同压下,若两种气体所占体积不同,其主要原因是()A.气体分子的大小不同B.气体分子间平均距离不同C.气体的物质的量不同D.气体的摩尔质量不同2.等物质的量的氢气和氦气,在同温同压下具有相同的()A.原子数B.体积C.质子数D.质量3.下列叙述正确的是()A.标况下,任何气体的摩尔体积都是22.4LB.1 mol气体的体积若为22.4L,必处于标准状况C.标况下0.5 mol H2.0.5 mol N2混合气体所占体积约为22.4LD.1 mol SO2的体积约为22.4L4.相同质量的下列气体,分别放在体积相同的密闭容器中,同温下压强最大的是()A.H2B.O2 C.CO2 D.NH35.同温同压下,等质量的SO2与CO2相比较,下列正确的是()A.密度比为16:11 B.密度比为11:16C.体积比为1:1 D.体积比为11:166.对1 mol CO和1 mol N2,下列说法正确的是()A.它们所含分子数相等B.它们的体积相等C.它们的质量相等D.它们的密度相等7.下列物质体积最大的是()A.常温常压下18g水B.通常状况下2g H2C.标况下0.4 mol CO2D.标况下,28g CO8.在标准状况下,将0.2 mol O2和0.8 mol H2混合后所得气体的体积为()A.4.44L B.17.92L C.22.4L D.小于22.4L9.决定一定量气体体积大小的主要因素是()A.气体分子的大小B.气体分子的质量C.气体分子间平均距离大小D.气体分子间作用力大小10.等质量的下列物质,在标准状况下体积最大的是()A.碳B.一氧化碳C.二氧化碳D.甲烷一、填空题1.在标准状况下,0.5mol任何气体的体积都约为_______。

气体摩尔体积学案第二课时气体摩尔体积【联系生活】1.气体被压缩〔填“容易”或“难”〕,说明气体分子间距离比较,〔填“大”或“小”〕;而固体和液体的体积被压缩〔填“容易”或“难”〕,这说明固体和液体分子间距离〔填“大”或“小”〕。
2.从一堆体积不同的篮球和乒乓球中随意选择一些球,在不考虑它们之间堆积缝隙的情况下,要想使球堆积的体积最大,你应考虑哪些因素?3.通过刚才的分析你能总结一下妨碍物质体积大小的因素有哪些吗?【学习导学】【一】决定物质体积的因素1.决定物质体积的因素〔1〕妨碍物质体积的因素a.构成物质的粒子;b.粒子的c.。
〔2〕决定固体或液体体积的要紧因素构成物质的粒子和粒子的。
〔3〕决定气体体积的要紧因素构成气体的和。
观看分析结论1:同温同压下,1mol不同的固态或液态物质,体积_______。
结论2:同温同压下,1mol任何气体的体积均______。
2、气体体积与物质的量的关系ρ2 ρ1 M 2M 1= 推论1:在标况下,任何气体1mol 所占有的体积相等,约为L 。
推论2:在相同条件下,任何等物质的量的气体所占有的体积相等,但不一定是22.4L 。
【二】气体摩尔体积1、定义:单位___________________的气体所占有的。
2、单位:,符号:_____。
3、气体体积V 、气体摩尔体积V m 和物质的量之间的关系表达式。
注意:〔1〕气体摩尔体积的数值取决于气体所处的和。
〔2〕标准状况下〔即〕,气体摩尔体积为。
【跟踪练习】1、判断以下说法是否正确。
①气体摩尔体积单位是L 。
②任何条件下,气体摩尔体积均是22.4L/mol ③标准状况下,1molH 2O 的体积约为22.4L 。
④1molCO 2的体积是22.4L 。
⑤20℃、101kPa 下,1molH 2的体积是22.4L 。
⑥只有在标准状况下,气体摩尔体积才是22.4L/mol 。
⑦标准状况下,0.5molH 2和0.5molO 2的混合气体体积是22.4L 。
](https://uimg.taocdn.com/e972a7a70875f46527d3240c844769eae109a362.webp)
高一化学教案气体摩尔体积[第二课时](精选3篇)
课时目标:通过学习,使学生能够掌握气体摩尔体积的概念和计算方法,并应用到实际问题中。
一、复习
1. 回顾上节课所学的气体摩尔体积的概念和计算方法。
2. 继续讨论上节课的问题:为什么气体在相同条件下,摩尔体积是相等的?
二、引入
1. 通过以下实验,引出气体摩尔体积的概念:取两个气瓶,一个气瓶中是氧气,另一个气瓶中是氮气,分别将两个气瓶中的气体放出来,观察它们充满的容积是否相等。
2. 引导学生发现:无论是什么气体,在相同条件下,摩尔体积是相等的。
因此,我们可以得出结论:在相同条件下,相等体积的气体,所含的摩尔数是相等的。
三、讲解
1. 阐述气体摩尔体积的计算方法:在一定条件下,气体的摩尔体积等于其所占的容积除以摩尔数。
2. 引导学生进行简单的计算练习。
四、拓展
1. 讨论题:当气体的容积和摩尔数已知时,如何求气体的摩尔体积?
2. 让学生通过实例演示求解方法。
3. 引导学生总结方法:气体的摩尔体积等于其所占的容积除以
摩尔数。
五、应用
1. 给出多个具体问题,让学生应用所学的知识进行计算。
2. 提示学生注意单位的转换。
六、总结
1. 总结气体摩尔体积的概念和计算方法。
2. 强调相同条件下,等体积的气体所含的摩尔数是相等的。
七、作业
1. 完成课后习题。
2. 思考:当气体的摩尔体积已知时,如何求解其所占的容积呢?。

《气体摩尔体积》导学案一、学习目标1、理解气体摩尔体积的概念。
2、掌握气体摩尔体积的计算及应用。
3、了解影响气体摩尔体积的因素。
二、知识回顾1、物质的量(n)、质量(m)和摩尔质量(M)之间的关系:\(n =\frac{m}{M}\)2、阿伏加德罗常数(\(N_{A}\)):\(1mol\)任何粒子的粒子数,约为\(602×10^{23}\)。
三、新课导入在我们的日常生活中,经常会接触到各种气体,比如氧气、氮气、氢气等。
那么,对于气体,我们如何来衡量它们的数量呢?这就需要引入一个新的物理量——气体摩尔体积。
四、知识讲解1、气体摩尔体积的概念单位物质的量的气体所占的体积叫做气体摩尔体积,符号为\(V_{m}\),常用单位为\(L/mol\)或\(m^{3}/mol\)。
2、标准状况下的气体摩尔体积在标准状况(\(0℃\)、\(101kPa\))下,\(1mol\)任何气体所占的体积约为\(224L\),即标准状况下的气体摩尔体积约为\(224L/mol\)。
需要注意的是,这里的“约为”是因为气体的体积会受到温度和压强等因素的影响,在标准状况下只是一个近似值。
3、气体摩尔体积的计算(1)已知气体的物质的量\(n\)和体积\(V\),则气体摩尔体积\(V_{m} =\frac{V}{n}\)(2)已知气体的质量\(m\)、摩尔质量\(M\)和体积\(V\),则\(n =\frac{m}{M}\),\(V_{m} =\frac{V}{n} =\frac{V}{\frac{m}{M}}=\frac{VM}{m}\)4、影响气体摩尔体积的因素(1)温度:温度越高,气体摩尔体积越大。
(2)压强:压强越大,气体摩尔体积越小。
只有在标准状况下,气体摩尔体积才约为\(224L/mol\)。
在其他温度和压强条件下,气体摩尔体积会发生变化。
五、例题讲解例 1:标准状况下,\(336L\)氧气的物质的量是多少?解:因为在标准状况下,\(V_{m} = 224L/mol\),\(V(O_{2})= 336L\)所以\(n(O_{2})=\frac{V(O_{2})}{V_{m}}=\frac{336L}{224L/mol} = 15mol\)例 2:\(56g\)氮气在标准状况下的体积是多少?解:氮气的摩尔质量\(M(N_{2})= 28g/mol\),\(m(N_{2})= 56g\)所以\(n(N_{2})=\frac{m(N_{2})}{M(N_{2})}=\frac{56g}{28g/mol} = 02mol\)因为在标准状况下,\(V_{m} = 224L/mol\)所以\(V(N_{2})= n(N_{2})×V_{m} = 02mol×224L/mol =448L\)六、课堂练习1、标准状况下,\(112L\)氢气的物质的量是多少?2、\(64g\)二氧化硫在标准状况下的体积是多少?七、知识拓展1、阿伏加德罗定律在相同的温度和压强下,相同体积的任何气体都含有相同数目的分子。

第2课时气体摩尔体积二、气体摩尔体积1.影响物质体积的因素{粒子数目粒子的大小粒子间的平均距离(1)决定固体或液体体积的主要因素{粒子数目粒子的大小(2)决定气体体积的主要因素{粒子的数目粒子间的平均距离{温度压强2.气体摩尔体积(1)定义:单位物质的量的物质所占的体积(2)符号:V m单位:L·mol-1、m3·mol-1(3)影响因素:温度、压强(4)标准状况数值:22.4 L·mol-1(5)物质的量(n)、气体摩尔体积(V m)、气体体积(V)的关系:V=n·V m3.阿伏加德罗定律(1)内容:同温、同压、同体积的任何气体含有相同数目的分子。
(2)适用范围:任何气体或混合气体(3)推论①同温、同压V1V2=n1n2②同温、同压ρ1ρ2=M1M2③同温、同体积p1p2=n1n2知识点一气体摩尔体积1.下列说法正确的是( )A.标准状况下,6.02×1023个分子所占的体积约是22.4 L B.0.5 mol H2所占的体积是11.2 LC.标准状况下,1 mol H2O的体积为22.4 LD.标准状况下,28 g CO与N2的混合气体的体积约为22.4 L知识点二阿伏加德罗定律及推论2.在两个密闭容器中,分别充有质量相同的甲、乙两种气体,若两容器的温度和压强均相同,且甲的密度大于乙的密度,则下列说法正确的是( )A.甲的分子数比乙的分子数多B.甲的物质的量比乙的物质的量少C.甲的摩尔体积比乙的摩尔体积小D.甲的相对分子质量比乙的相对分子质量小知识点三有关气体摩尔体积的计算3.在标准状况下有:①6.72 L CH4②3.01×1023个氯化氢分子③13.6 g硫化氢④0.2 mol氨气下列对这四种气体相关量的比较不正确的是( )A.体积:②>③>①>④B.密度:②>③>④>①C.质量:②>③>①>④D.氢原子数:①>④>③>②4.在标准状况下,H2和CO的混合气体7 L,质量为2.25 g,求H2和CO的体积分数。

《气体摩尔体积》学案【学习目标】理解气体摩尔体积的概念以及与物质的量之间的关系【自主学习】1、1.204×1023个H2SO4分子的质量是____________克,溶于水电离出H+的物质的量_________mol,SO42-____________mol,要使溶液中的SO42-完全沉淀,至少需要Ba2+____________mol。
2、10克CaCO3的物质的量为_________mol,C原子的物质的量为_______mol,往其中加入足量的稀盐酸,生成CO2的物质的量为_______mol。
【合作探究】1、阅读文字:影响物质体积大小的因素P522、气体摩尔体积:在一定温度和压强下,单位___________________的气体所占的体积,符号是,它的常用单位是___________________。
实验测定,在标准状况下(即0℃、1大气压),1mol任何气体(单一气体和混合气体)的体积都约为22.4L,故标准状况下的气体摩尔体积为。
常温常压下,气体的摩尔体积________(填>、<、=)22.4L/mol。
3:气体摩尔体积(Vm)、气体的体积(标准状况)和物质的量的关系①标准状况下,2molH2的体积为L;②标准状况下,0.5 molCO2的体积为L;③标准状况下,3molN2和O2的混合气体的体积为________________L。
④标准状况下,1.12LH2的物质的量为;⑤标准状况下,6.72LNH3的物质的量为___________,质量为___________克,H原子的数目为________N A;⑥标准状况下,5.6LCO和CO2混合气体的物质的量为________________。
⑦1.806×1023个CO2分子在标准状况下的体积为_______________L。
总结:标准状况下的气体摩尔体积(Vm)、气体的体积(标准状况)和物质的量的关系n=_____________________。

《气体摩尔体积》教学设计第一篇:《气体摩尔体积》教学设计《气体摩尔体积》教学设计第二节气体摩尔体积第一课时知识目标使学生在了解气体的体积与温度和压强有密切关系的基础上,理解气体摩尔体积的概念。
能力目标通过气体摩尔体积的概念和有关计算的教学,培养学生分析、推理、归纳、总结的能力。
情感目标通过本节的教学,激发学生的学习兴趣,培养学生的主动参与意识。
通过教学过程中的设问,引导学生科学的思维方法。
教学重点:气体摩尔体积的概念教学难点:相同温度和压强下,相同物质的量的任何气体所占的体积大约相同的原因。
教学方法:设疑、导思、归纳、应用教学手段:多媒体辅助教学过程:[复习提问] 1.1mol物质含有的粒子数约是多少?.什么叫摩尔质量?[引入新课] 前面我们学习的物质的量,它把宏观上可称量的物质与微观粒子联系起来,宏观上可感知的除了物质的质量,还有物质所占的体积上节课我们研究了1mol物质所具有的质量,这节课我们来讨论1mol物质所占的体积。
[板书]一、气体摩尔体积1.1mol固、液态物质的体积[提问] 已知物质的质量和密度,怎样求体积?学生回答:V= [投影]1mol几种固、液态物质的体积,填表物质;计算粒子数1mol 物质质量(g)20℃密度(g/cm3)体积(cm3)Fe6.02×10237.8Al6.02×10232.7Pb6.02×102320711.3H2O6.02×10231(4℃)H2SO46.02×10231.83学生分组计算出1molFe、Al、Pb、H2O、H2SO4的体积分别为:7.2、10、18.3、18、53.6cm3[微机显示] 1mol物质的体积[板书] 1mol固、液态物质的体积不相同。
2.1mol气态物质的体积[微机显示] 影响气体体积的因素指导学生注意观察分子间平均距离的变化。
[说明] 比较一定质量气体的体积,必须在相同温度和压强条件下。

气体摩尔体积的教案设计气体摩尔体积的教案设计(通用6篇)作为一名人民教师,通常需要准备好一份教案,借助教案可以恰当地选择和运用教学方法,调动学生学习的积极性。
教案要怎么写呢?下面是店铺帮大家整理的气体摩尔体积的教案设计(通用6篇),仅供参考,希望能够帮助到大家。
气体摩尔体积的教案设计篇1教学目标知识目标使学生在了解气体的体积与温度和压强有密切关系的基础上,理解气体摩尔体积的概念。
使学生在理解气体摩尔体积,特别是标准状况下,气体摩尔体积的基础上,掌握有关气体摩尔体积的计算。
能力目标通过气体摩尔体积的概念和有关计算的教学,培养学生分析、推理、归纳、总结的能力。
通过有关气体摩尔体积计算的教学,培养学生的计算能力,并了解学科间相关知识的联系。
情感目标通过本节的教学,激发学生的学习兴趣,培养学生的主动参与意识。
通过教学过程中的设问,引导学生科学的思维方法。
教学建议教材分析本节教材在学习了物质的量和摩尔质量概念的基础上,学习气体摩尔体积的概念及有关计算,这样的编排,有利于加深理解、巩固和运用有关概念,特别是深化了对物质的量及其单位的理解。
本节是今后学习有关气态反应物和生成物的化学方程式的计算,以及学习化学反应速率和化学平衡的重要基础。
本节教材首先注意了学科间的联系和学生已有的知识,通过计算得出1mol几种物质的体积,设问:1mol 气态物质的体积是不是也不相同呢?然后介绍气态物质的体积与外界温度、压强的关系,计算出标准状况下1mol气体的体积,引出气体摩尔体积的概念,最后是关于气体摩尔体积概念的计算。
教学建议教法建议1.认真钻研新教材,正确理解气体摩尔体积的概念。
原必修本39页在标准状况下,1mol任何气体所占的体积都约是22.4L,这个体积叫做气体摩尔体积。
认为22.4L/mol就是气体摩尔体积。
新教材52页气体摩尔体积的定义为单位物质的量气体所占的体积叫做气体摩尔体积。
即 Vm=V/n 。
由此可以看出,气体摩尔体积是任意温度和压强下,气体的体积与气体的物质的量之比,而22.4L/mol 是在特定条件(如:0℃,101KPa)下的气体摩尔体积。
化学《气体摩尔体积》教案化学《气体摩尔体积》教案在教学工作者实际的教学活动中,很有必要精心设计一份教案,编写教案助于积累教学经验,不断提高教学质量。
优秀的教案都具备一些什么特点呢?以下是小编为大家整理的化学《气体摩尔体积》教案,仅供参考,大家一起来看看吧。
知识目标使学生在理解气体摩尔体积,特别是标准状况下,气体摩尔体积的基础上,掌握有关气体摩尔体积的计算。
能力目标通过气体摩尔体积的概念和有关计算的教学,培养学生分析、推理、归纳、总结的能力。
通过有关气体摩尔体积计算的教学,培养学生的计算能力,并了解学科间相关知识的联系。
情感目标通过本节的教学,激发学生的学习兴趣,培养学生的主动参与意识。
通过教学过程(91aixue.c)中的设问,引导学生科学的思维方法。
[板书] 二、有关气体摩尔体积的计算[讨论] 气体的体积与气体的物质的量、气体的质量和气体中的粒子数目之间的关系:(由学生回答)[板书]1. 依据:和阿伏加德罗定律及其推论2.类型(1)标准状况下气体的体积与气体的物质的量、气体的质量和气体中的粒子数目之间的关系[投影] 例题1:在标准状况下,2.2gCO2的体积是多少?[讨论] 1.由学生分析已知条件,确定解题思路。
2.学生在黑板上或练习本上演算。
[强调] 1.解题格式要求规范化。
2.计算过程要求带单位。
[板书](2)气体相对分子质量的计算[投影] 例题2:在标准状况下,测得1.92g某气体的体积为672L。
计算此气体的相对分子质量。
[讨论] 分析已知条件首先计算气体的密度: =然后求出标准状况下22.4L气体的质量,即1l 气体的质量:M= V[学生解题] 分析讨论不同的解法。
[投影] 例题3:填表物质物质的量体积(标准状况)分子数质量密度H20.5lO244.8LCO244/22.4g.L-1N228gCl2.HCl混合气3.01×1023[练习]若不是标准状况下,可以利用阿伏加德罗定律及其推论解题。
高一化学教案气体摩尔体积[第一课时](精选3篇)第一篇:气体摩尔体积的概念和计算方法教学目标:1. 了解气体的摩尔体积的概念;2. 掌握气体摩尔体积的计算方法;3. 能够解决与气体摩尔体积相关的计算题目。
教学重点:1. 掌握气体摩尔体积的概念;2. 掌握气体摩尔体积的计算方法。
教学难点:1. 计算气体摩尔体积的相关问题。
教学过程:一、导入与导入教师可以通过展示一个被充满气体的气球引起学生的兴趣,然后提问“为什么气球上的字体可以充满气球呢?”,引导学生思考气体的特点。
二、概念讲解1. 气体摩尔体积的定义:在摩尔数相同的条件下,不同气体的体积相同。
也就是说,1mol气体的体积是一定的,无论是什么气体。
2. 计算方法:气体摩尔体积可以通过将气体的体积除以摩尔数来计算。
三、实例演练1. 例题一:30L的甲烷气体中含有2mol的甲烷,求甲烷气体的摩尔体积。
答案:30L/2mol = 15L/mol2. 例题二:一个容器内有5mol的氨气,体积为50L,求氨气的摩尔体积。
答案:50L/5mol = 10L/mol四、拓展应用1. 通过计算气体摩尔体积,可以进一步计算气体的密度;2. 探究不同气体的摩尔体积是否相同。
五、小结与展望教师对本节课的重点内容进行小结,并展望下节课的教学内容。
第二篇:气体摩尔体积的实验测定方法教学目标:1. 了解气体摩尔体积的实验测定方法;2. 掌握气体摩尔体积的实验计算方法;3. 能够通过实验结果计算气体摩尔体积。
教学重点:1. 掌握气体摩尔体积的实验计算方法;2. 能够通过实验结果计算气体摩尔体积。
教学难点:1. 进行气体摩尔体积实验的操作;2. 分析实验数据并计算气体摩尔体积。
教学过程:一、导入与导入教师可以通过展示实验装置的图示,引起学生的兴趣,然后提问“你们有没有想过如何实验测定气体的摩尔体积呢?”,引导学生思考如何进行实验。
二、概念讲解1. 遵循玻意耳定律:相同条件下,等压下,气体的摩尔体积是恒定的;2. 实验操作:用实验装置装满气体,记录气体的体积和摩尔数,然后计算气体的摩尔体积。
气体摩尔体积导学案【学习目标】1.通过思考分析、交流讨论,了解决定物质体积大小的主要因素和外部条件(温度、压强)对气体体积的影响;2.通过自主学习、概念辨析,正确理解和掌握气体摩尔体积的概念;3.通过课堂练习、分析讨论,初步学会用气体摩尔体积进行简单计算。
【学习重点】气体摩尔体积概念的建立。
【学习难点】影响物质体积的因素在宏观和微观之间的思维转化。
【学习过程】【课前预习】1.物质的聚集状态主要有态、态、态,许多物质在不同的温度和压强下可以呈现不同的聚集状态。
2.气体被压缩(填“容易”或“难”),说明气体分子间距离比较(填“大”或“小”);而固体和液体被压缩(填“容易”或“难”),说明构成固体和液体的粒子间距离比较(填“大”或“小”)。
3.温度升高,气体体积(填“增大”或“减小”),说明气体分子间距离(填“增大”或“减小”),压强增大,气体体积(填“增大”或“减小”),说明气体分子间距离(填“增大”或“减小”)。
4.物质的量是联系宏观和微观的一座桥梁,请分别写出物质的量与宏观质量、微观粒子数之间转化的公式,。
5.表一:下表列出了0℃、101kPa(标准状况)时几种气体的密度,请完成表格内容。
表二:下表列出了20℃时几种固体和液体的密度,请完成表格内容。
表三:假设电解1.8g H2O,根据电解水的化学方程式计算生成的O2、H2的质量。
根据O2、H2的摩尔质量,计算物质的量。
【课中互动解疑】◆活动一:认识影响物质体积的因素◆活动二:对气体摩尔体积概念的理解◆活动三:有关气体摩尔体积的简单计算◆归纳小结【课后巩固练习】1.下列有关气体体积的叙述中,正确的是()A.在一定的温度和压强下,各种气态物质的体积大小,由构成气体的分子大小决定。
B.在一定的温度和压强下,各种气态物质的体积大小,由构成气体的分子数决定。
C.不同的气体,若体积不同,则它们所含的分子数也不同。
D.气体摩尔体积是指1mol任何气体所占体积约为22.4L。
2023年高一化学教案气体摩尔体积[第二课时](精选3篇)教案一:教学目标:1. 了解气体摩尔体积的概念及计算方法。
2. 理解气体摩尔体积与气体分子间的相互作用力有关。
3. 掌握气体摩尔体积的计算步骤。
教学重点:1. 掌握气体摩尔体积的计算方法。
2. 理解气体摩尔体积与气体分子间的相互作用力有关。
教学准备:1. 教学课件或黑板。
2. 实验装置:容器、活塞、天平、气体收集装置。
3. 实验材料:小球或玉米粒、氢气和氧气。
教学过程:Step 1:引入首先,复习上一节课学到的气体的摩尔质量概念,并与学生一起回顾相关的计算方法。
Step 2:概念解释解释气体摩尔体积的概念,即在相同温度和压强下,1摩尔气体占据的体积。
Step 3:计算方法讲解气体摩尔体积的计算方法:1. 对于理想气体,根据理想气体状态方程PV = nRT,可以推导出摩尔体积公式V = V/n = Vm。
2. 对于非理想气体,由于分子间的相互作用力,摩尔体积会偏离理论值。
需要根据实验数据进行修正。
Step 4:示范实验展示一个实验,即收集氢气与氧气反应生成水的实验。
1. 实验装置:容器、活塞、天平、气体收集装置。
2. 实验步骤:将一定量的小球或玉米粒放入容器中,以模拟气体分子。
然后将氢气和氧气充满容器,观察实验现象。
3. 实验结果:根据实验结果,引导学生思考气体摩尔体积与气体分子间的相互作用力之间的关系。
Step 5:小结总结今天的学习内容,强调气体摩尔体积与气体分子间的相互作用力之间的关系,并帮助学生复习计算气体摩尔体积的方法。
教案二:教学目标:1. 掌握理想气体的摩尔体积计算方法。
2. 了解非理想气体的摩尔体积修正方法。
3. 能够运用所学知识解决相关问题。
教学重点:1. 理解理想气体和非理想气体的区别。
2. 掌握理想气体的摩尔体积计算方法。
3. 了解非理想气体的摩尔体积修正方法。
教学准备:1. 教学课件或黑板。
2. 实验装置:容器、活塞、天平、气体收集装置。
2023年高一化学教案气体摩尔体积[第一课时](精选3篇)教案一:气体摩尔体积实验教案教学目标:1. 了解气体摩尔体积的概念和计算方法;2. 学习使用实验方法测定气体摩尔体积;3. 培养学生的实验操作能力和数据处理能力。
教学准备:实验器材:燃气灯、导管、试管、集气瓶、平衡器、空气泵、氢气气瓶、水密封法气体收集装置等;实验材料:氢气、氧气、二氧化碳等气体。
教学过程:1. 导入:通过课堂讲解,复习气体分子运动理论和理想气体状态方程的相关知识。
2. 实验前的准备:a. 准备好实验器材和实验材料;b. 确保实验室环境安全。
3. 实验操作:a. 实验1:测定氢气的摩尔体积i. 取一个已经称好的空气泵瓶,称取一定量的氢气(体积为V);ii. 将氢气导入水密封法气体收集装置中,收集气体直至水位不再下降;iii. 完成收集后,记录气体温度和大气压力。
b. 实验2:测定氧气的摩尔体积i. 重复实验1的步骤,使用氧气代替氢气进行收集。
c. 实验3:测定二氧化碳的摩尔体积i. 重复实验1的步骤,使用二氧化碳代替氢气进行收集。
4. 数据处理:a. 计算气体摩尔体积的公式:V/Vmol = V / n;b. 根据实验数据,计算氢气、氧气和二氧化碳的摩尔体积。
5. 总结:a. 提出问题:根据实验结果,你觉得气体摩尔体积和气体分子的性质有关吗?为什么?b. 引导学生思考气体摩尔体积和气体分子的性质之间的关系。
教案二:气体摩尔体积模拟实验教案教学目标:1. 了解气体摩尔体积的概念和计算方法;2. 通过模拟实验,学习使用计算方法测定气体摩尔体积;3. 提高学生的实验操作能力和数据处理能力。
教学准备:实验器材:计算机、模拟实验软件等。
教学过程:1. 导入:通过课堂讲解,复习气体分子运动理论和理想气体状态方程的相关知识。
2. 介绍气体摩尔体积的概念和计算方法。
3. 使用模拟实验软件进行实验操作:a. 打开模拟实验软件,选择相应的实验模拟;b. 按照软件提示进行实验操作,并记录实验数据;c. 完成实验后,使用计算方法计算气体摩尔体积。
气体摩尔体积学案-CAL-FENGHAI-(2020YEAR-YICAI)_JINGBIAN
《气体摩尔体积》导学案
【学习目标】
1.知道固态、液态、气态物质的一些特性,掌握气体摩尔体积的概念。
2.了解物质的量、气体摩尔体积、体积之间的关系。
【学习重点】对气体摩尔体积的概念的理解
【学习难点】
1、物质的量、微粒数、摩尔质量、质量、气体摩尔体积、体积之间的简单换算
2、阿伏加德罗定律的理解
【学习过程】
一、决定物质体积的因素
1.决定物质体积的因素
(1)影响物质体积的因素
①构成物质的粒子________;②粒子的________;③________________。
(2)决定固体或液体体积的主要因素
构成物质的粒子______和粒子的______。
(3)决定气体体积的主要因素
构成气体的__________和________________。
2.阿伏加德罗定律
同温同压下,相同体积的任何气体都含有______数目的粒子(即阿伏加德罗定律)。
二、气体摩尔体积
1.定义:单位____________的气体所占有的________。
符号:V m,单位L·mol-1(或L/mol)和m3·mol-1(或m3/mol)。
2.计算公式:V m=____________。
3.影响气体摩尔体积的因素
(1)气体摩尔体积的数值取决于气体所处的________和______。
(2)标准状况下(即__________________),气体摩尔体积约为__________。
知识点1 气体摩尔体积
1.当温度和压强一定时,决定气体体积大小的主要因素是( )
A.分子直径的大小 B.分子间距离的大小
C.分子间引力的大小 D.分子数目的多少
2.下列有关气体摩尔体积的描述中正确的是( )
A.相同物质的量的气体摩尔体积也相同 B.通常状况下的气体摩尔体积约为 L C.标准状况下的气体摩尔体积约为L·mol-1
D.一定物质的量的气体所占的体积就是气体摩尔体积
知识点2 气体摩尔体积的应用
3.在标准状况下,由 g H2、11 g CO2和4 g O2组成的混合气体,其体积约为( ) A. L B. L C. L D. L
4.在标准状况下,与12 g H2的体积相等的N2( )
A.质量为12 g B.物质的量为6 mol C.体积约为 L D.分子数约为×1023 5.下列说法正确的是( )
A.标准状况下,×1023个分子所占的体积约是 L
B. mol H2所占的体积是 L
C.标准状况下,1 mol H2O的体积为 L
D.标准状况下,28 g CO与N2的混合气体的体积约为 L
知识点3 阿伏加德罗定律的简单应用
6.下列两种气体的分子数一定相等的是( )
A.质量相等的N2和CO B.体积相等的CO和C2H4
C.等温、等体积的O2和N2 D.等压、等体积的N2和CO2
7.相同条件下,等物质的量的两种气体一定满足( )
A.体积均为 L B.具有相同的体积
C.是双原子组成的分子 D.所含原子数目相同
8.阿伏加德罗常数约为×1023 mol-1,下列说法一定正确的是( )
A. L N2中所含的分子个数为×1023
B.标准状况下, L Cl2和HCl的混合气体中含分子总数为2××1023
C.4℃时, L水含水分子数为×1023 D.20 g Ne含原子个数为×1023
知识点4 物质的量在化学计算中的应用
9.下列物质中,含氢原子数目最多的是( )
A. mol H2O B. mol H2SO4 C. mol NH3 D. mol CH4
10.在同温同压下,某瓶充满O2时质量为116 g,充满CO2时质量为122 g,充满气体X时质量为114 g,则X的相对分子质量为( )
A.28 B.60 C.32 D.44
11.在标准状况下,CO和CO2的混合气体共 L,质量为61 g。
则两种气体的物质的量之和为________mol,其中CO2为________mol,CO占总体积的________%。
答案解析
基础落实
一、
1.(1)①数目②大小③粒子间的距离(2)数目大小(3)粒子数目粒子间的距离
2.相同
二、
1.物质的量体积
3.(1)温度压强(2)0℃和101 kPa L·mol-1
对点训练
1.D
3.C
4.B
5.D
6.A
7.B
8.D
N=1 mol××1023 mol-1=×1023,正确。
]
9.A
10.A
11.
解析(1)两种气体的物质的量之和为:错误!= mol。
(2)设混合气中CO的物质的量为x,CO2的物质的量为y,则有x+y=,28 g·mol-1·x+44 g·mol-1·y=61 g,解
得:x =1 mol ,y = mol 。
(3)CO 的体积分数即为物质的量分数,为1 mol mol
×100%≈%。