无机与分析化学 第九章
- 格式:ppt
- 大小:5.50 MB
- 文档页数:71

第九章氧化还原反应与氧化还原滴定一、选择题1、根据查表的标准电极电势值判断下列各组离子在酸性介质不能够共存的是()A Br2和ClO3-B Fe2+和Sn4+C Fe2+和Pb2+D Sn2+和I22、下列电对的电极电势不受介质酸度影响的是()A MnO4-/ MnO42-B MnO2/Mn2+C S/H2SD O2/H2O3、已知φΘ(S/ZnS)>φΘ(S/MnS)>φΘ(S/S2-)则()A K spΘ( ZnS) > K spθ( MnS)B K spΘ( ZnS) < K spΘ( MnS)C K spΘ( ZnS) = K spΘ( MnS)D 不能确定4、已知φΘ(MnO4-/ MnO2)=1.68 V φΘ(MnO2/ Mn2+)=1.23 V 则φΘ(MnO4-/ Mn2+)为()A 2.91 VB 0.45VC 1.51VD 1.825V5、下列有关Cu-Zn原电池的叙述中,错误的是()A 盐桥中的电解质可保持两个半电池的电荷平衡B 盐桥用于维持氧化还原反应的进行C 盐桥中的电解质不能参与电池反应D 电子通过盐桥流动6、原电池Zn|Zn2+(c1)|| Zn2+(c2)|Zn (c1≠c2),下列叙述中正确的是()A EΘ≠0 E=0B EΘ=0 E≠0C EΘ=0 E=0D EΘ≠0 E≠07、下列各组物质可能共存的是()A Cu2+、Fe3+、Sn4+、AgB Cu2+、Fe2+、Fe、Ag+C Cu2+、Fe、Fe3+、AgD I-、Fe3+、Sn4+、Fe2+8、下列电极反应中,若将离子浓度减少一半,而其它条件不变,则电极电势增大的是()A ClO4-+2H++2e = ClO3-+H2OB Co3++e = Co2+C S2O82-+2e = 2SO42-D 2Hg2++2e = Hg22+9、通常配制FeSO4溶液时,加入少量铁钉,其原因与下列反应中的哪一个无关?()A O2(g) +4H+(aq) +4e ==2H2O(l)B Fe3+(aq)+e ==Fe2+C Fe(s)+2Fe3+(aq)==Fe2+(aq)D Fe3+(aq)+3e==Fe(s)10、已知φΘ(Pb2+/ Pb)=-0.126V K spθ( PbCl2) =1.6×10-5,则φΘ(Pb2+/ Pb)为()A 0.268VB -0.41VC -0.268VD -0.016V11、用0.02 mol·L-1和0.06 mol·L-1KMnO4溶液滴定0.1 mol·L-1Fe2+溶液,两种情况下滴定突跃范围的大小()A 相同B 浓度大突跃大C 浓度小突跃小D 不能判断突跃大小12、间接碘量法加入淀粉指示剂的最佳时间是()A 滴定开始前加入B 接近终点时加入C 碘颜色完全褪去时加入D 任意时间均可13、已知φΘ(Ag+/ Ag)=0.799V K sp ( AgCl)= 1.56×10-10,若在半电池Ag+/Ag(1.0 mol·L-1)中加入KCl,使得溶液中KCl的浓度为1.0 mol·L-1,则其电极电势将()A 增加0.581VB 增加0.220VC 降低0.581VD 降低0.220V14、将反应Fe2++Ag+=Fe3++Ag组成原电池,下列哪种表示符号是正确的()。

第九章s区元素1. 为什么碱金属氯化物的熔点NaCl﹥KCl ﹥RhCl ﹥CsCl ?而碱土金属氯化物的熔点MgCl2﹤CaCl2 ﹤SrCl2 ﹤BaCl2 ?前者阳离子电荷小,极化力弱,主要比较晶格能;而后者阳离子电荷大,极化力较强,比较极化作用2. 锂、钠、钾在氧气中燃烧生成何种氧化物?各氧化物与水反应情况如何?分别生成Li2O、Na2O2、KO2 ;Li2O + H2O 〓 2 LiOHNa2O2 + 2H2O(冷水) 〓H2O2 + 2 NaOH2 Na2O2 + 2H2O(热水) 〓O2 + 4 NaOH2 KO2 + 2H2O 〓H2O2 + 2 KOH + O24. 比较下列性质的大小⑴与水反应的速率:MgO ﹤BaO⑵溶解度:CsI﹤LiI;CsF﹥LiF;LiClO4 ﹥KClO4 ⑶碱性的强弱:Be(OH)2 ﹤Mg(OH)2 ﹤Ca(OH)2 ﹤NaOH)⑷分解温度:K2CO3﹥Na2CO3 ﹥MgCO3 ﹥NaHCO3⑸水合能:Be2+﹥Mg2+ ﹥Na+ ﹥K+5. 解释下列事实⑴卤化锂在非极性溶剂中的溶解度大小的顺序为LiI﹥LiBr﹥LiCl﹥LiF (LiI电负性差小,极性小)⑵虽然电离能I(Li)﹥I(Na),但E⊖(Li+/Li) ﹤(Na+/Na)。
(Li+ 水合能大)。
⑶虽然E⊖(Li+/Li)﹤(Na+/Na),但锂与水反应不如与水反应钠激烈。
(Li熔点高,LiOH溶解度小)。
⑷锂的第一电离能小于铍的第一电离能,但锂的第二电离能却大于铍的第二电离能。
(内层难电离) 。
7. 利用什么性质可以区分下列化合物?⑴Be(OH)2 Mg(OH)2碱性、溶解度。
⑵BeCO3 MgCO3热稳定性。
⑶LiF KF水溶性。



第九章 习题解答1.离子键无饱和性和方向性,而离子晶体中每个离子有确定的配位数,二者有无矛盾? 答:二者无矛盾。
离子键无饱和性和方向性是由离子特征决定的。
只要离子晶体里自带有不同的电荷就会有库伦作用,无论周围的空间有多少带有相异电荷的离子,都会产生库伦吸引力,这就决定了离子键的不饱和性,而电荷相异的离子在任意方向的这种作用依然存在。
即没有固定方向,不存在方向性。
而离子在离子晶体由于空间条件及离子本身大小的限制,使一个离子周围只能有确定数目的作用,即配位数一定。
但相邻的离子间库伦引力依然存在,故两者不矛盾。
2.下列双原子分子或离子,哪些可稳定存在?哪些不可能稳定存在?请将能稳定存在的双原子分子或离子按稳定性由大到小的顺序排列起来。
H 2 He 2 He 2+ Be 2 C 2 N 2 N 2+答: H 2 σ1s 2 键级=122=- He 2 σ1s 2σ1s *2 键级=0222=- He 2+ σ1s 2σ1s *1键级=5.0212=- Be 2 σ1s 2σ1s *2σ2s 2σ2s *2键级=0244=-C 2 σ1s 2σ1s *2σ2s 2σ2s *2π2py 2π2pz 2 键级=2248=-N 2 σ1s 2σ1s *2σ2s 2σ2s *2π2py 2π2pz 2σ2px 2 键级=32410=-N 2+σ1s 2σ1s *2σ2s 2σ2s *2π2py 2π2pz 2σ2px 1键级=5.2249=-稳定存在的分子或离子:H 2 He 2+ C 2 N 2 N 2+ 不能稳定存在的分子或离子:He 2 Be 2 稳定性次序:N 2>N 2+>C 2>H 2>He 2+3.第二周期某元素的单质是双原子分子,键级为1是顺磁性物质。
(1)推断出它的原子序号; (2)写出分子轨道中的排布情况; 答:(1)原子序号5(2)B 2 σ1s 2σ1s *2σ2s 2σ2s *2π2py 1π2pz 14.在BCl 3和NCl 3分子中,中心原子的氧化数和配体数都相同,为什么二者的中心原子采取的杂化类型、分子构型却不同?答:BCl 3与NCl 3分子中,中心原子不同,中心原子的电子结构不同,使得两者的中心原子采用不同的杂化方式:B 采用的是sp 2杂化,每个杂化轨道的的夹角是120o ,与Cl 原子以3p x 轨道形成3个σ键,分子呈平面三角形。
第9章配位平衡与配位滴定法1.无水CrC13和氨作用能形成两种配合物A和B,组成份别为CrC13·6NH3和CrC13·5NH3。
加入AgNO3,A溶液中几乎全数的氯沉淀为AgC1,而B溶液中只有三分之二的氯沉淀出来。
加入NaOH并加热,两种溶液均无氨味。
试写出这两种配合物的化学式并命名。
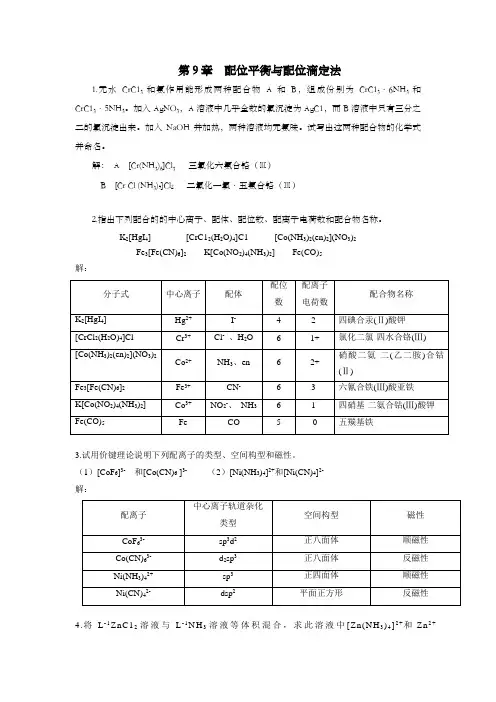
解:A [Cr(NH3)6]Cl3三氯化六氨合铬(Ⅲ)B [Cr Cl (NH3)5]Cl2二氯化一氯·五氨合铬(Ⅲ)2.指出下列配合的的中心离子、配体、配位数、配离子电荷数和配合物名称。
K2[HgI4] [CrC12(H2O)4]C1 [Co(NH3)2(en)2](NO3)2Fe3[Fe(CN)6]2K[Co(NO2)4(NH3)2] Fe(CO)5解:3.试用价键理论说明下列配离子的类型、空间构型和磁性。
(1)[CoF6]3-和[Co(CN)6 ]3- (2)[Ni(NH3)4]2+和[Ni(CN)4]2-解:4.将·L-1ZnC12溶液与·L-1NH3溶液等体积混合,求此溶液中[Zn(NH3)4]2+和Zn2+的浓度。
解: Zn 2+ + 4NH 3 = [Zn(NH 3)4]2+ 平衡浓度/mol·L -1 x ×+4x ≈ ≈94342243109230050⨯=⋅==++..x .)NH (c )Zn (c ))NH (Zn (c K f θx =c(Zn 2+)=×10-9mol·L -15.在·L -1[Ag(NH 3)2]+溶液中加入1mL 1mol·L -1NaC1溶液,溶液中NH 3的浓度至少需多大才能阻止AgC1沉淀生成?解: [Ag(NH 3)2]++Cl - = AgCl + 2NH 3 平衡浓度/mol·L -1 c(NH 3)107233210771101111-+-⨯⨯⨯===..K K ))NH (Ag (c )Cl (c )NH (c K sp f j 11073510107711011010050--⋅=⨯⨯⨯⨯=Lmol .....)NH (c6.计算AgC1在·L -1氨水中的溶解度。




13. 两个半电池,电极相同,电解质溶液中的物质也相同,都可以进行电极反应,但溶液的浓度不同,它们组成电池的电动势(A )A. E = 0,E ≠0B. E ≠0,E ≠0C. E ≠0,E = 0D. E = 0,E = 014. 用Nernst 方程式计算Br 2/Br −电对的电极电势,下列叙述中正确的是(B )A. Br 2的浓度增大,E 增大B. Br −的浓度增大,E 减小C. H +的浓度增大,E 减小D. 温度升高对E 无影响5.已知在1. 0mol ·L -1H 2SO 4溶液中,电对Ce 4+/Ce 3+和Fe 3+/Fe 2+的条件电极电势分别为1.44V 和 0.68V ,在此条件下用Ce (SO 4)2标准溶液滴定Fe 2+,其化学计量点的电势值为:( C )A. 2.12VB. 0.86VC. 1.06VD. 1.26V6.已知Cl 元素电势图:酸性介质中:E A Ө/V ClO -───Cl 2───Cl -碱性介质中:E B Ө/V ClO -───Cl 2───Cl -则:( B )A. 碱性介质中Cl 2会发生逆歧化反应B. 碱性介质中会发生歧化反应C. 酸性介质中Cl 2会发生歧化反应D. 酸性或碱性介质中都不发生歧化反应9. KBrO 3是强氧化剂,Na 2S 2O 3是强还原剂,但在用KBrO 3标定Na 2S 2O 3时,不能采用它们之间的直接反应其原因是:( C )(A )两电对的条件电极电位相差太小 (B )可逆反应(C )反应不能定量进行 (D )反应速率太慢3. 已知H 2O 2的电势图:酸性介质中:O 2H 2O 2H 2O 0.67V 1.77V 碱性介质中:O 2H 2O 2H 2O -0.08V 0.87V说明H 2O 2的歧化反应 (C )A. 只在酸性介质中发生B. 只在碱性介质中发生C. 无论在酸性介质中还是碱性介质中都发生D. 无论在酸性介质中还是碱性介质中都不发生6. 下列氧化剂随H + 浓度的增大其氧化性增强的是 ( A)A . K 2Cr 2O 7B . FeCl 3C . K 2[PtCl 4]D . Cl 29.以K 2Cr 2O 7滴定Fe 2+,以二苯胺磺酸钠作指示剂,加入磷酸的目的在于 (A )(A )降低E (Fe 3+/ Fe 2+) (B )升高E (Fe 3+/ Fe 2+)(C )降低E (Cr 2O 72-/ Cr 3+) (D )升高E (Cr 2O 72-/ Cr3+)10.根据元素标准电势图M 4+M 2++0.40V M1.63 1.36 0.42 1.36下列说法正确的是(A)M4+是强氧化剂(B)M是强还原剂(C)M4+能与M反应生成M2+(D)M2+能岐化生成M和M4+ (D)11. 已知电对(Cl2/Cl-)的标准电极电势为+1.36V,在下列电极反应中标准电极电势为+1.36V 的电极反应是(D)A. Cl2 + 2e- = 2Cl-B. 2Cl2 + 4e- = 4Cl-C. 1/2Cl2 + e- = Cl-D. 都是12. 下列电极反应中,有关离子浓度减小时,电极电势增大的是(B)A. Sn4+ + 2e- = Sn2+B. Cl2 + 2e- = 2Cl-C. Fe2+ + 2e- = FeD. 2H+ + 2e- = H25.已知在1. 0mol·L-1H2SO4溶液中,电对Ce4+/Ce3+和Fe3+/Fe2+的条件电极电势分别为1.44V和0.68V,在此条件下用Ce(SO4)2标准溶液滴定Fe2+,其化学计量点的电势值为:(D)A. 2.12VB. 0.86VC. 1.26VD.1.06V10.已知EΘ(Cu2+/Cu)=0.337V,K稳[Cu(NH3)4]2+=4.3×1013,则电极反应[Cu(NH3) 4]2++2e-==== Cu+4NH3的EΘ([Cu(NH3) 4]2+/Cu)为:(B)A. 0.337VB. -0.067VC. 0.740VD. -0.470V14.已知下列反应在标准状态下,皆正向自发进行:2Fe2+ +Br2 2 Fe3+ +2 Br-Fe3+ +2 I-2Fe2+ + I2则有关E的大小顺序正确的是D(A)E(Fe3+/ Fe2+)> E(I2/ I-)> E(Br2/ Br -)(B)E(I2/ I-)> E(Fe3+/ Fe2+)> E(Br2/ Br -)(C)E(Br2/ Br -)> E(I2/ I-)> E(Fe3+/ Fe2+)(D)E(Br2/ Br -)> E(Fe3+/ Fe2+)> E(I2/ I-)6、由电对MnO4-与Mn2+与Fe3+/Fe2+组成原电池,已知电对MnO4-/ Mn2+的φθ大于Fe3+/Fe2+E°值,若增大溶液的PH值,原电池的电动势将:B(1)增大(2)减小(3)不变(4)无法判断17、对于下列电极反应,MnO2+4H++2e=Mn2++2H2O如果增大溶液的pH值,则该电极的电极电势:B(1)增大(2)减小(3)不变(4)不能判断15.已知Cl元素电势图:1.63 1.36酸性介质中:E AӨ/V ClO-───Cl2───Cl-碱性介质中:E B Ө/V ClO -───Cl 2───Cl -则:( B )A. 碱性介质中Cl 2会发生逆歧化反应B. 碱性介质中会发生歧化反应C. 酸性介质中Cl 2会发生歧化反应D. 酸性或碱性介质中都不发生歧化反应5.下列氧化剂随H + 浓度的增大其氧化性增强的是 (A)(A.) K 2Cr 2O 7 (B. FeCl 3(C.) K 2[PtCl 4] (D )Cl 27.将反应 Zn + Cu 2+=Zn 2+ + Cu 设计为原电池,若在铜半电池溶液中加入氨水后,则电池电动势E 值将 ( C.(A.) 增大 (B.) 不变 (C. )变小 (D.) 无法判断11.已知3+/Fe 2+)=0.771V ,2+/Fe)= -0.447V , (O 2/H 2O)=1.229V ,则下列氧化还原能力大小顺序正确的是 D 。

《无机与分析化学基础》第九章酸碱滴定法酸碱滴定法是一种常用的分析化学定量分析方法,通过溶液中酸碱的中和反应来确定溶液中酸碱的浓度。
本文将介绍酸碱滴定法的原理、实验步骤以及注意事项。
酸碱滴定法的原理是基于酸碱中和反应的化学方程式。
一般来说,酸和碱在适当的条件下可以完全中和,生成盐和水。
滴定过程中,用一种称为指示剂的物质来指示滴定终点的改变。
指示剂通常是一个颜色变化明显的有机化合物,在滴定中逐渐改变颜色,当滴定剂的体积接近等于滴定液的体积时,指示剂的颜色会突然改变,这个点称为滴定终点。
进行酸碱滴定的实验步骤如下:1.准备滴定仪器和试剂。
滴定仪器包括滴定管、滴定架、移液管等。
试剂包括滴定液、指示剂等。
2.准备待测溶液。
首先用溶剂将样品溶解,并将样品转移到滴定瓶中。
可以使用酸碱滴定法来测量样品中酸碱含量。
3.在滴定瓶中加入适量的指示剂。
根据滴定液的性质和待测溶液的性质选择合适的指示剂。
4.滴定。
将滴定瓶放在滴定架上,使用滴定管连接到滴定瓶上。
然后,将滴定液缓慢添加到滴定瓶中,并同时轻轻摇动滴定瓶,直到指示剂的颜色发生明显改变。
记录滴定液的体积。
5.计算待测溶液中酸碱的浓度。
根据滴定液的浓度和滴定液的使用量,计算出待测溶液中酸碱的浓度。
在进行酸碱滴定实验时,需要注意以下几点:1.滴定过程中需要保持溶液搅拌均匀。
这是为了使滴定液与待测溶液充分混合,保证反应得到准确的结果。
2.滴定液的浓度和选择适当的指示剂非常重要。
滴定液的浓度应该与待测溶液中酸碱的浓度相近,这样可以减小误差。
同时,指示剂的选择也要合适,颜色变化要明显。
3.在滴定过程中,滴定液的滴定速度要适量。
滴定液的滴定速度太快会导致误差,滴定速度太慢会浪费时间。
总结起来,酸碱滴定法是一种简单而有效的定量分析方法,可以用于测定溶液中酸碱的浓度。
通过准备滴定仪器和试剂、滴定过程中的注意事项,可以进行准确、可靠的酸碱滴定实验。
第九章 配位化合物与配位滴定法习题1.是非判断题1-1中心离子的未成对电子数越多,配合物的磁矩越大。
1-2配合物由内界和外界组成。
1-3配位数是中心离子(或原子)接受配位体的数目。
1-4配位化合物K 3[Fe(CN)5CO]的名称是五氰根·一氧化碳和铁(Ⅱ)酸钾。
1-5一般说来,内轨型配合物比外轨型配合物稳定。
1-6配合物中由于存在配位键,所以配合物都是弱电解质。
1-7同一种中心离子与有机配位体形成的配合物往往要比与无机配合体形成的配合物更稳定。
1-8配合物的配位体都是带负电荷的离子,可以抵消中心离子的正电荷。
1-9电负性大的元素充当配位原子,其配位能力强。
1-10在螯合物中没有离子键。
1-11配位物中心离子所提供杂化的轨道,其主量子数必须相同。
1-12配合物的几何构型取决于中心离子所采用的杂化类型。
1-13外轨型配离子磁矩大,内轨型配合物磁矩小。
1-14配离子的配位键越稳定,其稳定常数越大。
1-15氨水溶液不能装在铜制容器中,其原因是发生配位反应,生成[Cu(NH 3)4]2+,使铜溶解。
1-16在配离子[Cu(NH 3)4]2+解离平衡中,改变体系的酸度,不能使配离子平衡发生移动。
1-17已知[HgI 4]2-的4θβ=K 1,[HgCl 4]2-的4θβ=K 2,,则反应[HgCl 4]2-+4I -=[HgI 4]2-+4Cl -的平衡常数为K 1/K 2。
1-18 [Cu(NH 3)3]2+ 的积累稳定常数β3是反应[Cu(NH 3)2]2+ + NH 3⇔[Cu(NH 3)3]2+的平衡常数。
1-19已知θϕ[Fe 3+/Fe 2+]=0.77V ,电极反应[Fe(C 2O 4)3]3-+ e=[Fe(C 2O 4)2]2-+ C 2O 42-,在标准状态时,θϕ的计算式为:θθθθθϕϕc O C c c O C Fe c c O C Fe c Fe F /)(/])([/])([lg 0592.0)/e 2422242334223---+⋅++(= 。
⽆机及分析化学第9章习题解答第九章化学分析法习题解答习题9-11. 能⽤于滴定分析的化学反应必须具备哪些条件?解①反应要定量完成,没有副反应伴⽣。
②反应速率要快,或有简便的⽅法加速反应。
③有可靠、简便的⽅法指⽰滴定终点。
2. 基准物应具备哪些条件?基准物的称量范围如何估算?解基准物质必须具备以下条件:①试剂的纯度⾜够⾼,含量在99.9%以上,⼀般使⽤基准试剂或优级纯试剂。
②物质组成与化学式完全相符,若含有结晶⽔,其结晶⽔含量应与化学式相符。
③性质稳定,不易和空⽓中的O 2或CO 2等作⽤,不易发⽣风化和潮解。
④最好具有较⼤的相对分⼦量,可减⼩称量误差。
其称量范围是要计算使标准溶液消耗体积控制在20~30mL 之间所需基准物的质量。
3. 下列物质中那些可以⽤直接法配制标准溶液?那些只能⽤间接法配制?24422732232H SO , KOH, KMnO , K Cr O , KIO , Na S O 5H O ?4. 什么是滴定度?滴定度与物质的量浓度如何换算?解滴定度(T )指每毫升标准溶液所相当的待测物的质量,以符号T 待测物/滴定剂表⽰,单位为g ?mL 1-。
若a A~b B ,则两种浓度之间的换算关系为:3A/B B A 10a T c M b-=?。
5. 什么是“等物质的量的规则”,运⽤时基本单元如何选取?解当待测组分A 与滴定剂B 的基本单元选取适当时,两组分所相当的物质的量相等,此规则称为等物质的量的规则。
若a A~b B ,A 与B 之间等物质的量的关系为:11A B n()=n()b a。
其⼀般的选择原则如下:酸碱滴定中,基本单元的选取以⼀个质⼦转移为基准;配位滴定中,以与EDTA 等物质的量反应为基准;氧化还原滴定中,以⼀个电⼦的转移为基准。
6. 已知浓硝酸的相对密度为 1.42,含3HNO 约为70%,求其物质的量浓度。
如欲配制 1.0L 、130.25mol L HNO -?溶液,应取这种浓硝酸多少毫升?解 (1)31000 1.4270/100(HNO )1663.01c ??==(1mol L -?) (2)330.25 1.010(HNO )1616V ??==(mL) 7. 已知密度为1.051g mL -?的冰醋酸(含HAc99.6%),求其物质的量浓度。