乙酸
- 格式:docx
- 大小:14.91 KB
- 文档页数:2

乙酸知识点总结一、乙酸简介乙酸,也被称为醋酸,是一种常见的有机酸,在化学式中表示为CH3COOH。
它是无色透明的液体,具有强烈的刺激性气味,常温下为固态。
乙酸是一种重要的化工原料,广泛用于制造染料、农药、香料、塑料等。
此外,乙酸也是食品工业中的重要添加剂,用于制造醋酸盐和醋。
二、乙酸的制备方法1. 发酵法:通过乙醇发酵的方法制备乙酸,是工业上最常用的方法。
在发酵过程中,酵母菌或其他微生物将乙醇氧化成乙酸,同时释放出能量。
该方法的优点是原料来源丰富、工艺成熟、成本较低,缺点是生产过程中需要消耗大量的粮食或淀粉。
2. 合成法:通过化学反应将甲烷氧化成乙酸。
该方法需要使用大量的氧化剂和高纯度的原料,工艺复杂,成本较高。
尽管如此,由于该方法可以获得高纯度的乙酸,因此在某些特定领域仍被广泛应用。
三、乙酸的物理性质乙酸是一种无色透明的液体,具有强烈的刺激性气味。
它的沸点为117.9摄氏度,熔点为16.6摄氏度。
在常温下,乙酸可以与水、乙醇等溶剂互溶。
此外,乙酸还具有还原性和酸性。
四、乙酸的化学性质1. 酸性:乙酸是一种有机酸,具有强烈的酸性。
在溶液中,乙酸可以解离出氢离子和醋酸根离子。
其酸性强度接近于盐酸和硫酸,因此可以与碱反应生成盐和水。
2. 酯化反应:乙酸可以与醇类发生酯化反应,生成酯类物质。
酯化反应是可逆反应,需要在催化剂的作用下进行。
生成的酯类物质具有香味和口感,因此在食品和香料工业中广泛应用。
3. 取代反应:乙酸可以发生取代反应,被其他基团取代。
例如,在乙醇的存在下加热时,乙酸可以被卤素取代生成卤代乙酸。
此外,乙酸也可以被其他烷基取代生成一系列的取代产物。
4. 氧化反应:在催化剂的作用下,乙酸可以被氧化成过氧乙酸。
过氧乙酸是一种强氧化剂,可以用于消毒和漂白等用途。
五、乙酸的应用1. 化工原料:乙酸是一种重要的化工原料,主要用于制造染料、农药、香料、塑料等化学品。
通过与其他原料的反应,乙酸可以转化为各种有用的化学品,满足不同行业的需求。




有关乙酸的知识点总结一、乙酸的物理性质1、外观:纯乙酸为无色液体,有刺激性气味,易挥发。
2、密度:乙酸的密度为1.05g/cm3,是水的密度略大。
3、熔点和沸点:乙酸的熔点为16.6℃,沸点为117.9℃。
4、溶解性:乙酸能与水、醇、醚等多种有机物相溶,但与某些有机物质或溶剂反应较为缓慢。
5、酸性:乙酸是一种中等强度的酸,在水中能够解离成CH3COO-和H+。
6、挥发性:乙酸具有很强的挥发性,因此在慎防溢出、防止挥发的时候需要格外小心。
二、乙酸的化学性质1、酸性反应:乙酸与碱反应生成乙酸盐和水,此反应也被称为酸碱中和反应。
例如,乙酸与氢氧化钠反应生成乙酸钠和水的方程式为CH3COOH + NaOH = CH3COONa + H2O。
2、氧化还原反应:乙酸在适当的条件下可以发生氧化还原反应,例如与氧气反应生成二氧化碳和水。
3、酯化反应:乙酸与醇发生酯化反应,生成乙酸酯。
该反应在有机合成和香精香料行业中有着广泛的应用。
4、酸酐形成:当乙酸加热到较高温度时,会脱水生成乙酸酐,该反应是有机合成中的重要反应之一。
5、聚合反应:乙酸可以进行聚合反应,生成聚乙酸。
三、乙酸的制备方法1、木醋液干馏法:木醋液是通过木材的干馏得到的一种液体产物,其主要成分是乙酸。
木醋液通过加热蒸馏,可以得到甲醋酸、醋醛、甲醛等多种产品,其中乙酸的产率最高。
2、乙烯氧化法:将乙烯与氧气反应,在催化剂的催化下生成乙酸。
这是工业上生产乙酸的主要方法之一。
3、醋酐水解法:醋酐是一个无色、易挥发的液体,在水中可以水解生成乙酸。
四、乙酸的应用领域1、食品加工:乙酸作为一种食品添加剂,可以用作醋的原料,或者用于调味品的生产。
2、医药:乙酸在医药工业中用于生产药物原料、药品配方等。
3、化学工业:乙酸作为一种重要的有机化合物,有着广泛的应用,例如作为有机合成的原料、催化剂等。
4、清洁剂:乙酸可以用于清洁剂的生产,具有除去油垢、杀菌、消毒等功能。
5、其他:乙酸还可以用于制备醋酸纤维素、醋酸丁酯等多种有机化合物。

中文名: 乙酸;冰醋酸英文名: Acetic acid glacial 别名: Glacial acetic acid分子结构:分子式: C2H4O2分子量: 60.05物理化学性质熔点:16-16.5ºC沸点:117-118ºC水溶性:MISCIBLE折射率:1.3715闪点:40ºC密度:1.048性质描述:无色透明液体。
熔点16.635℃沸点117.9℃,相对密度1.0492(20/4℃)折射率1.3716闪点(开杯)57℃自燃点465℃粘度11.83mPa·s(20℃)纯乙酸在16℃以下时,能结成冰状固体,故称冰醋酸。
与水、乙醇、苯和乙醚混溶,不溶于二硫化碳。
当水加到乙酸中,混合后的总体积变小,密度增加。
分子比为1:1,进一步稀释,不再发生上述体积的改变。
有刺激性气味。
安全信息安全说明:S23:不要吸入蒸汽。
S26:万一接触眼睛,立即使用大量清水冲洗并送医诊治。
S45:出现意外或者感到不适,立刻到医生那里寻求帮助(最好带去产品容器标签)。
危险品标志: C:腐蚀性物质危险类别码: R10:易燃。
R35:会导致严重灼伤。
危险品运输编号: UN2789其他信息产品应用:生产方法及其他形式存在;排泄物和血液中以游离酸的形式存在。
许多微生物可以将不同的有机物通过发酵转化为乙酸。
中国古代就有关于制醋的记载,早在公元前,人类已能用酒经各种乙酸菌氧化发酵制醋,19世纪后期,发现将木材干馏可以获得乙酸。
1911年,在德国建成了世界上第一套乙醛氧化生产乙酸的工业装置。
不久又研究发展了低碳烃氧化生产乙酸的方法。
1960年原联邦德国采用甲醇在高压(20MPa)下经羰基化制乙酸的方法。
随后,美国孟山都公司采用铑络合物催化剂(以碘化物作助催化剂),使甲醇羰基化制乙酸的压力降到0.3-3.0MPa,并于1970年建成生产能力135kt乙酸的甲醇低压羰基化工业装置。
由于该法技术经济先进,从70年代中期起新建的大厂多采用甲醇低压羰基化法。

乙酸的化学式和别名【别名】醋酸【分子式】C2H4O2【结构式】CH3COOH【性质】无色透明液体。
是醋的重要成分,一种典型的脂肪酸,有刺激性酸味。
无水物的相对密度1.049(20℃),沸点118℃,熔点16.604℃,闪点(幵杯)57℃,自燃温度427℃,折射率1.3716(20℃)。
乙酸是弱酸,但能与碱类起中和作用,生成乙酸盐;也能与醇类起酯化作用,生成各种酯类、可与水、乙醇、乙醚、甘油及苯混溶,不溶于二硫化碳。
水溶液的pH值:6%时为2.4,0.6%时为 2.9。
乙酸蒸气极易着火,与空气混合的爆炸范围为4%-17%、低浓度无毒,高浓度有较强腐蚀性。
普通乙酸含量约为36%;具有饱和脂肪酸的通性,与某些金属、金属氧化物和氢氧化物反应生成盐;与醇进行酯化反应。
【简要制法】①可由乙醛与空气或氧气在乙酸锰和乙酸钴催化剂的作用下,经液相氧化制成乙酸②由甲醇与一氧化碳在催化剂作用下合成乙酸。
③丁烷或石脑油及均相催化剂(乙酸锰和乙酸钴)溶于乙酸后,在高压下通入空气,进行氧化反应也可制成乙酸【用途】乙酸是重要的有机化工原料。
用于合成乙酸乙烯酯、乙酸酯、乙酸盐、巯基乙酸和氯代乙酸等,也用作制造橡胶、塑料、染料等的溶剂。
印染工业中用作染料显色液的抗碱剂、涂料印花粘合剂的调制剂以及用作助染剂、缓染剂等。
食品工业用作酸味剂及香料。
发酵工业用作曲香酒的增香剂。
也是制造染料、药品、农药、合成纤维的原料。
还用作消毒剂、杀菌剂等。
[安全与防护]乙酸属二级有机酸性腐蚀物品,危规编号:94001。
用铝合金或塑料桶包装,铝桶装每桶净重100kg、200kg、塑料桶装每桶25L。
贮存时注意防火防爆。
低浓度乙酸无毒,浓度超过5%时,对皮肤有较强腐蚀性对呼吸道、食道、眼睛等有较强刺激作用皮肤触及时应立即用大量清水或2%小苏打溶液清洗。

乙酸的化学知识点总结一、化学性质1. 乙酸的物理性质乙酸是一种无色液体,在室温下易挥发,有刺激性气味。
它可以与水混溶,呈现酸性反应。
乙酸的沸点为118℃,密度为1.049g/cm³,在冰点下可结晶成固体。
2. 乙酸的化学性质乙酸是一种中等强度的酸,它可以和碱发生中和反应,生成醋酸盐。
此外,乙酸还可以发生酯化反应和脱水反应。
例如,与酒精发生酯化反应可生成乙酸乙酯,与浓硫酸反应可以脱水生成乙烯。
3. 乙酸的氧化性乙酸在空气中也可被氧化成二氧化碳和水,因此在储存和使用时需要注意防止氧化。
此外,乙酸也可以作为还原剂,例如可以将过氧化氢还原为水。
4. 乙酸的共轭碱乙酸的共轭碱为乙酰离子(CH3COO-),它是一种较弱的碱。
在水溶液中,乙酸可以与水反应生成乙酰离子和氢离子。
乙酰离子是一种较弱的碱性物质,它在水溶液中可以接受氢离子形成乙酸,从而保持了乙酸和乙酰离子之间的平衡。
二、化学结构乙酸的化学结构可以表示为CH3COOH,它是一种含有羧基的碳链酸。
乙酸分子中含有一个羧基和一个甲基,羧基是一种含氧饱和的碳氧双键,可以发生酸性反应。
同时,乙酸还含有一个甲基,使得它具有一定的亲疏水性。
乙酸分子中的羧基和甲基是通过单键连接在一起的,形成了一个分子。
乙酸分子可以通过共价键连接成链状结构或环状结构。
在液态和固态下,乙酸分子通常呈链状结构,而在气态下,由于分子间的相互作用减弱,乙酸分子可以形成环状结构。
三、用途1. 食品加工乙酸是一种常见的食品添加剂,它可以用于调味剂、酱料、酱油等食品加工中,提供了食品的口感和保存性。
2. 化工原料乙酸是一种重要的化工原料,它可以用于生产醋酸乙烯酯、纤维素醋酸盐等有机化合物。
此外,乙酸也可用于合成其他酸类和酯类物质。
3. 清洁消毒乙酸是一种常见的清洁和消毒剂,它可以用于清洁厨房、浴室等场所,有效杀菌消毒,去除油污垢。
4. 医药用途乙酸也可以用于医药制剂的生产,例如酊剂、口服溶液等。

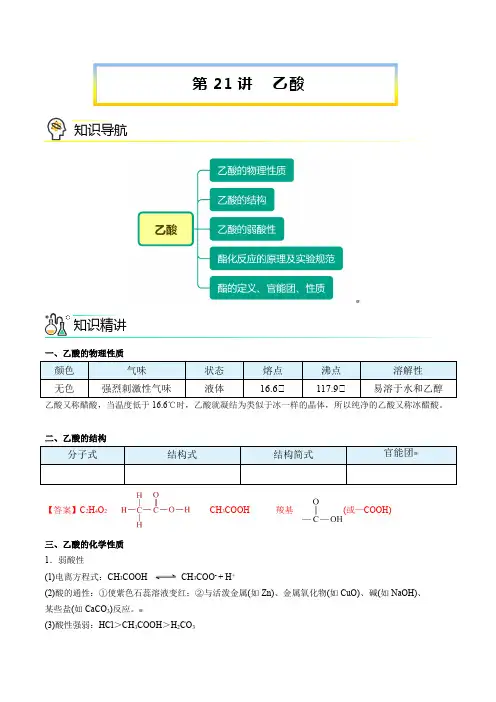
一、乙酸的物理性质颜色 气味 状态 熔点 沸点 溶解性 无色强烈刺激性气味液体16.6℃117.9℃易溶于水和乙醇乙酸又称醋酸,当温度低于16.6℃时,乙酸就凝结为类似于冰一样的晶体,所以纯净的乙酸又称冰醋酸。
二、乙酸的结构分子式 结构式 结构简式官能团【答案】C 2H 4O 2CH 3COOH羧基(或—COOH)三、乙酸的化学性质 1.弱酸性(1)电离方程式:CH 3COOHCH 3COO - + H +(2)酸的通性:①使紫色石蕊溶液变红;②与活泼金属(如Zn)、金属氧化物(如CuO)、碱(如NaOH)、 某些盐(如CaCO 3)反应。
(3)酸性强弱:HCl >CH 3COOH >H 2CO 3第21讲 乙酸知识导航知识精讲(4)应用:除水垢CaCO3 + 2CH3COOH === Ca(CH3COO)2 + CO2↑+ H2O 2.酯化反应实验装置实验步骤在一支试管中加入3 mL乙醇,然后边振荡试管边慢慢加入2 mL浓H2SO4和2 mL乙酸,再加入几片碎瓷片。
连接好装置,用酒精灯小心加热,将产生的蒸气经导管通到饱和Na2CO3溶液的液面上。
实验现象饱和Na2CO3溶液的液面上有无色透明的油状液体生成,且能闻到香味。
实验结论①乙酸与乙醇在浓H2SO4存在且加热的条件下,反应生成了不溶于水的物质。
②化学方程式:____________________________________________________【答案】CH3COOH + CH3CH2OH CH3COOCH2CH3 + H2O乙酸乙酯的物理性质:颜色气味状态密度溶解性无色透明有芳香气味油状液体比水小难溶于水,易溶于有机溶剂四、酯化反应的概念与原理1.定义:酸与醇反应生成酯和水的反应,叫酯化反应。
2.特点:酯化反应属于取代反应,也是可逆反应,乙酸乙酯会与水发生水解反应生成酸和醇。
3.原理:酸脱羟基,醇脱氢。
五、酯酯的官能团是酯基(,或写作—COOR),很多鲜花和水果的香味都来自酯。

乙酸求助编辑百科名片冰乙酸乙酸,俗名醋酸,广泛存在于自然界,它是一种有机化合物,是烃的重要含氧衍生物,是典型的脂肪酸。
乙酸被公认为食醋内酸味及刺激性气味的来源。
在家庭中,乙酸稀溶液常被用作除垢剂。
食品工业方面,在食品添加剂列表E260中,乙酸是规定的一种酸度调节剂。
中文名:乙酸外文名:Acetic Acid别名:冰乙酸(100%纯乙酸),醋酸结构简式:C H3COOH CAS编号: 64-19-7EINECS号:E INECS号:200-580-7 熔点:16 .6℃沸点:117 .9℃目录简介制备有氧发酵无氧发酵甲醇羰基化乙醇氧化乙醛氧化乙烯氧化丁烷氧化托普索法应用历史命名易错点物理性质化学性质酸性二聚物溶剂化学反应鉴别生物化学环境影响其他补充危险性泄漏处理急救防护措施储运安全信息用途测定方法合成乙酸国家标准美国标准发展状况物质毒性展开简介制备有氧发酵无氧发酵甲醇羰基化乙醇氧化乙醛氧化乙烯氧化丁烷氧化托普索法应用历史命名易错点物理性质化学性质酸性二聚物溶剂化学反应鉴别生物化学环境影响环境标准其他补充危险性泄漏处理急救储运安全信息用途测定方法合成乙酸国家标准美国标准发展状况物质毒性展开编辑本段简介【英文名称】Acetic Acid【英文别名】Glacial acetic acid; Acetic acid solution; acetic acid 50%; acetic acid, of a concentration of more than 10 per cent, by weight, of acetic acid; Acetic Acid Glacial BP; Natural Acetic Acid; Acetic acid (36%); Acetic acid,food grade; Acetic Acid Glacial; GAA【其他名称】冰乙酸(100%的乙酸),醋酸(俗名);乙酸; 冰醋酸; 酸(食品级); 冰乙酸; 冰醋酸(食品级); 乙酸,无水; 醋酸(食品级); 乙酸,36%; 醋酸,36%【分子式】C2H4O2【结构简式】CH3COOH【简写式】HOAc【CAS编号】64-19-7【EINECS号】200-580-7InChI=1/C2H4O2/c1-2(3)4/h1H3,(H,3,4)[1]【分子量】60.05【相对密度】1.05【挥发性】易挥发冰醋酸【适应症】该品不同浓度用以治疗各种皮肤浅部真菌感染,灌洗创面及鸡眼、疣的治疗。
乙酸一标识中文名乙酸;醋酸英文名acetic acid分子式C2H4O2相对分子质量60.05CAS号64-19-7OⅡ结构式CH3—C—OH危险性类别第8.1类酸性腐蚀品化学类别有机酸二主要组成与性状主要成分含量一级≥99.0%;二级≥98.0%。
外观与性状无色透明液体,有刺激性酸臭。
主要用途用于制造醋酸盐、醋酸纤维素、医药、颜料、酯类、塑料、香料等。
三健康危害侵入途径吸入、食入、经皮吸收。
健康危害吸入本品蒸气对鼻、喉和呼吸道有刺激性。
对眼有强烈刺激作用。
皮肤接触,轻者出现红斑,重者引起化学灼伤。
误服浓乙酸,口腔和消化道可产生糜烂,重者可因休克而致死。
慢性影响:眼睑水肿、结膜充血、慢性咽炎和支气管炎。
长期反复接触,可致皮肤干燥、脱脂和皮炎。
四急救措施皮肤接触立即脱去被污染的衣着,用大量流动清水冲洗,至少15分钟,就医。
眼睛接触立即提起眼睑,用大量流动清水或生理盐水彻底冲洗至少15分钟。
就医。
吸入迅速脱离现场至空气新鲜处。
保持呼吸道通畅。
如呼吸困难,给输氧。
如呼吸停止,立即进行人工呼吸。
就医。
食入误服者用水漱口,就医。
五燃爆特性与消防燃烧性易燃闪点(℃)39 爆炸下限(%)4.0 引燃温度(℃)463爆炸上限(%)17.0最小点火能(mJ)0.62最大爆炸压力(Mpa)无资料危险特性易燃。
其蒸气与空气混合能形成爆炸性混合物,遇明火、高热有引起燃烧爆炸。
与铬酸、过氧化钠、硝酸或其它氧化剂接触,有引起爆炸的危险。
具有腐蚀性。
灭火方法用雾状水保持火场容器冷却,用水喷射逸出液体,使其衡释成不燃性混合物,并用雾状水保护消防人员。
灭火剂:雾状水、抗溶性泡沫、二氧化碳、干粉。
六泄漏应急处理迅速撤离泄漏污染区人员至安全区,并进行隔离,严格限制出入。
切断火源。
建议应急处理人员戴自给正压式呼吸器,穿防酸碱工作服。
不要直接接触泄漏物。
尽可能切断泄漏源,防止进入下水道、排洪沟等限制性空间。
小量泄漏:用砂土、干燥石灰或苏打灰混合。
乙酸知识点总结大全乙酸,化学式为CH3COOH,是一种有机酸,也称为醋酸。
下面将介绍乙酸的相关知识点,包括性质、用途、生产方法、危害等方面。
一、乙酸的性质1. 物理性质:乙酸是一种无色透明的液体,在室温下为低毒、刺激性的酒类气味。
乙酸的沸点为118℃,密度为1.049 g/cm³,易挥发,可以与水、醇等多种有机溶剂混溶。
2. 化学性质:a. 乙酸与碱反应生成乙酸盐和水,是一种弱酸,对金属没有明显的腐蚀作用。
b. 乙酸可发生酯化反应,生成醋酸乙酯等有机化合物。
c. 乙酸在氧气的存在下,容易发生氧化反应,生成二氧化碳和水。
d. 乙酸还可以通过还原反应生成甲醇。
二、乙酸的用途1. 工业用途:a. 乙酸是一种重要的工业原料,可以用于制备乙酸乙酯、聚乙烯醋酸乙烯酯等化工产品。
b. 乙酸还用作溶剂,可以溶解树脂、纤维素、油漆等物质。
2. 食品工业:乙酸是一种重要的食品添加剂,可以用于醋的制备,调味料等。
3. 医药用途:乙酸可以用于制备醋酸铅等药物原料。
三、乙酸的生产方法1. 乙醇氧化法:将乙醇与氧气在高温、高压下进行催化氧化反应,生成乙醛,再将乙醛氧化生成乙酸。
2. 乙烯燃烧法:将乙烯与空气或氧气在高温下燃烧,生成乙醛,再将乙醛氧化生成乙酸。
四、乙酸的危害1. 对人体的危害:长期接触乙酸会对人体的呼吸系统、皮肤等造成刺激和伤害。
2. 环境危害:乙酸对水体和土壤也有一定的污染作用,可能对生物造成不利影响。
总结:乙酸是一种重要的化工原料和食品添加剂,具有多种用途。
在生产和使用过程中,需要注意乙酸的性质和危害,合理使用和处理。
3.3 饮食中的有机化合物
第2课时乙酸
【学习目标】
1.掌握乙酸的分子结构,理解羧基的结构特征。
2.了解乙酸的物理性质。
3.掌握乙酸的主要化学性质:酸性和酯化反应。
【自主探究】
一、乙酸的物理性质
℃时,乙酸会凝结为,所以无水乙酸又称为。
二、乙酸的组成和结构
三、乙酸的化学性质
四、乙酸的用途
除了做调味品外,你知道乙酸在生活中还有哪些用途吗?
【深度探究】
一、乙酸的酸性
1. 如何用实验证明乙酸具有酸性?
【练一练】生活中可以用食醋除去水壶中的水垢(主要成分为碳酸钙和氢氧化镁),请你写出相关的反应方程式。
2. 如何用实验证明乙酸和碳酸的酸性强弱?
3.请设计一个实验,验证醋酸、碳酸、硅酸的酸性强弱:CH3COOH>H2CO3>H2SiO3(H2SiO3是不溶于水的白色胶状沉淀)。
画出实验装置图,并指明各装置中的药品。
二、酯化反应
1. 分析乙酸和乙醇发生酯化反应时可能断裂了哪些化学键?
2.根据酯化反应机理,书写以下酸和醇发生酯化反应的反应方程式。
(1)乙酸和甲醇
(2)甲酸和乙醇
(3)乙二酸和乙醇
(4)乙酸和乙二醇
小结:饱和一元酸和饱和一元醇反应的通式:
【课堂小结】
根据今天对乙酸的学习,请你总结乙酸的性质。