肝移植术后胆道并发症的发生原因与对策
- 格式:doc
- 大小:5.06 KB
- 文档页数:2

肝移植术后并发症的原因及防治20 世纪八十年代中期以来,原位肝移植( OLT )已成为终末期肝病的金标准治疗。
虽然OLT的手术成功率已达90 % ~10 0% , 5年、1 0年生存率分别已达 70%~80%、 60%~70 %,但仍有不少问题尚未解决或不可避免,移植后并发症发生率高达 14%~55 %左右,直接影响了移植后的近远期生存率。
下面就 OLT 术后并发症的原因及防治作一简述。
一、肝移植术后外科并发症1.术后出血:(1)腹腔内出血:较常见,发生率 10%~20%,是术中和术后早期的主要死因。
原因有肝硬化致凝血功能差;后腹膜等侧枝循环创面渗血;移植肝小血管分支未被结扎出血;血管吻合口漏血;膈肌血管出血;供肝功能不良致凝血因子缺乏;外源性凝血因子补充不足;转流术中肝素的作用,转流停止后未作充分的中和;引流管出口处腹壁出血等。
常见出血部位为① 门脉高压后腹膜侧枝循环创面(如腔静脉后),②膈肌血管,⑧新肝韧带创面,④新肝活检处。
⑤ 腹腔引流管洞口等。
腹腔内出血一般多指发生在术后1~3d,除表现为持续性的引流管血性液体外,最常见的为高度的腹胀及进行性血压下降,部分病人因血块堵塞可致引流管无排。
若诊断为活动性出血,应果断进行剖腹止血。
我院25例OLT发生术后腹腔内大出血 1 例。
(2)消化道出血:多为胃十二指肠粘膜糜烂或应激性溃疡所致,曲张静脉破裂出血不多见。
供肝功能正常时,出血量一般不大,给予 H2 受体拮抗剂或泵抑制剂后均可停止。
2.血管并发症:肝动脉、门静脉及肝上、肝下下腔静脉四个吻合口均可出现相关的血管并发症,早期血管并发症的出现往往导致供肝的丢失,多与手术技术不当有关。
(1)肝动脉血栓形成:肝动脉管腔最小,吻合技术要求更高,最容易出现并发症,尤其是小儿。
原因常为吻合技术不当,肝流出道不畅,排斥反应,供肝血管较小和肝动脉变异,活体或劈离式肝移植等引起。
肝动脉栓塞后会出现以下结果:移植早期发生的主干栓塞往往导致移植肝无功能(PNF );分支血管的缺血引起胆管缺血坏死,出现胆瘘或胆道狭窄;肝局灶性坏死感染。




胆道系统并发症
王学浩;钱晓峰
【期刊名称】《山东医药》
【年(卷),期】2005(45)17
【摘要】@@ 近年来国内肝移植术的疗效不断提高(文献报道其1年生存
率>85%,5年生存率>70%,已接近国际先进水平).但胆道系统并发症的发生率仍高达10%~30%,依然是阻碍患者生存率进一步提高的重要原因.胆道并发症主要包括胆漏、胆管狭窄、胆泥或胆管结石引起的胆管梗阻、壶腹部功能障碍等.其中胆漏和胆管狭窄最为常见,约占70%.
【总页数】1页(P62)
【作者】王学浩;钱晓峰
【作者单位】南京医科大学附属第一医院,江苏南京 210029;南京医科大学附属第一医院,江苏南京 210029
【正文语种】中文
【中图分类】R5
【相关文献】
1.肝移植术后胆道系统并发症的原因分析及护理 [J], 席淑华;陈律;李歆;张冰荷
2.高位胆道系统恶性肿瘤根治性术后并发症的危险因素分析 [J], 黄罗顺;仇毓东;毛谅;贾文俊;邵聪;孙士全
3.腹腔镜胆道系统手术并发症及处理要点 [J], 徐大华
4.Oddi括约肌切开对胆道系统并发症的系统研究 [J], 周滨;李政;李晓华
5.355例胆道系统感染常见病原菌及其耐药性研究 [J], 万辉;熊秋
因版权原因,仅展示原文概要,查看原文内容请购买。




肝移植术后胆道并发症:风险因素分析肝移植手术是一种治疗终末期肝病的有效方法,可以挽救许多病人的生命,但是术后胆道并发症仍然是一个严重的问题。
胆道并发症包括胆道狭窄、结石、胆管炎等,不仅会影响病人的生活质量,还可能导致肝移植的失败。
因此,了解胆道并发症的风险因素,有助于减少其发生的可能性,提高肝移植的成功率。
胆道并发症的发生率在肝移植手术后,胆道并发症的发生率约为10%-30%,其中以胆道狭窄最常见,约占40%左右。
胆道狭窄的发生率最高的是肝移植后6个月至1年期间,但此后的2-3年内也有可能发生。
其他的胆道并发症的发生率相对较低,一般在5%以下。
胆道并发症的风险因素1.手术因素手术因素是引起胆道并发症的重要原因之一。
手术时的操作技巧、手术时间、手术对肝的破坏程度等都会影响胆道并发症的发生率。
一般认为,手术时间超过10小时、肝切开时间较长、术中出现大量出血等都会增加胆道并发症的风险。
2.受移植肝的质量受移植肝的质量也是胆道并发症的一个风险因素。
在肝移植前,医生一般会进行评估,选择适合移植的肝脏。
如果受移植肝的质量不理想,比如存在肝内胆管异常、肝门静脉压力过高等情况,胆道并发症的风险就会增加。
3.移植后免疫抑制治疗术后的免疫抑制治疗也是引起胆道并发症的重要风险因素。
免疫抑制药物可以防止移植物被宿主的免疫系统攻击,但同时也会削弱宿主的免疫系统,使病人容易感染和出现其他并发症,包括胆道并发症。
4.病人的个体因素病人的个体因素也会影响胆道并发症的发生率。
比如,病人身体虚弱、有其他慢性疾病、年龄较大等因素都会增加胆道并发症的风险。
此外,术前是否存在胆管损伤、胆管感染等情况也会影响胆道并发症的发生率。
如何降低胆道并发症的风险针对上述风险因素,有一些方法可以帮助降低胆道并发症的发生率。
具体包括以下几个方面:1.选择适当的受移植肝在肝移植前,医生需要评估捐献者的肝脏质量,选择适合移植的对象。
如果选择失误,移植后可能出现各种并发症,包括胆道并发症。

肝硬化患者肝移植术后的并发症预防肝硬化是一种严重的肝脏疾病,当病情发展到晚期,肝移植往往成为患者延续生命的重要选择。
然而,肝移植术后并非一劳永逸,患者可能面临多种并发症的风险。
了解并预防这些并发症对于提高患者的术后生存质量和长期生存率至关重要。
一、感染感染是肝移植术后最常见的并发症之一。
由于手术过程中的创伤、免疫抑制剂的使用导致免疫系统功能下降,患者更容易受到细菌、病毒、真菌等病原体的侵袭。
预防感染需要从多个方面入手。
首先,医护人员在手术过程中要严格遵循无菌操作原则,减少细菌的侵入。
其次,术后要加强病房的消毒和管理,限制探视人员,保持环境清洁。
患者自身也要注意个人卫生,勤洗手、勤换衣物。
在饮食方面,要确保食物的新鲜和卫生,避免食用生冷、不洁的食物。
对于免疫抑制剂的使用,需要根据患者的具体情况进行个体化调整,在有效抑制免疫排斥反应的同时,尽量减少对免疫系统的过度抑制。
定期监测患者的免疫功能指标,如白细胞计数、淋巴细胞亚群等,以便及时发现免疫功能的异常并采取相应的措施。
二、排斥反应排斥反应是肝移植术后另一个需要密切关注的问题。
急性排斥反应通常发生在术后的数天至几周内,而慢性排斥反应则可能在术后数月甚至数年后出现。
为了预防排斥反应,术后需要密切监测患者的肝功能指标,如胆红素、转氨酶等,以及通过肝穿刺活检等方法明确是否存在排斥反应。
免疫抑制剂的合理使用是预防排斥反应的关键。
目前常用的免疫抑制剂包括糖皮质激素、环孢素、他克莫司等。
医生会根据患者的个体情况制定个性化的免疫抑制方案,并在术后根据患者的病情和药物浓度进行调整。
患者需要严格按照医嘱按时服药,不得擅自增减药量或停药。
同时,要定期到医院复查,以便及时发现和处理可能出现的排斥反应。
三、血管并发症血管并发症主要包括肝动脉血栓形成、门静脉血栓形成和下腔静脉狭窄等。
这些并发症会严重影响肝脏的血液供应,导致肝功能损害甚至移植肝失功。
预防血管并发症需要在手术过程中精细操作,确保血管吻合的质量。
肝移植术后胆道并发症发生率高达10%~34%,严重影响肝移植受者生存时间及生活质量,是肝移植后居第2位的主要并发症[1]。
随着对该并发症的进一步认识和外科技术的提高,外科技术原因造成的吻合口、引流管相关并发症发生率呈下降趋势,而非外科技术原因造成的胆道并发症变则成了主要类型。
因此,被称为“阿基里斯之踵再现”。
1 与外科技术相关的胆道并发症
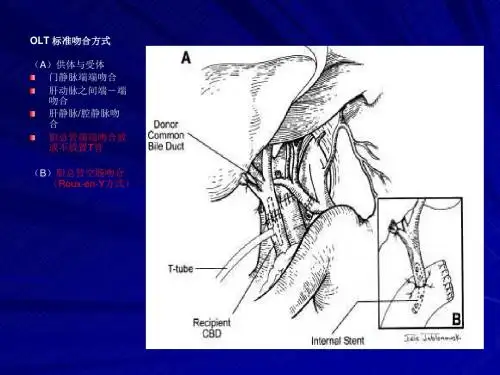
与外科技术相关的胆道并发症主要包括胆管端端吻合口狭窄、胆漏、胆肠吻合口狭窄、肝门部胆管狭窄及t管相关并发症等。
胆管端端吻合口狭窄文献报道发生率为8.7%~18.2%[2-4],特别是在活体肝移植中发生率高达32.6%[5]。
其原因是多方面的,可能与下列因素有关:(1)吻合口胆管断端缺血,特别是供肝胆管断端血运不良。
这多发生于供肝修剪过程中胆管游离过长,或修剪过程中损伤供应胆管的小动脉支,或供肝、受者胆管断端间距过长、重建后张力过大而引起局部血液循环障碍。
组织缺血、缺氧导致纤维组织增生,引起端端吻合口狭窄。
因此,修剪时应注意两者间距,避免重建后张力过大。
重建时,应尽量保留供肝胆管,剪除多余的受者胆管;供肝、受者胆管断端切缘应见到明确的出血;供肝肝门部组织不宜修剪过多,防止损伤胆管的小动脉支。
(2)胆管吻合技术缺陷,随着胆道重建技术的进步,此种原因造成的狭窄已不常见。
其多发生于胆管直径过小或供肝与受者胆管直径相差较大时。
另外,缝合时缝线牵拉过紧、针距或边距不合理、缝线选择不适当等,也是引起吻合口狭窄的因素。
针对上述因素,重建时对于供肝、受者胆管直径相差较大的病例(往往是受者胆管直径远大于供肝直径),可将供肝胆管与切缘垂直切开3~4 mm,与受者胆管行整形吻合。
缝合时缝线不宜牵拉紧,针距、边距控制在2~3 mm为宜。
目前较为常用6 0 pds缝线,以减少局部化学反应。
(3)吻合口局部及周围炎症反应,常发生于出现胆漏的患者。
胆漏时吻合口局部因炎症反应而充血、水肿,引起纤维组织增生、吻合口狭窄。
对于吻合口漏患者,可经内镜放置鼻导管引流;对供肝和受者胆管直径相差较大,端端吻合不满意者,可考虑放置8~12号t管,同时,吻合口周围应充分引流。
胆漏是肝移植中较常见的并发症,特别是在儿童肝移植和活体部分肝移植中较易发生,文献报道发生率为5.2%~28.5% [6-7],儿童活体部分肝移植中发生率高达40%[4]。
胆漏主要发生于胆管吻合口及活体移植肝断面,处理不当或不及时,易引起腹腔感染、脓毒血症、吻合口狭窄等。
术后影像学监测对及时发现胆漏有很大帮助。
当发现肝断面胆漏并积存于腹腔内时,应及时在超声引导下经皮穿刺引流;吻合口漏时,应积极进行经内镜鼻导管引流,且鼻导管应置于吻合口以上,以减少胆漏,同时腹腔内应置管引流;对于合并胆汁性腹膜炎者,应积极进行腹腔探查、引流。
胆肠吻合口狭窄在肝移植患者中发生率并不高。
全肝移植很少应用胆肠吻合,除非受者胆管病变严重。
但在活体部分肝移植中相当一部分病例需行胆肠吻合术。
胆肠吻合时,由于供肝胆管口径相对狭小,术后易发生狭窄,特别是远期易发生胆肠吻合口狭窄。
预防的关键在于胆肠吻合时精细操作。
建议胆肠吻合口后壁以6 0 pds缝线行无张力连续缝合,前壁行间断缝合,保持游离空肠盲襻长度在50 cm以上,避免返流性胆管炎。
与外科技术相关的肝门部胆管狭窄的发生率甚低,往往是供肝修剪过程中损伤了肝门部胆管的血供,导致肝门部胆管缺血、坏死、纤维组织增生和狭窄。
此种情况早期无临床症状不易发现,常于术后数月出现肝门部胆狭窄的表现。
供肝修剪过程中避免在胆管周围进行过多分离、保护好供应胆管的小动脉支,可以预防此种并发症的发生。
一旦发生,治疗上往往需行高位胆管空肠吻合术。
t管相关并发症主要为t管所致的“胆泥”堆积和拔除t管时的胆瘘。
移植后坏死脱落的胆管内皮细胞、胆汁中的黏蛋白沉积及少量血液成分混合,以“胆泥”的形式由胆管排出,途径中任何狭窄或留置管道均不利于胆泥排出。
此种情况将引起胆流不畅,甚至引发胆管炎。
术后大量使用激素,t管窦道不易形成,但拔除t管过早,将导致胆瘘及胆汁性腹膜炎。
统计表明,这种并发症占所有移植后胆道并发症的10%~60%[8]。
一项对照研究表明,肝移植后放置t管组胆道并发症发生率(20%)远高于未放置t管组(8%)[1]。
目前,多数移植中心肝移植后不常规放置t管。
对于特殊情况下放置t管的病例,拔管时间应术后8周以上,拔管时应避免粗暴操作。
当t管拔出时出现明显腹痛,应沿窦道置入直径相适的导尿管,暂时引流,如无腹膜炎表现,1周后可拔除导尿管。
2 非外科技术所致的胆道并发症
非外科技术性肝移植术后胆道并发症主要包括缺血型胆道病变(ischemia type biliary lesion,itbl)和肝内胆汁淤积。
itbl临床上表现为胆管上皮坏死、脱落、胆管铸型形成和胆管纤维化、胆管狭窄等广泛胆管树损伤。
其后果是移植肝胆道感染、狭窄、梗阻、胆汁淤滞和移植肝功能障碍。
胆管上皮细胞内谷胱苷肽水平低,自由基等有害因素对胆管上皮的毒性作用比对肝细胞的作用要强的多,其损伤往往是不可逆的。
此外,胆管上皮细胞容易受到杀伤细胞的攻击,也容易在损伤、缺氧、炎症等因素作用下增殖并分泌一系列细胞因子,因此,胆管上皮的损伤是itbl的中心环节。
目前对肝脏冷保存 再灌注后胆管上皮的损伤及其机制研究甚少,但一些相关研究结果提供了不少研究线索,其中,血管内皮细胞(vascular endothelial cells,vec)和微循环功能损害是不容忽视的环节。
在组织或器官缺血再灌注损伤(ischemic reperfusion injury,iri)的研究表明,vec一方面由于所处的特殊解剖位置和生理特点,其本身即成为iri的直接靶细胞,导致脏器微循环障碍,继而加重脏器的损伤;另一方面,vec可被激活,释放或表达多种生物活性物质,进一步影响微循环和损伤脏器[10]。
另外,中性粒细胞与内皮细胞表面黏附分子的相互作用,介导白细胞牢固黏附于内皮细胞上,结果导致血液流变异常,活化的白细胞产生毒性氧化代谢物导致细胞栓塞,并使微小血管通透性增加引起血管收缩,从而成为微循环损害的主要原因之一。
一氧化氮能够作用于血管平滑肌,使血管扩张。
此外,它尚能通过某种机制抑制体内p 选择蛋白和icam 1这两种黏附因子的表达,从而减轻白细胞黏附反应,保护内皮细胞的完整性,减轻组织器官的损伤,同时也起到了维持血流通畅的作用。
因此,移植肝复流的同时,给予一氧化氮,可能对移植肝胆管微循环障碍具有保护作用。