高考氧化还原反应考点汇总(下)
- 格式:pdf
- 大小:360.22 KB
- 文档页数:4

高中化学氧化还原反应知识点1、根据氧化还原反应方程式化合价降低,得电子,被还原氧化剂 + 还原剂 == 还原成产物 + 水解产物化合价升高,失电子,被氧化在同一水解还原成反应中,水解性:氧化剂>水解产物还原性:还原剂>还原成产物氧化剂的氧化性越强,则其对应的还原产物的还原性就越弱;还原剂的还原性越强,则其对应的氧化产物的氧化性就越弱。
基准:2cl2+2nabr===2nacl+br22、根据金属活动性顺序表在金属活动性顺序表,金属的边线越依靠前,其还原性就越弱(铂金除外);金属的边线越依靠后,其阳离子的水解性就越弱。
k、ca、na、mg、al、zn、fe、sn、pb、(h)、cu、hg、ag、pt、au3、根据元素周期表同周期元素,随着核电荷数的递增,其单质氧化性逐渐增强,还原性逐渐减弱。
同主族元素,随着核电荷数的递增,其单质氧化性逐渐减弱,还原性逐渐增强。
对于氧化剂来说,同族元素的非金属原子,它们的最为外层电子数相同而电子层数不同时,电子层数越多,原子半径越大,就越难得电子。
因此,它们单质的水解性就越强。
4、根据反应的难易程度水解还原成反应越难展开(整体表现为反应所须要条件越高),则氧化剂的水解性和还原剂的还原性就越弱。
(例如卤族元素和氢气反应)1、电子守恒规律:氧化剂得电子总数等于还原剂失电子总数。
例如:11p4+60cuso4+96h2o=20cu3p+24h3po4+60h2so42、既有氧化性又有还原性的物质与强还原性物质反应时表现氧化性,与强氧化性物质反应时整体表现还原性,(亚铁离子和锌、次氯酸根)在自身的水解-还原成反应中既整体表现水解性又整体表现还原性(氯气异构化)。
稀硫酸与开朗金属单质反应时,就是氧化剂,起至氧化作用的就是h,被还原成分解成h2,浓硫酸就是强氧化剂,与还原剂反应时,起至氧化作用的就是s,被还原成后通常分解成so2。
3、归属于中规律:同种元素相同价态的物质之间出现水解-还原成反应时,生成物中该元素的价态介于反应物中高价与低价之间,且不能交叉。
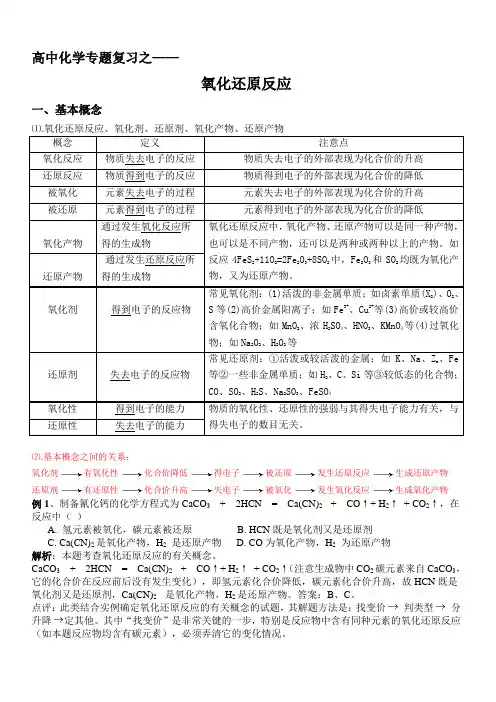
高中化学专题复习之——氧化还原反应一、基本概念⑴.氧化还原反应、氧化剂、还原剂、氧化产物、还原产物概念定义注意点氧化反应物质失去电子的反应物质失去电子的外部表现为化合价的升高还原反应物质得到电子的反应物质得到电子的外部表现为化合价的降低被氧化元素失去电子的过程元素失去电子的外部表现为化合价的升高被还原元素得到电子的过程元素得到电子的外部表现为化合价的降低氧化产物通过发生氧化反应所得的生成物氧化还原反应中,氧化产物、还原产物可以是同一种产物,也可以是不同产物,还可以是两种或两种以上的产物。
如反应4FeS2+11O2=2Fe2O3+8SO2中,Fe2O3和SO2均既为氧化产物,又为还原产物。
还原产物通过发生还原反应所得的生成物氧化剂得到电子的反应物常见氧化剂:(1)活泼的非金属单质;如卤素单质(X2)、O2、S等(2)高价金属阳离子;如Fe3+、Cu2+等(3)高价或较高价含氧化合物;如MnO2、浓H2SO4、HNO3、KMnO4等(4)过氧化物;如Na2O2、H2O2等还原剂失去电子的反应物常见还原剂:①活泼或较活泼的金属;如K、Na、Zn、Fe等②一些非金属单质;如H2、C、Si等③较低态的化合物;CO、SO2、H2S、Na2SO3、FeSO4氧化性得到电子的能力物质的氧化性、还原性的强弱与其得失电子能力有关,与得失电子的数目无关。
还原性失去电子的能力⑵.基本概念之间的关系:氧化剂有氧化性化合价降低得电子被还原发生还原反应生成还原产物还原剂有还原性化合价升高失电子被氧化发生氧化反应生成氧化产物例1、制备氰化钙的化学方程式为CaCO3+ 2HCN = Ca(CN)2 + CO↑+ H2↑+ CO2↑,在反应中()A. 氢元素被氧化,碳元素被还原B. HCN既是氧化剂又是还原剂C. Ca(CN)2是氧化产物,H2是还原产物D. CO为氧化产物,H2为还原产物解析:本题考查氧化还原反应的有关概念。
CaCO3+ 2HCN = Ca(CN)2 + CO↑+ H2↑+ CO2↑(注意生成物中CO2碳元素来自CaCO3,它的化合价在反应前后没有发生变化),即氢元素化合价降低,碳元素化合价升高,故HCN既是氧化剂又是还原剂,Ca(CN)2 是氧化产物,H2是还原产物。

化学复习专题 氧化还原反应考点1:氧化还原反应的基本概念1.结合实例理解氧化还原反应的相关概念实例:在Fe 2O 3+3CO=====高温2Fe +3CO 2的反应中 是氧化剂, 是还原剂; 元素被氧化, 元素被还原;Fe 2O 3具有氧化性,CO 具有还原性; 是氧化产物, 是还原产物。
2.归纳总结氧化还原反应的概念(1)氧化还原反应的特征及本质①特征:有元素的化合价变化 ②本质:有电子的转移(得失或偏移)(2)氧化剂:在氧化还原反应中得到电子(或电子对偏向)的反应物(即所含元素的化合价降低)(3)还原剂:在氧化还原反应中失去电子(或电子对偏离)的反应物(即所含元素的化合价升高)(4)还原产物:氧化剂得到电子后生成的对应产物。
(5)氧化产物:还原剂失去电子后生成的对应产物。
3.基于双线桥理解氧化还原反应的概念之间的关系:概括为升失氧、降得还,剂性一致、其他相反4. 四种基本反应类型和氧化还原反应的关系可用下图表示:题组训练:1.三氟化氮(NF 3)是微电子工业中一种优良的等离子刻蚀气体,它在潮湿的环境中能发生反应:3NF 3+5H 2O===2NO +HNO 3+9HF ,下列有关该反应的说法正确的是( )A .NF 3是氧化剂,H 2O 是还原剂B .HF 是还原产物C .还原剂和氧化剂的物质的量之比是2∶1D .NF 3在潮湿的空气中泄漏会产生红棕色气体2.被称为万能还原剂的NaBH 4溶于水并和水反应:NaBH 4+2H 2O===NaBO 2+4H 2↑,下列说法中正确的是(NaBH 4中H 为-1价)( )A .NaBH 4既是氧化剂又是还原剂B .NaBH 4是氧化剂,H 2O 是还原剂C .硼元素被氧化,氢元素被还原D .被氧化的元素与被还原的元素质量之比为1∶13.ClO 2是一种杀菌消毒效率高、二次污染小的水处理剂。
实验室中可通过以下反应制得:2KClO 3+H 2C 2O 4+H 2SO 4=====△2ClO 2↑+K 2SO 4+2CO 2↑+2H 2O 。

高考氧化还原反应的常考点一、氧化还原反应的基本概念氧化还原反应是指在化学反应中,物质所含的电子数发生变化的反应。
通常,一个物质失去电子的过程称为氧化反应,而得到电子的过程则称为还原反应。
二、氧化数的表示方法氧化数是一个描述原子或分子电子分布的数值,常用来表示原子或分子的氧化状态。
在化合物中,正负化合价之和为零,单质化合价为零。
三、常见氧化还原反应类型及其实例1.置换反应:一种单质替代另一种单质的反应,如铁与稀硫酸反应生成硫酸亚铁和氢气。
2.分解反应:一种化合物分解成两种或多种单质的反应,如水分解为氢气和氧气。
3.歧化反应:一种物质中的同一种元素发生氧化和还原反应,如氯气与水反应生成盐酸和次氯酸。
4.归中反应:一种物质中的元素从高价变为低价或从低价变为高价的反应,如硫在氧气中燃烧生成二氧化硫。
四、氧化还原反应中的电子转移数计算在氧化还原反应中,电子转移数的计算是重要的考点。
电子转移数等于化合价变化数乘以参与反应的原子个数。
五、氧化还原反应在生活和工业领域的应用案例分析1.工业制硫酸:利用二氧化硫、氧气和水在高温下反应生成硫酸。
2.汽车尾气处理:汽车尾气中的一氧化碳和氮氧化物通过催化转化器转化为二氧化碳和水。
3.金属的冶炼:金属可以通过氧化还原反应从其化合物中被还原出来,如铁的冶炼。
六、歧化与归中反应特点及实例分析1.歧化反应:一种物质中的同一种元素发生氧化和还原反应,如氯气与水反应生成盐酸和次氯酸。
特点是在一个分子内部发生氧化还原反应。
2.归中反应:一种物质中的元素从高价变为低价或从低价变为高价的反应,如硫在氧气中燃烧生成二氧化硫。
特点是电子转移发生在同一元素之间。
七、酸碱条件对氧化还原反应的影响酸碱条件可以影响氧化还原反应的方向和速率。
在酸性条件下,氧化剂的氧化性通常增强,还原剂的还原性减弱;在碱性条件下则相反。
此外,酸碱条件还可能影响中间产物和最终产物的生成。
八、配平技巧和策略在配平氧化还原反应时,可以采用多种技巧和策略,如化合价升降守恒法、电子得失守恒法等。

考点05 氧化还原反应(好题冲关)【基础过关】1.下列过程属于化学反应,且与氧化还原反应无关..的是( )A.石灰纯碱法除水垢B.补铁口服液中添加维生素C.工业上原油的分馏D.生活中用“暖宝宝”取暖2.下列物质的应用涉及氧化还原反应的是( )A.利用氢氟酸刻蚀玻璃B.利用活性炭由红糖制备白糖C.煅烧石灰石制备生石灰D.应用漂白粉对环境进行消杀3.(2023·湖南省高三联考)《本草纲目》中记载:“(火药)乃焰硝(KNO3)、硫黄、杉木炭所合,以为烽燧铳机诸药者。
”火药燃烧爆炸时发生的反应为S+2KNO3+3C K2S+N2↑+3CO2↑。
下列有关说法错误的是( )A.氧化产物与还原产物的物质的量之比为3:2B.反应每转移6mol电子,则能生成11.2LN2C.该反应过程有极性键、非极性键和离子键的形成D.该反应中分别被S和硝酸钾氧化的碳原子数之比为1:54.(2023·天津高三模拟)汽车剧烈碰撞时,安全气囊中发生反应10NaN3+2KNO3=K2O+5Na2O+16N2↑。
若氧化产物比还原产物多1.75mol,则下列判断正确的是( )A.生成42.0LN2(标准状况)B.有0.25molKNO3被氧化C.转移电子的物质的量为1.25mol D.被还原的N原子的物质的量为3.75mol5.ClO-可用于处理含CN-的废水,处理过程中体系存在ClO-、CN-、N2、Cl-、HCO3-、H2O六种物质。
下列有关说法正确的是( )A.ClO-是氧化剂,N2是氧化产物之一B.反应配平后氧化剂与还原剂的化学计量数之比为3:2C.若生成标准状况下2.24 L N2,则转移电子0.2 molD.含CN-的废水也可用Cr2O72-处理6.将SO2气体不断通人Fe2(SO4)3溶液中,溶液颜色逐渐变浅,最后至浅绿色,然后往溶液中滴加K2Cr2O7溶液,溶液又变成棕黄色(还原产物为Cr3+),则下列有关说法错误的是( )A.氧化性:Cr2O72->Fe3+>SO2B.标准状况下,若有6.72LSO2参加反应,则最终能消耗0.1molK2Cr2O7C.通入SO2时反应的离子方程式为:SO2+2Fe3++2H2O= SO42-+2Fe2++4H+D.随着上述操作的进行,溶液的酸性越来越强7.向CuSO4溶液中逐滴加入KI溶液至过量,观察到产生白色沉淀CuI,溶液变为棕色。

高中化学中的氧化还原反应知识点总结!一、氧化还原反应的基本概念1.氧化还原反应的本质:有电子转移(得失)氧化还原反应概念图2.氧化还原反应的特征:元素化合价的变化应用:在化学方程式中标出各物质组成元素的化合价,只要有一种元素的化合价发生了变化,即可说明该反应是氧化还原反应。
口诀:升失氧氧还原剂,降得还还氧化剂(化合价上升,失电子,发生氧化反应,被氧化得到氧化产物,在反应中做还原剂;化合价下降,得电子,发生还原反应,被还原得到还原产物,在反应中做氧化剂)。
3.化学反应的分类我们把化学反应按是否发生电子转移分成两大类:氧化还原反应和非氧化还原反应。
下面我们来介绍氧化还原反应与四种基本反应类型的关系:①置换反应置换反应是单质与化合物反应生成新单质和新化合物,该过程一定伴随着电子得失,故一定是氧化还原反应。
如我们熟悉的Fe + CuSO4 == FeSO4 + Cu,铁失2个电子生成亚铁离子,同时,铜离子得两个电子生成铜单质。
②复分解反应与置换反应性质完全相反地,复分解反应是两种化合物互相交换成分,并不存在电子转移,故一定不是氧化还原反应。
如HCl + NaOH == NaCl + H2O.③化合反应和分解反应而化合反应和分解反应既可能是氧化还原反应,如:C + O2 =点燃= CO2;2H2O2 =(MnO2)= 2H2O + O2↑;又可能是非氧化还原反应,如:CaO + H2O == Ca(OH)2;2NaHCO3=△= Na2CO3 + H2O + CO2↑.④当然,我们可以将上述关系用Venn图表示:氧化还原反应与四种基本反应关系图4.有关氧化还原的判断①判断氧化性和还原性I. 元素处于最高价态时,只有氧化性;II. 元素处于最低价态时,只有还原性;•特殊地,金属的最低价态为0价,没有负价,故金属单质只有还原性;III.元素处于中间价态时,既有氧化性又有还原性。
②判断氧化剂和还原剂I. 常见的氧化剂及其对应的还原产物i. 活泼非金属单质• X2 → X-(X表示F、Cl、Br、I等卤素)•O2→O2- / OH- / H2Oii. 具有处于高价态元素的化合物•MnO2→ M n2+•H2SO4→ SO2 / S•HNO3→ NO / NO2•KMnO4(酸性条件) → M n2+•FeCl3→ F e2+ / Feiii.其他•H2O2→ H2OII. 常见的还原剂及其对应的氧化产物i. 活泼的金属单质•Na → Na+•Al → A l3+ii. 活泼的非金属单质•H2→ H2O•C → CO / CO2iii.具有处于低价态元素的化合物•CO → CO2•SO2→ SO3 / SO42-•H2S → S / SO2•HI → I2•Na2SO3→ SO42-•FeCl2→ Fe3+III.特殊情况i. 在氧化还原反应中,氧化剂和还原剂可能是同一种物质,氧化产物和还原产物也可能是同一种物质,如歧化反应和部分归中反应。
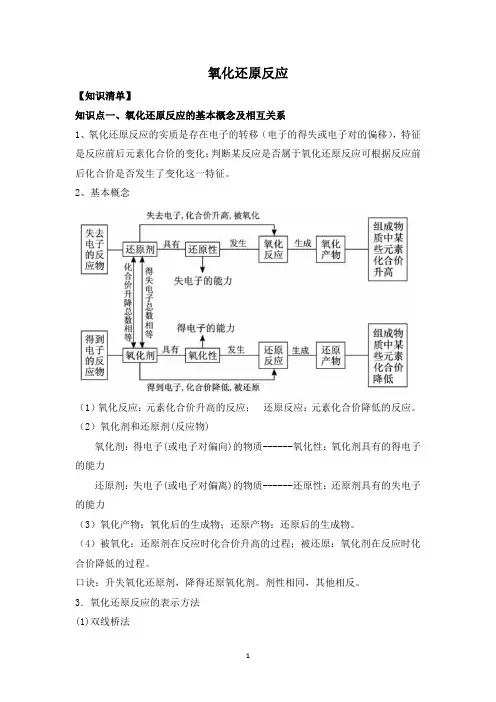
氧化还原反应【知识清单】知识点一、氧化还原反应的基本概念及相互关系1、氧化还原反应的实质是存在电子的转移(电子的得失或电子对的偏移),特征是反应前后元素化合价的变化;判断某反应是否属于氧化还原反应可根据反应前后化合价是否发生了变化这一特征。
2、基本概念(1)氧化反应:元素化合价升高的反应;还原反应:元素化合价降低的反应。
(2)氧化剂和还原剂(反应物)氧化剂:得电子(或电子对偏向)的物质------氧化性:氧化剂具有的得电子的能力还原剂:失电子(或电子对偏离)的物质------还原性:还原剂具有的失电子的能力(3)氧化产物:氧化后的生成物;还原产物:还原后的生成物。
(4)被氧化:还原剂在反应时化合价升高的过程;被还原:氧化剂在反应时化合价降低的过程。
口诀:升失氧化还原剂,降得还原氧化剂。
剂性相同,其他相反。
3.氧化还原反应的表示方法(1)双线桥法箭头必须由反应物指向生成物,且两端对准同种元素。
箭头方向不代表电子转移方向,仅表示电子转移前后的变化。
在“桥”上标明电子的“得到”与“失去”,且得失电子总数应相等。
如:(2)单线桥法箭头必须由还原剂中失电子的元素指向氧化剂中得电子的元素。
箭头方向表示电子转移的方向。
在“桥”上标明转移的电子总数。
4.氧化还原反应与四种基本反应类型的关系(1)有单质参加的化合反应一定是氧化还原反应;(2)有单质生成的分解反应一定是氧化还原反应;(3)置换反应一定是氧化还原反应;(4)复分解反应一定不是氧化还原反应。
知识点二、常见的氧化剂和还原剂(1)常见的氧化剂:①活泼的非金属单质:F2、O2、O3、Cl2等;②含有高价态元素的化合物:HNO3、KMnO4、K2Cr2O7、浓H2SO4等;③某些金属元素的高价态离子:Fe3+、Cu2+等;④其它:H2O2、Na2O2、HClO等。
(2)常见的还原剂:①活泼的金属单质:K、Na、Fe、Mg等;②含有低价态元素的化合物:H2S、HI、CO2、SO2、H2SO3等;③某些非金属单质:H2、C等。

氧化还原反应知识点①、氧化反应:元素化合价升高的反应还原反应:元素化合价降低的反应氧化还原反应:凡有元素化合价升降的化学反应就是②、氧化还原反应的判断依据-----有元素化合价变化失电子总数= 化合价升高总数= 得电子总数= 化合价降低总数。
③、氧化还原反应的实质------电子的转移(电子的得失或共用电子对的偏移口诀:失.电子,化合价升.高,被氧.化(氧化反应),还原剂;得.电子,化合价降.低,被还.原(还原反应),氧化剂;④、氧化剂和还原剂(反应物)氧化剂:得电子(或电子对偏向)的物质------氧化性还原剂:失电子(或电子对偏离)的物质------还原性氧化产物:氧化后的生成物还原产物:还原后的生成物。
氧化剂+⑥、判断氧化剂或还原剂强弱的依据i. 根据方程式判断氧化性:氧化剂>氧化产物还原性:还原剂>还原产物ii.根据反应条件判断当不同氧化剂作用于同一还原剂时,如氧化产物价态相同,可根据反应条件的难易来进行判断,如:4HCl(浓)+MnO2 MnCl2+2H2O+Cl2↑16HCl(浓)+2KMnO4=2KCl+2MnCl2+8H2O+5Cl2↑易知氧化性:KMnO4>MnO2。
iii. 由氧化产物的价态高价来判断当含变价元素的还原剂在相似的条件下作用于不同的氧化剂时,可由氧化产物相关元素价态的高低来判断氧化剂氧化性的强弱。
如:2Fe+3Cl2 2FeCl3 Fe+S FeS 可知氧化性:Cl2>S。
化合价降低,得电子,被还原化合价升高,失电子,被氧化练习一一、单项选择题1.下面有关氧化还原反应的叙述正确的是 ( )A.在反应中不一定所有元素的化合价都发生变化B.肯定有一种元素被氧化,另一种元素被还原C.非金属单质在反应中只作氧化剂D.金属原子失电子越多,其还原性越强2.下列自然、生活中的事例不属于氧化还原反应的是()A.动物呼吸B.植物光合作用C.金属生锈D.石膏点制豆腐3.氢化钙可以作为生氢剂(其中CaH2中氢元素为-1价),反应方程式如下:CaH2+2H2O=Ca(OH)2+2H2↑,其中水的作用是()A.既不是氧化剂也不是还原剂B.是氧化剂C.是还原剂D.既是氧化剂又是还原剂4.已知硫酸铅难溶于水,也难溶于硝酸,却可溶于醋酸铵溶液中,形成无色的溶液,其化学方程式是:PbSO4+2NH4Ac =Pb(Ac)2+(NH4)2SO4。


高中化学知识点总结氧化还原反应高中化学知识点总结——氧化还原反应氧化还原反应是化学反应中最重要的一类反应,也是高中化学中的重要知识点之一。
本文将对氧化还原反应进行总结,包括氧化还原反应的定义、氧化还原反应的特征、氧化还原反应的基本理论和氧化还原反应的应用。
一、氧化还原反应的定义氧化还原反应又称为电子转移反应,是指化学反应过程中原子、离子或分子之间电子的转移。
在氧化还原反应中,有一种物质失去或获得电子,称为氧化剂和还原剂。
氧化是指物质失去电子,还原是指物质获得电子。
氧化还原反应可以用化学方程式来表示,其中氧化剂和还原剂以及其产品都要写出来,并标记出在反应中的电子转移过程。
二、氧化还原反应的特征1. 电子转移:氧化还原反应中,发生反应的物质之间发生电子的转移,其中一种物质被氧化失去电子,另一种物质被还原获得电子。
2. 氧化剂和还原剂:在氧化还原反应中,发生氧化反应的物质被称为还原剂,因为它使其他物质还原;发生还原反应的物质被称为氧化剂,因为它使其他物质氧化。
3. 氧化数变化:在氧化还原反应中,物质的氧化数会发生变化。
氧化数是指一个原子在化合物中的电荷数,是衡量氧化程度的指标。
在氧化反应中,氧化剂会使物质的氧化数增加,而还原剂会使物质的氧化数减少。
三、氧化还原反应的基本理论1. 氧化反应和还原反应:氧化还原反应可以分为氧化反应和还原反应。
氧化反应是指物质失去电子的过程,还原反应是指物质获得电子的过程。
2. 氧化还原反应的电子守恒定律:在氧化还原反应中,氧化剂和还原剂之间的电子转移必须是电子的守恒,即总得失电子数等于总得到电子数。
3. 氧化还原反应的质子守恒定律:在氧化还原反应中,质子也必须守恒,即总失去质子数等于总得到质子数。
四、氧化还原反应的应用氧化还原反应在生活中和工业生产中有着广泛的应用,下面列举几个常见的应用场景:1. 腐蚀:金属遭受氧化反应与环境中的氧气发生作用,形成氧化物,导致金属腐蚀。
2. 防锈处理:利用还原剂将金属表面的氧化物还原为金属,形成保护层,起到防止金属进一步氧化的作用,从而防止锈蚀。

氧化还原反应知识点归纳一、基本概念1、定义:特征或外在表现:本质:2、5组概念①氧化剂:得电子(或电子对偏向)的物质;还原剂:失电子(或电子对偏离)的物质。
②氧化反应:元素化合价升高的反应;还原反应:元素化合价降低的反应。
③氧化性:氧化剂具有的得电子的能力;还原性:还原剂具有的失电子的能力。
④氧化产物:还原剂被氧化后的对应的生成物;还原产物:氧化剂被还原后对应的生成物。
⑤被氧化:还原剂在反应时化合价升高的过程;被还原:氧化剂在反应时化合价降低的过程。
口诀:氧化剂,降得还。
什么剂,什么性。
什么产物,什么性。
3、氧化还原反应与四大基本反应类型的关系——图示①有单质参与的反应一定是氧化还原反应。
②有单质参与的化合或分解反应一定是氧化还原反应。
③无单质参与的化合反应一定不是氧化还原反应。
④氧化剂和还原剂可以是同一种物质。
⑤氧化产物和还原产物可以是同一种物质。
4、常见氧化剂①非金属性较强的单质:F2、Cl2、Br2、I2、O3、O2等②变价元素中高价态化合物:KClO3、KMnO4、Fe3+盐、K2Cr2O7、浓H2SO4、HNO3、K2FeO4、Ag+、Cu2+等③其它HClO、MnO2、Na2O2、H2O2、NO2、CO2、银氨溶液、新制氢氧化铜等5、常见还原剂①金属性较强的单质K、Na、Mg、Al、Fe、Zn②某些非金属单质:H2、C、Si等③变价元素中某些低价态化合物:H2S、HBr、HI、Fe2+及碱和盐、CO、SO2、Na2SO3、Na2S2O3等二、单双线桥1、在氧化还原反应中,表示同一元素反应前后电子转移情况时,分别将氧化剂与其产物、还原剂与其产物中相应的变价元素用直线连接起来,箭头从反应物指向产物,线上标出得失电子总数,称为“双线桥法”。
2、表示氧化剂和还原剂之间元素的电子转移情况时,将氧化剂中降价元素与还原剂中升价元素用直线连接起来,箭头从还原剂指向氧化剂,线上标出电子转移总数,称为“单线桥法”。
高考化学氧化还原反应知识整理高考化学氧化还原反应第一片:概述1.概念:一种物质被氧化,一种物质被还原的反应。
(注意:该处的“一种”是广义的“一种”,非就是一种,可能是多种。
有被氧化、还原的物质即可)2.特征:有化合价的改变。
3.实质:有电子的转移。
(电子的得失→形成离子键,共用电子对的偏移→形成极性共价键,统称电子转移)4.关系:⑴氧化和还原的关系:是一个反应的不同对象,相互对立,相互依存,不是两个孤立的反应。
像“买和卖”一样。
⑵和四类基本反应类型的关系:置换反应一定是氧化还原反应,复分解反应一定是非氧化还原反应,化合反应和分解反应不一定。
(注意:有单质参加或有单质生成的化学反应,不一定是氧化还原反应,如:同素异形体的转变等)⑶和有机氧化还原的关系有机的氧化是除氢或加氧,还原是除氧或加氢,若从化合价(氧化数)的改变看,和无机的氧化还原反应是一致的。
⑷几个重要概念间的关系化合价升高→失电子→做还原剂→表现还原性→被氧化→发生氧化反应→得氧化产物;化合价降低→得电子→做氧化剂→表现氧化性→被还原→发生还原反应→得还原产物5.表示:⑴单线桥法例:⑵双线桥法例:第二片:规律1.守恒规律参加氧化还原反应的各元素,化合价升降总数相等,即:氧化剂得电子总数等于还原剂失电子总数,即电子守恒。
2.先后规律氧化、还原性强的氧化、还原剂,优先被还原或氧化,如在FeBr2和FeI2的混合液中滴入氯水,因还原性I->Fe2+>Br-,所以,I-最先被氧化,当Fe2+部分被氧化时,溶液中肯定没有I-,Br-一定还没有被氧化。
3.价态规律:⑴某元素处于最高价时,只有氧化性;最低价时,只有还原性;中间价态时,既有氧化性又有还原性。
(注意:非价态愈高氧化性愈强,价态愈低还原性愈强)。
⑵不同物质的同种元素,处于不同价态时,生成物往中间价态靠拢(注意只靠近,不交叉。
也有叫归中规律的)如:H2S+H2SO4(浓)=S+SO2+H2O,氧化产物是S,还原产物是SO2。
全国高考化学氧化还原反应的综合高考真题分类汇总及答案解析一、高中化学氧化还原反应1.2ClO 是一种优良的消毒剂,浓度过高时易发生分解,为了运输和贮存便利常将其制成2NaClO 固体,模拟工业上用过氧化氢法制备2NaClO 固体的实验装置如图所示。
已知:2ClO 熔点-59℃、沸点11℃、22H O 沸点150℃A 中的化学方程式:32224222422NaClO H O H SO 2ClO O Na SO 2H O ++=↑+↑++(1)3NaClO 放入仪器A 中,仪器B 中的药品是__________(写化学式)。
如果仪器B 改成分液漏斗,实验过程中可能会出现的实验现象__________。
(2)C 装置有明显缺陷,请绘出合理的装置图(标明气流方向)__________。
(3)向A 装置中通入空气,其作用是赶出2ClO ,然后通过C 再到D 中反应。
通空气不能过快的原因是__________,通空气也不能过慢原因是__________。
(4)冰水浴冷却的目的是__________。
a.降低2NaClO 的溶解度b.减少22H O 的分解c.使2ClO 变为液态d.加快反应速率(5)写出D 中发生反应的化学方程式__________,22H O 在反应起到__________作用。
假设在反应中消耗掉22H O a g 则有__________mol 电子转移。
【答案】H 2O 2 液体无法顺利滴落 空气流速快时,2ClO 不能被充分吸收 空气流速过慢时,2ClO 不能及时被移走,浓度过高导致分解 abc2ClO 2+H 2O 2+2NaOH=2NaClO 2+O 2↑+2H 2O 还原剂 a/17【解析】【分析】氯酸钠(NaClO 3)在酸性条件下与过氧化氢生二氧化氯,ClO 2与氢氧化钠溶液和过氧化氢发生氧化还原反应生成NaClO 2,NaClO 2的溶解度随温度升高而增大,通过冷却结晶,过滤洗涤得到晶体NaClO 2•3H 2O 。
易错类型04氧化还原反应【易错点01】不能正确辨析氧化还原反应有关概念【易错点02】不能正确判断物质氧化性或还原性强弱【易错点03】不能利用氧化还原反应规律判断反应能否进行【易错点04】不能利用氧化还原反应规律判断反应物的反应顺序【易错点05】不能正确书写陌生的氧化还原反应方程式【易错点06】不能利用守恒律进行氧化还原反应综合判断与计算易错点1不能正确辨析氧化还原反应有关概念【分析】1.理清两条概念线索2.三步解答氧化还原反应概念的相关题目:易错点2不能正确判断物质氧化性或还原性强弱【分析】物质的氧化性(或还原性)的强弱与得失电子的难易程度有关,与得失电子的数目无关,但外界因素(如反应条件、反应物浓度、酸碱性等)也影响物质的氧化性(或还原性)。
例如,NO-3在酸性条件下具有强氧化性,但在中性或碱性条件几乎不表现氧化性。
易错点3不能利用氧化还原反应规律判断反应能否进行【分析】含不同价态同种元素的物质间发生氧化还原反应时,该元素价态的变化一定遵循“高价+低价→中间价”,而不会出现交叉现象。
简记为“两相靠,不相交”。
例如,不同价态硫之间可以发生氧化还原反应的是①②③④。
注:⑤中不会出现H2S转化为SO2而H2SO4转化为S的情况。
易错点4不能利用氧化还原反应规律判断反应物的反应顺序【分析】1.难易律(1)内容:越易失电子的物质,失去电子后就越难得电子,越易得电子的物质,得到后就越难失电子,一种氧化剂同时和几种还原剂相遇时,还原性最强的优先发生反应;同理,一种还原剂同时和几种氧化剂相遇时,氧化性最强的优先发生反应。
可把常见微粒的氧化性、还原性按强弱以位置前后的形式排列:(2)应用:①判断物质的稳定性;②判断物质反应的先后顺序,即左上方的一种氧化剂可氧化它右下方的还原性微粒.若有多种,则优先氧化较右下方的微粒;③选择合适的氧化剂或还原剂,如要氧化Fe2+而Br-不被氧化,则可选择Br2;④判断氧化性微粒、还原性微粒能否共成。
氧化还原反应的知识点总结1、定义氧化还原反应: 氧化剂:(常见 F 2、Cl 2、Br 2、I 2、O 2、O 3 HNO 3 MnO 4― Fe 3+ 过氧化物(H 2O 2、Na 2O 2) HClO)氧化剂强弱:MnO 4-(H +)>HClO>Cl 2>浓硝酸>Br 2>稀硝酸>Fe 3+>I 2还原剂:金属单质 S 2- 、SO 2、SO 32- Fe 2+ I -还原剂强弱 S 2- >SO 32- > I - >Fe 2+即时练习:对于反应IBr + H2O === HBr + HIO 的说法正确的是 ( )A . IBr 只做氧化剂B .IBr 只做还原剂C . IBr 既是氧化剂又是还原剂D .IBr 既不是是氧化剂又不是还原剂 2、基本概念之间的关系:氧化剂有氧化性化合价降低得电子被还原发生还原反应生成还原产物 还原剂有还原性化合价升高失电子被氧化发生氧化反应生成氧化产物例:1、16HCl(浓) + 2KMnO 4 = 2KCl + 2MnCl 2 + 8H 2O +5Cl 2中的氧化剂与还原剂,氧化产物和还原产物,什么物质被氧化和被还原2、在氧化还原反应:中,被氧化与被还原的硫原子数比是( ) A .1∶2B .2∶1C .1∶1.3∶23、反应原则氧化性——氧化剂>氧化产物 还原性——还原剂>还原产物练习:根据下列反应方程式,判断指定的四种物质的氧化性由强到弱的顺序正确的是( )(1)Cl 2+2KI =2KCl +I 2(2)2FeCl 2+Cl 2=2FeCl 3(3)2FeCl 3+2HI =2FeCl 2+2HCl +I 2 (4)H 2S +I 2=2HI +S A .S >I 2>Fe 3+>Cl 2 B .Cl 2>Fe 3+>I 2>S C .Fe 3+>Cl 2>S >I 2 D .Cl 2>I 2>Fe 3+>S 下列反应中,能说明氯的氧化性比硫强的反应是( )A .HCl 2CuS S H CuCl22+↓==+B .C .S HCl 2S H Cl 22+==+D .334242FeCl2)SO (Fe 2FeSO6Cl 3+=+O H 3S K 2SO K KOH 6S 32232++=+ H 2S NaCl 2 S Na 2HCl 2 + == +4、几种特殊氧化还原反应歧化反应 2KMnO 4 = K 2MnO 4 + MnO 2 + O 2↑ 归中反应: 2H 2S + SO 2 = 3S ↓ +2 H 2O自身氧化还原反应: 2KClO 3 = 2KCl + 3O 2↑例:下列反应中,氧化与还原在同一元素中进行的是( )A .O H NaClO NaCl NaOH 2Cl 22++=+B .Fe+CuSO 4=FeSO 4+CuC .D .已知氧化还原反应:2Cu(IO 3)2+24KI+12H 2SO 4=2CuI ↓+13I 2+12K 2SO 4+12H 2O 其中1mol ,氧化剂在反应中得到的电子为( )A .10molB .11molC .12molD .13mol5、氧化还原电子得失分析方法:双线桥法,单线桥法例:从矿物学资料查得,在一定条件下自然界存在如下反应:14CuSO 4+ 5FeS 2+ H2O ==7Cu 2S + 5FeSO 4+ H 2SO 4,下列说法正确的是 ( ) A 、Cu 2S 既是氧化产物又是还原产物B 、5mol FeS 2发生反应,有10mol 电子转移C 、产物中的SO 4²-有一部分是氧化产物D 、FeS 2只做还原剂6 、氧化还原反应的配平(化合价不交叉原则)1、常规配平法:化合价升降总数相等 1、标变价2、求总数3、配化学计量数NH 3+ O 2NO+ H 2ONH 3+ CuO==== N 2+ Cu+ H 2OMnO 4-+H 2O 2+ H += Mn 2++ O 2十H 2OKClO 3 + HCl (浓)--- KCl + ClO 2 +Cl 2↑+ H 2OFeS+H 2SO 4(浓) ==== Fe 2(SO 4)3+S+SO 2+H 2OH 2C 2O 4+ KMnO 4+ H 2SO 4−→− K 2SO 4+ MnSO 4+ CO 2↑+ H 2O2、最小公倍数法 (配平关键是找出前后出现“个数”最多的原子)Al+ Fe 3O 4 ==== Al 2O 3+ FeNH 3+ O 2NO+H 2O3、原子个数守恒法(待定系数法)(方程式甚为复杂,不妨用原子个数守恒法)KMnO 4+ FeS+ H 2SO 4-- K 2SO 4+ MnSO 4+ Fe 2(SO 4)3+ S+ H 2OH 2C 2O 4+ KMnO 4+ H 2SO 4−→−K 2SO 4+ MnSO 4+ CO 2↑+ H 2O4、观察法(出现次数少的元素原子数先配平)Fe3O4+CO ==== Fe+CO2P4+P2I4+H2O === PH4I+H3PO4注歧化反应的配平1、将反应物写两遍2、逆向配平Cl2 + NaOH NaCl + NaClO3 + H2O练习1、下列对反应NO2+H2O===HNO3+NO的说法中正确的是()A.氧化剂与还原剂的质量比为1∶2B.氧化产物与还原产物的物质的量之比为1∶2C.NO2是氧化剂,H2O是还原剂D.若有6 mol NO2参与反应时,有3 mol电子发生转移2、在Cu+HNO3(稀)=Cu(NO3)2+NO↑+H2O反应中,若有64gCu被氧化,则被还原的HNO3的质量是()A.168g B.42g C.126g D.60g3、在H2S+SO2=S+H2O的反应中,还原产物和氧化产物的质量比是()A.1∶1 B.2∶1 C.1∶2 D.2∶34、下列叙述正确的是()A.元素的单质可由氧化或还原含该元素的化合物来制得.B.得电子越多的氧化剂,其氧化性就越强.C.阳离子只能得电子被还原,只能作氧化剂.D.含有最高价元素的化合物不一定具有强氧化性.5、在氧化还原反应S+KOH=K2SO3+K2S+H2O中,被氧化与被还原的硫原子数之比为()A.1 :1 B.2 :1 C.1 :2 D.3 :26、若(NH4)2SO4在强热时分解的产物是SO2、N2、NH3和H2O,则该反应中化合价发生变化和未发生变化的N原子数之比为()A.1∶4 B.1∶2 C.2∶1 D.4∶17、(1)请将5种物质:N2O、FeSO4、Fe(NO3)3、HNO3和Fe2(SO4)3分别填入下面对应的横线上,组成一个未配平的化学方程式。
考点05 氧化还原反应(核心考点精讲)一、3年真题考点分布二、命题规律及备考策略【命题规律】从近三年高考试题来看,氧化还原反应除浙江选考卷外,一般不单独考查,而是与其它模块知识融合进行综合考查,如选择题中与阿伏加德逻常数结合考查电子转移数目,以化学实验为载体,考查氧化还反应相关概念和规律;非选择题一般在无机推断或化工流程题中考查信息型化学反应方程式的书写,在综合实验题中考查氧化还原反应的相关计算。
【备考策略】复习时选择题中要关注氧化还原反应与N A、化学实验等常见角度的融合,理解核心概念;填空题中要关注:①信息型化学反应方程式的书写,这是化工流程题和原理综合中必考的知识点,②关注综合实验题中涉及氧化还原反应的实验原理,进而强化氧化还原反应的相关计算,尤其是得失电子守恒的应用。
【命题预测】预测2024年高考中,氧化还原反应在高考中考查形式有:(1)出现在阿伏伽德罗常数的正误判断中;(2)出现在离子共存问题中;(3)出现在离子方程式的正误判断中;(4)出现在简答题中根据信息书写化学方程式,能力要求高,难度较大。
1.氧化还原反应的本质和特征2.基于双线桥理解氧化还原反应概念之间的关系概括为“升失氧、降得还,剂性一致、其他相反”。
4.常见的氧化剂和还原剂(1)常见氧化剂及其还原产物(1)单线桥法如:(2)双线桥法如:1.常见元素的化合价可以借助化合价口诀来记忆:一价氢、钾、钠、氟、氯、溴、碘、银;二价氧、钙、钡、镁、锌;三铝、四硅、五价磷;说变价也不难,二三铁、二四碳、二四六硫都齐全;铜汞二价最常见。
2.近几年高考中一些特殊物质中元素化合价判断CuFeS2Cu+2Fe+2S-2K2FeO4Fe+6Li2NH N-3LiNH2N-3AlN N-3Na2S2O3S+2MO+2M+5C2O2-4C+3HCN C+2N-3CuH Cu+1H-1FeO n-4Fe+(8-n)Si3N4Si+4N-3请判断下列说法的正误(正确的打“√”,错误的打“×”)(1)有单质参加或有单质生成的化学反应一定是氧化还原反应()(2)金属阳离子一定只具有氧化性()(3)氧化还原反应中有一种元素被氧化时,一定有另一种元素被还原()(4)氧化还原反应中的反应物,不是氧化剂就是还原剂()(5)某元素从游离态变为化合态,该元素可能被氧化也可能被还原()(6)水做还原剂时,产物中一般有O2()(7)NO2溶于水发生氧化还原反应()(8)硝酸铜的分解产物可能是CuO、NO、NO2()(9)NaHCO3+H2===HCOONa+H2O的反应中,NaHCO3被氧化()(10)Na2O2与水的反应中,水是还原剂()(11)有单质参加的化合反应或有单质生成的分解反应一定是氧化还原反应()(12)在氧化还原反应中,还原剂失去电子的总数等于氧化剂得到电子的总数()(13)生产生活中使用的非金属单质都是通过氧化还原反应制得的()(14)在化学反应中,得电子越多的氧化剂,其氧化性就越强()答案:(1)× (2)×(3)×(4)×(5) √(6) √ (7) √(8)×(9)×(10)×(11) √(12) √(13)×(14)×例1 (2023·浙江省天域全国名校协作体高三联考)火箭推进发生反应的化学方程式为:C2N2H8+2N2O4=2CO2↑+3N2↑+4H2O (偏二甲肼中C、N元素的化合价相等)。
三、氧化还原反应1、准确理解氧化还原反应的概念1.1 氧化还原反应各概念之间的关系(1)反应类型:氧化反应:物质所含元素化合价升高的反应。
还原反应:物质所含元素化合价降低的反应。
氧化还原反应:有元素化合价升高和降低的反应。
(2)反应物:氧化剂:在反应中得到电子的物质还原剂:在反应中失去电子的物质(3)产物:氧化产物:失电子被氧化后得到的产物还原产物:得电子被还原后得到的产物(4)物质性质:氧化性:氧化剂所表现出得电子的性质还原性:还原剂所表现出失电子的性质(5)各个概念之间的关系如下图例题1:下列变化过程属于还原反应的是( D )A.HCl→MgCl2B.Na→Na+C.CO→CO2D. Fe3+→Fe例题2:下列化学反应不属于氧化还原反应的是( C )A、3Cl2 + 6KOH =5KCl + KClO3 + 3H2OB、2NO2 + 2NaOH =NaNO3 +NaNO2 +H2OC、SnCl4 + 2H2O = SnO2 + 4HClD、3CCl4 + 2K2Cr2O7 = 2CrO2Cl2 + 3COCl2 +2KCl1.2 常见的氧化剂与还原剂(1)物质在反应中是作为氧化剂还是作为还原剂,主要取决于元素的化合价。
①元素处于最高价时,它的原子只能得到电子,因此该元素只能作氧化剂,如+7价的Mn和+6价的S②元素处于中间价态时,它的原子随反应条件不同,既能得电子,又能失电子,因此该元素既能作氧化剂,又能作还原剂,如0价的S和+4价的S③元素处于最低价时,它的原子则只能失去电子,因此该元素只能作还原剂,如-2价的S(2)重要的氧化剂①活泼非金属单质,如F2、Cl2、Br2、O2等。
②元素处于高价时的氧化物、高价含氧酸及高价含氧化酸盐等,如MnO2,NO2;浓H2SO4,HNO3;KMnO4,KClO3,FeCl3等。
③过氧化物,如Na2O2,H2O2等。
(3)重要的还原剂①金属单质,如Na,K,Zn,Fe等。