PH试纸原理
- 格式:doc
- 大小:38.00 KB
- 文档页数:3

PH试纸的⽤法 pH试纸遇到酸碱性强弱不同的溶液时,显⽰不同的颜⾊,可与标准⽐⾊卡对照确定溶液的pH值,它可以粗略地检验溶液酸碱性的强弱。
那么,pH试纸怎么⽤呢?让店铺来告诉你吧! ⼀、pH试纸的使⽤⽅法 1、打开pH试纸包装盒,会发现⾥⾯含有pH试纸颜⾊⽐对卡和pH试纸两部分。
2、取出试纸后,应将盛放试纸的容器盖严,以免被⼀些⽓体玷污。
3、⽤试纸检验⽓体的性质时,⼀般先把试纸⽤蒸馏⽔润湿,粘在玻璃棒⼀端,⽤玻璃棒把试纸放到盛待测⽓体的容器⼝附近(不得接触溶液)。
稍等⽚刻,观察试纸是否改变颜⾊,判断⽓体性质。
4、⽤试纸检验溶液的性质时,⼀般把⼀⼩块试纸放在表⾯或玻璃⽚上,⽤沾有待测溶液的玻璃棒点在试纸的中部。
稍等⽚刻,观察是否改变颜⾊。
判断溶液性质,尤其在使⽤pH试纸时玻璃棒不仅要洁净,⽽且不得有蒸馏⽔。
5、最后均将检测结果与pH试纸颜⾊⽐对卡进⾏对⽐,以确定被检测溶液的酸碱程序。
通常情况下,pH值越⼩,则溶液酸性越强。
pH值为7时,显中性,接近于⽔的酸碱性。
pH值越⼤,则溶液碱性越强。
⼆、pH试纸原理 pH试纸上有甲基红、溴甲酚绿、百⾥酚蓝这三种指⽰剂。
甲基红、溴甲酚绿、百⾥酚蓝和酚酞⼀样,在不同pH值的溶液中均会按⼀定规律变⾊。
甲基红的变⾊范围是pH4.2(红)--6.2(黄),溴甲酚绿的变⾊范围是pH3.6(黄)--5.4(绿),百⾥酚蓝的变⾊范围是pH6.7(黄)--7.5(蓝)。
⽤定量甲基红加定量溴甲酚绿加定量百⾥酚蓝的混合指⽰剂浸渍中性⽩⾊试纸,晾⼲后制得的pH试纸可⽤于测定溶液的pH值便不难理解了。
通常pH值是⼀个介于0和14之间的数,当pH<7的时候,溶液呈酸性,当pH>7的时候,溶液呈碱性,当pH=7的时候,溶液呈中性。
三、各种试纸的⽤途 1、红⾊⽯蕊试纸遇到碱性溶液变蓝,蓝⾊⽯蕊试纸遇到酸性溶液时变红,它们可以定性地判断⽓体或溶液的酸、碱性。
2、淀粉碘化钾试纸中的碘离⼦,当遇到氧化性物质时被氧化为碘,碘遇淀粉显⽰蓝⾊,它可以定性地检验氧化性物质的存在,如氯⽓、溴蒸⽓(和它们的溶液)、N02等。

(一)多数矿泉水的pH值都不低于7.0,都呈弱碱性。
测试活动是企业的一种宣传手段,它利用了百姓对饮用水相关知识的不了解。
其实,国家对生活饮用水标准制定了106项指标,其中,有5个强制性指标,但饮用水pH值的范围并不在这5个强制性指标中。
(二)可参考:http:83.htmlPH试纸的应用是非常广泛的,PH的反应原理是基于PH指示剂法,目前,国产的一般的PH分析试纸中含有甲基红[PH4.2(红)~6.2(黄)],溴甲酚绿[PH3.6(黄)~5.4(绿)]溴百里香酚蓝[PH6.7(黄)~7.5(蓝)],这些混合的酸碱指示剂适量配合可以反映PH4.5~9.0的变异范围。
以酚酞在不同酸碱条件下变色规律为例说明PH试纸的变色原理:把酚酞滴入浓H2SO4,呈现橙色,不论振荡多长时间,其颜色都不变。
若把该橙色液配入大量水中,得无色液。
酚酞滴入稀NaOH溶液呈紫红色,将酚酞滴入浓NaOH溶液(浓度大于2mol/l),开始时浓NaOH溶液表面酚酞滴入处会出现一些紫红色、略加振荡紫红色立即消失。
其实,这是酚酞在不同的酸碱条件下,因其结构的改变而呈现4种相应的变色情况。
PH试纸上有甲基红、溴甲酚绿、百里酚蓝这三种指示剂。
甲基红、溴甲酚绿、百里酚蓝和酚酞一样,在不同PH值的溶液中均会按一定规律变色。
甲基红的变色范围是PH4.2(红)--6.2(黄),溴甲酚绿的变色范围是PH3.6(黄)--5.4(绿),百里酚蓝的变色范围是PH6.7(黄)--7.5(蓝)。
用定量甲基红加定量溴甲酚绿加定量百里酚蓝的混合指示剂浸渍中性白色试纸,晾干后制得的PH试纸可用于测定溶液的PH值便不难理解了。
一、试纸的种类及性能1.石蕊(红色、蓝色)试纸:用来定性检验气体或溶液的酸碱性。
pH<5的溶液或酸性气体能使蓝色石蕊试纸变红色;pH>8的溶液或碱性气体能使红色石蕊试纸变蓝色。
2. pH试纸:用来粗略测量溶液pH大小(或酸碱性强弱)。
pH试纸遇到酸碱性强弱不同的溶液时,显示出不同的颜色,可与标准比色卡对照确定溶液的pH值。

第1篇一、实验目的1. 了解酸碱性的基本概念及测定方法。
2. 掌握使用pH试纸和石蕊试液测定物体酸碱性的方法。
3. 分析实验结果,总结物体酸碱性的规律。
二、实验原理酸碱性是溶液中氢离子(H+)和氢氧根离子(OH-)浓度的相对大小。
pH值是衡量溶液酸碱性的一个指标,pH值越小,溶液越酸性;pH值越大,溶液越碱性。
当pH值为7时,溶液呈中性。
pH试纸是一种用于测定溶液pH值的试纸,其颜色会根据溶液的酸碱性发生变化。
石蕊试液是一种常用的酸碱指示剂,它在酸性溶液中呈红色,在碱性溶液中呈蓝色。
三、实验仪器与药品1. 仪器:pH试纸、石蕊试液、烧杯、滴管、试管、蒸馏水、待测物体(如食醋、肥皂水、雨水等)。
2. 药品:pH试纸、石蕊试液。
四、实验步骤1. 取一小块pH试纸,将其放在干燥的玻璃片上。
2. 用滴管取少量待测物体,滴在pH试纸上。
3. 观察pH试纸的颜色变化,并与标准比色卡进行对照,记录pH值。
4. 取一小块石蕊试纸,将其放在干燥的玻璃片上。
5. 用滴管取少量待测物体,滴在石蕊试纸上。
6. 观察石蕊试纸的颜色变化,记录酸碱性。
7. 重复以上步骤,对多种待测物体进行测定。
五、实验结果与分析1. 食醋:pH试纸显示pH值约为2.4,石蕊试纸呈红色,表明食醋呈酸性。
2. 肥皂水:pH试纸显示pH值约为9.5,石蕊试纸呈蓝色,表明肥皂水呈碱性。
3. 雨水:pH试纸显示pH值约为5.6,石蕊试纸呈红色,表明雨水呈酸性。
通过实验结果可以看出,食醋和雨水呈酸性,肥皂水呈碱性。
这是因为食醋和雨水中的酸性物质浓度较高,而肥皂水中的碱性物质浓度较高。
六、实验总结1. 本实验通过pH试纸和石蕊试液测定了多种物体的酸碱性,验证了酸碱性的基本概念。
2. 实验结果表明,食醋和雨水呈酸性,肥皂水呈碱性。
3. 通过本实验,掌握了使用pH试纸和石蕊试液测定物体酸碱性的方法,提高了实验技能。
七、注意事项1. 在进行实验时,应注意操作规范,避免污染试剂。

常见酸(盐酸、硫酸)和碱(氢氧化钠、氢氧化钙)的鉴别方法鉴别实验设计的要求:原理正确,思路严密,操作简单,现象明显。
一、常见酸(盐酸、硫酸)溶液的鉴别:(例1、现有两瓶失去标签的无色溶液,只知道是稀盐酸和氯化钠溶液,请设计实验将它们鉴别出来。
)常用化学方法如下:1、pH试纸:(1)原理:酸溶液的pH小于7。
(2)方案:用胶头滴管吸取(或用干燥洁净的玻璃棒蘸取)少量样品溶液滴在pH试纸上,然后与标准比色卡对比读数,若pH小于7,则样品溶液为酸性溶液。
2、酸碱指示剂:(1)原理:酸性溶液能使紫色石蕊试液变红(2)方案:取少量样品溶液于试管中,向其中加入几滴紫色石蕊试纸,若紫色石蕊试液变红,则样品为酸性溶液。
3、较活泼金属:镁、铝、铁、锌(1)原理:酸的溶液能与活泼金属反应生成盐和氢气(2)方案:取少量样品溶液于试管中,向其中加入少量锌粒,若有大量气泡产生(且溶液质量增加),则样品为酸的溶液。
4、难溶于水的碱性氧化物:氧化铜、氧化铁、氧化镁等(1)原理:酸的溶液能与碱性氧化物反应生成盐和水(酸能溶解碱性氧化物)(2)方案:取少量样品溶液于试管中,向其中加入少量氧化铜(氧化铁/氧化镁),若固体溶解且溶液变成蓝色(黄色/无色),则样品为酸的溶液。
5、难溶于水的碱:氢氧化铜、氢氧化铁、氢氧化镁(1)原理:酸能与碱发生中和反应生成盐和水(酸能溶解碱)(2)方案:取少量样品溶液于试管中,向其中加入少量氢氧化铜(氢氧化铁/氢氧化镁),若固体溶解且溶液变成蓝色(黄色/无色),则样品为酸的溶液。
6、碳酸盐:碳酸钠、碳酸钙(1)原理:酸的溶液能与碳酸盐反应产生二氧化碳、水、盐(酸能溶解碳酸盐)(2)方案:取少量样品溶液于试管中,向其中加入少量碳酸钠(碳酸钙),若产生大量气泡(且固体溶解),则样品为酸的溶液。
二、常见碱溶液(氢氧化钠、氢氧化钙)的鉴别:(例2、现有两瓶失去标签的无色溶液,只知道是氢氧化钠和氯化钠溶液,请设计实验将它们鉴别出来。

实验名称:ph大测试教学目标:1、培养归纳整理能力2、初步学习简单的化学知识3、重点:ph值实验原理:生活中的物质大多分为三大类,分别为:酸性物质、中性物质和碱性物质。
pH试纸是检验溶液酸碱度的一把“尺子”,使用时,用滴管吸取溶液滴在试纸上,再根据试纸的颜色变化与标准比色卡比对就可以知道溶液的酸碱性度,pH值越小说明物质酸性越强,pH值越大说明物质碱性越强。
实验材料:ph测试纸、滴管、清水、洗衣粉、柠檬汁、小苏打粉、柠檬酸教学过程:1、上课纪律、实验规则2、实验名称:ph大测试3、实验导入:我们今天的实验名中有一个词,测试,你们听到这个词想到的可能是考试吧,考试就是用同一个标准测试这个阶段的学习情况,那我们今天这个测试是测什么呢?没错就是测pH值,小朋友听到这个可能都不知道pH是值什么,没关系,下面就和老师一起进入今天的实验吧。
4、实验器材介绍:我们先看下我们需要准备哪些实验材料,首先是pH测试纸,滴管、小苏打粉、柠檬酸,最后我们准备一些洗衣粉、柠檬汁和清水,这就是我们今天要用的实验材料了。
5、实验过程:1、配置洗衣粉溶液、小苏打粉溶液和柠檬酸溶液各40ml2、分别滴取少量溶液于pH试纸上3、根据试纸的颜色变化与标准比色卡比对6、验证猜想:刚刚我们用pH试纸检测了洗衣粉、柠檬酸、小苏打、柠檬汁的pH值那我们可以用pH试纸检测一下的一些东西,比如果汁、醋、沐浴露等等,看看他们的pH值是多少。
7、总结实验原理:生活中的物质大多分为三大类,分别为:酸性物质、中性物质和碱性物质。
pH试纸是检验溶液酸碱度的一把“尺子”,使用时,用滴管吸取溶液滴在试纸上,再根据试纸的颜色变化与标准比色卡比对就可以知道溶液的酸碱性度,pH值越小说明物质酸性越强,pH值越大说明物质碱性越强。
8、提出概念:pH是指溶液中氢离子的总数和总物质的量的比。
在标准温度(25℃)和压力下,pH=7的水溶液为中性,pH<7的水溶液为酸性,pH>7的水溶液为碱性。

ph表原理PH表原理。
PH是指溶液的酸碱度,通常用来表示溶液中氢离子的浓度。
PH值是一个反映溶液酸碱度的指标,它的数值越小,表示溶液越酸;数值越大,表示溶液越碱;而7表示中性。
PH表是用来测定溶液酸碱度的工具,下面我们来详细了解一下PH表的原理。
PH表的原理主要是依据了溶液中氢离子的浓度和酸碱度之间的关系。
在水溶液中,水分子会发生自离解,产生氢离子(H+)和氢氧根离子(OH-)。
PH值就是通过测定溶液中氢离子的浓度来反映溶液的酸碱度的。
PH值的计算公式为PH=-lg[H+],其中[H+]表示氢离子的浓度,lg表示以10为底的对数。
通过这个公式,我们可以计算出溶液的PH值。
PH表通常是一张图表,横轴是溶液的酸碱度,纵轴是PH值,通过查表我们可以得知不同PH值对应的溶液酸碱度。
PH表上通常会标注出酸性、中性和碱性的区间,让我们更直观地了解溶液的酸碱性质。
PH表的使用非常广泛,它可以用于实验室中的化学实验,也可以用于工业生产中的酸碱度控制。
在实验室中,我们可以通过PH表来检测溶液的酸碱度,从而判断化学反应的进行情况。
在工业生产中,PH表可以用来监测废水的酸碱度,以便进行废水处理和排放。
除了PH表,我们还可以通过PH试纸或PH计来测定溶液的PH值。
PH试纸是一种简单易用的工具,通过把试纸浸湿后,再与溶液接触,根据试纸颜色的变化来判断溶液的酸碱度。
而PH计则是一种精密的仪器,可以直接测定溶液的PH值,精度更高。
总的来说,PH表是一种用来测定溶液酸碱度的工具,它的原理是基于溶液中氢离子浓度和酸碱度之间的关系。
PH表的使用范围非常广泛,不仅可以用于实验室中的化学实验,也可以用于工业生产中的酸碱度控制。
通过PH表,我们可以更加直观地了解溶液的酸碱性质,从而更好地进行实验和生产。

pH值调节技巧在化学领域中,pH值是衡量溶液酸碱程度的指标。
掌握pH值调节技巧对于许多实验室或实际应用来说至关重要。
本文将介绍一些常见的pH值调节技巧,帮助读者在需要时能够准确且有效地调节溶液的pH值。
一、原理概述要理解pH值的调节技巧,我们首先需要了解一些基本的化学原理。
pH值是通过测量溶液中氢离子(H+)的浓度来确定的。
具体来说,pH值是对数表达式,以10为底,代表溶液中溶质的酸碱性。
pH值小于7表示酸性溶液,pH值大于7表示碱性溶液,而pH值为7则表明溶液为中性。
二、酸性溶液的调节技巧1. 使用酸性物质:当需要将碱性溶液调节为酸性时,可以添加一些酸性物质来降低pH值。
常见的酸性物质包括硫酸、盐酸等。
在添加酸性物质时要小心,并逐渐添加,以免过量导致溶液酸性过强。
2. 稀释溶液:有时候可以通过稀释溶液来降低酸性。
通过加入适量的水来稀释溶液,酸性物质的浓度会相应降低,从而减小溶液的酸性。
这种方法适用于需要微调pH值的情况。
三、碱性溶液的调节技巧1. 使用碱性物质:当需要将酸性溶液调节为碱性时,可以添加一些碱性物质来提高pH值。
常见的碱性物质包括氢氧化钠、氢氧化钾等。
同样地,添加碱性物质时也需要逐渐添加以避免过量。
2. 中和反应:有时候可以通过进行中和反应来调节溶液的碱性。
选择适当的酸性物质,并按照化学方程式进行适量的添加,可使酸性与碱性互相中和,达到所需的pH值。
四、pH试纸的使用pH试纸是一种便捷、快速测试溶液pH值的工具。
它通常是由一系列标有不同颜色指示剂的纸条组成,这些指示剂在不同pH值下会变色。
使用pH试纸,仅需将其浸入待测试的溶液中,待片刻后,纸条的颜色会发生变化。
根据试纸上的颜色变化与标度的对应关系,即可判断溶液的pH值范围。
虽然pH试纸不能提供精确的pH值,但在一般情况下,它们足以满足日常实验和测试的需求。
五、注意事项在进行pH值调节时,关注以下几点非常重要:1. 安全性:对于有毒或腐蚀性的酸性或碱性物质应小心操作,佩戴防护手套和护目镜等安全装备,避免伤害自己。
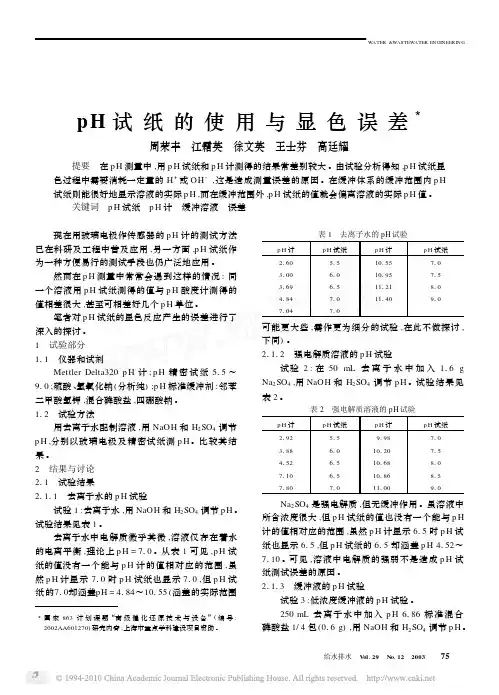
pH 试纸的使用与显色误差3周荣丰 江霜英 徐文英 王士芬 高廷耀 提要 在p H 测量中,用p H 试纸和p H 计测得的结果常差别较大。
由试验分析得知,p H 试纸显色过程中需要消耗一定量的H +或OH -,这是造成测量误差的原因。
在缓冲体系的缓冲范围内p H 试纸则能很好地显示溶液的实际p H ,而在缓冲范围外,p H 试纸的值就会偏离溶液的实际p H 值。
关键词 p H 试纸 p H 计 缓冲溶液 误差 现在用玻璃电极作传感器的p H 计的测试方法已在科研及工程中普及应用,另一方面,p H 试纸作为一种方便易行的测试手段也仍广泛地应用。
3国家863计划课题“高级催化还原技术与设备”(编号:2002AA601270)研究内容;上海市重点学科建设项目资助。
然而在p H 测量中常常会遇到这样的情况:同一个溶液用p H 试纸测得的值与p H 酸度计测得的值相差很大,甚至可相差好几个p H 单位。
笔者对p H 试纸的显色反应产生的误差进行了深入的探讨。
1 试验部分111 仪器和试剂Mettler Delta320p H 计;p H 精密试纸515~910;硫酸、氢氧化钠(分析纯);p H 标准缓冲剂:邻苯二甲酸氢钾,混合磷酸盐,四硼酸钠。
112 试验方法用去离子水配制溶液,用NaOH 和H 2SO 4调节p H ,分别以玻璃电极及精密试纸测p H 。
比较其结果。
2 结果与讨论211 试验结果21111 去离子水的p H 试验试验1:去离子水,用NaOH 和H 2SO 4调节p H 。
试验结果见表1。
去离子水中电解质微乎其微,溶液仅存在着水的电离平衡,理论上p H =710。
从表1可见,p H 试纸的值没有一个能与p H 计的值相对应的范围,虽然p H 计显示710时p H 试纸也显示710,但p H 试纸的710却涵盖pH =4184~10155(涵盖的实际范围表1 去离子水的pH 试验p H 计p H 试纸p H 计p H 试纸2160515101557103100610101957153169615111218104184710111409107104710可能更大些,需作更为细分的试验,在此不做探讨,下同)。

ph测定原理
pH测定原理基于酸碱指示剂的颜色变化。
酸碱指示剂是一种化学物质,可以在酸性和碱性环境中显示不同的颜色。
常用的指示剂有酚酞、溴蓝等。
当酸性溶液中加入酚酞指示剂时,溶液呈现黄色。
随着溶液变得碱性,指示剂颜色逐渐变为红色。
这是由于酸性环境中H+离子的浓度高,使得酚酞呈现黄色;碱性环境中OH-离子的浓度高,与酚酞发生反应生成酚酞阴离子,从而使溶液呈现红色。
在测定pH值时,可以通过加入酸碱指示剂,观察其颜色变化来判断溶液的酸碱性。
根据不同的指示剂,可以将溶液的pH 值大致确定在一定的范围内。
例如,酚酞指示剂可以判断溶液的pH值在酸性到中性范围;溴蓝指示剂可以判断溶液的pH 值在中性到碱性范围。
除了酸碱指示剂,pH值也可以通过电极法进行测定。
电极法是基于溶液中的氢离子(H+)浓度来确定pH值的。
常用的电极有玻璃电极和饱和甘汞电极。
玻璃电极可以测定中性和碱性溶液的pH值,饱和甘汞电极适用于测定酸性溶液的pH值。
总的来说,pH测定原理可以通过酸碱指示剂或电极法来判断溶液的酸碱性,并确定其pH值。
这在许多科学实验和工业生产中具有重要的应用价值。

关于ph试纸测试酸性的实验篇一:实验一、测定溶液的酸碱性(pH)实验一、测定溶液的酸碱性(pH)实验目的:学习用比色法测定溶液的酸碱性(pH)的方法。
实验原理:化学上,用不同的指示剂混合液浸泡试纸,晒干后制成pH 试纸,它可以在不同酸碱度的溶液中显示不同的颜色。
根据试纸的变色情况,与标准比色卡对照可测定出溶液的pH。
实验用品:仪器:玻璃片、玻璃棒、滤纸、洗瓶等。
药品:pH试纸、各种待测溶液(自来水、稀盐酸、稀NaOH溶液、食盐水、洗洁精等)。
实验步骤:在玻璃片上放一小片pH试纸,用玻璃棒醮取待测溶液点在pH试纸上,把试纸显示的颜色与标准比色卡对照,即可得出等测溶液的pH。
选择一些物质测定其pH,并把测定结果列在下表中。
要求:按pH试纸由小到大的顺序对被检验的物质进行排队。
说明:⑴ pH=7为中性;pH数值越小,酸性越强;反之pH数值越大,碱性越强。
⑵用pH试纸测溶液的pH值,虽然比较简单,但精度不高。
要测定溶液精确的pH值,必须用pH计测定。
注意:⑴ pH试纸不能直接浸入待测溶液中。
⑵滴加待测溶液后,应立即与标准比色卡对照。
⑶用于醮取待测液的玻璃棒,每测过一次溶液的pH值后,都要用蒸馏水冲洗干净,并用滤纸擦干。
⑷若玻璃棒醮取溶液不方便,也可改为滴管滴加待测溶液,但只能滴一滴待测溶液。
⑸在标准比色卡中,相邻pH色调差异很小。
因此比色时要认真对照。
篇二:2终稿pH试纸检测尿液的酸碱度的实验报告 2pH试纸检测尿液的酸碱度的实验报告---体教11001班第一组黄典 202200276 一:试验名称晨尿酸碱度检测二:试验目的掌握pH试纸检测尿液酸碱度的原理和方法,通过试验基本了解尿液的成分,进一步分析测试前24小时训练和饮食对尿液酸碱度的影响并进一步指导实践。
三:试验原理pH试纸的应用是非常广泛的,pH的反应原理试基于pH指示法,目前,一般的尿液pH分析试纸中含有甲基红[pH4.2(红)—6.2(黄)],溴甲酚绿[pH3.6(黄)—5.4(绿)],溴百里香酚蓝[pH6.7(黄)—7.5(蓝)],这些混合的酸碱指示剂适量配合可以反映尿液pH4.5—9.0的变异范围。

ph测量的原理
PH测量的原理是通过测量溶液中的氢离子(H+)浓度来确定
溶液的酸碱性。
pH值是用来表示溶液中酸碱性强弱的指标,
它是一个指数值,通常在0到14之间。
在中性溶液中,H+离
子和OH-离子的浓度相等,因此pH值为7;在酸性溶液中,
H+离子的浓度高于OH-离子,pH值小于7;在碱性溶液中,OH-离子的浓度高于H+离子,pH值大于7。
PH测量可以使用PH电极进行。
PH电极是一种针状电极,内
部含有酸碱敏感玻璃膜。
当PH电极浸入待测溶液中时,溶液
中的H+离子会与酸碱敏感玻璃膜发生反应,引起电极内部的
电势变化。
这一电势变化可以通过电极与参比电极之间的电路测量并转化为PH值。
实际使用中,需要将PH电极校准到已知的酸碱溶液中,以确
定电极的灵敏度和准确性。
然后,将PH电极插入待测溶液中,测量出的电势变化与已知溶液的测量结果进行比较,从而确定待测溶液的PH值。
需要注意的是,PH测量是一种相对指标,它只能表示溶液的
酸碱性强弱,而不能提供具体的离子浓度信息。
此外,持续使用的PH电极可能会失去灵敏度,需要定期进行校准和维护。
PH试纸原理基本信息化学离不开溶液,溶液有酸碱之分。
检验溶液酸碱性的“尺子”是“广泛pH试纸”。
这是一种现成的试纸,使用时,撕下一条,放在表面皿中,用一支干燥的玻璃棒从玻璃容器中蘸取一滴溶液,从它的颜色变化就可以知道溶液的酸碱性,十分方便。
pH试纸按测量精度上可分0.2级、0.1级、0.01级或更高精度。
pH试纸上有甲基红、溴甲酚绿、百里酚蓝这三种指示剂。
甲基红、溴甲酚绿、百里酚蓝和酚酞一样,在不同PH值的溶液中均会按一定规律变色。
甲基红的变色范围是pH4.4(红)--6.2(黄),溴甲酚绿的变色范围是pH3.6(黄)--5.4(绿),百里酚蓝的变色范围是pH6.7(黄)--7.5(蓝)。
用定量甲基红加定量溴甲酚绿加定量百里酚蓝的混合指示剂浸渍中性白色试纸,晾干后制得的pH试纸可用于测定溶液的pH值便不难理解了。
什么是pH?pH=-lg[H+],用来量度物质中氢离子的活性。
这一活性直接关系到水溶液的酸性、中性和碱性。
水在化学上是中性的,但不是没有离子,即使化学纯水也有微量被离解:严格地讲,只有在与水分子水合作用以前,氢核不是以自由态存在。
注意:pH不应写成PH 这是一个容易出错的地方。
试纸的使用方法1.检验溶液的酸碱度:取一小块试纸在表面皿或玻璃片上,用洁净的玻璃棒蘸取待测液点滴于试纸的中部,观察变化稳定后的颜色,与标准比色卡对比,判断溶液的性质。
2.检验气体的酸碱度:先用蒸馏水把试纸润湿,粘在玻璃棒的一端,再送到盛有待测气体的容器口附近,观察颜色的变化,判断气体的性质。
(试纸不能触及器壁)注意1.试纸不可直接伸入溶液。
2.试纸不可接触试管口、瓶口、导管口等。
3.测定溶液的pH时,试纸不可事先用蒸馏水润湿,因为润湿试纸相当于稀释被检验的溶液,这会导致测量不准确。
正确的方法是用蘸有待测溶液的玻璃棒点滴在试纸的中部,待试纸变色后,再与标准比色卡比较来确定溶液的pH。
4.取出试纸后,应将盛放试纸的容器盖严,以免被实验室的一些气体沾污pH试纸的发现pH试纸的雏形——石蕊试纸是波义耳在一次偶然的机会中发现的: 在一次紧张的实验中,放在实验室内的紫罗兰,被溅上了浓盐酸,爱花的波义耳急忙把冒烟的紫罗兰用水冲洗了一下,然后插在花瓶中。
酸度计(ph计)的原理pH值的测量方法主要有两种: 比色法和电测法。
测量范围0~14pH。
比色法是通过pH 试纸颜色的变化测量溶液的pH值,是采用有些指示剂在不同的酸碱度下能呈现能变化或变化为不同颜色这一种特性来测量溶液酸碱度的一种方法。
此方法方便、快捷,但比色法受因溶液本身颜色或含蛋白质等干扰而限制采用,这种方法只适用于分辨力大于0. 5pH值的测量,而对于分辨力小于0. 5pH的测量,我们均采用电计测法即用酸度计进行。
我这单主要介绍这种测量方法。
酸度计(以下简称pH计)是根据pH实用定义采用氢离了选择性电极测量水溶液pH值的一种广泛使用的化学分析仪器,是用其电势法测量pH。
其原理是: 当一个氢离了可逆的指示电极和一个参比电极同时浸入在某一溶液中组成原电池(参比电极电位原则是不变的,并应己知),在一定的温度下产生一个电动势,这个电动势与溶液的氢离了活度有关,而与其他离了的存在关系很小(如图1所示)。
25℃下液相中氢离了活度为lmol/ kg,气相氢气压为1. 01325× (1个大气压),这时的氢电极称为标准氢电极,它的电极电势为零。
任何电极的电势都可以依据这个标准氢电极来度量。
将待测电极与标准氢电极连接,温度控制在25℃,所测的电池电动势称为标准电极电势。
因此,待测溶液pH的变化可以直接表示为它所构成的电池电动势的变化:式中: R为摩尔气体常数(8. 3143J/ mol·k) ; F为法拉第常数(96487. 0c/ mol ) ; T 为绝温度( 273. 15 ℃+ t) ; Eo为标准电极电位,V。
由上式可知,测得电池电动势后,可以计算出溶液的pH值。
pH值的数值跟产生的电动势电压(一般在±500m V以内)有很大的关系。
目前广泛使用的pH计就是根据这一原理而设计的。
酸度计(ph计)常用电极的介绍从图1可见酸度计主要是通过电极和溶液产生微电压,所以使用于什么电极对酸度值的大小很关键。
次氯酸钠使ph试纸褪色原理1. 前言嘿,朋友们,今天咱们聊聊一个听起来有点儿“科学家范儿”的话题——次氯酸钠是怎么让pH试纸褪色的。
别担心,这可不是要给你上什么高深的化学课,而是要让你明白这个看似神秘的过程其实非常有趣,也非常实用!就像煮方便面一样,简单又好吃!2. 次氯酸钠是什么2.1 一点小科普好吧,先来聊聊次氯酸钠。
它可不是一个难以发音的外星名,而是咱们日常生活中常见的漂白剂,很多家庭都会用它来消毒杀菌。
想象一下,洗碗时那一股清香的气味,没错,就是它的功劳!次氯酸钠在水中溶解后,形成了次氯酸(HOCl),这可是一个强大的氧化剂,能够帮助咱们消灭细菌、病毒,简直是家庭清洁的得力助手。
2.2 生活中的小角色可能你会想,“这东西和我有啥关系?”其实关系可大了!你在清洁厨房、洗衣服的时候,次氯酸钠就像个无形的小帮手,默默奉献。
但如果我们把它放到pH试纸上,那就有好戏看了。
pH试纸是用来测试溶液酸碱度的小工具,通常是红色或蓝色的。
现在问题来了,次氯酸钠是怎么让这些颜色消失的呢?3. 颜色变化的秘密3.1 化学反应的魔法首先,让我们走进化学反应的世界。
pH试纸上的颜色其实是由一些指示剂组成的,这些指示剂会随着酸碱度的变化而变色。
比如,酸性环境中试纸变红,而碱性环境中则变蓝。
可当次氯酸钠登场时,它的强氧化性就发挥作用了。
次氯酸钠会和试纸上的指示剂发生反应,破坏它们的结构,就像我们用水浇花,花朵虽然美丽,却受不了大雨的冲刷。
试纸的颜色就是这样被“冲”掉了,褪色变成白色,简直是一场“颜色的大逃亡”!3.2 过程中的小惊喜你可能会觉得,这听起来有点儿无聊,但其实这过程就像看一场精彩的魔术表演!每次试纸的颜色变化,都像是揭开了一层神秘的面纱,给人一种意想不到的惊喜。
就好像你打开冰箱,发现里面藏着一块巧克力,哇,真是开心到飞起!这个变化其实也告诉我们,次氯酸钠不仅仅是个漂白剂,它还是个小小的化学家,能和各种物质进行各种反应,创造出不一样的效果。
PH值的测定方法PH值是指溶液的酸碱性程度的量化指标,是一个常用的化学参数,能够用来描述溶液的酸碱特性。
在化学、环境科学、生物学、医学等领域中,PH值的测定方法有多种,下面将介绍其中的几种常用方法。
1.酸碱指示剂法酸碱指示剂法是最为常见、简便、快速的PH值测定方法之一、常用的酸碱指示剂包括酚酞、溴甲酚、甲基橙、溴酚蓝等,这些指示剂都有着特定的酸碱变色区间。
通过向待测溶液中加入适量的指示剂,根据溶液的颜色变化判断PH值。
2.PH试纸法PH试纸法是一种常用的快速测定PH值的方法。
PH试纸通常是由特殊的纸张制成,上面涂有酸碱指示剂。
将PH试纸浸入待测溶液中,待试纸充分湿润后,通过对比试纸颜色与参考色标的颜色变化来估计PH值。
3.电化学法电化学法是一种能够精确测定PH值的方法。
常用的电化学PH值测定仪器有PH计、电位差计等。
这些仪器是基于电极原理工作的,其原理是通过测量溶液中的电势来推算PH值。
其中,最常用的是玻璃电极PH计,它使用特殊的玻璃电极和参比电极进行测量,精度较高。
4.酸碱滴定法酸碱滴定法是一种准确测定PH值的方法。
它基于酸碱的中和反应,通过滴定溶液中准确测量所需的酸碱溶液的体积,计算出溶液的酸碱浓度,从而得到PH值。
在滴定过程中,常用的指示剂如酚酞、溴酚蓝可以用来指示溶液的中和点。
5.荧光分光光度计法荧光分光光度计法是一种精确、灵敏度高的PH值测定方法。
这种方法利用一些化合物在不同PH值下荧光特性的变化,通过检测荧光的强度来测定PH值。
常用的荧光分光光度计有针对不同PH范围的荧光探针。
除了上述几种常用的PH值测定方法外,还有一些其他的方法,包括电极法、纳米颗粒探针法、生物传感器法等等。
各种方法适用于不同的情境和要求,选择合适的PH值测定方法可以提高测量的准确性和可靠性。
小分子水试剂原理
小分子水试剂原理是指一种用于检测水的试剂,其原理是利用试剂与水中的特定物质之间的化学反应产生可观察的色变或指示剂的染色反应。
常见的小分子水试剂有pH试纸、溴酚蓝试剂等。
这些试剂通常含有一种指示剂,其在特定条件下与水中的物质发生化学反应,产生不同的颜色变化,从而可以判断水中物质的含量或性质。
例如,pH试纸可以测量溶液的酸碱性。
pH试纸通常是由指示剂和吸附剂组成的纸条,指示剂会在酸性或碱性条件下发生颜色变化。
当试纸浸泡在水中时,指示剂会与水中的氢离子
(H+)或氢氧离子(OH-)发生化学反应,使试纸发生颜色变化,从而可以判断水的pH值。
溴酚蓝试剂可以用于检测水中含有的游离氯或溴的浓度。
溴酚蓝试剂是一种指示剂,其在不同浓度的溶液中会显示不同的颜色。
当溴酚蓝试剂与水中的游离氯或溴发生反应时,会产生颜色变化,从而可以判断水中游离氯或溴的含量。
总之,小分子水试剂通过与水中特定物质产生化学反应,从而产生可观察的色变或染色反应,进而判断水中物质的含量或性质。
PH试纸原理
基本信息
pH试纸”。
这是一种现成的试纸,使用时,撕下一条,放在表面皿中,用一支干燥的玻璃棒从玻璃容器中蘸取一滴溶液,从它的颜色变化就可以知道溶液的酸碱性,十分方便。
pH试纸按测量精度上可分0.2级、0.1级、0.01级或更高精
度。
pH
溴甲酚绿、百里酚蓝和酚酞一样,在不同
甲基红的变色范围是pH4.4(红)--6.2(黄),溴甲酚绿的变色范围是pH3.6(黄)--5.4(绿),百里酚蓝的变色范围是pH6.7(黄)--7.5(蓝)。
用定量甲基红加定量溴甲酚绿加定量百里酚蓝的混合指示剂浸渍中性白色试纸,晾干后制得的pH试纸可用于测定溶液的pH值便不难理解了。
什么是pH?pH=-lg[H+],用来量度物质中氢离子的活性。
这一活性直接关系到水溶液的酸性、中性和碱性。
水在化学上是中性的,但不是没有离子,即使化学纯水也有微量被离解:严格地讲,只有在与水分子水合作用以前,氢核不是以自由态存在。
注意:pH 不应写成PH 这是一个容易出错的地方。
试纸的使用方法
1.用洁净的玻璃棒蘸取待测液点滴于试纸的中部,观察变化稳定后的颜色,与标准比色卡对比,判断溶液的性质。
2.检验气体的酸碱度:先用蒸馏水把试纸润湿,粘在玻璃棒的一端,再送到盛有待测气体的容器口附近,观察颜色的变化,判断气体的性质。
(试
纸不能触及器壁)
注意
1.试纸不可直接伸入溶液。
2.试纸不可接触试管口、瓶口、导管口等。
3.测定溶液的pH时,试纸不可事先用蒸馏水润湿,因为润湿试纸相当于稀释被检验的溶液,这会导致测量不准确。
正确的方法是用蘸有待测溶液的玻璃棒点滴在试纸的中部,待试纸变色后,再与标准比色卡比较来确定溶液的pH。
4.取出试纸后,应将盛放试纸的容器盖严,以免被实验室的一些气体沾污
pH试纸的发现
pH试纸的雏形——石蕊试纸是波义耳在一次偶然的机会中发现的: 在一次紧张的实验中,放在实验室内的紫罗兰,被溅上了浓盐酸,爱花的波义耳急忙把冒烟的紫罗兰用水冲洗了一下,然后插在花瓶中。
过了一会波义耳发现深紫色的紫罗兰变成了红色的。
这一奇怪的现象促使他进行了许多花木与酸碱相互作用的实验。
由此他发现了大部分花草受酸或碱作用都能改变颜色,其中以石蕊地衣中提取的紫色浸液最明显,它遇酸变成红色,遇碱变成蓝色。
利用这一特点,波义耳用石蕊浸液把纸浸透,然后烤干,这就制成了实验中常用的酸碱试纸——石蕊试纸。
pH试纸的物质组成及化学式
pH试纸的应用是非常广泛的,pH的反应原理是基于pH指示剂法,目前,一般的pH分析试纸中含有甲基红[pH4.2(红)~6.2(黄)],溴甲酚绿[pH3.6(黄)~5.4(绿)]溴百里香酚蓝[pH6.7(黄)~7.5(蓝)],这些混合的酸碱指示剂适量配合可以反映pH4.5~9.0的变异范围。
以酚酞在不同酸碱条件下变色规律为例说明PH试纸的变色原理:把酚酞滴入浓H2SO4,呈现橙色,不论振荡多长时间,其颜色都不变。
若把该橙色液配入大量水中,得无色液。
酚酞滴入稀NaOH溶液呈紫红色,将酚酞滴入浓NaOH溶液(浓度大于2mol/l),开始时浓NaOH溶液表面酚酞滴入处会出现一些紫红色、略加振荡紫红色立即消失。
其实,这是酚酞在不同的酸碱条件下,因其结构的改变而呈现4种相应的变色情况。
pH试纸上有甲基红、溴甲酚绿、百里酚蓝这三种指示剂。
甲基红、溴甲酚绿、百里酚蓝和酚酞一样,在不同pH值的溶液中均会按一定规律变色。
甲基红的变色范围是pH4.2(红)--6.2(黄),溴甲酚绿的变色范围是pH3.6(黄)--5.4(绿),百里酚蓝的变色范围是pH6.7(黄)--7.5(蓝)。
用定量甲基红加定量溴甲酚绿加定量百里酚蓝的混合指示剂浸渍中性白色试纸,晾干后制得的pH试纸可用于测定溶液的pH值便不难理解了。
什么是pH?pH是拉丁文“Pondus hydrogenii”一词的缩写(Pondus=压强、压力hydrogenium=氢),用来量度物质中氢离子的活性。
这一活性直接关系到水溶液的酸性、中性和碱性。
水在化学上是显中性的,但不是没有离子,即使化学纯水也有微量被离解:严格地讲,只有在与水分子水合作以前,氢核不是以自由态存在。
H2O+ H2O= + OHˉ由于水全氢离子(H3O)的浓度是与氢离子(H)浓度等同看待,上式可以简化成下述常用的形式:H2O= + OHˉ此处正的氢离子人。