第六章 酶、细胞、原生质体固定化
- 格式:ppt
- 大小:1.95 MB
- 文档页数:44


第一章绪论一、名词解释1、酶:是具有生物催化功能的生物大分子2、酶工程:酶的生产与应用的技术过程称为酶工程。
它是利用酶的催化作用进行物质转化的技术,是将酶学理论与化工技术、微生物技术结合而形成的新技术,是借助工程学手段利用酶或细胞、细胞器的特定功能提供产品的一门科学3、核酸类酶:为一类具有生物催化功能的核糖核酸分子.它可以催化本身RNA剪切或剪接作用,还可以催化其他RNA,DNA多糖,酯类等分子进行反应4、蛋白类酶:为一类具有生物催化功能的蛋白质分子,它只能催化其他分子进行反应。
5、酶的生产:是指通过人工操作获得所需酶的技术过程。
主要包括微生物发酵产酶,动植物培养产酶,酶提取和分离纯化等6、酶的改性是通过各种方法改进酶的催化特性的技术过程,主要包括酶分子的修饰,酶固定化,酶非水相催化等7、酶的应用:是通过酶的催化作用获得人们所需要的物质或者不良物质的技术过程,主要包括酶反应器的选择和设计以及酶在各领域的应用等。
8、酶的专一性:又称为特异性,是指酶在催化生化反应时对底物的选择性,即在一定条件下,一种酶只能催化一种或一类结构相似的底物进行某种类型反应的特性。
亦即酶只能催化某一类或某一种化学反应。
9、酶的转换数:酶的转换数Kp。
又称为摩尔催化活性,是指每个酶分子每分钟催化底物转化的分子数二、填空题1、根据分子中起催化作用的主要组分的不同,酶可以分为_________和____________两大类.2、核酸类酶分子中起催化作用的主要组分是__________,蛋白类酶分子中起催化作用的主要组分是________________。
3、进行分子内催化作用的核酸类酶可以分为________________,_________________。
4、酶活力是_______________的量度指标,酶的比活力是_______________的量度指标,酶的转换数的主要组分是________________的度量指标。

第一章:绪论◆酶:由生物体产生的具有生物催化功能的生物大分子,按照分子中起催化作用的主要组分的不同,自然界中天然存在的酶可以分为蛋白类酶(protein enzyme)和核酸类酶◆酶工程:酶的生产、改性与应用的技术过程称为酶工程◆锁与钥匙学说:底物结构必须与酶活性部位的结构非常互补,就像锁与钥匙一样,这样才能紧密结合,形成酶-底物复合物。
这个学说可以解释酶的绝对专一性,但是不能解释酶的相对专一性。
◆诱导契合理论:酶分子活性中心的结构并不与底物分子的结构互补,但活性中心有一定的柔性,当底物分子与酶分子相遇时可以诱导酶蛋白的构象发生相应的变化,使活性中心的各个结合基团与催化基团达到对底物结构正确的空间排布与定向,从而使酶与底物互补结合,产生酶-底物复合物,并使底物发生化学反应◆中间产物学说:酶首先与底物结合成酶-底物复合物,然后转变成酶-过渡态中间物复合物,然后,生成酶-产物复合物,最后从酶分子上释放产物,从而大大降低反应的活化能(分子由基态转变为过渡态即活化态所需的能量)。
◆Km 值是当酶反应速度为最大反应速度一半时的底物浓度◆竞争性抑制:抑制剂竞争性与酶的活性中心结合,从而阻止底物与酶的结合。
这是最常见的一种可逆抑制作用。
随着底物浓度增加,酶的抑制作用减弱。
Vm 不变,Km 增大◆非竞争性抑制:底物和抑制剂可以同时与酶结合,抑制剂结合于活性中心以外的部位,两者没有竞争作用,但影响产物的释放,Vm 降低,Km 不变◆反竞争性抑制Vm 降低,Km 减小◆酶活力:酶催化底物发生化学反应的能力。
测定酶活力,实际上就是测定酶促反应进行的速度。
酶促反应速度越快,酶活力就越大;反之,速度越慢,酶活力就越小。
◆酶的比活力:每毫克酶蛋白(酶制剂)所含的酶活力单位数称为酶的比活力,用U/mg 蛋白表示。
酶的比活力是酶制剂的一个纯度指标。
对同一种酶来说,比活力愈高,表明酶纯度愈高。
◆酶的生产方法:.提取分离法;生物合成法;化学合成法第二章:微生物发酵产酶结构基因、操纵基因与启动基因一起组成操纵子,分为诱导型与阻遏型。




酶工程第一章测试试题卷一填空每空1分,共20分1.1878年,____首次将酵母中酒精发酵的物质称为酶.2.1913年,Michaelis 和Menten根据中间产物学说,推导出酶催化反应的基本动力学方程----米氏方程,可用公式表示为_______.3.1982年Thomas Cech等人发现四膜虫的rRNA可以在没有蛋白质存在的情况下自身催化切除内含子,完成加工过程.这一具有催化活性的RNA的发现改变了传统的酶的化学本质是____________的概念;4.对同一种酶可同时采用系统命名和_____命名两种方法.5.乳酸脱氢酶可标识为1.1.1,其中EC代表_________.6.催化L-谷氨酸 D—谷氨酸的酶属于________酶.7.核酸类酶的基本组成单位是_________.8.酶的有机辅助因子在催化过程中起_______________的作用.9.在酶的二级结构β—片状折叠中,________式结构更稳定.10.酶的绝对专一性又称为___________专一性.11.PH对酶的影响主要是影响到了氨基酸的________状态.12.在测酶活力时,为了使酶反应速度不受底物浓度底限制,反应系统应使用足够高的底物浓度,一般要求:__________.13.酶分离纯化整个工作包括三个基本环节:抽取纯化和________.14.工业应用的三大酶制剂是蛋白酶 ________和脂肪酶.15 核酸类酶催化反应的类型,可以将R-酶分为三类:剪切酶,剪接酶和________酶.16、具有不同分子形式但却催化相同反应的酶称为__________.17、每毫克蛋白或RNA中所具有的酶活力数称为酶的_______.用u/mg表示.18、酶制剂可分为液体酶制剂,固体酶制剂,纯酶制剂和_______酶制剂.二. 选择题每题2分,共10分1.谷氨酸脱氢酶可有以下四种底物,由Km推断它的最适底物是 .A. 谷氨酸Km=B. α-酮戊二酸Km=C. NAD氧化形 Km=D. NAD 还原形 Km=2. D EA B CF G图示抑制模式属于:A累积反馈抑制B无分支途径中酶活性反馈抑制C 顺序反馈抑制D 协调反馈抑制3.有两种蛋白酶样品,A样品32mg,酶活力单位数为样品52mg ,酶活力单位数为190U,则两样品纯度为:A A >B B. A < B C. A = B D. 不能断定.4.某酶四种底物的Km 如下,与酶亲和力最大的底物是:A ×10-2B × 10-1C ×10-2D ×10-65.从世界范围看,酶制剂在哪一行业中的应用占比例最高A 淀粉业B 乳制品C 洗涤剂业D 制酒业三. 名词解释每题3分,共12分1.调节酶2.别构效应3.固定化酶四. 判断题每题1分,共7分2.1/Km越大,酶与底物亲和力越大.3.酶的最适温度是一个固定不变的常数,其数值不受底物的种类.作用时间而改变.4.盐析法分离蛋白质时,应将溶液PH调至蛋白质等电点附近.5.酶浓度越高,酶结晶越大.6.调节酶就是别构酶.7.大肠杆菌丙酮酸脱氢酶是多酶复合体.五. 说明题共6分1.图示并说明竞争性抑制和非竞争性抑制的区别.6分六. 简答题共21分1.简介酶分子中氨基酸残基种类及作用.8分2请比较说明吸附层析、离子交换层析、凝胶层析、亲和层析的原理.8分3、固定化酶的制备原则是什么5分酶工程第一章测试参考答案一填空每空1分,共18分1.库尼 =vmaxS/Km+S 3.酶是具有生物催化功能的蛋白质.4.习惯5.国际酶学委员会6.异构酶7.核糖核苷酸8.传递电子原子和基团的作用.9.反平行10.立体异构11.解离 12.S>5Km 13.制剂. 14淀粉酶 15多功能酶16同工酶 17酶的比活力.18固定化酶制剂二. 选择题每题3分,共15分. 4D三. 名词解释每题5分,共15分1.调节酶: 在代谢途径和物质转化体系中起调节作用的关键酶.2.别构效应:一种化合物与酶的活性中心以外的部位结合,引起酶的构象发生变化的现象.3.固定化酶:在一定空间内呈闭锁状态存在的酶,能连续地进行反应,反应后酶可以回收重复使用.四. 判断题每题2分,共14分1.正确2.错误3. 正确4. 错误5. 错误6. 正确7. 正确五、图示说明题共12分2.图示并说明竞争性抑制和非竞争性抑制的区别.6分竞争性抑制剂结构往往与正常底物非常相似,从而与底物竞争酶分子上同一个结合部位活性中心,阻止底物和酶的结合.因而酶不能与抑制剂和底物同时结合.ESI复合物缺乏反应活性基团不能继续分解成产物,形成死端复合物.图4分,解释2分不论底物分子是否与酶结合, 非竞争性抑制剂都能与酶分子结合产生死端复合物. 非竞争性抑制剂与活性中心以外的基团结合,其结构肯与底物分子毫无相关之处,两者没有竞争作用,但ESI不能进一步分解成产物. 图4分,解释2分七. 简答题共26分1.请比较说明吸附层析、离子交换层析、凝胶层析、亲和层析分离酶的原理.16分1维持酶的催化活性和专一性.2应有利于生产自动化.连续化.3与载体牢固结合4载体不与底物.产物和反应物发生化学反应.5成本要低,利于工业使用.第二、三章酶的生物合成法生产测试题填空题1、SOD是_________酶,具有____________________的功效;2、依据在体外培养时对生长基质依赖性差异,动物细胞可分为两类:__________、______________;3、动物细胞培养的PH应控制在______________;温度控制在_______,允许波动_______;判断题谷草芽孢杆菌是应用最广泛的产酶微生物;√大多数产酶微生物采用淀粉或其水解产物为碳源,植物细胞一般以蔗糖为碳源;√植物细胞培养要求的氮源一般为有机氮源;×动物细胞培养主要用于各种功能蛋白质的生产;√动物细胞传代培养时可以用胃蛋白酶分散细胞;×简答题:1、固定化原生质体产酶有何特点2、植物细胞培养产酶的工艺流程3、酶的生物合成有哪几种模式各有何特点P36-384、影响酶生物合成的主要因素有哪些结合酶的生物合成模式,分析说明怎样提高产酶效率;P39答案:填空题1、抗辐射、抗氧化、抗衰老2、贴壁依赖型细胞,非贴壁依赖型细胞3、-微碱性,℃ ,允许波动范围在+-℃简答题1、1、变胞内产物为胞外产物固定化黑曲霉原生质体生产葡萄糖氧化酶,使细胞内葡萄糖氧化酶的90%以上分泌到细胞外;2、提高产酶率固定化枯草芽孢杆菌原生质体生产碱性磷酸酶,使原来存在于细胞间质中的碱性磷酸酶全部分泌到发酵液中,产酶率提高36%;3、稳定性好4、易于分离纯化2、外植体诱导愈伤组织细胞培养分离纯化酶第四章酶的提取与分离纯化测试题填空题1、酶在结晶之前,酶液必须经过纯化达到一定的纯度;通常酶的纯度应当在_______以上,方能进行结晶;2、酶结晶的主要方法有:________、________、________、________;3、酶的剂型有:_____、______、________和固定化酶制剂;通常用作分析试剂或用作医疗药物的酶制剂要求是___________ ;4、注射用的医用酶应设法除去____________;判断题1、一般采用稀盐溶液进行酶的提取,盐的浓度一般控制在~ mol/L ;√2、常用硫酸铵盐析沉淀酶蛋白;√3、盐析沉淀酶蛋白时,溶液的pH值应调节到远离酶的等电点;×4、等电点结晶是通过缓慢改变浓酶液的pH值,使之逐渐远离酶的等电点,而使酶析出结晶的过程;×名词解释:1、选择性变性沉淀法2、酶的提取3、亲和层析简答题:1、酶的分离纯化工作的基本原则2、举例说明细胞破碎的几种方法及原理;3、稳定酶的方法有哪些答案:填空题1、50%;2、盐析结晶法、有机溶剂结晶法、透析平衡结晶法、等电点结晶法;3、固体酶制剂、液体酶制剂、纯酶制剂、固定化酶制剂;纯酶制剂;4、热源物质名词解释1、选择性变性沉淀法:选择一定的条件使酶液中存在的某些杂蛋白等杂质变性沉淀,而不影响所需的酶,这种分离方法称为选择性变性沉淀法2、酶的提取是指在一定的条件下,用适当的溶剂处理含酶原料,使酶充分溶解到溶剂中的过程,也称为酶的抽提;3、亲和层析是利用生物分子与配基之间所具有的专一而又可逆的亲和力,使酶等生物分子分离纯化的技术;简答题1、1、防止酶变性失效凡用于预防蛋白质变性失效的方法与措施都应考虑用于酶的分离纯化;A、除少数例外外,所有操作都必须在低温条件下进行,特别是在有机溶剂存在的情况下更应小心;B、大多数酶在PH<4或PH>10的情况下稳定,应控制整个系统不要过酸、过碱,同时要避免在调整PH时局部过酸或过碱;C、重金属能使酶失效,有机溶剂能使酶变性,微生物污染以及蛋白酶的存在都能使酶分解破坏,所有这些都应周全考虑;可以加入蛋白酶抑止剂,杀菌剂,稳定蛋白质构象和酶活性的还原剂;2、酶活性测定贯串纯化过程的始终也就是说,从原理开始,整个过程的每一步都要进行比活力与总活力的检测与比较,以便知道每一步骤中可采用什么方法与什么条件,分别使酶的纯度提高了多少,回收了多少酶,从而决定其取舍;3、选择有效的纯化方法凡用于蛋白质纯化的一切方法同样适用于酶;应根据目的酶的物理、化学性质选取;4、原料来源要方便,成本要低1、添加底物、抑止剂和辅酶2、添加-SH保护剂如谷胱甘肽、二巯基乙醇3、低温0-4℃4、添加某些低分子无机离子 Ca2+保护淀粉酶,Mn2+能稳定溶菌酶,CL-能稳定透明质酸酶等5、固体酶制剂稳定性高可保存数月或几年以上;热敏性酶多用冷冻干燥法,例如注射用酶等;6、固定化酶也是提高酶的稳定性的好方法;第四章酶的提取与分离纯化测试题填空题1、酶在结晶之前,酶液必须经过纯化达到一定的纯度;通常酶的纯度应当在_______以上,方能进行结晶;2、酶结晶的主要方法有:________、________、________、________;3、酶的剂型有:_____、______、________和固定化酶制剂;通常用作分析试剂或用作医疗药物的酶制剂要求是___________ ;4、注射用的医用酶应设法除去____________;判断题1、一般采用稀盐溶液进行酶的提取,盐的浓度一般控制在~ mol/L ;√2、常用硫酸铵盐析沉淀酶蛋白;√3、盐析沉淀酶蛋白时,溶液的pH值应调节到远离酶的等电点;×4、等电点结晶是通过缓慢改变浓酶液的pH值,使之逐渐远离酶的等电点,而使酶析出结晶的过程;×名词解释:1、选择性变性沉淀法2、酶的提取3、亲和层析简答题:1、酶的分离纯化工作的基本原则2、举例说明细胞破碎的几种方法及原理;3、稳定酶的方法有哪些答案:填空题1、50%;2、盐析结晶法、有机溶剂结晶法、透析平衡结晶法、等电点结晶法;3、固体酶制剂、液体酶制剂、纯酶制剂、固定化酶制剂;纯酶制剂;4、热源物质名词解释1、选择性变性沉淀法:选择一定的条件使酶液中存在的某些杂蛋白等杂质变性沉淀,而不影响所需的酶,这种分离方法称为选择性变性沉淀法2、酶的提取是指在一定的条件下,用适当的溶剂处理含酶原料,使酶充分溶解到溶剂中的过程,也称为酶的抽提;3、亲和层析是利用生物分子与配基之间所具有的专一而又可逆的亲和力,使酶等生物分子分离纯化的技术;简答题1、1、防止酶变性失效凡用于预防蛋白质变性失效的方法与措施都应考虑用于酶的分离纯化;A、除少数例外外,所有操作都必须在低温条件下进行,特别是在有机溶剂存在的情况下更应小心;B、大多数酶在PH<4或PH>10的情况下稳定,应控制整个系统不要过酸、过碱,同时要避免在调整PH时局部过酸或过碱;C、重金属能使酶失效,有机溶剂能使酶变性,微生物污染以及蛋白酶的存在都能使酶分解破坏,所有这些都应周全考虑;可以加入蛋白酶抑止剂,杀菌剂,稳定蛋白质构象和酶活性的还原剂;2、酶活性测定贯串纯化过程的始终也就是说,从原理开始,整个过程的每一步都要进行比活力与总活力的检测与比较,以便知道每一步骤中可采用什么方法与什么条件,分别使酶的纯度提高了多少,回收了多少酶,从而决定其取舍;3、选择有效的纯化方法凡用于蛋白质纯化的一切方法同样适用于酶;应根据目的酶的物理、化学性质选取;4、原料来源要方便,成本要低1、添加底物、抑止剂和辅酶2、添加-SH保护剂如谷胱甘肽、二巯基乙醇3、低温0-4℃4、添加某些低分子无机离子 Ca2+保护淀粉酶,Mn2+能稳定溶菌酶,CL-能稳定透明质酸酶等5、固体酶制剂稳定性高可保存数月或几年以上;热敏性酶多用冷冻干燥法,例如注射用酶等;6、固定化酶也是提高酶的稳定性的好方法;第五章酶分子的修饰与应用测试题填空题1、酶分子修饰的意义是:_____________,______________,_________;名词解释1、酶分子修饰通过各种方法使酶分子的结构发生某些改变,从而改变酶的某些特性和功能的过程称为酶分子修饰;2、金属离子置换修饰3、酶分子的物理修饰简答题:1、什么是酶分子的侧链修饰酶分子侧链修饰有何意义2、请举例说明酶分子修饰的应用答案填空题:1、提高酶的活力;增强酶的稳定性;降低或消除酶的抗原性;名词解释1、酶分子修饰:通过各种方法使酶分子的结构发生某些改变,从而改变酶的某些特性和功能的过程称为酶分子修饰;2、把酶分子中的金属离子换成另一种金属离子,使酶的功能和特性发生改变的修饰方法称为金属离子置换修饰;3、通过各种物理方法使酶分子的空间构象发生某些改变,从而改变酶的某些特性和功能的方法称为酶分子的物理修饰;简答题1、采用一定的方法一般为化学法使酶的侧链基团发生改变,从而酶分子的特性和功能的修饰方法称为侧链基团修饰;意义:1、通过酶分子侧链基团修饰,可以研究各种基团在酶分子中的作用及其对酶的结构、特性和功能的影响,并可以用于研究酶的活性中心的必须基团;如果某基团修饰后不引起酶活力的显着变化,则可以认为此基团属于非必须基团;2、通过酶分子侧链基团修饰,可以测定某一种基团在酶分子中的数量,例如,采用三硝基苯磺酸测定氨基的数量;用对汞苯甲酸测定巯基的数量;用碳二亚胺测定羧基的数量;用四唑重氮盐测定咪唑基的数量等;3、酶分子侧链基团修饰,在酶工程方面可以提高酶的活力、增加酶的稳定性、降低酶的抗原性,并且可以引起酶催化特性和催化功能的改变,以提高酶的使用价值;4、酶分子侧链基团修饰,还可以获得自然界原来不存在的新酶种,例如,某些抗体酶和人工改造的核酸类酶;第六章酶、细胞、原生质体固定化与应用测试题填空题1、固定化酶的制备方法主要有:______、_______、________、_________;2、交联法常用的双功能试剂是:_____________;判断题1、酶经固定化后,其作用的最适pH值往往会发生一些变化;√2、固定化酶的最适作用温度与游离酶相比没有变化;×3、一般来说,用带负电荷的载体制备的固定化酶,其最适pH值比游离酶的最适pH值为高即向碱性一侧移动;用带正电荷载体制备的固定化酶的最适pH值比游离酶的最适PH为低即向酸性一侧移动√4、一般说来,催化反应的产物为酸性时,固定化酶的最适pH值要比游高酶的最适PH低一些;产物为碱性时,固定化酶的最适pH值要比游离酶的最适pH值高一些;×5、固定化酶的底物特异性变化与底物分子量的大小有一定关系;√名词解释1、交联法2、载体活化3、固定化细胞;简答题1、什么是固定化酶有何显着优点2、请举例说明固定化酶、细胞、原生质体技术的应用答案填空题1、吸附法、包埋法、结合法、交联法和热处理法等;名词解释1、交联法:借助双功能试剂使酶分子之间发生交联作用,制成网状结构的固定化酶的方法称为交联法;2、载体活化:要使载体与酶形成共价键对酶进行固定化,必须首先使载体活化,即借助于某种方法,在载体上引进一活泼基团;然后此活泼基团再与酶分子上的某一基团反应,形成共价键;3、固定在载体上并在一定的空间范围内进行生命活动的细胞称为固定化细胞;简答题1、什么是固定化酶有何显着优点固定化酶是指固定在一定载体上并在一定的空间范围内进行催化反应的酶;固定化酶既保持了酶的催化特性,又克服了游离酶的不足之处,具有增加稳定性、可反复或连续使用以及易于和反应产物分开等显着优点;2、略第七章酶非水相催化测试题判断题1、有机溶剂往往会使酶变性失活,因此只有在水溶液中酶才有催化活性;2、在有机介质中,由于酶分子活性中心的结合部位与底物之间的结合状态发生某些变化,致使酶的底物特异性发生改变;3、许多酶在有机介质中的热稳定性比在水溶液中的热稳定性更好;4、目前世界上化学合成药物中的40%左右属于手性药物;在这些手性药物中,大多数仍然以外消旋体形式使用;5、常用的消炎解热镇痛药萘普生Neproxen的两种对映体中,S +-萘普生的疗效是R---萘普生疗效的28倍;6、镇静剂反应停的S-构型有镇静作用,R-构型也有镇静作用,但疗效甚微;7、一些消旋体药物可以在有机介质体系中用酶法进行拆分,获得单一对映体;名词解释1、酶的对映体选择性2、手性化合物第八章酶定向进化复习题一、填空题:酶基因随机突变的方法有:________、____________、_________;二、名词解释:酶定向进化易错PCR技术三、简答题:1.酶定向进化的特点2.酶随机突变的三种方法是什么请解释并比较分析;3.举例说明酶定向进化技术的应用;第九章酶反应器复习题P240复习题1、2、5第十章 1 酶在医药方面的应用测试题一、填空题1、指示肝功能异常的常用酶有:____、______、_______;2、_________酶可以检测癌细胞;3、治疗消化不良、食欲不振的酶有:______、______、________;4、具有抗癌作用的酶有:______、______、_______、__________;5、_________酶可以治疗各种出血;6、_____________酶可以治疗龋齿;7、___________酶可以溶血栓;8、____________酶可以治疗白血病;9、____________酶用于制造抗肿瘤人参皂苷;10、___________酶可用于制造人胰岛素;二、判断题1、乳酸脱氢酶广泛存在于各种组织以及红细胞中,在正常情况下,血清中乳酸脱氢酶的含量很低,但是在肝癌、急性肝炎、心肌梗塞等疾病的患者血清中,该酶活力显着升高;√2、蛋白酶可用于治疗多种疾病,是在临床上使用最早、用途最广的药用酶之一,它可作为消化剂、消炎剂并可用于治疗高血压;√三、请写出以下药品的酶法生产反应式6-氨基青霉烷酸6-APA多巴四、分析说明题1、请分析说明尿糖试纸检测尿糖的原理2、绘图并说明血液透析装置及装置中酶法除去尿素的原理;3、举两例分析说明酶在药物制造方面的应用价值;4、请分析说明溶菌酶的应用价值5、请分析说明SOD的应用价值答案填空题1、谷丙转氨酶、谷草转氨酶、胆碱酯酶2、端粒酶3、淀粉酶、蛋白酶、脂肪酶4、L-精氨酸酶、L-组氨酸酶、L-蛋氨酸酶、谷氨酰胺酶5、凝血酶6、右旋糖酐酶7、溶纤酶8、L- 天冬酰胺酶9、β-D-葡萄糖苷酶 10、无色杆菌蛋白酶请写出以下药品的酶法生产反应式1、6-氨基青霉烷酸6-APA青霉素青霉素酰化酶 6-氨基青霉烷酸6-APA2、多巴酪氨酸β-酪氨酸酶多巴邻苯二酚+丙酮酸+氨β-酪氨酸酶多巴分析说明题4、溶菌酶主要从蛋清、植物和微生物中分离得到;作用机理:溶菌酶作用于细菌的细胞壁,可使病原菌、腐败性细菌等溶解消灭,对抗生素有耐药性的细菌同样起溶菌作用,具有显着疗效而对人体的副作用很小,是一种较为理想的药用酶;应用价值:临床上主要用于治疗各种炎症,溶菌酶与抗生素联合使用,可显着提高抗生素的疗效,常用于难治的感染病症的治疗;还可用于食品保鲜;在护肤品中添加可以消除皮肤表面黏附的细菌,起到杀菌消炎的作用;5、SOD即超氧化物歧化酶,具有抗氧化、抗衰老、抗辐射的功效,添加到护肤品中可以有效防治紫外线对人体的伤害,消除自由基的影响,减少色素沉着;在医疗领域,用于预防辐射损伤,治疗红斑狼疮,皮肌炎,结肠炎,氧中毒;第十章2 酶在食品方面的应用测试题填空题1、_______酶和__________酶可用于食品保鲜;2、______________酶可将蔗糖原料中的棉子糖分解成蔗糖与半乳糖,提高蔗糖的收得率;3、果胶酶pectinase是催化果胶质分解的一类酶的总称,主要包括______和___________;4、_________酶可用于呈味核苷酸的酶法生产;判断题1、糊精是淀粉低程度水解的产物,广泛应用于食品增稠剂、填充剂和吸收剂;√2、写出以下产品酶法生产的反应式1、L-氨基酸的生产2、低乳糖奶的生产3、L-苹果酸的生产4、天苯肽的酶法生产写出以下工艺过程酶法处理的反应式1、柑橘制品脱苦处理2、果蔬制品的脱色简答题1、请分析说明果葡糖浆生产的工艺流程及条件控制2、请分析说明右旋糖酐酶的应用价值3、请分析说明酶在啤酒发酵生产中的应用答案填空题1、葡萄糖氧化酶,溶菌酶2、蜜二糖酶α-半乳糖苷酶3、果胶酯酶PE,聚半乳糖醛酸酶PG4、5,磷酸二酯酶写出以下产品酶法生产的反应式1、L-氨基酸的生产N-酰基DL-氨基酸氨基酰化酶 L-氨基酸蛋白质蛋白酶 L-氨基酸延胡索酸+氨天冬氨酸酶 L-天冬氨酸α-酮戊二酸+NH3+NADPH谷氨酸脱氢酶 L-谷氨酸+H2O+NADP+a-酮戊二酸+L-氨基酸转氨酶 L-谷氨酸+α-酮酸2、低乳糖奶的生产乳糖乳糖酶β半乳糖苷酶半乳糖+葡萄糖3、L-苹果酸的生产延胡索酸+水延胡索酸酶 L-苹果酸4、天苯肽的酶法生产L-Asp +L-Phe-Ome嗜热菌蛋白酶L-Asp-L-Phe-OmeL-天冬氨酸 L-苯丙氨酸甲酯天苯肽写出以下工艺过程酶法处理的反应式1、柑橘制品脱苦处理柚苷柚配质-7-芸香糖苷柚苷酶β-鼠李糖苷酶鼠李糖+无苦味的普鲁宁柚配质一7一葡萄糖苷2、果蔬制品的脱色花青素花青素酶β-葡萄糖和它的配基简答题1、请分析说明果葡糖浆生产的工艺流程及条件控制工艺流程:淀粉浆a-淀粉酶,Ca2+,80~90℃液化液糖化酶葡萄糖DE>96%层析去Ca2+,pH值为6.5~7.0,加入0.01 mol/L的硫酸镁,在60~70℃的温度条件下,葡萄糖异构酶果葡糖浆;控制条件:1、钙离子对a-淀粉酶有保护作用,在淀粉液化时需要添加,但它对葡萄糖异构酶却有抑制作用,所以葡萄糖溶液需用层析等方法精制;2、控制PH3、控制温度葡萄糖转化为果糖的异构化反应是吸热反应;随着反应温度的升高,反应平衡向有利于生成糖的方向变化,异构化反应的温度越高,平衡时混合糖液中果糖的含量也越高;但当温度超过70℃时,葡萄糖异构酶容易变性失活,所以异构化反应的温度以60~70℃为宜;2、请分析说明右旋糖酐酶的应用价值制糖设备中存在大分子黏性葡聚糖,堵塞管道,妨碍设备清洗及蔗糖的结晶;用右旋糖酐酶内切α-1,6-葡聚糖酶处理,可使右旋糖酐分解为异麦芽糖与异麦芽三糖,黏度迅速下降;右旋糖酐酶还可用于防龋;3、请分析说明酶在啤酒发酵生产中的应用在啤酒酿造过程中,制浆和调理两个阶段是要使用酶制剂的1、浸泡麦芽浆时,温度约65℃,有利于蛋白酶,β-葡聚糖酶,α-淀粉酶,发挥作用,使麦芽中的多糖及蛋百类物质降解为酵母可利用的合适的营养物质;2、加啤酒花前,煮沸麦芽汁使上述酶失活;在发酵完毕后,啤酒需要加一些酶处理,以使其口味和外观更易于为消费者接受;蛋白酶降解使啤酒混浊的蛋白质成分,防止啤酒的冷混浊,延长啤酒的储存期;糖化酶能够降解啤酒中的残留糊精,一方面保证了啤酒中最高的乙醇含量,另一方面不必添加浓糖液来增加啤酒的糖度;这种低糖度的啤酒糖尿病患者也可以饮用;第十章 3 酶在其他领域的应用测试题填空题1、造纸业的主要用酶有:___________和___________;2、________酶可以水解RNA,生产四种5,核苷酸;3、生丝脱胶和羊毛除垢可以用____________酶;4、利用__________酶检测有机磷农药污染5、利用_________酶的同工酶监测重金属污染6、通过___________监测大肠杆菌污染名词解释:酶标记免疫反应检测请分析说明蛋白酶在轻工、化工业中的应用;加酶洗涤剂应该满足什么条件加酶洗涤剂有何优势酶法检测必须具备什么条件答案填空题1、木质素酶,木聚糖酶2、5,-磷酸二酯酶3、蛋白酶4、胆碱酯酶5、乳酸脱氢酶6、β-葡聚糖苷酸酶名词解释:酶标记免疫反应检测是将酶的检测技术与免疫检测技术相结合,用于测定样品液中抗体。

第六章酶、细胞和原生质体的固定化前言随着酶工程在不断发展,酶的应用越来越广泛,包括了:医药、食品、轻工、化工、环境保护和科学研究等方面。
如:抗体酶、核酸类酶、端粒酶。
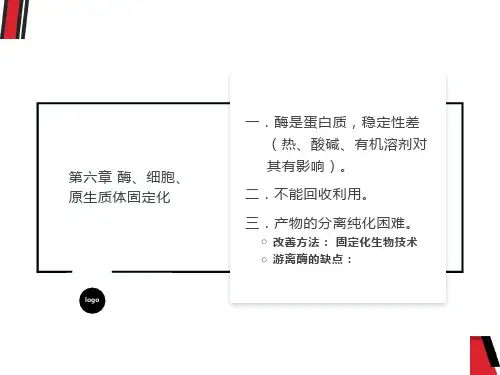
酶的应用——酶工程优点:专一性强催化效率高作用条件温和酶的稳定性较差:除了某些耐高温的酶和胃蛋白酶等可以耐受较低的pH条件,大多数酶在高温、强酸、强碱和重金属离子等外界因素影响下,都容易变性失活。
缺点(不足)酶的稳定性较差:除了某些耐高温的酶和胃蛋白酶等可以耐受较低的pH条件,大多数酶在高温、强酸、强碱和重金属离子等外界因素影响下,都容易变性失活。
酶的一次性使用:酶一般都是在溶液中与底物反应,反应结束后,酶即使活性很高,都会随着反应体系一起被处理掉,很难多次反复回收利用。
产物的分离纯化较困难.酶固定化的产生第一节酶的固定化一、固定化酶发展的背景二、固定化酶的概念三、酶的固定化方法一、固定化酶发展的背景固定化酶(Immobilized Enzyme)是20世纪60年代发展起来的—项新技术。
以往使用的酶绝大多数是水溶性的酶。
这些水溶性酶催化结束后,极难回收,因而阻碍了酶工业的进一步发展。
60年代后,在酶学研究领域内涌现出固定化酶。
它是通过物理的或化学的手段,将酶束缚于水不溶的载体上,或将酶柬缚在一定的空间内,限制酶分子的自由流动,但能使酶充分发挥催化作用;过去曾称其为水不溶酶或固相酶。
1971年第一届国际酶工程会上正式建议采用固定化酶的名称。
一、固定化酶发展的背景从60年代起,固定化酶的研究发展很快,起初人们把注意力集中在酶的固定化方法研究上近年来,不但固定化方法和载体开发有了长足发展,并且已转向它在工业、医药、化学分析、亲和层析、环境保护、能源开发以及理论研究等方面的应用研究。
二、固定化酶的概念曾用名:固相酶、水不溶酶1971年,第一届国际酶工程会议, Immobilized enzyme固定化酶:采用各种方法,将酶与水不溶性载体结合,在一定空间范围内起催化作用的酶。


酶工程思考题第一章绪论1、酶工程的主要任务是什么?2、简述酶工程的主要内容。
3、简述影响酶催化作用的因素。
4、简述酶活力测定步骤。
5、为什么要对酶的特性进行改良?如何改良?6、两大类酶分类与命名的基础是什么?分类与命名的原则是否相同?7、酶的比活力、酶的转换数与催化周期、酶结合效率与活力回收率、相对酶活力这些概念分别有什么作用?第二章微生物发酵产酶1、简述用于酶的生产的细胞应具备的条件。
2、原核生物酶生物合成调节控制模式的实质分别是什么?在酶的发酵生产中如何运用?3、在DNA分子中,与酶的生物合成有密切关系的基因是什么?它们有什么特点和作用?4、在酶的发酵生产中,为什么应尽量控制溶氧速度等于或稍高于耗氧速度?5、在酶的发酵生产中,如何提高酶产量?6、在酶的发酵生产中,为什么延续合成型是最理想的合成模式?对于其它合成模式的酶,如何使它们接近延续合成型?7、什么是生长和产酶动力学?二者的基本动力学方程是什么?8、绘出微生物发酵产酶的一般工艺流程图。
9、在碳源的选择和使用上,如何注意酶生物合成的调节作用?第三章动植物细胞培养产酶1、简述植物细胞的特性。
2、简述植物细胞培养的特点。
3、简述动物细胞的特性。
4、简述动物细胞培养的特点。
第四章酶的提取与分离纯化1、为什么要对细胞进行破碎?如何破碎?2、简述影响酶提的主要因素。
3、简述沉淀分离的主要方法和原理。
4、简述影响离心分离的主要因素。
5、简述层析分离的主要方法和原理。
6、在离子交换层析中,为什么要对离子交换剂进行处理?如何处理?7、在电泳分离中,颗粒的泳动速度受到哪些因素的影响?第五章酶分子修饰1、在限定位点进行修饰的方法有()。
2、能探酶活性中心位置的方法有()。
3、既是修饰方法,又是固定化方法有()。
4、不改变酶的组成单位及其基团的修饰方法有()。
5、采用定点突变技术的修饰方法有()。
6、只适用于酶分子中含有金属离子的修饰方法有()。
7、目前应用最广泛的修饰方法有()。