(医疗药品管理)中药炮制规范
- 格式:doc
- 大小:267.00 KB
- 文档页数:168


医院中药炮制管理制度第一章总则第一条为规范医院中药炮制过程,保障患者用药安全和疗效,依据国家相关法律法规以及医院实际情况,订立本管理制度。
第二条本管理制度适用于医院内全部中药炮制相关的科室和人员。
第三条中药炮制指在医院内进行中药汤剂、中药颗粒、中药胶囊等的配制、煎煮、包装等工作。
第四条本管理制度应与医院其他制度相互搭配,确保医院内部管理的衔接性和全都性。
第二章组织机构第五条设立中药炮制管理部门,由专职中药炮制负责人负责中药炮制工作的协调、监督和管理。
第六条每个中药炮制科室需设立专职或兼职的中药炮制操作人员,具备相关中药炮制技术和知识。
第三章中药炮制操作要求第七条中药炮制操作人员应符合以下要求:•具备中药炮制相关专业技术知识和操作技能;•具备良好的职业道德和责任心;•严格遵守中药炮制的操作规程和标准。
第八条中药炮制操作人员应经过规定的培训和考核,取得相应的操作资格才略上岗。
第九条中药材的采购、储存、配制和包装等过程中,应遵从中药的质量掌控要求,确保药材的质量和纯度。
第十条在中药炮制过程中,应严格依照处方要求和药材配比,正确称量和配制中药材。
第十一条中药材的研磨、煎煮过程中应掌握好火候和时间,确保中药的煎煮质量。
第十二条中药煎煮过程中,应有专人负责监控炉温,确保煎煮过程的稳定性和安全性。
第十三条在中药颗粒和中药胶囊的包装过程中,应严格依照规定的包装要求进行操作,确保包装质量和药品的安全。
第四章质量掌控第十四条中药炮制需要建立相应的质量掌控体系,确保中药的质量稳定和安全可靠。
第十五条中药炮制过程中应严格依照国家、行业和医院订立的质量标准执行。
第十六条中药炮制科室应建立中药炮制记录档案,包含中药炮制的操作记录、质量检验记录等,以备日后的追溯和审计。
第十七条中药炮制科室应定期进行自查和内部质量评估,及时发现问题并进行整改。
第五章安全管理第十八条中药炮制科室应建立安全管理制度,规范中药炮制过程中的安全操作。


第一条为加强中药临床疗效和用药安全~根据《药品管理法》及《药品经营质量管理规范》制定本制度。
第二条“临方炮制”是指医师处方的特殊要求而进行的饮片质量的加工~以求转化药物的性能~降低毒副作用~以提高疗效。
药物的炮制必须严谨、遵章炮制~所用辅料及操作必须按“饮片炮制规范”进行。
第三条临方炮制的目的是:一、除去杂质和非药用部分~或分开不同的药用部分~使药材清洁纯净。
二、易于粉碎~便于配方、制剂和发挥药材有效成分的作用。
三、降低或消除药材的毒性或副作用。
如制草乌~醋制芫花~可使毒性降低。
四、转变药材性能。
如生地黄味甘~性寒~清热凉血。
熟地黄味甘、微苦~性微温~滋阴补血。
五、增强药材的疗效~或引药归经。
六、矫正臭味。
动物类和其它具有特殊臭味的药材~通过炮制可以使气味有所改善。
七、便于贮藏~保存药效。
第四条炮炙应取净药材或切制品~进行加热或与辅料共同加热处理。
除另有规定外~常用的方法和要求如下:1、炒炒制时~应注意加热的温度(通常称“文火”、“文武火”和“武火”)、炒制时间和炒制程度的要求~炒时应火力均匀并不断翻动~勿使受热不均。
清炒取净药材或切制品(置锅内~用文火炒至规定的程度时~取出~放凉。
经炒制后~能缓和药性~其中某些成分可能分解、破坏或者挥发一部分~能使药材松脆~易于粉碎或煎煮~并能矫臭矫味~利于贮藏。
炒焦取净药材或切制品~用武火炒至表面焦褐色、断面色变探~或至规定的程度时~取出~放凉。
一般用于增强健胃消食作用。
麸炒取麸皮~置热锅内~翻炒至微冒烟时~加入净药材或切制品~迅速翻动~至表面呈黄色或色变深时~取出~筛去麸皮~放凉。
麸炒能减少药材中的油脂或烈性~避免引起呕吐或其它副作用。
除另有规定外~每1000克净药材或切制品~用麸皮50—100克。
米炒取大米同净药材或切制品~共置锅内~加热拌炒至米呈黄色~取出~筛去米。
米炒能增强药材健脾和胃作用~降低药材毒性。
每1000克净药材或切制品~用大米200克。
2、煮取净药材或切制品~照该品炮制项下的规定~加水或规定辅料~拌匀~煮至吸干或药材透心时~取出~干燥。

医疗机构应用传统工艺配制中药制剂备案管理实施细则第一条【目的依据】为规范我省医疗机构应用传统工艺配制中药制剂的备案管理工作,保证传统中药制剂安全、有效和质量稳定,根据《中华人民共和国中医药法》《中华人民共和国药品管理法》和国家食品药品监督管理总局《关于对医疗机构应用传统工艺配制中药制剂实施备案管理的公告》,结合我省实际,制定本实施细则。
第二条【适用范围】我省行政区域内医疗机构应用传统工艺配制中药制剂(以下简称传统中药制剂)的备案管理工作适用本细则。
法律、法规、规章另有规定的,从其规定。
第三条【职责划分】省食品药品监督管理局负责全省传统中药制剂的备案管理工作。
市(州)食品药品(市场)监督管理局负责组织对辖区内传统中药制剂品种配制、使用的监督检查。
市(县、区)食品药品(市场)监督管理局负责传统中药制剂的日常监督管理工作。
第四条【制剂范围】本细则传统中药制剂包括以下剂型:(一)由中药饮片经粉碎或仅经水或油提取制成的丸剂(包括蜜丸、水蜜丸、水丸、糊丸、蜡丸、浓缩丸等)、散剂、丹剂、锭剂、茶剂、煎膏剂(膏滋)、膏药、胶剂、浸膏剂、流浸膏剂、糊剂、汤剂、合剂、口服液剂、糖浆剂、搽剂、洗剂等传统剂型;(二)由中药饮片经水提取制成的颗粒剂以及由中药饮片经粉碎后制成的胶囊剂;(三)由中药饮片用传统方法提取制成的酒剂、酊剂。
第五条【资格条件】医疗机构配制传统中药制剂应当取得《医疗机构制剂许可证》并有相应制剂剂型配制范围。
未取得《医疗机构制剂许可证》或者《医疗机构制剂许可证》无相应制剂剂型的医疗机构可委托省内取得《医疗机构制剂许可证》或《药品生产许可证》且有委托配制制剂相应剂型的单位配制。
委托配制须同时向省食品药品监督管理局备案。
第六条【备案禁止】有属于下列情形之一的,不得备案:(一)《医疗机构制剂注册管理办法(试行)》中规定的不得作为医疗机构制剂申报的情形;(二)与市场上已有供应品种相同处方的不同剂型品种;(三)中药配方颗粒;(四)备案品种信息不齐全或材料内容不符合规定形式的;(五)其他不符合国家有关规定的制剂。

附件1:甘肃省食品药品监督管理局甘肃省中药炮制规范标准号:当归(鲜制)DangguiANGELICAE SINENSIS RADIX本品为伞形科植物当归Angelica sinensis(Oliv.)Diels的低温干燥根。
秋末采挖,待水分稍蒸发后,除去须根和泥沙,清洗,趁鲜低温干燥,闷润,切薄片或厚片,低温干燥。
按性状分别称为“当归圆片”、“当归全归片”、“当归头片”和“当归尾片”。
【性状】当归圆片呈类圆形、椭圆形或不规则厚片。
直径0.3~2.5cm。
外表面浅棕色至棕褐色,具不规则的抽缩皱纹及横长的皮孔样突起。
切面略显粗糙,有时具裂隙或抽缩皱纹;皮部黄白色,具多数棕色点状分泌腔,形成层环黄棕色,木质部色较淡。
质稍硬而脆。
有浓郁的香气,味甘、辛、微苦。
当归全归片呈长条形、长卵形薄片,长3~20cm,宽0.3~4cm;中、下部具2~4条形分枝。
常断裂成归头片和归尾片。
当归头片呈长卵形、宽卵形薄片,少数有分枝。
长3~10 cm,宽0.5~4 cm。
当归尾片呈长条形薄片,多弯曲,少数有分枝。
长1~10 cm,宽0.2~0.8 cm。
【鉴别】(1) 粉末淡黄棕色。
韧皮薄壁细胞纺锤形,壁略厚,表面有极微细的斜向交错纹理,有时可见菲薄的横隔。
梯纹导管和网纹导管多见,直径约至80μm。
有时可见油室碎片。
(2)取本品粉末0.5g,加乙醚20ml,超声处理10分钟,滤过,滤液蒸干,残渣加乙醇1ml使溶解,作为供试品溶液。
另取当归对照药材0.5g,同法制成对照药材溶液。
照薄层色谱法(中国药典2015年版通则0502)试验,吸取上述两种溶液各10μl,分别点于同一硅胶G薄层板上,以正己烷–乙酸乙酯(4﹕1)为展开剂,展开,取出,晾干,置紫外光灯(365nm)下检视。
供试品色谱中,在与对照药材色谱相应的位置上,显相同颜色的荧光斑点。
(3)取本品粉末3g,加1%碳酸氢钠溶液50ml,超声处理10分钟,离心,取上清液用稀盐酸调节pH值至2~3,用乙醚振摇提取2次,每次20ml,合并乙醚液,挥干,残渣加甲醇1ml使溶解,作为供试品溶液。
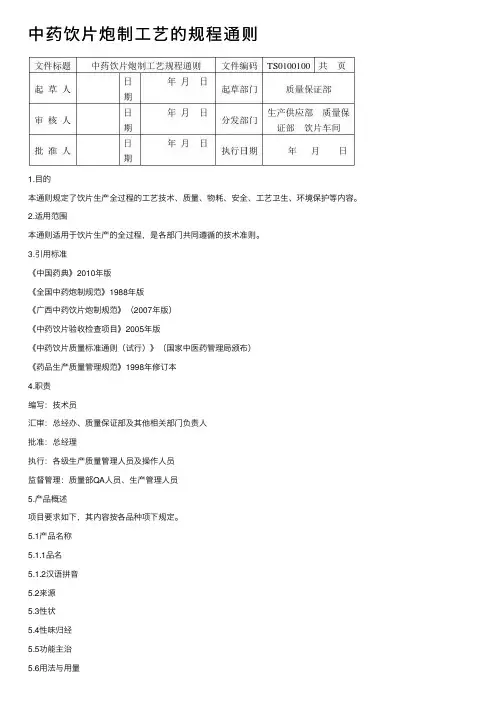
中药饮⽚炮制⼯艺的规程通则1.⽬的本通则规定了饮⽚⽣产全过程的⼯艺技术、质量、物耗、安全、⼯艺卫⽣、环境保护等内容。
2.适⽤范围本通则适⽤于饮⽚⽣产的全过程,是各部门共同遵循的技术准则。
3.引⽤标准《中国药典》2010年版《全国中药炮制规范》1988年版《⼴西中药饮⽚炮制规范》(2007年版)《中药饮⽚验收检查项⽬》2005年版《中药饮⽚质量标准通则(试⾏)》(国家中医药管理局颁布)《药品⽣产质量管理规范》1998年修订本4.职责编写:技术员汇审:总经办、质量保证部及其他相关部门负责⼈批准:总经理执⾏:各级⽣产质量管理⼈员及操作⼈员监督管理:质量部QA⼈员、⽣产管理⼈员5.产品概述项⽬要求如下,其内容按各品种项下规定。
5.1产品名称5.1.1品名5.1.2汉语拼⾳5.2来源5.3性状5.4性味归经5.5功能主治5.6⽤法与⽤量5.7贮藏5.8规格6.⼯艺流程图6.1清炒⼯艺流程图6.2加辅料炒⼯艺流程图6.3炙制⼯艺流程图6.4燀制⼯艺流程图6.5煮制⼯艺流程图6.6蒸制⼯艺流程图6.7烫制⼯艺流程图6.8煨制⼯艺流程图6.9⽔飞⼯艺流程图6.10煅制⼯艺流程图7. 操作过程及⼯艺条件7.1净制: 按照领料程序从库房领出原料,根据《中国药典》2005年版、《全国中药炮制规范》1988年版、《⼴西中药饮⽚炮制规范》2007年版及该品种《炮制⼯艺规程》进⾏净制⽣产。
7.1.1净选操作⼈员严格按照净制SOP进⾏操作。
7.1.1.1操作⼈员选⽤不锈钢筛⽹,筛除泥沙、杂质,⼿选去⾮药⽤部份及霉变药材。
7.1.1.2操作⼈员将净选后的药材在QA监控下转⼊洗药区。
7.1.2.1洗药前的检查,洗药间不得有上次⽣产剩余的物料,洗药池洁净度应符合⽣产要求。
7.1.2.2洗药操作:7.1.2.1检查为正常后⽅可将药材放⼊洗药池内,先打开排⽔阀,再打开进⽔阀将清洁⽔喷⼊洗药池内,使药材得到充分清洗(冲5分钟),清洗⼲净后起料,起料后放⼊洗药⽤料盘内滤去余⽔。

国家中医药管理局卫生部关于印发《医院中药饮片管理规范》的通知国中医药发〔2007〕11号各省、自治区、直辖市卫生厅局、中医药管理局,新疆生产建设兵团卫生局:为加强医院中药饮片管理,保障人体用药安全、有效,根据《中华人民共和国药品管理法》及其《实施条例》等法律、行政法规的有关规定,国家中医药管理局和卫生部制定了《医院中药饮片管理规范》,现印发给你们,请遵照执行。
国家中医药管理局卫生部二○○七年三月十二日医院中药饮片管理规范第一章总则第一条为加强医院中药饮片管理,保障人体用药安全、有效,根据《中华人民共和国药品管理法》及其《实施条例》等法律、行政法规的有关规定,制定本规范。
第二条本规范适用于各级各类医院中药饮片的采购、验收、保管、调剂、临方炮制、煎煮等管理。
第三条按照麻醉药品管理的中药饮片和毒性中药饮片的采购、存放、保管、调剂等,必须符合《麻醉药品和精神药品管理条例》、《医疗用毒性药品管理办法》和《处方管理办法》等的有关规定。
第四条县级以上卫生、中医药管理部门负责本行政区域内医院的中药饮片管理工作。
第五条医院的中药饮片管理由本单位法定代表人全面负责。
第六条中药饮片管理应当以质量管理为核心,制定严格的规章制度,实行岗位责任制。
第二章人员要求第七条二级以上医院的中药饮片管理由单位的药事管理委员会监督指导,药学部门主管,中药房主任或相关部门负责人具体负责。
药事管理委员会的人员组成和职责应当符合《医疗机构药事管理办法》的规定。
一级医院应当设专人负责。
第八条直接从事中药饮片技术工作的,应当是中药学专业技术人员。
三级医院应当至少配备一名副主任中药师以上专业技术人员,二级医院应当至少配备一名主管中药师以上专业技术人员,一级医院应当至少配备一名中药师或相当于中药师以上专业技术水平的人员。
第九条负责中药饮片验收的,在二级以上医院应当是具有中级以上专业技术职称和饮片鉴别经验的人员;在一级医院应当是具有初级以上专业技术职称和饮片鉴别经验的人员。

福建中药饮片炮制规范篇一:中药饮片炮制技术标准需得到统一中药饮片炮制技术标准需得到统一目前我国中药饮片炮制技术标准至今仍不统一,究其原因有多方面。
全国饮片质量普遍低下,也不排除有造假现象;行业至今没有一套统一的中药饮片炮制技术标准;新版GMP已经执行,但是目前的现状却是真正按照GMP标准实行的企业,却在市场无序竞争中却活得很艰难;医院鉴别手段落后,消费者的认识伤有很多的误区等等。
饮片质量低下是全国通病有数据显示,除中国外,全球目前有160个国家和地区在使用中药和针灸,有5万个中医医疗机构。
难以想象的供需差异,催生着中药价格飞涨,造假现象也不时抬头。
国家药监局药品质量公告显示,中药饮片不合格率一直高于西药和中成药。
药品稽查查出的案件中,48%涉及中药饮片。
禹州药商杨侑才(化名)受访时称,中药饮片加工环节掺假是潜规则,造假饮片集中在常用药和名贵药两块,比如全蝎中掺盐、山茱萸掺果核,白参造假西洋参,用僵虫造假冬虫夏草。
3月9日,在省内一家中药材市场内,一位药商指着陈列架上12种大小不一的云南产三七说,光看个头从190元到990元共有12种价格,想真正细分其品质和药效,“恐怕博士毕业也不行”。
“一袋70元一斤的三七粉,里面完全就是叶子和须磨成的粉末。
10年前虫草全国一年才产100多吨,现在一年只产5吨左右。
你说,现在市场上流通的超过5吨以外的虫草是真是假?”他说。
据了解,多年来,药监部门多次清理整顿中药饮片市场,但奏效不大,中药饮片从加工、批发、分销早已形成利益链。
一组最新数据显示,中药饮片质量低下是全国通病,江苏省不合格率为30.59%,甘肃省不合格率为55.4%,天津市为2.2%,北京去年公布的中药饮片合格率是80%。
炮制技术标准至今仍不统一河南本草国药馆董事长宫沛霖在受访时称,中药是典型的一分价钱一分货,他认为乱就乱在没有一套统一的中药饮片炮制技术标准,再就是政府多头管理导致责任界定模糊。
中国中医研究院博士生导师、中药复方新药开发国家工程研究中心常务副主任叶祖光曾公开说,“九五”期间我国就已开展中药饮片标准化研究,但至今没有一套完整的中药饮片标准化体系出台。

中药临方炮制管理办法第一条为加强中药临床疗效和用药安全,根据《药品管理法》及《药品经营质量管理规范》《中华人民共和国药典2015》,《湖南省炮制规范2010》制定本制度。
第二条“临方炮制”是指医师处方的特殊要求而进行的饮片质量的加工,以求转化药物的性能,降低毒副作用,以提高疗效。
药物的炮制必须严谨、遵章炮制,所用辅料及操作必须按《湖南省炮制规范2010》进行。
第三条临方炮制的目的是一、除去杂质和非药用部分,或分开不同的药用部分,使药材清洁纯净。
二、易于粉碎、便于配方、制剂和发挥药材有效成分的作用。
三、降低或消除药材的毒性或副作用。
如制草乌、醋制芫花,可使毒性降低。
四、转变药材性能。
如生地黄味甘、性寒、清热凉血。
熟地黄味甘微苦、性微温、滋阴补血。
五、增强药材的疗效或引药归经。
六、矫正臭味。
动物类和其它具有特殊臭味的药材,通过炮制可以使气味有所改善。
七、便于贮藏保存药效。
第四条炮炙应取净药材或切制品进行加热或与辅料共同加热处理。
除另有规定外,常用的方法和要求如下:1、炒炒制时应注意加热的温度(通常称“文火”、“文武火”和“火”)炒制时间和炒制程度的要求,炒时应火力均匀并不断翻动勿使受热不均。
清炒取净药材或切制品置锅内用文火炒至规定的程度时,取出,放凉。
经炒制后能缓和药性,其中某些成分可能分解、破坏或者挥发一部分,能使药材松脆、易于粉碎或煎煮,并能矫臭矫味、利于贮藏。
炒焦取净药材或切制品,用武火炒至表面焦褐色、断面色变深或至规定的程度时,取出,放凉。
一般用于增强健胃消食作用。
麸炒取麸皮,置热锅内,翻炒至微冒烟时,加入净药材或切制品,迅速翻动,至表面呈黄色或色变深时,取出,筛去麸皮放凉。
麸炒能减少药材中的油脂或烈性,避免引起呕吐或其它副作用。
除另有规定外每1000克净药材或切制品用麸皮50—100克。
米炒取大米同净药材或切制品共置锅内,加热拌炒至米呈黄色取出筛去米。
米炒能增强药材健脾和胃作用,降低药材毒性。

总局关于对医疗机构应用传统工艺配制中药制剂实施备案管理的公告(2018年第19号)2018年02月12日 发布 为贯彻实施《中华人民共和国中医药法》(以下简称《中医药法》)和《中华人民共和国药品管理法》,做好对医疗机构应用传统工艺配制中药制剂(以下简称传统中药制剂)的备案管理工作,促进其健康、有序发展,现将有关事项公告如下: 一、本公告所规定的传统中药制剂包括: (一)由中药饮片经粉碎或仅经水或油提取制成的固体(丸剂、散剂、丹剂、锭剂等)、半固体(膏滋、膏药等)和液体(汤剂等)传统剂型; (二)由中药饮片经水提取制成的颗粒剂以及由中药饮片经粉碎后制成的胶囊剂; (三)由中药饮片用传统方法提取制成的酒剂、酊剂。
二、医疗机构应严格论证中药制剂立题依据的科学性、合理性和必要性,并对其配制的中药制剂实施全过程的质量管理,对制剂安全、有效负总责。
三、医疗机构所备案的传统中药制剂应与其《医疗机构执业许可证》所载明的诊疗范围一致。
属于下列情形之一的,不得备案: (一)《医疗机构制剂注册管理办法(试行)》中规定的不得作为医疗机构制剂申报的情形; (二)与市场上已有供应品种相同处方的不同剂型品种; (三)中药配方颗粒; (四)其他不符合国家有关规定的制剂。
四、医疗机构配制传统中药制剂应当取得《医疗机构制剂许可证》,未取得《医疗机构制剂许可证》或者《医疗机构制剂许可证》无相应制剂剂型的医疗机构可委托符合条件的单位配制,但须同时向委托方所在地省级食品药品监督管理部门备案。
五、传统中药制剂的名称、说明书及标签应当符合《医疗机构制剂注册管理办法(试行)》有关规定,说明书及标签应当注明传统中药制剂名称、备案号、医疗机构名称、配制单位名称等内容。
六、医疗机构应当通过所在地省级食品药品监督管理部门备案信息平台填写《医疗机构应用传统工艺配制中药制剂备案表》(附件),并填报完整备案资料。
医疗机构应当对资料真实性、完整性和规范性负责,并将《医疗机构应用传统工艺配制中药制剂备案表》原件报送所在地省级食品药品监督管理部门。
国家药监局关于发布中药标准管理专门规定的公告文章属性•【制定机关】国家药品监督管理局•【公布日期】2024.07.09•【文号】国家药品监督管理局公告2024年第93号•【施行日期】2025.01.01•【效力等级】部门规范性文件•【时效性】尚未生效•【主题分类】药政管理正文国家药监局关于发布中药标准管理专门规定的公告2024年第93号为全面贯彻落实《中共中央国务院关于促进中医药传承创新发展的意见》,进一步加强中药标准管理,建立符合中医药特点的中药标准管理体系,推动中药产业高质量发展,根据相关法律、法规、规章和规范性文件,国家药监局组织制定了《中药标准管理专门规定》,现予发布,自2025年1月1日起施行。
特此公告。
附件:中药标准管理专门规定国家药监局2024年7月9日附件中药标准管理专门规定第一章总则第一条为进一步加强中药标准管理,建立符合中医药特点的中药标准管理体系,推动中药产业高质量发展,根据《中华人民共和国药品管理法》《中华人民共和国中医药法》《中华人民共和国药品管理法实施条例》《药品注册管理办法》《药品标准管理办法》等法律、行政法规、规章和规范性文件,制定本规定。
第二条中药材、中药饮片、中药配方颗粒、中药提取物、中成药等的国家药品标准、药品注册标准和省级中药标准的管理适用本规定。
第三条坚持传承与创新并重,遵循中医药理论,尊重传统经验,体现中药特点,鼓励新技术和新方法在中药标准中应用,支持采用大数据、人工智能等先进技术,持续提高中药质量可控性。
第四条坚持科学、严谨、实用、规范的原则,在继承传统经验和技术的基础上,加强基础研究,采用现代科学技术研究制定中药标准,兼顾标准的适用性和经济合理性。
第五条坚持以临床为导向,加强中药监管科学研究,科学设置与安全性和有效性相关联的项目和指标。
第六条坚持对中药质量的整体评价,根据关键质量属性及产品特点,建立反映中药整体质量的控制项目、方法和指标,保障中药安全、有效和质量稳定可控。
《药品生产质量管理规范(2016年修订)》附录——中药饮片【最新资料】附件1中药饮片第一章范围第一条本附录适用于中药饮片生产管理和质量控制的全过程。
第二条产地趁鲜加工中药饮片的~按照本附录执行。
第三条民族药参照本附录执行。
第二章原则第四条中药饮片的质量与中药材质量、炮制工艺密切相关~应当对中药材质量、炮制工艺严格控制,在炮制、贮存和运输过程中~应当采取措施控制污染~防止变质~避免交叉污染、混淆、差错,生产直接口服中药饮片的~应对生产环境及产品微生物进行控制。
第五条中药材的来源应符合标准~产地应相对稳定。
第六条中药饮片必须按照国家药品标准炮制,国家药品标准没有规定的~必须按照省、自治区、直辖市食品药品监督管理部门制定的炮制规范或审批的标准炮制。
第七条中药饮片应按照品种工艺规程生产。
中药饮片生产条件应与生产许可范围相适应~不得外购中药饮片的中间产品或成品进行分包装或改换包装标签。
— 3 —第三章人员第八条企业的生产管理负责人应具有药学或相关专业大专以上学历,或中级专业技术职称或执业药师资格,、三年以上从事中药饮片生产管理的实践经验~或药学或相关专业中专以上学历、八年以上从事中药饮片生产管理的实践经验。
第九条企业的质量管理负责人、质量受权人应当具备药学或相关专业大专以上学历,或中级专业技术职称或执业药师资格,~并有中药饮片生产或质量管理五年以上的实践经验~其中至少有一年的质量管理经验。
第十条企业的关键人员以及质量保证、质量控制等人员均应为企业的全职在岗人员。
第十一条质量保证和质量控制人员应具备中药材和中药饮片质量控制的实际能力~具备鉴别中药材和中药饮片真伪优劣的能力。
第十二条从事中药材炮制操作人员应具有中药炮制专业知识和实际操作技能,从事毒性中药材等有特殊要求的生产操作人员~应具有相关专业知识和技能~并熟知相关的劳动保护要求。
第十三条负责中药材采购及验收的人员应具备鉴别中药材真伪优劣的能力。
第十四条从事养护、仓储保管人员应掌握中药材、中药饮片贮存养护知识与技能。
国家中医药管理局、卫生部关于印发《医院中药饮片管理规范》的通知文章属性•【制定机关】国家中医药管理局,卫生部(已撤销)•【公布日期】2007.03.12•【文号】国中医药发[2007]11号•【施行日期】2007.03.12•【效力等级】部门规范性文件•【时效性】现行有效•【主题分类】医疗管理正文国家中医药管理局、卫生部关于印发《医院中药饮片管理规范》的通知(国中医药发〔2007〕11号)各省、自治区、直辖市卫生厅局、中医药管理局,新疆生产建设兵团卫生局:为加强医院中药饮片管理,保障人体用药安全、有效,根据《中华人民共和国药品管理法》及其《实施条例》等法律、行政法规的有关规定,国家中医药管理局和卫生部制定了《医院中药饮片管理规范》,现印发给你们,请遵照执行。
二○○七年三月十二日医院中药饮片管理规范第一章总则第一条为加强医院中药饮片管理,保障人体用药安全、有效,根据《中华人民共和国药品管理法》及其《实施条例》等法律、行政法规的有关规定,制定本规范。
第二条本规范适用于各级各类医院中药饮片的采购、验收、保管、调剂、临方炮制、煎煮等管理。
第三条按照麻醉药品管理的中药饮片和毒性中药饮片的采购、存放、保管、调剂等,必须符合《麻醉药品和精神药品管理条例》、《医疗用毒性药品管理办法》和《处方管理办法》等的有关规定。
第四条县级以上卫生、中医药管理部门负责本行政区域内医院的中药饮片管理工作。
第五条医院的中药饮片管理由本单位法定代表人全面负责。
第六条中药饮片管理应当以质量管理为核心,制定严格的规章制度,实行岗位责任制。
第二章人员要求第七条二级以上医院的中药饮片管理由单位的药事管理委员会监督指导,药学部门主管,中药房主任或相关部门负责人具体负责。
药事管理委员会的人员组成和职责应当符合《医疗机构药事管理办法》的规定。
一级医院应当设专人负责。
第八条直接从事中药饮片技术工作的,应当是中药学专业技术人员。
三级医院应当至少配备一名副主任中药师以上专业技术人员,二级医院应当至少配备一名主管中药师以上专业技术人员,一级医院应当至少配备一名中药师或相当于中药师以上专业技术水平的人员。
凡例《北京市中药饮片炮制规范》(2008年版),以下简称《规范》,是北京市生产、经营、使用、检验以及监督管理中药饮片的法定依据。
中成药中的原料药炮制方法,除另有规定外,均按本规范执行。
“凡例”是解释和使用《规范》进行中药饮片炮制加工和质量检定的基本反导原则,并把与正文,附录及质量检定有关的共性问题加以规定,避免本《规范》中重复说明。
“凡例”中的有关规定与《规范》正文具有同等约束力。
一、本《规范》分目录、正文、附录、索引四部分。
其中目录与正文对应,按药用部位编排,分为根及根茎类、叶类、花类、皮类、全草类、藤木类、果实种子类、树脂类、矿物类、动物类、菌藻类、其它类十二类。
各类中药按名称首字笔画顺序排列,炮制品列在生品后,仅收载炮制品的按炮制品名称笔画顺序排列。
附录收载了炮制目的、炮制通则、炮制常用辅料、中药用药禁忌、毒性中药管理等内容。
索引包括汉语拼音索引、笔画索引。
二、每一品种项下,按顺序分别列有:(1)品名;(2)药材来源;(3)炮制;(4)性状;(5)鉴别;(6)检查;(7)浸出物;(8)含量测定;(9)性味与归经;(10)功能与主治;(11)用法与用量;(12)注意;(13)贮藏。
三、每个品种一般按下列各项记述。
1、品名包括中文名和汉语拼音。
采用《中华人民共和国药典》2005年版、《卫生部药品标准》(中药材)第一册及《北京市中药材标准》(1998年版)的正式用名;上述标准未收载的品种,采用北京市习用名称。
2、药材来源包括药材原植(动)物的科名、植(动)物中文名、拉丁学名、药用部位(矿物药注明类、族、矿石名或岩石名、主要成分)及采收季节、产地加工和优质评价等内容。
3、炮制包括药材净制、切制、炮炙等加工方法。
记述加工炮制的操作要点和基本要求,辅料量,简明工艺参数等。
4、性状系指对炮制后的中药饮片形状、大小、表面、色泽、质地、断面及气味等特征的描述。
同一名称有多种来源的饮片,其性状有明显区别的均分别描述。
医院中药饮片管理规范第一章总则第一条为加强医院中药饮片管理,保障人体用药安全、有效,根据《中华人民共和国药品管理法》及其《实施条例》等法律、行政法规的有关规定,制定本规范。
第二条本规范适用于各级各类医院中药饮片的采购、验收、保管、调剂、临方炮制、煎煮等管理。
第三条按照麻醉药品管理的中药饮片和毒性中药饮片的采购、存放、保管、调剂等,必须符合《麻醉药品和精神药品管理条例》、《医疗用毒性药品管理办法》和《处方管理办法》等的有关规定。
第四条县级以上卫生、中医药管理部门负责本行政区域内医院的中药饮片管理工作。
第五条医院的中药饮片管理由本单位法定代表人全面负责。
第六条中药饮片管理应当以质量管理为核心,制定严格的规章制度,实行岗位责任制。
第二章人员要求第七条二级以上医院的中药饮片管理由单位的药事管理委员会监督指导,药学部门主管,中药房主任或相关部门负责人具体负责。
药事管理委员会的人员组成和职责应当符合《医疗机构药事管理办法》的规定。
一级医院应当设专人负责。
第八条直接从事中药饮片技术工作的,应当是中药学专业技术人员。
三级医院应当至少配备一名副主任中药师以上专业技术人员,二级医院应当至少配备一名主管中药师以上专业技术人员,一级医院应当至少配备一名中药师或相当于中药师以上专业技术水平的人员。
第九条负责中药饮片验收的,在二级以上医院应当是具有中级以上专业技术职称和饮片鉴别经验的人员;在一级医院应当是具有初级以上专业技术职称和饮片鉴别经验的人员。
第十条负责中药饮片临方炮制工作的,应当是具有三年以上炮制经验的中药学专业技术人员。
第十一条中药饮片煎煮工作应当由中药学专业技术人员负责,具体操作人员应当经过相应的专业技术培训。
第十二条尚未评定级别的医院,按照床位规模执行相应级别医院的人员要求。
第三章采购第十三条医院应当建立健全中药饮片采购制度。
采购中药饮片,由仓库管理人员依据本单位临床用药情况提出计划,经本单位主管中药饮片工作的负责人审批签字后,依照药品监督管理部门有关规定从合法的供应单位购进中药饮片。
中药炮制规范第九批品名目录及内容根、根茎类豆蔻壳蒲包草根青果核胡颓子根南瓜子凌霄根草豆蔻蜘蛛香草果仁桃树根功劳子穿破石白胡椒桑树根朝天子铁包金地肤子酸模肥皂子果实、种子类白茄子曼陀罗子樟梨子广天仙子瓜蒌子万年青子桂丁香银花子桂花子大风子红豆蔻马蔺子莱菔子白平子-棕榈子六轴子甜瓜子水苦荬甜石莲水蜈蚣芦子荜澄茄乌韭棉花子北瓜蒲种壳绿豆莳萝子榧子石仙桃桑椹光明子桃仁西青果荜茇蒲葵子豆蔻草类矿物类大金牛草咸秋石红旱莲草大青盐绒线草无名异百蕊草密陀僧牛筋草云母石酢浆草铅粉田字草银硝- 灯笼草铁落点地梅银朱丁葵草腰黄肺形草铜绿狗舌草针砂狗尾草胆矾盒子草皮硝碎米荠雄黄苍耳草水银西小草青铅薄荷藤、木、茎枝类动物类萝藦藤龙骨锁阳龙齿豆蔻壳doukouke(讨论稿1)本品为姜科植物白豆蔻AmomumkravanhPierreexGagnep.或爪哇白豆蔻AmomumcompactumSolandexMaton的干燥成熟果壳。
【通用名称】白蔻衣、白蔻壳、白豆蔻壳、蔻壳。
【炮制】将原药除去残留种子等杂质,筛去灰屑。
【性状】本品呈多裂瓤瓣状或半圆形,长1~1.8cm。
外表面黄白色至淡黄棕色,有三条纵向槽沟及隆起线,两端可见突起的柱基及圆形果柄痕。
内表面黄白色至淡黄色。
体轻,质脆,易纵向碎裂。
气芳香,味微辛凉。
【检查】杂质不得过2%(中国药典2005年版一部附录ⅨA)。
水分照水分测定法(中国药典2005年版一部附录ⅨH第一法)测定,不得过10.0%。
【性味与归经】辛,微温。
归肺、脾、胃。
【功能与主治】行气宽中,和胃止呕。
用于胸脘胀满,恶心呕吐。
【用法与用量】3~5g。
【贮藏】置干燥处。
豆蔻壳质量标准起草说明参照原药典标准115页原规范176页豆蔻壳收载于上海市中药炮制规范1994年版。
根据上海市食品药品监督管理局对上海市中药炮制规范重新修订的要求,修订了白豆蔻壳的质量标准,并增订了白豆蔻壳的水分、杂质等检查项目。
具体结果如下:一、来源同上海市中药炮制规范1994年版。
二、炮制同上海市中药炮制规范1994年版。
三、性状同上海市中药炮制规范1994年版。
四、检查项1、水分不得过10.0%。
拟订。
2、杂质不得过2%。
拟订。
五、其他性味、功能与主治、用法与用量、贮藏项均同上海市中药炮制规范1994年版。
编写小组:根据药典在性味上增加了归经。
在文字上作了相应的修改。
白平子Baipingzi(讨论稿1)本品为菊科植物红花CarthamustinctoriusL.的干燥成熟果实。
【通用名称】红花子。
【炮制】将原药除去黑粒等杂质,筛去灰屑。
【性状】本品略呈卵形,长5~8mm,宽4~5mm。
外表面白色至黄白色,稍具光泽,有4条棱线,上端四角鼓起,中心有圆形花柱基,基部较狭,歪斜一侧可见果柄痕。
果壳坚脆,剖开后,内有黄白色种子1粒。
子叶两片,肥厚,富油性。
气微,味微苦。
【检查】杂质不得过2%(中国药典2005年版一部附录ⅨA)。
水分照水分测定法(中国药典2005年版一部附录ⅨH第一法)测定,不得过12.0%。
【性味】辛,温。
【功能与主治】解痘毒,活血。
用于痘出不快,妇女血气瘀滞腹痛。
【用法与用量】3~9g,用时捣碎。
【贮藏】置阴凉干燥处,防泛油。
白平子质量标准起草说明原药材标准83页原规范174页白平子收载于上海市中药炮制规范1994年版。
根据上海市食品药品监督管理局对上海市中药炮制规范重新修订的要求,修订了白平子的质量标准,并增订了白平子的水分、杂质等检查项目。
具体结果如下:一、来源同上海市中药炮制规范1994年版。
二、通用名称同上海市中药炮制规范1994年版。
三、炮制同上海市中药炮制规范1994年版。
四、性状同上海市中药炮制规范1994年版。
五、检查项1、水分不得过12.0%。
拟订。
2、杂质不得过2%。
拟订。
六、其他性味、功能与主治、用法与用量、贮藏项均同上海市中药炮制规范1994年版。
编写小组:根据中药材标准,在性状上进行了适当的修改。
北瓜Beigua(讨论稿1)本品为葫芦科植物笋瓜CucurbitamaximaDuch.exLam.栽培品种鼎足瓜(金瓜)的新鲜成熟果实。
【炮制】用时,除去瓜蒂等杂质,洗净,切成块。
【性状】本品果形奇异。
上半部呈扁圆形,直径10~25cm;外表桔红色,光滑;可见自顶端中央向四周辐射的细腻花纹,有时可见大小不一、分布不规则的瘤状斑痕;中央下陷处具残留短柄,无柄座。
下半部小,略呈圆方形,显著突起成脐,并有十字形深沟,呈四足状,脐部灰白色。
果肉黄色或深黄色,厚约5mm;具液汁;种子多数,若南瓜子形。
气微,味甘。
【检查】不得有干瘪或霉烂。
【性味】甘,微苦,平。
【功能与主治】用于治支气管哮喘。
单味应用或与其他药材配制成膏滋服。
【用法与用量】鲜果1只(约重500g),去蒂,加入冰糖、蜂蜜各50g,炖熟,其可食部分10次服用。
【贮藏】置阴凉处,防腐烂、干瘪。
北瓜质量标准起草说明药材标准79页北瓜上海市中药炮制规范1994年版未于收载,根据上海市食品药品监督管理局对上海市中药炮制规范重新修订的要求,修订了北瓜的质量标准,本品的药材标准收载于《上海市中药材标准》(p79)中,据此作出修订,具体结果如下:一、品名据《上海市中药材标准》订。
二、来源据《上海市中药材标准》订。
三、通用名称无。
四、炮制参照北瓜通常使用方法,起草本项。
五、性状本品依据《上海市中药材标准》药材性状描述,起草本项。
六、检查本项有“不得有干瘪或霉烂”检查,系据《上海市中药材标准》中内容修订。
七、性味与归经性味照《上海市中药材标准》。
归经待查。
八、功能与主治照《上海市中药材标准》录,但仅有主治内容,无功能内容;拟讨论。
九、用法与用量照《上海市中药材标准》录。
十、贮藏照《上海市中药材标准》,语句稍作修改和补充。
编写小组:在文字上作了适当的修改。
荜澄茄Blchengqie(讨论稿1)本品为樟科植物山鸡椒Litseacubeba(Lour.)Pers.的干燥成熟果实。
【通用名称】荜澄茄。
【炮制】将原药除去果柄等杂质,筛去灰屑。
【性状】本品呈圆球形,直径4~6mm。
外表面棕褐色至黑褐色,具隆起的网状皱纹,基部可见圆形果柄痕,外皮油润;除去外皮,可见硬脆的果粒,种子1粒,黄棕色,有肥厚子叶2片,富油性,气芳香,味稍辣而微苦。
【鉴别】取本品粉末0.25g,加石油醚(60~90)10ml,超声处理15分钟,放冷,滤过,虑液作为供试品溶液。
另取荜澄茄对照药材0.25g,同法制成对照药材溶液。
照薄层色谱法(附录ⅥB)试验。
吸取上述两种溶液各5μl,分别点于同一高效硅胶G薄层板上,以石油醚(60~90)-乙醚(3︰2)为展开取出剂,展开,晾干,喷以10%硫酸乙醇溶液,在105℃加热至斑点显色清晰,分别置日光及紫外光灯(365nm)下检视。
供试品色谱中,在与对照药材色谱相应的位置上,显相同颜色的斑点或荧光斑点。
【检查】杂质不得过2.0%(中国药典2005年版一部附录ⅨA)水分照水分测定法(中国药典2005年版一部附录ⅨH第二法)测定,不得过10.0%。
总灰分不得过5.0%(附录ⅨK)。
酸不溶性灰分不得过1.0%(附录ⅨK)。
【浸出物】照醇溶性浸出物测定法项下的热浸法(附录ⅨА)。
测定,以乙醇作溶剂,不得少于28.0%。
【性味与归经】辛,温。
归脾、胃、肾、膀胱经。
【功能与主治】温中散寒,行气止痛。
用于胃寒呕逆,脘腹冷痛,寒疝腹痛,寒湿,小便浑浊。
【用法与用量】1.5~3g。
【贮藏】置阴凉干燥处。
荜澄茄质量标准起草说明荜澄茄收载于上海市中药炮制规范1994年版。
根据上海市食品药品监督管理局对上海市中药炮制规范重新修订的要求,并参照中国药典2005年版,修订了荜澄茄的质量标准,并增订了荜澄茄的鉴别、水分、杂质、总灰分、酸不溶性灰分、浸出物等项目。
具体结果如下:一、样品二、来源同上海市中药炮制规范1994年版。
三、炮制同上海市中药炮制规范1994年版。
四、性状同上海市中药炮制规范1994年版。
并参照中国药典2005年版,作了适当修改。
编写小组:根据大药典范,对性状进行了适当的修改。
五、鉴别参照中国药典2005年版。
对性状进行了适当修改,六、检查项1、水分不得过12.0%。
参照中国药典2005年版。
2、杂质不得过1%。
拟订。
3、总灰分不得过4.0%。
参照中国药典2005年版。
编写小组:现改为不得过5.0%。
4、酸不溶性灰分不得过1.0%。
参照中国药典2005年版。
5、浸出物照醇溶性浸出物测定法项下的热浸法(附录XА)测定以乙醇作溶剂,不得少于28.0%。
参照中国药典2005年版。
七、其他性味与归经、功能与主治、用法与用量、贮藏项均同上海市中药炮制规范1994年版、中国药典2005年版一部。
草豆蔻Caodoukou(讨论稿1)本品为姜科植物草豆蔻A1piniakatsumadaiHayata的干燥近成熟种子(种子团)。
【通用名称】草蔻。
【炮制】将原药除去杂质,筛去灰屑。
【性状】本品为类球形的种子团,直径1.5~2.7cm。
外表面灰褐色,中间有黄白色的隔膜,将种子团分成3瓣,每瓣有种子多数,粘连紧密,种子团略光滑。
种子为卵圆状多面体,长3~5mm,直径约3mm,外被淡棕色膜质假种皮,种脊为一条纵沟,一端有种脐;质硬,将种子沿种脊纵部两瓣,纵断面观呈现斜心形,种皮没种脊向内伸入部分约占整个表面积的1/2;胚乳灰白色。
气香,味辛、微苦。
【鉴别】(1)本品横切面:假种皮有时残存,为多角形薄壁细胞。
种皮表皮细胞类圆形,壁较厚;下皮为1~3列薄壁细胞,略切向延长;色素层为数列棕色细胞,其间散有类圆形油细胞1~2列,直径约50μm;内种皮为1列栅状厚壁细胞,棕红色,内壁与侧壁极厚,胞腔小,内含硅质块。
外胚乳细胞含淀粉粒及草酸钙方晶和少数细小簇晶。
内胚乳细胞含糊粉粒。
粉末黄棕色。
种皮表皮细胞表面观呈长条形,直径约至30μm,壁稍厚,常与下皮细胞上下层垂直排列;下皮细胞表面观长多角形或类长方形。
色素层细胞皱缩,界限不清楚,含红棕色物,易碎裂成不规则色素块。
油细胞散列于色素层细胞间,呈类圆形或长圆形,含黄绿色油状物。
内种皮厚壁细胞黄棕色或红棕色,表面观多角形,壁厚,非木化,胞腔内含硅质块;断面观细胞1列,栅状,内壁及侧壁极厚,胞腔偏外侧,内含硅质块。
外胚乳细胞充满淀粉粒集结成的淀粉团,有的包埋有细小草酸钙方晶。
内胚乳细胞含糊粉粒及脂肪油滴。
(2)取本品粉末1g,加甲醇5ml,置水浴中加热振摇5分钟,滤过,滤液作为供试品溶液。
另取山姜素和小豆蔻明对照品,加甲醇制成每1ml各含2mg的混合溶液,作为对照品溶液。
照薄层色谱法(附录ⅥB)试验,吸取上述两种溶液各5μl,分别点于同一硅胶G薄层板上,以苯-醋酸乙酯-甲醇(15︰4︰1)为展开剂,展开,取出,晾干,于100℃加热至斑点显色清晰,置紫外光灯(365nm)下检视。