在一个密闭容器内有四种物质解读
- 格式:doc
- 大小:19.00 KB
- 文档页数:1

2024届江苏省江阴市江阴初级中学九年级化学第一学期期中达标检测试题注意事项:1.答卷前,考生务必将自己的姓名、准考证号填写在答题卡上。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑,如需改动,用橡皮擦干净后,再选涂其它答案标号。
回答非选择题时,将答案写在答题卡上,写在本试卷上无效。
3.考试结束后,将本试卷和答题卡一并交回。
一、单选题(本题包括12个小题,每小题3分,共36分.每小题只有一个选项符合题意)1.在一个密闭容器内有甲、乙、丙、丁四种物质,在一定条件下充分反应,测得反应前后各物质的质量如下,下列说法正确的是物质甲乙丙丁反应前质量/g 20 10 20 20反应后质量/g 2 待测32 26A.乙一定是催化剂B.该反应是化合反应C.待测质量为10 g D.反应中甲、丁的质量比为1∶1 2.为预防新型禽流感蔓延,可用ClO2进行环境消毒。
制取CO2的反应过程示意图如图所示,下列说法错误的是()A.反应物是NaClO2和Cl2B.该反应是化合反应C.保持氯气化学性质的最小粒子是氯分子D.反应后原子的种类没有改变3.锶元素的原子结构示意图和在元素周期表中显示的信息见图.下列说法正确的是()A.锶的相对原子质量是87.62gB.锶原子的中子数为38C.锶离子的核外电子数是36,形成的锶离子符号是Sr2+D.从这两张图中能得出锶原子的质子数为为874.下列属于化学性质的是 ( )A.可燃性B.导电性C.溶解性D.挥发性5.下列物质的化学式书写不正确...的是A.氧气O2B.二氧化硫SO2C.氧化铁FeO D.氯化钠NaCl6.下列现象的微观解释中,不正确的是A.“八月桂花香”——分子在不断地运动B.水烧开后易把壶盖冲起——温度升高,分子空隙变大C.氧气和液氧都可助燃——相同物质的分子,化学性质相同D.水结冰体积膨胀——温度降低,分子体积变大7.下列给物质加热的操作不正确的是A.试管口不要对着自己或他人B.试管内液体体积不应超过试管容积的1/3C.应先使试管底部均匀受热,再用酒精灯的外焰固定加热D.加热后的试管,应立即用冷水冲洗干净8.科学家正致力于将二氧化碳转化为甲烷,其反应的微观示意图如下。

第一步小题夯基础考点27密闭容器中反应前后的质量变化真题回顾1.(2020海南省卷)一定条件下,甲、乙混合后发生化学反应,测得反应前后各物质的质量变化如下表所示。
下列说法中,不正确的是()物质甲乙丙丁反应前的质量/g 50 0.5 0 0反应后的质量/g 23 X 24 3A.X 的值等于0 B.甲一定是化合物C.丙和丁的质量变化比为8:1 D.该反应是分解反应【答案】A【解析】反应后质量增多的物质是生成物,质量减少的物质是反应物,差量是生成的质量或参加反应的质量。
根据质量守恒定律,50g+0.5g+0g+0g=23g+X+24g+3g,X=0.5。
甲是反应物,参加反应的质量为:50g-23g=27g,乙的质量不变,既不是反应物,也不是生成物。
丙是生成物,生成丙的质量为24g,丁是生成物,生成丁的质量为3g。
该反应是:甲→丙+丁。
根据以上分析可知:A、X 的值等于0.5,故A错误;B、甲发生分解反应,故甲一定是化合物,故B正确;C、丙和丁的质量变化比为24:3= 8:1,故C正确;D、该反应是:甲→丙+丁,是由一种物质生成两种物质的反应,属于分解反应,故D正确。
故选A。
2.(2020辽宁营口)在点燃条件下,甲和乙反应生成丙和丁。
它们的微观结构示意图如下所示(其中“”代表氢原子,“●”代表碳原子,“”代表氧原子)。
下列叙述错误的是()物质甲乙丙丁微观示意图A.生成物均为氧化物B.甲中碳、氢、氧三种元素的质量比为12:3:8C.在该反应中,生成丙和丁的质量比为3:11 D.在该反应中,甲和乙的分子个数比为1:3 【答案】C【解析】根据题意,该反应的方程式为C2H6O+3O2点燃2CO2+3H2O。
A、生成物是水与二氧化碳,两者均是由两种元素组成的化合物,且其中一种是氧元素,因此都是氧化物,故A正确;B、甲即为乙醇,则甲中碳、氢、氧三种元素的质量比=(12×2):(1×6):16=12:3:8,故B正确;C、反应中生成丙和丁的质量比等于其相对分子质量和化学计量数乘积的比,即:(3×16)(2×44)=54:88=27:44,故C错误;D、由反应方程式可知在该反应中,甲和乙两种物质的分子个数比为1:3,故D正确;故选C。

质量守恒定律------表格题化学反应中,随着时间的延续,反应物的质量会减少,生成物的质量会增加。
这就给判断谁是反应物,谁是生成物提供了依据。
即:质量减少的物质是反应物,质量增加的物质是生成物。
如果有“待测”项,结合质量守恒定律,就可以算出。
选项中往往考察:1、物质是反应物、生成物、还是催化剂、杂质?2、反应后,各物质的质量或质量比3、反应物真正参加反应的那一部分质量的质量比4、某物质的组成元素及其质量比等5、化学反应及其反应类型;化学计量数之比1、在一密闭容器中有A、B、C、D四种物质,一定条件下使之反应,一段时间后,测得反应前后各物质的质量如下:物质 A B C D反应前质量/g 90 10 8 2反应后质量/g 11 59.25 29.75 10则该密闭容器中发生的化学反应类型为反应(填“化合”或“分解”)。
2、在一个密闭容器内有A、B、C、D四种物质,在一定条件下充分反应,测得反应前后各物质的质量如下表,请根据此推断密闭容器中发生的化学反应的基本类型为()物质 A B C D反应前质量/g 24.5 2.0 1.0 8.0反应后质量/g 0 16.9 待测 8.0A、分解反应B、化合反应C、置换反应D、复分解反应3、在一个密闭容器内有A、B、C、D四种物质,在一定条件下充分反应。
测得反应前后各物质的质量如下:物质 A B C D 反应前质量/g 0 80 10 25反应后质量/g 111 0 1 3则该密闭容器中发生的化学反应为( )A. A+B→C+DB. B+C+D→AC. A→B+C+DD. B+D→A+C4、把A、B、C、D四种纯净物放在一密闭容器中,在一定条件下充分反应,反应前后各物质的质量如下表:物质 A B C D 反应前质量/g 2 24.5 2 1反应后质量/g 16.9 0 2 未知回答下列问题:(1)反应后D的质量是g;(2)C物质可能是(填写反应物、生成物或催化剂);(3)容器中发生反应的反应类型是(填写基本反应类型)。

专题五 化学方程式考点13 质量守恒定律【划考点】一、质量守恒定律的理解1.内容:参加化学反应的各物质的质量总和等于反应后生成的各物质的质量总和2.实质:分子分解→ 原子重新结合→ 新分子,也是化学变化的实质3.质量守恒定律总结根据质量守恒定律,得出化学反应过程中的“变与不变”(1)6个不变宏观:① 元素的种类不变 ;② 元素的质量不变 ;③ 物质的总质量不变微观:①原子的种类不变;② 原子的数目不变 ;③ 原子的质量不变(2)2个一定变宏观: 物质的种类改变 ;微观 分子的种类改变(3)2个可能改变① 元素的化合价可能改变 ;② 分子的总数可能改变思维突破:①只适用于 化学变化 ,不能用于 物理变化 。
①质量守恒定律指的是“质量守恒”,不包括其他方面的守恒。
如气体之间的反应,其反应前后,气体体积可能发生变化,不能用质量守恒定律解释。
①质量守恒定律强调参加反应的各物质,没有参加反应的物质不包括在内 。
①“质量总和”包括生成的固体、液体、气体 的物质质量总和二、质量守恒定律的运用:(1)解释常见化学现象中的质量关系,如:铁生锈质量增加,木炭燃烧成灰质量减少等。
(2)利用质量守恒定律,根据化学方程式确定物质的化学式。
(3)利用质量守恒定律,根据化学方程式确定物质的相对分子质量。
(4)利用质量守恒定律,根据化学方程式求反应中某元素的质量。
(5)利用质量守恒定律,根据化学方程式求反应中某物质的质量三、质量守恒定律的验证方案二:铁钉与硫酸铜溶液反应前后质量的测定方案三:盐酸与碳酸钠粉末反应前后质量的测定方案四:镁条燃烧前后质量的测定1.验证质量守恒定律,必须在密闭环境中进行。
2.红磷燃烧实验中气球的作用:缓冲气压,防止红磷燃烧放热导致温度升高气压变大。
3.用气球密封后,发现反应结束后,天平不平衡,原因是:鼓起的气球受空气浮力的影响,干扰实验结果。
【明考向】考向1——定性推断【典例1】下列现象不能用质量守恒定律解释的是是()A.石蜡熔化前后,其质量不变B.高锰酸钾加热后固体质量减少C.木材在空气中燃烧后化为灰烬,灰烬的质量小于木材的质量D. 在空气中加热铜丝,生成物的质量比原来铜丝的质量大【答案】A【解析】质量守恒定律适用于化学变化,不适用于物理变化,故选A。

质量守恒定律(含解析)一、单选题1.某可燃化合物×完全燃烧的化学方程式为X+O2→CO2+H2O(未配平)则X不可能是()A. COB. CH4C. 甲醇(CH3OH) D. 乙醇(CH3CH2OH)2.在一密闭容器内有4种物质,通过电火花引燃后发生充分反应,测得反应前后各物质的质量如下表:甲乙丙丁反应前的质量/g 4 10 1 25反应后的质量/g 未测定21 10 9已知丁的相对分子质量为甲的2倍,则该反应的化学方程式中甲与丁的化学计量数的比为()A. 1:1 B. 1:2 C. 1:3 D. 2:13.已知 2NaClO3+H2SO4+SO2=2X+2NaHSO4由此可知X物质的化学式为()A. ClO2B. NaClC. NaClOD. Cl2O4.在密闭容器内进行的某反应中,测得反应前(t0)、反应中(t1)、反应后(t2)不同时刻甲、乙、丙、丁四种物质的质量分数分别如下图所示,则下列说法不正确的是()A. t1时刻,乙、丁、丙所占的质量分数分别为22%、23%和43%B. 若反应前甲、乙、丙、丁四种物质的总质量为100克,则再增加12克甲,甲与乙则恰好C. 该反应既不可能是化合反应,也不可能是分解反应D. 若甲和丁分别是镁和碳,则该反应中甲和丁的化学计量数之比为1:25.关于化学方程式2H2+O22H2O的读法正确的是()A. 每2个氢分子和1个氧分子在点燃条件下发生反应,生成2个水分子B. 氢和氧在点燃条件下化合生成水C. 氢元素和氧元素在点燃条件下反应生成水D. 每4g氢气跟32g氧气在点燃的条件下反应生成36g水6.下列对化学反应前后质量变化的解释,不符合质量守恒定律的是()A. 高锰酸钾受热分解后固体剩余物的质量减小,是因为放出了氧气B. 蜡烛燃烧后质量变小,是因为蜡烛受热形成了石蜡蒸气C. 细铁丝在氧气中燃烧后,质量增大,是因为生成物中含有氧的质量D. 白磷在密闭容器中燃烧,反应前后总质量不变,是因为生成物都没有逸散7.在化学反应A+B=C+D中,已知80g A与24g B恰好完全反应生成42g C,则生成D的质量为()A. 56gB. 62gC. 52gD. 60g8.下列实验方案中,设计不合理的是()A. 用二氧化锰区别水和过氧化氢溶液 B. 用过滤的方法将浑浊的水变为澄清的水C. 用燃烧木炭的方法制备纯净的二氧化碳气体D. 用熟石灰鉴别氯化铵和氯化钾9.下列问题的研究中,未利用对比实验思想方法的是()A. MnO2的催化作用B. 碘的溶解性C. 白磷红磷着火点 D. 水的组成10.长期放置在空气中的银制品,其表面会逐渐变黑,这是由于银和空气中的微量硫化氢发生了下列反应:4Ag+2H2S+O2═2X+2H2O,其中X的化学式为()A. AgSB.Ag2O C.Ag2O2 D.Ag2S11.下图是两种气体发生化学反应的微观示意图,其中相同的球代表同种原子,下列有关说法正确的是()A. 分子在化学变化中不可分割 B. 反应后生成了两种新的化合物C. 该反应属于置换反应D. 化学反应前后原子的种类和数量不变12.在X+2O2CO2+2H2O中,根据质量守恒定律,X的化学式为( )A. CH4B. C2H5OHC. CH3OHD. CH3COOH13.向1molFe2O3中通入CO并加热,随着CO的通入,有关量的变化如下图,分析正确的是()A. 曲线甲表示生成铁物质的量 B. 曲线乙表示氧化铁物质的量C. K点时生成铁与剩余氧化铁物质的量相等D. K点时固体中铁元素物质的量是2mol二、多选题14.在托盘天平的两盘上各放一只质量相同的烧杯,在两只烧杯里分别加入等质量、等溶质质量分数的稀盐酸,将天平调节至平衡。

1.(2022春·山东东营·八年级统考期中)下列有关质量守恒定律说法正确的是 A .点燃蜡烛时,蜡烛的质量越来越少,所以这个化学反应不遵守质量守恒定律 B .100g 水完全蒸发可以得到100g 水蒸气,这个规律符合质量守恒定律 C .4g 木炭在16g 氧气中充分燃烧必然生成20g 二氧化碳D .24g 镁在空气中完全燃烧生成40g 氧化镁,实际消耗氧气的质量为16gA .蜡烛燃烧前装置内只有氧气B.氧气浓度小于一定值时,蜡烛无法燃烧C.过程中装置内物质总质量不断减少D.蜡烛熄灭后瓶内只剩二氧化碳气体和水蒸气【答案】B【详解】A、装置内是空气,空气中有氮气、氧气、二氧化碳等,此选项错误;B、由氧气含量的变化图可知,当氧气体积分数达到15.96%时蜡烛熄灭,因此氧气浓度小于一定值时,蜡烛无法燃烧,此选项正确;C、根据质量守恒定律,该装置密闭,因此总质量不变,此选项错误;D、由氧气含量的变化图可知,蜡烛熄灭后氧气有剩余,此选项错误。
故选B。
3.(2023春·山东淄博·八年级淄博市张店区实验中学校考期中)质量守恒定律是自然科学的基本定律之一,它的发现使得化学科学由定性研究内定量研究,促进了化学科学的发展。
化学反应前后可能生改变的是A.原子的种类B.元素的化合价C.原子的数目D.元素的质量下列说法正确的是A.m=20B.乙一定是化合物C.丙一定是该反应的催化剂D.反应中甲和丁的质量之和一定等于乙的质量【答案】C【详解】A、测定空气中氧气的含量时需要在导管处夹一个弹簧夹,防止反应时集气瓶中的气体受热膨胀排出,使实验结果更准确,此选项错误;B、有气体生成或有气体参加反应的实验要验证质量守恒定律,需要在密闭容器中进行;石灰石与稀盐酸反应生成二氧化碳,所以要在密闭容器中进行,此选项错误;C、验证氢气的纯度,首先氢气的密度小于空气,所以试管口要朝下,其次氢气具有可燃性,所以将试管移到酒精灯火焰处点燃,若听到轻微的噗噗声,说明氢气较纯;若听到尖锐的爆鸣声,说明氢气不纯,此选项正确;D、套试管夹时应从下往上套,此选项错误;故选C。

【题型一:质量守恒定律的理解】1、下列现象不能用质量守恒定律解释的是()A.木材燃烧,余下灰烬的质量小于原木材质量B.铜丝在火焰上灼烧,灼烧后的“铜丝”质量增加C.加热高锰酸钾,剩余固体质量减少D.将一定质量的水冷凝后结成冰,质量不变【答案】D【解析】A、木材燃烧,余下灰烬的质量小于原木材质量,是因为生成的二氧化碳逸散到了空气中,该选项遵循质量守恒定律;B、铜丝在火焰上灼烧,灼烧后的“铜丝”质量增加,是因为铜和空气中的氧气反应生成了氧化铜,该选项遵循质量守恒定律;C、加热高锰酸钾,剩余固体质量减少,是因为反应生成的氧气逸出,该选项遵循质量守恒定律;D、水冷凝后结成冰的过程没有发生化学变化,不能用质量守恒定律解释。
故选:D。
2、化学反应前后,给出下列各项:①原子数目;①分子数目;①元素种类;①物质的总质量;①物质种类;①原子种类;①电子数目。
其中没有变化的是()A.①①①①①B.①①①①①C.①①①①①D.①①①①①【答案】B【解析】化学反应前后,①原子数目、①元素种类、①物质的总质量、①原子种类、①电子数目没有变化;①物质种类一定发生改变;①分子数目可能改变。
故选B。
3、质量守恒定律是帮我们认识化学反应实质的重要理论。
关于反应aA+bB=cC+dD,下列说法正确的是()A.化学计量数a与b之和一定等于c与d之和B.若取xg A和xg B反应,生成C和D的质量总和不一定是2xgC.反应物A和B的质量比一定等于生成物C和D的质量比D.反应中一定有元素化合价的改变【答案】B【解析】A、参加反应的A、B的质量总和一定等于生成的C、D的质量总和,但化学计量数a与b之和不一定等于c与d之和,故A不正确;B、物质参加化学反应按一定的质量比进行,由于参加反应的A、B的质量比不一定是1:1,若取xgA和xgB反应,生成C和D的质量总和不一定是2xg,故B正确;C、参加反应的A、B的质量总和一定等于生成的C、D的质量总和,但反应物A和B的质量比不一定等于生成物C和D的质量比,故C不正确;D、该反应两种物质参与反应,不是分解反应,故D不正确。

第6讲 物质的量 气体摩尔体积[复习目标] 1.了解物质的量、阿伏加德罗常数、摩尔质量、气体摩尔体积的含义并能进行简单的计算。
2.理解阿伏加德罗定律并能进行有关气体体积、压强与物质的量关系的判断。
考点一 物质的量 摩尔质量1.物质的量(1)概念:表示含有一定数目粒子的集合体。
(2)符号为n ,单位是摩尔(mol)。
(3)使用范围:适用于微观粒子或微观粒子的特定组合。
(4)阿伏加德罗常数:指1 mol 任何粒子的粒子数,符号为N A ,N A ≈6.02×1023 mol -1。
(5)公式:n =N N A 或N =n ·N A 或N A =Nn 。
2.摩尔质量1.物质的量是表示微粒数目多少的物理量( )2.2 mol H 2O 的摩尔质量是1 mol H 2O 的摩尔质量的2倍( ) 3.1 mol O 2的质量与它的相对分子质量相等( )4.12 g 12C中所含碳原子的数目约为6.02×1023()5.1 mol OH-的质量为17 g·mol-1()答案 1.× 2.× 3.× 4.√ 5.×质量、物质的量与微粒数目之间的换算1.“可燃冰”是由水和甲烷在一定条件下形成的类冰结晶化合物。
1.6 g“可燃冰”(CH4·x H2O)的物质的量与6.02×1021个水分子的物质的量相等,则该“可燃冰”的摩尔质量为______________,x的值为______________。
答案160 g·mol-182.最近材料科学家研究发现了首例带结晶水的晶体在5 K下呈现超导性。
据报道,该晶体的化学式为Na0.35CoO2·1.3H2O。
若用N A表示阿伏加德罗常数的值,试计算12.2 g该晶体中含氧原子数约为__________,氢原子的物质的量约为________mol。
答案0.33N A0.26计算判断物质中所含指定微粒数目的技巧弄清楚微粒与所给物质的关系:原子(电子)的物质的量=分子(或特定组合)的物质的量×1个分子(或特定组合)中所含这种原子(电子)的个数。


九年级化学专题复习中考真题练—质量守恒定律(含解析)一、单选题1.(2023·四川乐山·统考中考真题)已知物质R 由一种或多种物质组成。
取一定质量的R 在足量的氧气中完全燃烧,生成4.4g 二氧化碳和3.6g 水,下列分析不正确的是()A .参加反应的R 和氧气的质量总和一定等于8.0gB .所取R 质量的最小值为1.6gC .R 可能是酒精(25C H OH )D .若R 为CO 和2H 的混合物,则CO 和2H 的分子个数比为1:2【答案】C【解析】A 、依据质量守恒定律,参加反应的物质的总质量等于生成物的质量之和,故参加反应的R 和氧气的质量总和一定等于生成的二氧化碳和水的质量之和,为4.4g+3.6g=8.0g ,故A 正确;B 、依据质量守恒定律,反应前后元素的种类、质量相等,则R 中一定含有碳元素和氢元素,可能含有氧元素,则R 质量的最小值是碳元素和氢元素的质量之和,碳元素的质量等于二氧化碳中碳元素的质量,为:124.4g 100%44⨯⨯=1.2g ;氢元素的质量等于水中氢元素的质量,为:23.6g 100%18⨯⨯=0.4g ,所取R 质量的最小值为:1.2g+0.4g=1.6g ,故B 正确;C 、综上分析,碳原子和氢原子的个数比为:1.2g 0.4g :121=1:4,R 不可能是酒精,故C 错误;D 、若CO 和H 2的分子个数比为1:2,则碳原子和氢原子的个数比为:()122⨯:=1:4,故D 正确。
故选C 。
2.(2023·四川遂宁·中考真题)我国力争在2060年前实现碳中和,二氧化碳的捕获、储存、利用和转化等是实现目标的重要途径。
人工光合固碳装置通过电化学手段将二氧化碳转化为甲酸(HCOOH),该反应的微观示意图如图,下列说法正确的是()A.甲酸由甲酸分子构成B.甲酸中氢元素的质量分数最大C.反应前后氧元素的化合价没有变化D.参加反应的与的微粒个数比为2:3【答案】A【解析】A、由图示可知,甲酸由甲酸分子构成,正确;B、根据甲酸中碳、氢、氧元素的质量比为(12×1):(1×2):(16×2)=6:1:16可知,甲酸中氧元素的质量分数最大,错误;C、生成物中氧气是单质,单质中元素的化合价为0,则反应前后氧元素的化合价一定发生了变化,错误;D、由反应的微观示意图,图中是2个二氧化碳分子和2个水分子在一定条件下反应生成2个甲酸分子和1个氧分子,参加反应的与的微粒个数比为2:2=1:1,错误。

2025届福建省福州市鼓楼区延安中学化学九年级第一学期期末调研模拟试题考生请注意:1.答题前请将考场、试室号、座位号、考生号、姓名写在试卷密封线内,不得在试卷上作任何标记。
2.第一部分选择题每小题选出答案后,需将答案写在试卷指定的括号内,第二部分非选择题答案写在试卷题目指定的位置上。
3.考生必须保证答题卡的整洁。
考试结束后,请将本试卷和答题卡一并交回。
一、单选题(本大题共10小题,共20分)1.氯气经常用于自来水消毒,也可用于制造盐酸、漂白粉和漂粉精等。
实验室通常用二氧化锰固体和浓盐酸在加热的条件下制取氯气。
反应的化学方程式为:222MnO +4HCl ()MnCl +2X+Cl 加热浓,则x 的化学式为A .H 2B .H 2OC .O 2D .HClO2.下列对一些事实的解释不正确的是( )A .AB .BC .CD .D3.蔗糖存在于多种植物的果实中,其化学式为C 12H 22O 11。
下列有关蔗糖的说法正确的是 A .属于混合物B .由12个碳原子、22个氢原子和11个氧原子构成C .由碳、氢、氧三种元素组成D .碳、氧元素质量比为12:114.炒菜时油锅中的油不慎着火,用锅盖盖灭的原理是( ) A .降低油的着火点 B .让油与空气隔绝C.降低温度至油的着火点以下D.清除了可燃物5.下列化学用语与含义相符的是A.1个汞原子—1Hg B.2个钠离子—Na2+C.2个过氧化氢分子—H2O2D.3个氦原子—3He6.物质的用途和物质的性质密切相关,下列有关说法错误的是()A.石墨可用作电极,是因为石墨具有优良的导电性能B.碳和一氧化碳都可用于冶炼金属,是因为它们都具有还原性C.铝用作“银粉”漆,涂在铁栏杆表面防锈,是因为铝在常温下化学性质稳定D.清洗餐具时,常加入一定量的洗涤剂,是因为洗涤剂具有乳化功能7.在一只密闭容器内有四种物质,在一定条件下充分反应,测得反应前后各物质的质量如下表:下列说法正确的是( )A.该反应一定是分解反应B.该反应一定是化合反应C.参加反应的X、Z的质量比为1:4 D.反应后X的质量为28.下列化学用语与含义相符的是()A.2H表示2个氢元素B.2N表示2个氮原子C.O3表示3个氧原子D.2Mg+2表示2个镁离子9.地壳中元素含量居于第二位的是()A.O B.Cl C.N D.Si10.化学使生活更美好,运用学习的化学知识,判断下列说法不正确的是()A.炒菜时油锅着火可用锅盖盖灭B.不锈钢抗锈蚀性能比生铁好C.图书资料失火可用干冰灭火减少损失D.进入煤井作业时可以点火照明二、填空题(本大题共1小题,共4分)11.Cl2和ClO2都是自来水的常用消毒剂。
【化学】化学《化学方程式》练习题及答案一、选择题1.在一个密闭容器内有四种物质,一定条件下充分反应后,测得反应前后各物质的质量如表,下列推理正确的是物质X Y Z Q反应前质量/g410121反应后质量/g01215待测A.反应物是X和Y,成物是Q和ZB.参加反应的Y和Q的质量比是1∶1C.参加反应的X与Q的质量比是1∶3D.反应后生成15 g Z【答案】C【解析】由表中数据分析可知,反应前后X的质量减少了4 g﹣0 g=4 g,故X是反应物,参加反应的X的质量为4 g;反应前后Y的质量增加了12 g﹣10 g=2 g,故Y是生成物;同理确定Z 是生成物,生成的Z的质量为15 g﹣1 g=14 g;由质量守恒定律,Q应是反应物,且参加反应的Q的质量为14 g+2 g﹣4 g=12 g,故待测的数值为21g﹣12 g=9 g。
A、根据分析,可知反应物是X和Q,生成物是Y和Z,故选项说法错误;B、参加反应的Y的质量为12 g ﹣10 g=2 g,参加反应的Q的质量为14 g+2 g﹣4 g=12 g,故参加反应的Y和Q的质量比是1∶6,故选项说法错误;C、参加反应中X、Q的质量比为4 g∶12 g=1∶3,故选项说法正确;D、根据表格中的数据,反应后生成Z的质量为15 g﹣1 g=14 g,故选项说法错误。
故选C。
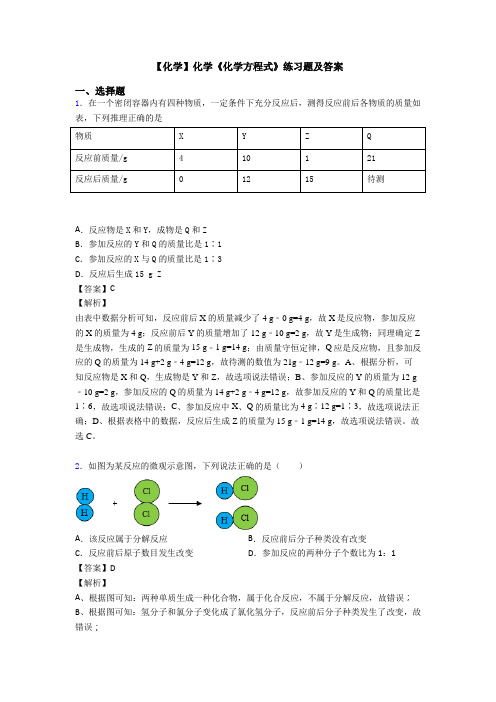
2.如图为某反应的微观示意图,下列说法正确的是()A.该反应属于分解反应B.反应前后分子种类没有改变C.反应前后原子数目发生改变D.参加反应的两种分子个数比为1:1【答案】D【解析】A、根据图可知:两种单质生成一种化合物,属于化合反应,不属于分解反应,故错误;B、根据图可知:氢分子和氯分子变化成了氯化氢分子,反应前后分子种类发生了改变,故错误;C 、由微粒的变化可知,反应前后原子数目没有发生改变,故错误;D 、由微粒的变化可知,参加反应的两种分子个数比为1:1,故正确。
点睛:化学反应的实质一般是指在化学变化中,分子分成原子,原子重新组合成新的分子(或直接聚集构成新物质)。

2020年浙教版八年级下科学同步学习精讲精练第3章空气与生命第3章经典专题讲练2——质量守恒定律概念理解及专项计算目录 (1) (3) (4)一、质量守恒定律概念理解1.概念:参加化学反应的各物质的质量总和,等于反应后生成的各物质的质量总和。
【注】使用质量守恒定律时的注意事项①质量守恒定律,不适用于物理变化。
②概念中的“参加反应的各物质的质量”是指真正参加反应的那部分物质的质量.③概念中“各物质的质量总和”包括“各种状态的反应物及各种状态的生成物”。
④质量守恒定律不包括体积守恒。
2.微观解释化学反应的过程,实际上就是参加反应的各物质(反应物)的分子,分裂成原子,然后重新组合成新的分子而生成其他物质的过程,因此在反应的前后,原子的种类、个数、质量都没有改变,所以元素的种类和质量、物质的总质量在化学反应前后均保持不变。
3. 质量守恒定律中量的关系二、质量守恒定律的验证1.实验原理的选择:一切易操作、速率适中、便于称量、现象明显的化学实验都可用于进行验证质量守恒定律。
2.实验装置的选择:有气体参加(或生成)的实验在密闭装置中进行。
三、质量守恒定律的应用1. 解释反应前后物质的质量变化一些化学变化,反应前和反应后的物种总质量不相等,主要原因如下:增加——有空气中的氧气参加了反应反应后生成物质量减少——生成物中有气体放出没有变化——反应前后没有气体参加或者逸出2. 推断反应物或生成物的组成元素如,已知酒精在空气中燃烧生成二氧化碳和水,根据这一事实,推断出酒精中肯定含有什么元素?可能含有什么元素?则可根据质量守恒定律——化学反应前后元素种类不变,得到如下推断:酒精+O2 CO2+H2O,由生成物中的元素种类可知:酒精中一定含有的元素:C、H;可能含有的元素:O。
说明:若要确定是否含有氧元素,则需要定量才可计算(见本专题例题分析)。
3. 求反应物或生成物的质量如,在A+2B=C+D的反应中,5克A跟一定量的B恰好完全反应,生成3克C和10克D,则B的质量可直接根据质量守恒定律的定义——参加反应物质质量总和=反应生成物质质量总和,求得m(B)=3g+10g—5g=8g。

化学方程式的书写与配平以及计算➢ 知识点一:质量守恒定律1、内容:在化学反应中,参加化学反应的各物质的质量总和等于反应后生成的各物质的质量总和。
2、实质:参加反应的各物质分子分解成原子,原子重新组合成新的分子的过程。
反应前后元素的种类没变;原子的种类和数量都没有改变,原子间只是进行重新组合,因此反应前后各物质的质量总和必然相等。
3、理解:五个不变,两个一定改变,一个可能改变: ⎪⎪⎪⎩⎪⎪⎪⎨⎧⎪⎩⎪⎨⎧⎩⎨⎧原子质量不变原子数目不变原子种类不变微观元素种类不变量不变反应物与生成物的总质宏观)五个不变(1 ⎩⎨⎧种类一定改变微观:构成物质的分子变宏观:物质种类一定改)两个一定改变(2的数目可能改变)一个可能改变:分子(34、质量守恒定律的应用:(1)求反应物与生成物的质量(2)反应物或生成物的化学式(3)判断是否全部反应【例1】煤油中含有噻吩,噻吩(用X 表示)有令人不愉快的气味,其燃烧的化学方程式可表示为:X+6O 24CO 2+SO 2+2H 2O ,则噻吩X 的化学式为( C )A .C 4H 4S 2B .C 2H 6SC .C 4H 4SD .C 6H 6S【例2】将一定质量的a,b,c,d四种物质放入一密闭容器中,在一定条件下反应一段时间后,测得各物质的质量如表:物质a b c d反应前的质量/g 6.414.0 3.2 1.0反应一段时间后的质量/g10.07.2x 1.0下列有关说法正确的是(C)A.a和b是反应物B.x=3.2C.该反应属于分解反应D.d一定是催化剂【例3】某有机物6.0g在空气中完全燃烧,共得到17.6g二氧化碳和10.8g水,则该化合物的组成元素是(B)A.一定只含有碳元素B.一定只含有碳、氢两种元素C.一定含有碳、氢、氧三种元素D.一定含有碳、氢元素,可能含有氧元素【例4】定量研究对于化学科学发展有重大作用,因此我们应该掌握好有关质量守恒定律的相关知识.(1)在化学变化前后一定不变的是.①原子数目①原子的种类①分子数目①分子的种类①元素的种类①物质的总质量①物质的种类A.①①①①B.①①①①C.①①①①D.①①①①(2)①某物质R在空气中燃烧生成了二氧化碳、二氧化硫和水,从化学反应前后元素种类变化情况的角度分析可知:物质R中一定含有元素,可能含元素.①某物质R共4.6g在空气中燃烧生成了8.8g二氧化碳和5.4g水,从化学反应前后元素种类变化情况的角度分析可知:物质R中一定含有元素.(3)在一定条件下,在一个密闭容器内发生某反应,依据测得的反应过程中各物质的质量如表所示,回答下列问题物质X Y Z W反应前质量/g103900反应后质量/g 3.23a 3.2表中a=,在反应中Y这种物质可能是该反应的剂.答:(1)A;(2)①碳、硫、氢;氧;①碳、氢、氧;(3)93.6;催化剂.【变式训练】1.在一个密闭容器中有四种物质,在一定条件下充分反应后,测得反应前后各物质的质量如下:物质X Y Z Q反应前质量/g410121反应后质量/g01215待测已知x的相对分子质量为n,Q的相对分子质量为2n,则下列推断正确的是(D)A.反应后Q的质量为10gB.反应中Y与Q发生改变的质量比为1:1C.反应后生成15gZD.该反应方程式中X与Q的化学计量数之比为2:32.某化合物完全燃烧,需要O24.8g,同时只生成CO24.4g和水2.7g,则该化合物中(C)A.只含碳、氢两种元素B.只含碳、氧两种元素C.含碳、氢、氧三种元素D.无法确定3.西班牙瑞奥汀河是一条酸河,经调查发现是由于上游河床含有的物质R在水中氧的作用下发生反应所致,其反应的化学方程式是:2R+2H2O+7O2═2H2SO4+2FeSO4则R的化学式是(D)A.FeS B.Fe2S3C.FeO D.FeS24.化学变化是化学学科最具特色的内容,而质量守恒定律是认识化学变化的一个基本规律,对科学发展具有重大意义。

2024届浙江省宁波市九校中考联考化学试卷请考生注意:1.请用2B铅笔将选择题答案涂填在答题纸相应位置上,请用0.5毫米及以上黑色字迹的钢笔或签字笔将主观题的答案写在答题纸相应的答题区内。
写在试题卷、草稿纸上均无效。
2.答题前,认真阅读答题纸上的《注意事项》,按规定答题。
一、单选题(本大题共15小题,共30分)1.下图为汽车尾气处理所涉及反应的微观过程,下列说法错误的是A.反应前后元素种类不变B.反应前后原子数目没有增减C.生成物的分子个数比为1: 1D.该反应能减少有害气体排放2.根据如图提供的信息分析,下列说法错误的是()A.若X>10,则该微粒属于阳离子B.氟元素为金属元素C.氟的相对原子质量是19.00D.氟原子核外有9个电子3.有关反应2Mg+O2点燃2MgO的说法正确的是A.镁加氧气在点燃条件下生成氧化镁B.每3克镁和2克氧气在点燃条件下生成5克氧化镁C.每2克镁和3克氧气在点燃条件下生成5克氧化镁D.每2份镁和1份氧气在点燃条件下生成2份氧化镁4.一定条件下,甲、乙混合后发生化学反应,测得反应前后各物质的质量变化如下表所示。
下列说法中,不正确的是物质甲乙丙丁反应前的质量/g 50 0.5 0 0反应后的质量/g 23 X 24 3A.x的值等于0.5B.甲一定是化合物C.丙和丁的质量变化比为8:1D.该反应是化合反应5.下列过程中不发生化学变化的是()A.把水喷向空中B.服用胃药治疗胃酸过多C.钟乳石的形成D.盐酸腐蚀碳酸钙6.下列图标表示“国家节水标志”的是A.B.C.D.7.下列说法正确的是()A.铝合金和塑料都属于有机合成材料B.碳酸钙可以用于制作补钙剂C.洗涤剂除去油污是因为溶解作用D.油锅着火立即用水浇灭8.下列现象中,只发生物理变化的是A.钢铁生锈B.酒精挥发C.纸张燃烧D.粮食酿酒9.在一个密闭容器内有四种物质,一定条件下充分反应后,测得反应前后各物质的质量如表,下列推理正确的是物质X Y Z Q反应前质量/g 4 10 1 21反应后质量/g 0 12 15 待测A.反应物是X和Y,成物是Q和ZB.参加反应的Y和Q的质量比是1∶1C.参加反应的X与Q的质量比是1∶3D.反应后生成15 g Z10.下列生活常识错误的是()A.叶子发黄可多施氮肥B.鉴别真假羊毛衫可用燃烧法闻气味C.把燃气热水器安装在浴室内方便使用D.蜂窝煤比煤球燃烧旺是蜂窝煤与氧气的接触面积大11.下列物质的化学式和俗名对应不相符的是A.Hg-水银B.NaOH-苛性钠C.NaHCO3-苏打D.C2H5OH-酒精12.卢瑟福的“α粒子轰击金箔”实验为建立现代原子理论打下了基础,下图a、b、c、d四条线,可能是α粒子在该实验中运动轨迹的是A.abcd B.abc C.bcd D.ad13.氢氧化钠是重要的化工原料,下列不是..其俗称的是A.纯碱B.烧碱C.苛性钠D.火碱14.化学是一门以实验为基础的科学。

人教版2021届初三化学上册同步练习:质量守恒定律【含答案】1、下列说法中,符合质量守恒定律的是( )A.蜡烛完全燃烧后,生成水和二氧化碳的质量之和等于蜡烛的质量B.镁带在空气中燃烧后,生成物的质量比镁带的质量增加了C.高锰酸钾受热分解后,剩余固体的质量与反应物的质量相等D.100水与100g酒精混合后总质量为200g【答案】B【解析】应用质量守恒定律分析问题时,要注意的是参加化学反应的各物质的质量总和等于反应后生成的各物质的质量总和。
蜡烛、镁带等固体在空气中燃烧,参加反应的物质除了蜡烛、镁带外,还有氧气;高锰酸钾分解有氧气生成。
2、在化学变化中,下列说法正确的是()①原子的种类、元素的种类、分子的种类均不变;②原子的数目、分子的数目均不变③原子的质量、元素的质量、物质的总质量均不变;④原子核的种类、数量、质量均不变A. ①②B. ①③C. ③④D. ②④【答案】C【解析】①原子的种类、元素的种类均不变,分子的种类改变,错误;②原子的数目不变,分子的数目不能确定,错误;③原子的质量、元素的质量、物质的总质量均不变,正确;④原子核的种类、数量、质量均不变,正确。
故选C。
3、在密闭容器中加热蔗糖可产生碳和水,由此可以说明( )A.蔗糖是由碳和水组成的纯净物 B.蔗糖是由碳和水组成的混合物C.蔗糖分子是由碳元素和水分子构成的 D.蔗糖是由碳元素、氢元素和氧元素组成的【答案】D【解析】注意蔗糖是反应产生了“碳和水”,根据质量守恒定律,可判定蔗糖是由碳、氢、氧三种元素组成的。
4、某种燃料是目前使用较多的“绿色可再生能源”,其在空气中完全燃烧的化学反应方程式:X+3O22CO2+3H2O.则X物质的化学式为()A.CH3COOH B.C2H5OH C.C2H4D.C2H6【答案】B【解析】根据质量守恒定律和化学方程式可得,X的化学式中应含有C的个数为:2,应含有O的个数为:2×2+3﹣3×2=1,应含有H的个数为:2×3=6.故可推断X的化学式为:C2H6O,即C2H5OH。

2025年深圳市中考化学一轮总复习:质量守恒定律及其应用一.选择题(共25小题)
1.在一个密闭容器中放入甲、乙,丙、丁四种物质,在一定条件下发生化学反应,一段时间后,测得有关数据如表:对该反应的认识正确的是()
物质甲乙丙丁反应前质量/g181232
反应后质量/g待测26212 A.甲待测值是5
B.该反应是分解反应
C.反应中甲乙的质量比1:5
D.物质丙是该反应的催化剂
2.乙炔(化学式为C2H2)可用作燃料,当氧气不足时,乙炔燃烧会生成二氧化碳、一氧化碳和水,若一定质量的乙炔燃烧生成了6.6g二氧化碳、1.4g一氧化碳,则生成水的质量为()
A.0.6g B.0.9g C.1.8g D.3.6g
3.一定质量的某化合物完全燃烧,需要3.2g氧气,生成4.4g二氧化碳和1.8g水。
下列判断错误的是()
A.该化合物中碳、氢、氧的原子个数比为2:4:1
B.该化合物中一定含有碳、氢、氧三种元素
C.参加反应的该化合物的质量为3.0g
D.该化合物中碳元素的质量分数为40%
4.下列关于质量守恒定律的说法正确的是()
A.1.2g碳与3.2g氧气反应能生成4.4g二氧化碳
B.2g氢气在2g氧气中充分燃烧能生成4g水
C.用盐酸和碳酸钠粉末反应验证质量守恒定律时,可在敞口容器中进行
D.点石(碳酸钙)成金(金子)遵循质量守恒
5.将CO和CO2的混合气体5g先缓缓通过足量的灼热氧化铜后,再缓缓通入足量的澄清石灰水中,得到白色沉淀15g(假设每步反应都进行完全),则原混合气体中碳元素的质
第1页(共32页)。
4580482
在一个密闭容器内有四种物质,在一定条件下充分反应后.测得反应前后各物质的质量如下:
物质 X Y Z Q
反应前质量/g 4 10 1 21
反应后质量/g 0 12 15 待测
已知X的相对分子质量为n,Q的相对分子质量为2n,试计算反应后Q的质量为______g 解:从表中可看出物质X在反应前后质量从4g变为0g,则表明X是完全反应了。
物质Y的质量从10g变为12g,是表明反应后生成了Y,生成的物质是2 g。
物质Z质量从1g 变为15g,也表明反应后生成了Z,生成的质量是14g。
故得到反应后生成的物质Y、Z的质量之和是2g + 14g = 16g。
根据质量守恒得。
参加反应的物质X是4g,而反应后生成的物质的质量是16g。
故得反应物的质量是小于生成物的。
因此Q也是反应物。
参加反应的质量为:16g – 4g = 12g。
由此可得反应后Q物质的质量为:21g – 12g = 9g。
答:略。