苯的物理性质
- 格式:wps
- 大小:35.50 KB
- 文档页数:2

关于苯的知识点总结一、苯的基本性质1. 物理性质苯是一种无色透明的液体,在室温下呈无色无味的液体。
其结构是六个碳原子形成一个环状结构,环上每个碳原子与另外两个碳原子相连接。
苯的密度为0.8765 g/cm3,在室温下很容易挥发。
苯的沸点为80.1摄氏度,熔点为5.4摄氏度。
苯是一种良好的溶剂,可以溶解许多有机物。
2. 化学性质苯是一种不稳定的有机化合物,容易发生反应。
它与氧气在阳光下可以发生自由基反应,生成苯酚。
苯也可以通过加成反应发生氢化反应,生成环己烷。
此外,苯还可以通过硝化反应生成硝基苯,通过氯化反应生成氯苯等。
二、苯的生产与用途1. 生产苯可以通过石油煤焦油裂解或苯乙烯裂解生产,也可以通过催化剂将甲苯进行甲基化反应来生产。
目前,大多数苯是通过石油煤焦油裂解来生产。
2. 用途苯是一种重要的工业原料,可以用于生产酚、苯酚、硝基苯、甲苯、邻二甲苯等。
这些产物在医药、农药、染料、塑料、合成纤维、香料等领域有广泛的用途。
此外,苯还可以用作溶剂、去污剂、染料中间体等。
三、苯的危害性1. 对人体的危害苯对人体有一定的毒性,长期接触或大量吸入苯汽会引起失眠、头晕、恶心等症状,严重的可致白血病等疾病。
苯的蒸气是易燃和爆炸的,所以在生产和使用中要注意防范。
2. 对环境的危害苯对环境也有一定的危害,过量排放会导致大气污染,对植物、动物和水环境造成影响。
因此,要严格控制苯的排放,加强环境监测和治理。
总之,苯是一种重要的有机化合物,具有广泛的应用价值。
但同时,也需要注意其对人体和环境的危害,加强安全生产和使用管理,确保其生产和使用不会对人类和环境造成不良影响。


苯 2015-5-14⑴苯的来源:苯最初主要是由煤干馏所得煤焦油蒸馏得到,现在主要由石油产品的催化重整来大量生产。
⑵苯的物理性质:无色、有特殊气味的液体;熔点(5.5℃,如用冰冷却,可以凝结成无色晶体)、沸点(80.1℃)较低,易挥发;比水轻,不溶于水,良好的有机溶剂(可用作萃取碘水中的碘的萃取剂)。
⑶苯的分子结构:分子式为C6H6,最简式为CH,结构简式可表示为或。
苯分子具有平面正六边形结构,六角环(苯环)上的碳碳之间的化学键是一种介于单键和双键之间的独特的键。
芳香烃:分子里含有一个或多个苯环的碳氢化合物,叫做芳香烃,简称芳烃。
苯是最简单、最基本的芳烃。
苯的同系物的通式为CnH2n-6(n≥6)。
⑷苯的化学性质:苯分子的特殊结构决定了苯兼有饱和烃和不饱和烃的性质。
①氧化反应:Ⅰ可燃性:在空气中燃烧,火焰明亮并伴有浓烟,放出大量的热量。
2C6H6+15O2−−−点燃12CO2+6H2OⅡ稳定性:苯不与KMnO4酸性溶液、溴水发生反应。
②取代反应:苯较易发生取代反应。
Ⅰ卤代反应+Br 2−−→−3FeBr +HBr (催化剂为FeBr 3)溴苯(无色、比水重、不溶于水的油状液体)+Cl 2−−→−3FeCl +HCl (催化剂为FeCl 3)Ⅱ 硝化反应 +HNO 3+H 2O硝基苯(无色、比水重、难溶于水、有苦杏仁味的有毒液体)注意:硝化反应中应控制温度在55℃~60℃,为了便于控制温度,且使反应物均匀受热,通常将反应物置于水浴中加热。
③加成反应:苯不具有典型的碳碳双键所应有的加成反应的性质,但在特定的条件下,苯仍然能够发生加成反应。
+3H 2 环己烷(无色、油状液体)注意:反应条件与有机反应的产物的关系:烷烃与气态的卤素单质(如溴蒸气)在光照条件下发生取代反应,烯烃、炔烃与溴的四氯化碳溶液(或溴水)发生加成反应,苯与液溴在FeBr 3作催化剂的条件下也发生取代反应。
苯与氯气在FeCl 3作催化剂的条件下发生取代反应,而在光照条件下却发生加成反应。

苯物理性质苯是无色有甜味的气体,沸点80.5 ℃,熔点-5.6 ℃。
易溶于乙醇、醚等多数有机溶剂,微溶于水;其蒸汽对眼及上呼吸道粘膜有刺激作用。
密度比空气略大(标准状况下, 1体积空气= 1.085立方米)。
燃烧时火焰呈黄色,带蓝紫色或淡蓝色荧光。
苯可由煤焦油中提炼而得。
它也是一种重要的化工原料。
目前世界各国都在不断地发展精细化学品的合成技术以取代天然产物,如今已广泛应用到医药卫生、农业科研和食品加工等领域。
这些高级精细化学品主要包括:合成树脂、表面活性剂、增塑剂、香料、染料、杀虫剂、除草剂、农药、油漆、颜料、洗涤剂、油墨、各种化学试剂、各种医药及其他精细化工产品。
在我们日常生活中,苯用途很广,因为苯可以制造多种化工产品,又是优良的溶剂和各种有机化合物的提纯剂,还是合成纤维、合成橡胶和塑料的原料,同时苯又是生产合成洗涤剂的重要原料。
苯的衍生物主要有苯的硝化、卤代物,包括苯胺类、苯酚类等,还有苯并芘类、萘系、蒽醌系等,是合成染料、农药、医药、合成橡胶和塑料的中间体,具有良好的溶解性和抗氧化性。
例如合成纤维、合成橡胶和塑料的原料,合成树脂及医药、农药、染料的中间体,此外,苯还是制造染料、药物、炸药、火药的重要原料。
它在工业生产中是一种重要的溶剂,它被广泛用作生产甲苯二异氰酸酯( TDI)的原料。
(1)导电性和绝缘性苯分子中含有大量共轭双键,这使苯的共轭体系对周围的空间产生共轭效应。
在苯环的两侧各有一个大的π键,这两个大的π键构成共轭体系,并使苯环对称于环平面的轴上。
由于共轭体系的影响,使苯的导电能力非常差。
但苯能形成对称的共轭体系,因而其介电常数较大,能显示出优良的电绝缘性。
(2)亲水性和亲脂性许多物质的结构决定了它们在溶剂和非极性溶剂中的溶解性。
苯也不例外,在水中的溶解度极小。
苯在非极性溶剂中是非极性的,但在极性溶剂中是极性的,如苯在乙醇中的溶解度约为在水中的20倍。
因此苯的极性越小越容易溶解在极性溶剂中。


苯知识点总结一、苯的物理性质1. 外观:苯是一种无色透明的液体,具有较好的流动性。
2. 沸点和熔点:苯的沸点为80.1℃,熔点为5.5℃。
3. 密度:苯的密度为0.874g/mL,是一种较轻的液体。
4. 溶解性:苯是一种较好的溶剂,可以溶解许多有机和无机物质,例如:脂肪烃、芳香烃等。
5. 可燃性:苯是一种易燃液体,其燃烧产生碳氧化物和水。
二、苯的化学性质1. 稳定性:苯是一种相对稳定的化合物,不易与氧、氮、硫等发生反应,但在高温下会发生加成反应。
2. 溶解性:苯具有较好的溶解性,对于许多有机化合物具有较好的溶解性,例如:苯酚、甲苯等。
3. 与卤原子的取代反应:苯可以和氯、溴等卤素发生取代反应,生成取代苯。
4. 与亲电试剂的加成反应:由于苯分子中有π键存在,因此苯可以发生加成反应,形成结构更为复杂的化合物。
三、苯的结构苯的化学式为C6H6,结构图中有6个碳原子和6个氢原子,碳原子之间通过π键相互连接,形成一个具有平面六角形结构的分子。
苯的分子中具有芳芬环结构,不饱和度较高。
四、苯的合成苯的合成可以通过以下几种方法实现:1. 通过油页岩的干馏过程中蒸馏分离得到。
2. 通过苯甲酸钠和氢氧化钠在高温下发生脱羧反应得到。
3. 通过二苯基过氧化物在氯化氢气氛下发生环合反应得到。
4. 通过甲苯的加氢反应得到。
五、苯的应用苯作为一种重要的有机化合物,在工业生产和科学研究领域具有广泛的应用价值,主要体现在以下几个方面:1. 作为重要的有机合成原料,用于合成苯乙烯、苯酚、硝苯、二甲苯等有机化合物。
2. 作为溶剂,用于化工生产中有机物的提取、分离和纯化过程中。
3. 用于生产二苯乙烯、工业染料、医药和农药等化工产品的原料。
4. 用作汽油、柴油、燃料油的添加剂,用于提高其辛烷值和抗燃性。
综上所述,苯是一种重要的有机化合物,具有优良的溶解性和化学反应性,对于有机化学和工业生产具有重要的应用价值。
我们需要深入学习和了解苯的性质和结构,以更好地应用它,推动化工领域的发展和进步。

苯物理性质苯是一种有特殊气味的无色油状液体。
在室温下,苯是一种可燃性、无色、易挥发的液体,有毒性,是最轻的化学品之一。
分子式为C9H7。
其相对密度为0.8,熔点-92 ℃,沸点78 ℃,闪点19 ℃,自燃点540 ℃,爆炸极限1%-4%,蒸气压0.16mmHg( 20 ℃),易溶于水、乙醇等有机溶剂,常温下的蒸汽压为11.3×10-5Pa(-50 ℃),能从空气中吸收氧气。
苯具有难燃、低毒、高沸点、挥发性强等特点。
其蒸气比空气重,能被液化。
1、亲油性和疏水性苯与大多数烃类相似,具有亲油性,但是苯环上没有可与氢结合的氢原子,因此苯具有疏水性,可以和非极性溶剂混溶。
苯还具有表面活性作用,使它可以很容易地在水中形成共价键。
因此苯溶解在苯中会自动游离出来,这时候的苯不再具有极性,也就是不再亲油。
苯不能溶解于醚、酮、脂肪族的烃等极性小的溶剂。
2、氢键和分子间作用力苯分子中含有许多活泼的不同的氢原子,当苯分子与一些含有H、 CH、 NH的有机化合物反应时,常常形成两个或多个活泼的中间体,即加成物分子。
其中包括:苯乙烯中间体(苯加氢得到的产物);联苯(由2-甲基苯加氢而得到);联苄(由苯甲醛经二聚作用得到)。
在苯分子中,虽然未发现重叠的苯环,但是在侧链上存在有一个碳原子,而这些碳原子却像一个个小钩子,牢固地钩住苯环上的碳原子。
由于苯环的空间位阻效应,造成了苯环上的原子相互吸引力比其他烃类大得多,使苯具有较大的分子间作用力。
2、沸点和密度苯是一种无色、挥发性的液体。
它沸点78 ℃,密度0.797g/cm3,折射率1.3454。
其溶于有机溶剂和乙醇等,可与水互溶。
3、电离能和电负性苯的电离能很小,约为0.0058电子伏特。
苯的电负性为2.6,居第3位,高于脂肪烃、卤代烃及醇。
它的电负性随分子量增大而增加,随相对分子质量增大而减小,随碳原子数增加而增大。
因此苯是一种带负电的有机化合物。
当苯环上连接两个或三个不同的基团时,就生成不同类型的苯。
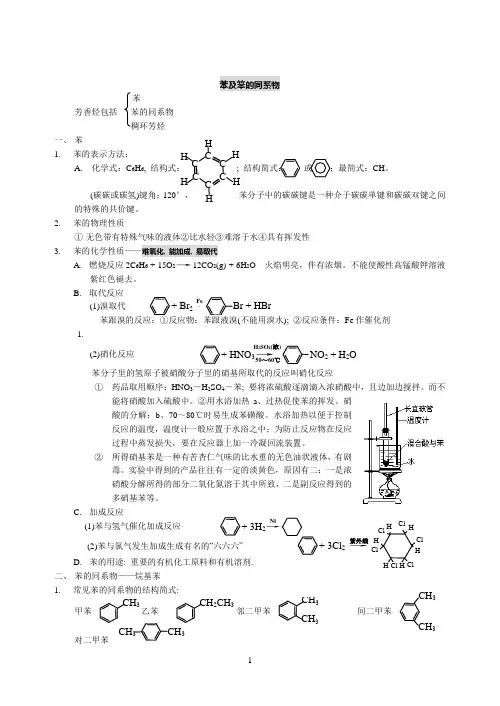
+ HNO 3→ NO 2 + H 2O H 2SO 4(浓)50~60℃苯及笨的同系物苯芳香烃包括 苯的同系物 稠环芳烃 一、 苯 1.苯的表示方法:A. 化学式:C 6H 6, 结构式: ; 结构简式: 或 ;最简式:CH 。
(碳碳或碳氢)键角:120°, 苯分子中的碳碳键是一种介于碳碳单键和碳碳双键之间的特殊的共价键。
2. 苯的物理性质① 无色带有特殊气味的液体②比水轻③难溶于水④具有挥发性 3.苯的化学性质——难氧化, 能加成, 易取代A. 燃烧反应2C 6H 6 + 15O 2→12CO 2(g) + 6H 2O 火焰明亮,伴有浓烟。
不能使酸性高锰酸钾溶液紫红色褪去。
B. 取代反应(1)溴取代 Fe 作催化剂1.(2)硝化反应苯分子里的氢原子被硝酸分子里的硝基所取代的反应叫硝化反应① 药品取用顺序:HNO 3―H 2SO 4―苯; 要将浓硫酸逐滴滴入浓硝酸中,且边加边搅拌。
而不能将硝酸加入硫酸中。
②用水浴加热a 、过热促使苯的挥发、硝酸的分解;b 、70~80℃时易生成苯磺酸。
水浴加热以便于控制反应的温度,温度计一般应置于水浴之中;为防止反应物在反应过程中蒸发损失,要在反应器上加一冷凝回流装置。
② 所得硝基苯是一种有苦杏仁气味的比水重的无色油状液体,有剧毒。
实验中得到的产品往往有一定的淡黄色,原因有二:一是浓硝酸分解所得的部分二氧化氮溶于其中所致,二是副反应得到的多硝基苯等。
C. 加成反应(1)苯与氢气催化加成反应(2)苯与氯气发生加成生成有名的“六六六” D. 苯的用途: 重要的有机化工原料和有机溶剂. 二、 苯的同系物——烷基苯 1.常见苯的同系物的结构简式:甲苯 , 、乙苯 、邻 邻二甲苯 、 间二甲苯、 对二甲苯 + 3H 2→Ni+ 3Cl 2 → 紫外线 ClClCl ClClCl HHH H H HCH 3 CH 2CH 3 CH 3CH 3CH 3CH 3 C H 3 CH 3C C CC C C H H H HH + Br 2→ Br + HBrFe2.化学性质:A. 与苯的相同之处: 能加成:, 甲苯的一氯取代产物有四种(苯环上与甲基邻、间、对位及甲基), 而催化加氢产物甲基环己烷的一氯取代产物则要增加一种(变成五种)B. 取代反应与溴的取代产物是——2, 4, 6—三溴甲苯:与硝酸的取代产物是: 2, 4, 6—三硝基甲苯(T. N. T.):T.N.T.是一种黄色针状晶体, 它是一种烈性炸药, 所以, T.N.T.又称黄色炸药.C. 与苯的不同之处: 能被酸性高锰酸钾溶液所氧化, 使之褪色. 而且, 不论其侧链有多少, 都被氧化成羧基(—COOH)——有多少侧链, 就产生多少羧基, 不论其侧链有多长, 都被氧化成只含有一个碳的羧基(—COOH):利用这点可以鉴别苯和苯的同系物。


CH 3C 2H 5CH 2CH CH 2第九讲 苯基本知识点1、苯的物理性质:苯是 色,带有 气味的液体,有毒。
溶于水,密度比水 。
用冰冷却,苯凝结成无色的晶体,晶体类型是 ,通常可 (实验操作)溴水中的溴,是一种良好的有机溶剂。
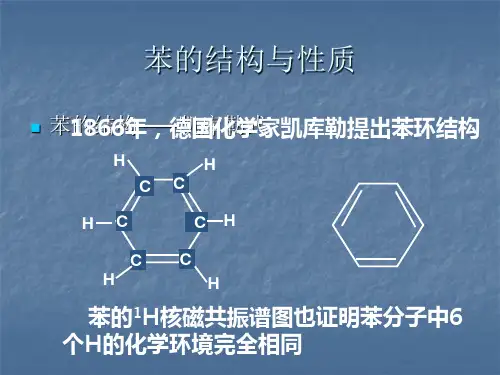
2、苯的结构:分子式 结构式 ,结构简式 或 。
苯分子是 构型,苯环上的碳碳键是一种介于 之间的独特 键。
3、苯的化学性质:苯不能被 氧化,一般也不能与溴水发生 反应,但可以 溴水中的溴。
(1)苯在空气中燃烧:反应方程式: ,现象 。
(2)取代反应:①苯的溴代反应:化学方程式: ,②苯的硝化反应:化学方程式: ;③苯的磺化反应:化学方程式: ;(3)加成反应: 苯与氢气的加成反应: ;课堂练习1.下列分子中各原子不处于同一平面内的是…………………………………………( )(A) 乙烷 (B) 乙烯 (C) 乙炔 (D) 苯2.将下列各种液体分别与溴水混合并振荡,不能发生化学反应,静置后混合液分成两层,下层几乎无色的是( )(A) 氯水 (B) 已烯 (C) 苯 (D) 碘化钾溶液3.下列物质不能使酸性高锰酸钾溶液褪色的是( )(A) 二氧化硫 (B) 乙苯 (C) 己烷 (D) 1,3一丁二烯4.属于苯的同系物的是………………………………………………………( )(A) (B) (C) (D)5.将苯分子中的一个碳原子换成一个氮原子,得到一种类似苯环结构的稳定有机物,此有机物的相对分子质量为( )(A) 78 (B) 79 (C) 80 (D) 816.已知二氯苯的同分异构体有三种,从而可推知四氯苯的同分异构体数( )(A) 1 (B) 2 (C) 3 (D) 47.合成相对分子质量在2000~50000范围内具有确定结构的有机化合物是一个新的研究领域。
1993年报道合成了两种烃A 和B ,其分子式分别为C 1134H 1146和C 1398H 1278。
B 的结构跟A 相似,但分子中多了一些结构为 的结构单元。
苯的化学性质和物理性质苯是一种碳氢化合物即最简单的芳烃,在常温下是甜味、可燃、有致癌毒性的无色透明液体,并带有强烈的芳香气味。
今天小编在这给大家整理了苯的化学性质和物理性质_苯的相关知识,接下来随着小编一起来看看吧!苯的化学性质苯参加的化学反应大致有3种:一种是其他基团和苯环上的氢原子之间发生的取代反应;一种是发生在苯环上的加成反应(注:苯环无碳碳双键,而是一种介于单键与双键的独特的键);一种是普遍的燃烧(氧化反应)(不能使酸性高锰酸钾褪色)。
苯的常见化学反应取代反应苯环上的氢原子在一定条件下可以被卤素、硝基、磺酸基、烃基等取代,生成相应的衍生物。
由于取代基的不同以及氢原子位置的不同、数量不同,可以生成不同数量和结构的同分异构体。
苯环的电子云密度较大,所以发生在苯环上的取代反应大都是亲电取代反应。
亲电取代反应是芳环有代表性的反应。
苯的取代物在进行亲电取代时,第二个取代基的位置与原先取代基的种类有关。
卤代反应苯的卤代反应的通式可以写成:PhH+X2—催化剂(FeBr3/Fe)→PhX+HX反应过程中,卤素分子在苯和催化剂的共同作用下异裂,X+进攻苯环,X-与催化剂结合。
以溴为例,将液溴与苯混合,溴溶于苯中,形成红褐色液体,不发生反应,当加入铁屑后,在生成的三溴化铁的催化作用下,溴与苯发生反应,混合物呈微沸状,反应放热有红棕色的溴蒸汽产生,冷凝后的气体遇空气出现白雾(HBr)。
催化历程:FeBr3+Br-——→FeBr4PhH+Br+FeBr4-——→PhBr+FeBr3+HBr反应后的混合物倒入冷水中,有红褐色油状液团(溶有溴)沉于水底,用稀碱液洗涤后得无色液体溴苯。
在工业上,卤代苯中以氯和溴的取代物最为重要。
硝化反应苯和硝酸在浓硫酸作催化剂的条件下可生成硝基苯PhH+HO-NO2-----H2SO4(浓)△---→PhNO2+H2O硝化反应是一个强烈的放热反应,很容易生成一取代物,但是进一步反应速度较慢。
一、实验目的1. 了解苯的物理性质。
2. 掌握苯的化学性质。
3. 熟悉苯的制备方法。
4. 提高实验操作技能和数据处理能力。
二、实验原理苯(C6H6)是一种有机化合物,分子式为C6H6,属于芳香烃。
苯的分子结构为平面正六边形,具有高度的对称性。
苯的物理性质表现为无色、透明、易挥发,密度比水小,不溶于水,溶于有机溶剂。
苯的化学性质表现为易发生取代反应,不易发生加成反应。
三、实验材料与仪器1. 实验材料:- 苯- 氯化铁- 硫酸铜- 硝酸- 氢氧化钠- 水浴锅- 试管- 滴管- 烧杯- 酒精灯- 滤纸- 铁架台- 热水浴2. 实验仪器:- 分光光度计- 紫外可见分光光度计- 酸度计- 红外光谱仪- 核磁共振仪四、实验步骤1. 物理性质实验:(1)观察苯的颜色、状态、气味;(2)测定苯的沸点、密度、折射率;(3)苯的溶解性实验:取一定量的苯,分别加入水和有机溶剂中,观察苯的溶解情况。
2. 化学性质实验:(1)苯的取代反应:a. 取一定量的苯,加入氯化铁催化剂;b. 在水浴锅中加热,观察反应现象;c. 用红外光谱仪分析反应产物。
(2)苯的硝化反应:a. 取一定量的苯,加入硝酸和硫酸混合液;b. 在水浴锅中加热,观察反应现象;c. 用红外光谱仪分析反应产物。
3. 苯的制备实验:(1)苯的蒸馏制备:a. 将苯的原料进行蒸馏,收集一定温度范围内的馏分;b. 通过分光光度计检测苯的浓度;c. 分析苯的纯度。
(2)苯的合成制备:a. 将苯的原料进行加氢反应,生成环己烷;b. 将环己烷进行氧化反应,生成苯;c. 通过分光光度计检测苯的浓度;d. 分析苯的纯度。
五、实验结果与分析1. 物理性质实验结果:- 苯为无色、透明、易挥发的液体;- 苯的沸点为80.1℃,密度为0.879g/cm³,折射率为1.501;- 苯在水中的溶解度为0.01g/100mL,在有机溶剂中的溶解度较大。
2. 化学性质实验结果:- 苯的取代反应产物为对氯苯甲酰苯甲酸;- 苯的硝化反应产物为对硝基苯甲酸。
苯物理性质一,在常温下,它是一种有特殊气味的无色透明液体,有毒。
苯是世界第二大通用化学品,已被广泛应用于各行各业。
它对人类健康和生存环境危害极大,是大气中的主要污染物之一。
它具有很强的挥发性,容易扩散到空气中,当人们吸入或接触到苯以后,可能引起呼吸道炎症,也可能引起皮肤损伤,产生过敏反应,严重时会导致血液系统疾病、神经精神疾病等。
二,苯可燃,具有微弱的芳香气味,与乙醇互为同分异构体。
三,苯的沸点比乙醇高,而且沸点随压力增加而升高,因此,苯的蒸汽压大于乙醇。
四,在正常条件下,苯难溶于水,但其水溶液仍有苯环结构。
五,苯具有较强的挥发性,蒸汽对人体的损害,甚至比汽油还大,并且苯能沿着地板砖上的裂缝侵入房间内,尤其是使用木地板或复合地板的房间。
六,苯可用作有机溶剂,可作油漆、硝基纤维素、醋酸纤维素的溶剂,聚苯乙烯塑料和聚氯乙烯塑料的稀释剂,印刷油墨的溶剂和涂料、粘胶剂的添加剂,制造杀虫剂、杀菌剂的原料,染料、农药以及橡胶的溶剂等。
9。
苯系物溶解度:能溶于甲醇、乙醇、丙酮、汽油、煤油、苯和氯仿等。
10。
储存时间:苯是一种危险化学品,应密封保存。
11。
苯在干燥空气中安定,加热能加速其挥发。
10。
苯的储运注意事项:防止倾倒和暴晒;储存于阴凉、通风的仓库内,远离火源,按有关规定进行装卸;装卸时轻装轻放,不得碰撞;储存于阴凉、通风、干燥的库房内,仓库温度宜在-5 ℃以上,保持防潮、防霉、防冻、防晒、防火;储存时限:自生产日期起6个月内有效,超过期限者须经试验合格后方可使用;运输时限:汽运,装运前检查包装是否完整,标志是否清晰,应附有危险货物运输标签,按《汽车危险货物运输规则》办理运输,运输途中必须采取严格的安全措施。
12。
苯物理性质1、相对密度: 1.6482、熔点:-26.3 ℃3、沸点: 162.8 ℃4、闪点: 19 ℃5、蒸汽压: 8.33kPa6、折射率: 1.3885、沸点: 83 ℃8、密度: 0.697、蒸气密度: 6.5g/L9。
物理性质
中文名:苯外文名:安息油
别名:Benzol 分子式:C6H6
密度0.8786 g/mL
相对蒸气密度(空气=1):2.77
蒸汽压(26.1℃):13.33kPa 二、物理性质
中文名:苯外文名:安息油
别名:Benzol 分子式:C6H6
密度 0.8786 g/mL
相对蒸气密度(空气=1):2.77
蒸汽压(26.1℃):13.33kPa
临界压力:4.92MPa
熔点 278.65 K (5.51 ℃)
沸点 353.25 K (80.1 ℃)
在水中的溶解度0.18 g/ 100 ml 水
标准摩尔熵So298 173.26 J/mol·K
标准摩尔热容Cpo 135.69 J/mol·K (298.15 K) 闪点-10.11℃(闭杯)
冰点:5 ℃
自燃温度 562.22℃
结构平面正六边形
最小点火能:0.20mJ。
爆炸上限(体积分数):8%
爆炸下限(体积分数):1.2%
燃烧热:3264.4kJ/mol
溶解性:不溶于水,可与乙醇、乙醚、乙酸、汽油、丙酮、四氯化碳和二硫化碳等有机溶剂互溶。
无色透明液体。
有芳香气味。
具强折光性。
易挥发。
能与乙醇、乙醚、丙酮、四氯化碳、二硫化碳、冰乙酸和油类任意混溶,微溶于水。
燃烧时的火焰光亮而带黑烟。
易燃。
低毒,半数致死量(大鼠,经口) 3800mG/kG。
有致癌可能性。
密度比水小。
临界压力:4.92MPa
熔点278.65 K (5.51 ℃)
沸点353.25 K (80.1 ℃)
在水中的溶解度0.18 g/ 100 ml 水
标准摩尔熵So298 173.26 J/mol·K
标准摩尔热容Cpo 135.69 J/mol·K (298.15 K)
闪点-10.11℃(闭杯)
冰点:5 ℃
自燃温度562.22℃
结构平面正六边形
最小点火能:0.20mJ。
爆炸上限(体积分数):8%
爆炸下限(体积分数):1.2%
燃烧热:3264.4kJ/mol
溶解性:不溶于水,可与乙醇、乙醚、乙酸、汽油、丙酮、四氯化碳和二硫化碳等有机溶剂互溶。
无色透明液体。
有芳香气味。
具强折光性。
易挥发。
能与乙醇、乙醚、丙酮、四氯化碳、二硫化碳、冰乙酸和油类任意混溶,微溶于水。
燃烧时的火焰光亮而带黑烟。
易燃。
低毒,半数致死量(大鼠,经口) 3800mG/kG。
有致癌可能性。
密度比水小。