高一化学 必修一 硫及其氧化物
- 格式:ppt
- 大小:2.27 MB
- 文档页数:28

化学高一必修一知识点化学是一门充满神奇和奥秘的学科,在高一必修一中,我们开始了化学知识的系统学习。
这一阶段的知识为后续的化学学习奠定了重要的基础。
下面就让我们一起来梳理一下这些关键的知识点。
首先是“化学实验基本方法”。
化学实验安全至关重要,进入实验室要遵守规则,比如不能用手直接接触药品,不能品尝药品的味道,要了解常见危险化学品的标志等。
过滤和蒸发是两种基本的分离提纯方法。
过滤用于分离固体和液体混合物,操作时要注意“一贴二低三靠”。
蒸发用于从溶液中提取溶质,要用玻璃棒不断搅拌,防止局部过热导致液滴飞溅。
蒸馏则可以用于分离沸点不同的液体混合物,比如制取蒸馏水。
萃取利用溶质在不同溶剂中的溶解度差异来分离溶质,例如用四氯化碳萃取碘水中的碘。
接下来是“化学计量在实验中的应用”。
物质的量是一个非常重要的物理量,它把微观粒子的数量和宏观可称量的物质联系起来。
1 摩尔任何粒子所含的粒子数都约为 602×10²³个,这个常数被称为阿伏伽德罗常数。
通过物质的量,可以方便地进行有关计算,比如物质的量(n)、质量(m)、摩尔质量(M)之间的关系是 n = m / M。
气体摩尔体积(Vm)用于衡量气体在一定条件下所占的体积,标准状况下(0℃、101kPa),Vm 约为 224 L/mol。
物质的量浓度(c)则是表示单位体积溶液中所含溶质的物质的量,计算公式为 c = n / V。
然后是“物质的分类”。
物质可以分为混合物和纯净物。
纯净物又分为单质和化合物。
化合物可以根据其组成和性质进一步分类,如氧化物、酸、碱、盐等。
分散系是一种混合物,包括溶液、胶体和浊液。
胶体具有丁达尔效应,这是区分胶体和溶液的一种简便方法。
“离子反应”也是重要的知识点之一。
电解质在水溶液中或熔融状态下能够导电,非电解质则不能。
在水溶液中能够完全电离的电解质称为强电解质,部分电离的是弱电解质。
离子反应的实质是离子之间的结合或交换,发生离子反应的条件通常是生成沉淀、气体、水等。

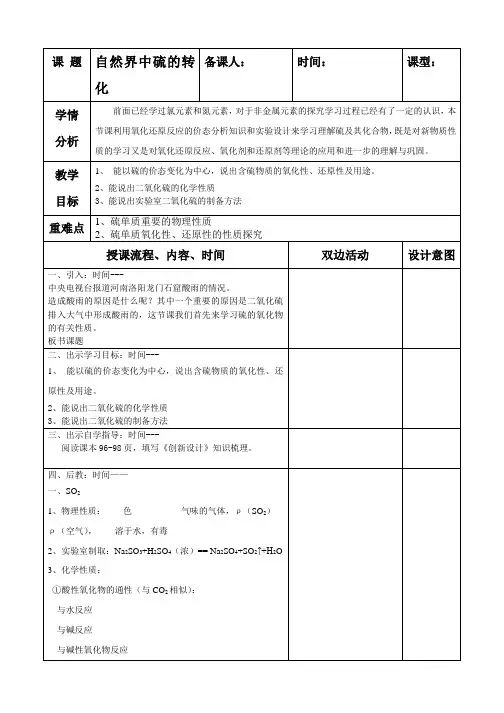
高一化学必修1第四章第三节硫和氮的氧化物〔第1课时 二氧化硫和三氧化硫〕编写人: 谢肇明审核人:许丰娟高一_____班第____组编号_____姓名_________小组评价______教师评价_______ 【学习目标】1、了解单质硫和二氧化硫的物理性质;了解可逆反响的概念。
2、掌握二氧化硫的主要化学性质;了解三氧化硫的化学性质。
【学习重点】二氧化硫的主要化学性质。
【使用说明】本学案需1课时完成。
课前请阅读教材89-91页并完成【预习自学】一、单质硫: 1、硫〔俗称〕:色固体〔晶体〕, 溶于水, 溶于酒精,溶于二硫化碳〔CS 2〕。
硫在自然界以态和态存在。
2、硫的原子构造,硫是比拟活泼的非金属单质,常见化合价为,你能说出其代表物吗?。
硫在反响中即表现氧化性又表现复原性。
3、硫的化学性质:〔1〕氧化性 S+Fe =FeS 2Cu+S =Cu 2S 结合氯气与铁、铜的反响比拟氯和硫的氧化性〔2〕复原性;S+O 2====二、二氧化硫和三氧化硫 1、二氧化硫 〔1〕物理性质SO 2是色、有的有气体,容易,易于水〔1体积水可溶解40体积〕。
密度比空气,收集SO 2用方法。
〔2〕二氧化硫的化学性质:写出以下反响的化学方程式。
SO 2 与 H 2O 的反响 (酸性氧化物)SO 2 与 O 2 的反响SO 2 与 NaOH 的反响(酸性氧化物) 2、三氧化硫〔1〕物理性质:标准状况下.....为无色、易挥发的晶体..℃℃。
〔2〕化学性质:属于酸性氧化物 SO 3 + H 2O ——SO 3 + CaO ——SO 3 + C a (O H )2 ——3、二氧化硫的主要来源; 含还硫物质的燃烧在煤、石油和某些金属矿物中含硫或硫的化合物在燃烧或冶炼时,会生成SO 2,这是大气中SO 2的主要来源[思考]怎样闻SO 2气体?[合作探究]〖实验探究1〗完成课本P90“实验4-7〞,思考交流课本P91“学与问〞。


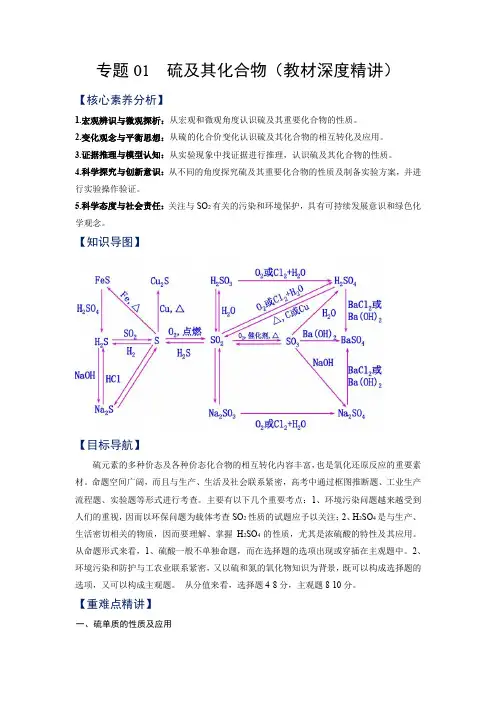
专题01 硫及其化合物(教材深度精讲)【核心素养分析】1.宏观辨识与微观探析:从宏观和微观角度认识硫及其重要化合物的性质。
2.变化观念与平衡思想:从硫的化合价变化认识硫及其化合物的相互转化及应用。
3.证据推理与模型认知:从实验现象中找证据进行推理,认识硫及其化合物的性质。
4.科学探究与创新意识:从不同的角度探究硫及其重要化合物的性质及制备实验方案,并进行实验操作验证。
5.科学态度与社会责任:关注与SO2有关的污染和环境保护,具有可持续发展意识和绿色化学观念。
【知识导图】【目标导航】硫元素的多种价态及各种价态化合物的相互转化内容丰富,也是氧化还原反应的重要素材。
命题空间广阔,而且与生产、生活及社会联系紧密,高考中通过框图推断题、工业生产流程题、实验题等形式进行考查。
主要有以下几个重要考点:1、环境污染问题越来越受到人们的重视,因而以环保问题为载体考查SO2性质的试题应予以关注;2、H2SO4是与生产、生活密切相关的物质,因而要理解、掌握H2SO4的性质,尤其是浓硫酸的特性及其应用。
从命题形式来看,1、硫酸一般不单独命题,而在选择题的选项出现或穿插在主观题中。
2、环境污染和防护与工农业联系紧密,又以硫和氮的氧化物知识为背景,既可以构成选择题的选项,又可以构成主观题。
从分值来看,选择题4-8分,主观题8-10分。
【重难点精讲】一、硫单质的性质及应用1.硫元素的存在形态(1)游离态:在火山口附近或地壳的岩层例存在; (2)化合态:以硫化物和硫酸盐的形式存在,⎩⎪⎨⎪⎧硫化物:硫铁矿FeS 2、黄铜矿CuFeS 2硫酸盐:芒硝Na 2SO 4·10H 2O 、石膏CaSO 4·2H 2O 、明矾KAl(SO 4)2·12H 2O 其它:蛋白质、化石燃料。
2.硫单质的物理性质硫单质俗称硫黄,是一种淡黄色固体;不溶于水,微溶于酒精,易溶于CS 2;有多种同素异形体,如单斜硫、斜方硫等。

人教版高一(必修一)化学第四章二氧化硫和三氧化硫(含答案解析)一、选择题1.常温下单质硫主要以S8方式存在。
加热时,S8会转化为S6、S4、S2等。
当温度到达750 ℃时,硫蒸气主要以S2方式存在(占92%)。
以下说法中正确的选项是()A.S8转化为S6、S4、S2属于物理变化B.不论哪种硫分子,完全熄灭时都生成SO2C.S8、S6、S4、S2均属于共价化合物D.把硫单质在空气中加热到750 ℃即得S2【解析】A.物理变化是没有新物质生成的变化,S8转化为S6、S4、S2属于化学变化,故A错误;B.不论哪种硫分子,组成元素只要硫元素,熄灭产物都是二氧化硫,故B正确;C.S8、S6、S4、S2均属于单质,故C错误;D.硫单质在空气中加热时,硫单质会和氧气之间发作反响,不会失掉纯真的硫单质,故D错误,应选B。
【答案】 B2.以下物质中,不能由单质直接化合生成的是()①CuS②FeS③SO3④H2S⑤FeCl2A.①③⑤B.①②③⑤C.①②④⑤D.全部【解析】①硫的氧化性较弱,和变价金属反响生成低价态化合物,硫和铜反响生成Cu2S不是CuS,所以CuS不能经过单质直接化合生成;②硫和铁反响能生成FeS,故FeS能经过单质直接化合生成;③硫和氧气反响生成SO2而不是SO3,故SO3不能由单质直接化合生成;④硫和氢气反响生成H2S,故H2S 能经过单质直接化合生成;⑤氯气的氧化性较强,和变价金属反响生成低价态化合物,氯气和铁反响生成FeCl3,而不是FeCl2,故FeCl2不能由单质直接化合生成。
【答案】 A【点评】此题考察了物质的变化,硫单质、氯气单质的性质,难度不大。
解题的关键是掌握好硫单质、氯气单质的氧化性的强弱不同。
3.以下说法不正确的选项是()A.硫粉在过量的纯氧中熄灭可以生成少量的SO2B.可以用品红溶液鉴别SO2和CO2C.SO2能使品红溶液、酸性KMnO4溶液褪色,但褪色原理不同D.大批SO2经过CaCl2的溶液能生成白色沉淀【解析】A.硫粉在过量的纯氧中熄灭可以生成少量的SO2,A正确;B.SO2能使品红溶液褪色,CO2不能,可以用品红溶液鉴别SO2和CO2,B正确;C.SO2能使品红溶液,酸性KMNO4溶液褪色,但褪色原理不同,后者是被酸性高锰酸钾溶液氧化,C正确;D.SO2与CaCl2溶液不反响,D错误,答案选D。

高一必修一化学硫的知识点化学中的硫是一个非金属元素,原子序数为16,化学符号为S。
硫是地壳中的重要成分之一,也是生命中不可或缺的元素之一。
在高一必修一化学中,我们需要了解硫的一些基本性质、化合物以及其在生活中的应用。
第一节:硫的基本性质与结构硫的原子结构由16个电子组成,其中两个位于内层,剩余的14个电子分布在外层。
硫原子的外层电子数目为6,因此它可以接受两个电子或者共享两个电子从而与其他元素形成化学键。
硫原子还有六个外层空轨道,使其能够参与到多种化学反应中。
硫是一种黄绿色的非金属元素,常见的硫的同素异形体有两种,即差异为晶体结构的单斜硫和正交硫。
硫在常温下为固体,具有蛋白质或橡胶的气味,它有较低的熔点和沸点。
此外,硫具有较好的导电性和热导性,但是它并不是好的导体。
第二节:硫的化合物与应用硫的化合物非常重要且多样化。
其中,硫酸是一种重要的化合物,在制药、农业和化学工业中广泛应用。
硫酸是无色的、无味的液体,能够与许多物质反应,如金属、碱和酸。
它是制造肥料、溶解矿石以及制造酸性清洁剂的重要原料。
此外,硫还和氧形成二氧化硫(SO2)和三氧化硫(SO3)等氧化物。
二氧化硫是一种无色气体,常见于燃烧和硫矿石的焙烧过程中。
它是大气中的主要污染物之一,并且对环境和人体健康构成威胁。
三氧化硫是一种无色气体,可以在一定条件下与水反应生成硫酸。
此外,硫还可形成硫化物,如硫化氢(H2S)、二硫化碳(CS2)和硫化锌(ZnS)等。
硫化氢是一种具有刺激性气味的无色气体,常见于腐烂的有机物体和地下矿区。
它有毒性,对人体和环境有害。
二硫化碳是一种具有刺激性气味的无色液体,在化学实验和工业生产中广泛应用。
硫化锌是一种无色晶体,被用作白色颜料,也可用于制造光学器件。
第三节:硫的危害与保护尽管硫广泛应用于工业和农业领域,但它也会对环境和人体健康造成一定的危害。
如前所述,二氧化硫是大气中的主要污染物之一,它可以导致酸雨的形成,对土壤、水源和植被造成损害。

高一化学必修一知识点总结高一化学必修一知识点总结高一化学必修一知识点总结1氯离子的检验使用硝酸银溶液,并用稀硝酸排除干扰离子(CO32-、SO32-)HCl+AgNO3==AgCl↓+HNO3NaCl+AgNO3==AgCl↓+NaNO3Na2CO3+2AgNO3==Ag2CO3↓+2NaNO3Ag2CO3+2HNO3==2AgNO3+CO2↑+H2OCl-+Ag+==AgCl↓二氧化硫制法(形成):硫黄或含硫的燃料燃烧得到(硫俗称硫磺,是黄色粉末) S+O2===(点燃)SO2物理性质:无色、刺激性气味、容易液化,易溶于水(1:40体积比) 化学性质:有毒,溶于水与水反应生成亚硫酸H2SO3,形成的溶液酸性,有漂白作用,遇热会变回原来颜色。
这是因为H2SO3不稳定,会分解回水和SO2SO2+H2OH2SO3因此这个化合和分解的过程可以同时进行,为可逆反应。
可逆反应——在同一条件下,既可以往正反应方向发生,又可以向逆反应方向发生的化学反应称作可逆反应,用可逆箭头符号连接。
一氧化氮和二氧化氮一氧化氮在自然界形成条件为高温或放电:N2+O2========(高温或放电)2NO,生成的一氧化氮很不稳定,在常温下遇氧气即化合生成二氧化氮:2NO+O2==2NO2一氧化氮的介绍:无色气体,是空气中的污染物,少量NO可以治疗心血管疾病。
二氧化氮的介绍:红棕色气体、刺激性气味、有毒、易液化、易溶于水,并与水反应:3NO2+H2O==2HNO3+NO这是工业制硝酸的方法。
高一化学必修一知识点总结2一、物质的分类把一种(或多种)物质分散在另一种(或多种)物质中所得到的体系,叫分散系.被分散的物食谱鞣稚⒅(可以是气体、液体、固体),起容纳分散质作用的物质称作分散剂(可以是气体、液体、固体).溶液、胶体、浊液三种分散系的比较分散质粒子大小/nm外观特征能否通过滤纸有否丁达尔效应实例溶液小于1均匀、透明、稳定能没有NaCl、蔗糖溶液胶体在1—100之间均匀、有的透明、较稳定能有Fe(OH)3胶体浊液大于100不均匀、不透明、不稳定不能没有泥水二、物质的化学变化1、物质之间可以发生各种各样的化学变化,依据一定的标准可以对化学变化进行分类.(1)根据反应物和生成物的类别以及反应前后物质种类的多少可以分为:A、化合反应(A+B=AB)B、分解反应(AB=A+B)C、置换反应(A+BC=AC+B)D、复分解反应(AB+CD=AD+CB)(2)根据反应中是否有离子参加可将反应分为:A、离子反应:有离子参加的一类反应.主要包括复分解反应和有离子参加的氧化还原反应.B、分子反应(非离子反应)(3)根据反应中是否有电子转移可将反应分为:A、氧化还原反应:反应中有电子转移(得失或偏移)的反应实质:有电子转移(得失或偏移)特征:反应前后元素的化合价有变化B、非氧化还原反应2、离子反应(1)、电解质:在水溶液中或熔化状态下能导电的化合物,叫电解质.酸、碱、盐都是电解质.在水溶液中或熔化状态下都不能导电的化合物,叫非电解质.注意:①电解质、非电解质都是化合物,不同之处是在水溶液中或融化状态下能否导电.②电解质的导电是有条件的:电解质必须在水溶液中或熔化状态下才能导电.③能导电的物质并不全部是电解质:如铜、铝、石墨等.④非金属氧化物(SO2、SO3、CO2)、大部分的有机物为非电解质.(2)、离子方程式:用实际参加反应的离子符号来表示反应的式子.它不仅表示一个具体的化学反应,而且表示同一类型的离子反应.复分解反应这类离子反应发生的条件是:生成沉淀、气体或水.书写方法:写:写出反应的化学方程式拆:把易溶于水、易电离的物质拆写成离子形式删:将不参加反应的离子从方程式两端删去查:查方程式两端原子个数和电荷数是否相等(3)、离子共存问题所谓离子在同一溶液中能大量共存,就是指离子之间不发生任何反应;若离子之间能发生反应,则不能大量共存.A、结合生成难溶物质的离子不能大量共存:如Ba2+和SO42-、Ag+和Cl-、Ca2+和CO32-、Mg2+和OH-等B、结合生成气体或易挥发性物质的离子不能大量共存:如H+和CO32-,HCO3-,SO32-,OH-和NH4+等C、结合生成难电离物质(水)的离子不能大量共存:如H+和OH-、CH3COO-,OH-和HCO3-等.D、发生氧化还原反应、水解反应的离子不能大量共存(待学)注意:题干中的条件:如无色溶液应排除有色离子:Fe2+、Fe3+、Cu2+、MnO4-等离子,酸性(或碱性)则应考虑所给离子组外,还有大量的H+(或OH-).(4)离子方程式正误判断(六看)(一)看反应是否符合事实:主要看反应能否进行或反应产物是否正确(二)看能否写出离子方程式:纯固体之间的反应不能写离子方程式(三)看化学用语是否正确:化学式、离子符号、沉淀、气体符号、等号等的书写是否符合事实(四)看离子配比是否正确(五)看原子个数、电荷数是否守恒(六)看与量有关的反应表达式是否正确(过量、适量)3、氧化还原反应中概念及其相互关系如下:失去电子——化合价升高——被氧化(发生氧化反应)——是还原剂(有还原性)得到电子——化合价降低——被还原(发生还原反应)——是氧化剂(有氧化性)高一化学必修一知识点总结3一、金属+盐溶液→新金属+新盐中:①金属的相对原子质量>新金属的相对原子质量时,反应后溶液的质量变重,金属变轻。

硫及其化合物的性质氧及其化合物的性质1.氧气(1)物理性质:(2)化学性质:(注意反应条件、反应现象、应用及有关实验操作)(写出化学方程式)与非金属反应(C、S、P、N2、Si)与金属反应(Na、Mg、Fe、Cu)与化合物反应(H2S、SO2、CO、Na2SO3、C2H2、C2H5OH、CH3CHO)(3)O2的制法:工业上主要采用分离液态空气法来得到氧气实验室可利用KMnO4、KClO3和H2O2的分解反应来制得氧气。
2.。
双氧水(1)物理性质:无色粘稠的,氧元素为价。
(2)化学性质:既有氧化性,又有还原性,以氧化性为主。
有弱酸性。
3.臭氧(1)物理性质:常温常压下,有特殊臭味的淡蓝色气体ρ3O > ρ2O(2)化学性质:①不稳定性:2O3= 3O2(升高温度分解速率加快)②极强的氧化性:6Ag + O3= 3Ag2O O3+2KI+H2O=2KOH+I2+O2③漂白和消毒:有些染料受到O3的强烈氧化作用会褪色,还可以杀死细菌,因此,O3是一种很好的脱色剂和消毒剂硫及其化合物的性质知识主线:H2S/S2- ------S----SO2/SO一.硫1.物理性质:硫通常是一种色、松脆的固体,不溶于水,微溶于,易溶于CS2。
思考:你还学过其他淡黄色固体吗?2.化学性质:单质硫是一种弱氧化剂,在反应中既可以表现出氧化性又可以表现出还原性。
a .氧化性(与H2、Fe、Cu、Hg、KNO3和C反应)思考:在与变价金属反应时,氯气和硫有什么不同?b.还原性与(与O2、HNO3、浓硫酸H2SO4反应)思考:硫与氧气能否一步反应生成SO3?c .与碱溶液反应(在强碱溶液中S 可发生歧化,生成s 2-和SO 32-) 用途:热的浓氢氧化钠溶液洗涤粘有硫的试管?3.硫的用途:用于制黑火药(KNO 3、C 、S )、火柴、焰火、H 2SO 4、农药、橡胶硫化剂。
二、硫化氢(H 2S )1.物理性质:无色、有臭鸡蛋气味、剧毒气体,能溶于水(1:2.26),密度比空气大。
高一化学必修一硫氯氮知识点硫氯氮是高中化学必修一中的重要知识点,掌握了这些知识,可以更好地理解化学反应和化学方程式的原理。
本文将介绍硫氯氮的基本性质和常见化合物,帮助大家更好地学习和理解这些内容。
1. 硫(S)的性质:硫是一种非金属元素,常见的物理性质有黄色固体、无味、无毒等。
硫在自然界中以硫矿的形式存在,可以被提取和加工成多种化合物,如二氧化硫、硫酸等。
硫的化学性质活泼,与氧、氢、元素等发生反应,生成相应的化合物。
2. 硫的化合物:(1)二氧化硫(SO2):是一种无色气体,有刺激性气味,广泛应用于工业生产。
二氧化硫可溶于水,形成亚硫酸,与氧气反应形成三氧化硫(二硫六氧,SO3)。
二氧化硫是大气污染的重要成分之一。
(2)硫酸(H2SO4):是一种无色液体,有强酸性,广泛应用于冶金、电子、化工等行业。
硫酸是化学实验室中常用的试剂之一,也是许多化学工艺的重要中间体。
3. 氯(Cl)的性质:氯是一种具有典型金属和非金属性质的元素,常见的物理性质有黄绿色气体、有刺激性气味等。
氯是一种强氧化剂,可以与大多数金属和非金属元素反应,生成相应的化合物。
4. 氯的化合物:(1)氯化钠(NaCl):是一种白色结晶固体,是食盐的主要成分。
氯化钠广泛应用于食品加工、调味等领域,也是制备其他氯化物的重要原料。
(2)氯气(Cl2):是一种黄绿色气体,有强烈刺激性气味。
氯气常用于消毒、漂白等领域,也是制备许多氯化物的重要原料。
5. 氮(N)的性质:氮是一种无色、无味的气体,是大气中主要成分之一。
氮具有较高的化学稳定性,不易与其他元素直接反应,但在高温和高压条件下能与氧、氢等元素直接反应。
6. 氮的化合物:(1)氨(NH3):是一种无色气体,具有强烈的刺激性气味。
氨广泛应用于农业和化工领域,是制备尿素等化合物的重要原料。
(2)硝酸(HNO3):是一种无色液体,具有强酸性,是化学实验室中常用的试剂之一。
硝酸广泛用于冶金、制药等行业,也是制备其他化合物的重要原料。
高一化学人教版必修一知识点梳理(实用版)编制人:__________________审核人:__________________审批人:__________________编制单位:__________________编制时间:____年____月____日序言下载提示:该文档是本店铺精心编制而成的,希望大家下载后,能够帮助大家解决实际问题。
文档下载后可定制修改,请根据实际需要进行调整和使用,谢谢!并且,本店铺为大家提供各种类型的教育资料,如幼儿教案、音乐教案、语文教案、知识梳理、英语教案、物理教案、化学教案、政治教案、历史教案、其他范文等等,想了解不同资料格式和写法,敬请关注!Download tips: This document is carefully compiled by this editor.I hope that after you download it, it can help you solve practical problems. The document can be customized and modified after downloading, please adjust and use it according to actual needs, thank you!Moreover, this store provides various types of educational materials for everyone, such as preschool lesson plans, music lesson plans, Chinese lesson plans, knowledge review, English lesson plans, physics lesson plans, chemistry lesson plans, political lesson plans, history lesson plans, and other sample texts. If you want to learn about different data formats and writing methods, please stay tuned!高一化学人教版必修一知识点梳理本店铺为各位同学整理了《高一化学人教版必修一知识点梳理》,希望对你的学习有所帮助!1.高一化学人教版必修一知识点梳理篇一硫及其化合物的性质1.铁与硫蒸气反应:Fe+S△==FeS2.铜与硫蒸气反应:2Cu+S△==Cu2S3.硫与浓硫酸反应:S+2H2SO4(浓)△==3SO2↑+2H2O4.二氧化硫与硫化氢反应:SO2+2H2S=3S↓+2H2O5.铜与浓硫酸反应:Cu+2H2SO4△==CuSO4+SO2↑+2H2O6.二氧化硫的催化氧化:2SO2+O22SO37.二氧化硫与氯水的反应:SO2+Cl2+2H2O=H2SO4+2HCl8.二氧化硫与氢氧化钠反应:SO2+2NaOH=Na2SO3+H2O9.硫化氢在充足的氧气中燃烧:2H2S+3O2点燃===2SO2+2H2O 10.硫化氢在不充足的氧气中燃烧:2H2S+O2点燃===2S+2H2O2.高一化学人教版必修一知识点梳理篇二主要反应的化学方程式:①铁与盐酸的反应:Fe+2HCl=FeCl2+H2↑②铁与硫酸铜反应(湿法炼铜):Fe+CuSO4=FeSO4+Cu③在氯化亚铁溶液中滴加氯水:(除去氯化铁中的氯化亚铁杂质)3FeCl2+Cl2=2FeCl3④氢氧化亚铁在空气中变质:4Fe(OH)2+O2+2H2O=4Fe(OH)3⑤在氯化铁溶液中加入铁粉:2FeCl3+Fe=3FeCl2⑥铜与氯化铁反应(用氯化铁腐蚀铜电路板):2FeCl3+Cu=2FeCl2+CuCl2⑦少量锌与氯化铁反应:Zn+2FeCl3=2FeCl2+ZnCl2⑧足量锌与氯化铁反应:3Zn+2FeCl3=2Fe+3ZnCl23.高一化学人教版必修一知识点梳理篇三电解质和非电解质1.定义:①条件:水溶液或熔融状态;②性质:能否导电;③物质类别:化合物。
化学高一必修一知识点整理(实用版)编制人:______审核人:______审批人:______编制单位:______编制时间:__年__月__日序言下载提示:该文档是本店铺精心编制而成的,希望大家下载后,能够帮助大家解决实际问题。
文档下载后可定制修改,请根据实际需要进行调整和使用,谢谢!并且,本店铺为大家提供各种类型的实用资料,如教案大全、书信范文、述职报告、合同范本、工作总结、演讲稿、心得体会、作文大全、工作计划、其他资料等等,想了解不同资料格式和写法,敬请关注!Download tips: This document is carefully compiled by this editor.I hope that after you download it, it can help you solve practical problems. The document can be customized and modified after downloading, please adjust and use it according to actual needs, thank you!Moreover, our store provides various types of practical materials for everyone, such as lesson plans, letter templates, job reports, contract templates, work summaries, speeches, reflections, essay summaries, work plans, and other materials. If you want to learn about different data formats and writing methods, please stay tuned!化学高一必修一知识点整理本店铺为大家整理的,在日常的学习中,大家都背过各种知识点吧?知识点也可以理解为考试时会涉及到的知识,也就是大纲的分支。
高一化学必修一硫的转化知识点硫的转化是高一化学必修一的重要知识点之一。
了解硫的转化过程和相关的反应机制,对于深入理解化学反应、环境保护和工业应用等方面都具有重要意义。
本文将分为三个部分介绍硫的转化知识点:硫的氧化反应、硫的还原反应和硫的构成物。
一、硫的氧化反应硫的氧化反应是指硫和氧气之间发生的化学反应。
常见的硫的氧化态有+2和+6,表示硫的电荷状态。
硫在氧气中可以氧化为二氧化硫(SO2)和三氧化硫(SO3)。
1. 二氧化硫的制备二氧化硫是一种无色有刺激性气味的气体,对环境和人体有一定的危害。
二氧化硫的制备方法主要有以下几种:a. 硫与氧气的直接反应:硫与氧气在高温下直接反应生成二氧化硫。
b. 金银催化剂催化反应:硫与氧气在金银催化剂的作用下,在适宜的条件下反应生成二氧化硫。
c. 硫化氢的氧化:硫化氢与氧气反应生成硫和水,硫与氧气继续反应生成二氧化硫。
d. 金属硫酸盐的热分解:金属硫酸盐在高温下热分解生成二氧化硫。
2. 三氧化硫的制备三氧化硫是一种无色有刺激性气味的固体,具有强烈的氧化性。
三氧化硫的制备方法主要有以下几种:a. 二氧化硫的催化氧化:二氧化硫在催化剂的作用下进一步氧化生成三氧化硫。
b. 金属硫酸盐的热分解:金属硫酸盐在高温下热分解生成三氧化硫。
c. 二氧化硫与过氧化氢反应:二氧化硫与过氧化氢反应生成三氧化硫和水。
二、硫的还原反应硫的还原反应是指硫与其他物质发生反应,还原为较低的氧化态。
硫的还原态主要有-2和-1。
1. 硫化物的氧化性还原反应硫化物是含硫化合物,常见的有硫化氢(H2S)、二硫化碳(CS2)等。
硫化物的氧化性还原反应是指硫化物与氧气或氧化剂反应,其中硫化氢是最常见的硫化物。
2. 酸性介质中的硫化反应在酸性介质中,硫可以与酸反应生成硫化氢气体。
三、硫的构成物硫的构成物包括硫酸和硫酸盐。
1. 硫酸的性质和制备硫酸是一种常见的无机酸,具有强酸性和强氧化性。
硫酸的制备常用的方法是硫的氧化反应,即硫与氧气反应生成二氧化硫后再与水反应生成硫酸。