培养转基因小鼠的原理
- 格式:doc
- 大小:11.25 KB
- 文档页数:2

基因编辑小鼠如何分类?
基因编辑小鼠可分为三大类、7 小类:
(1)转基因(Tg)首先构建表达载体,包含启动子、增强子、编码区、polyA 等元件,然后将表达载体注入到受精卵的细胞核内,外源表达载体将插入到受精卵的基因组内,再将该受精卵移植到受体母鼠输卵管内,发育成为小鼠个体,该小鼠就会表达转入的外源基因。
(2)基因全身性敲除(KO)利用Crispr/Cas9 系统,在受精卵的目标基因的编码区两侧分别切断,然后受精卵在连接断口的过程中,会丢失掉断口之间的序列(即编码区)。
该受精卵移植到受体母鼠输卵管内,发育成为小鼠个体,该小鼠将无法表达目标基因,导致目标基因将完全失去活性,表现为全身性基因敲除。
(3)基因敲入(KI)首先构建打靶载体:包含同源臂和外源基因,然后将表达载体通过显微注射的方法注入到受精卵的细胞核内,同时利用 Crispr/Cas9 系统,在受精卵目的基因位置切断基因组 DNA,受精卵会通过同源重组将外源基因定点整合到基因组内。
该受精卵移植到受体母鼠输卵管内,发育成为小鼠个体,该小鼠就携带了转入的外源基因。

转基因小鼠的制备方法1. 确定转基因目标首先需要确定要制备的转基因小鼠的目标。
这可能包括表达某一特定基因、缺失或激活某一基因、或者将外源基因导入小鼠基因组中。
确定目标可以指导后续制备转基因小鼠的方案和步骤。
2. 选择转基因制备方法根据目标确定适合的转基因制备方法。
常用的制备方法包括基因敲除、转基因导入、RNA干扰等技术。
选择合适的方法可以提高转基因小鼠制备成功率和效率。
3. 筛选合适的人工受精方法在制备转基因小鼠的过程中,需要进行人工受精。
选择合适的人工受精技术可以增加诞生的转基因小鼠数量和通过率。
4. 获取合适的基因材料获取适合用于转基因制备的基因材料,如合成的DNA、质粒DNA等。
同时需要对基因材料进行检测和纯化,确保其纯度和有效性。
5. 操作动物实验室在制备转基因小鼠的过程中,需要操作动物实验室,按照严格的操作规程进行。
这包括对实验室环境、设备的维护和消毒,以及对动物进行规范的喂养和饲养。
6. 采集卵巢和精子制备转基因小鼠的过程中需要采集卵巢和精子,所以需要进行手术操作。
手术前需要对手术器械和手术区域消毒和准备,同时需要准确的手术技术和配合的团队,以确保手术的成功率和安全性。
7. 受精与移植将采集到的卵巢和精子进行人工受精,通过一定的操作步骤,将受精卵移植到雌鼠子宫中。
这个过程需要对移植操作技术的掌握和实验设备的准备,同时要考虑动物的生理状态和应对可能出现的并发症。
8. 生成基因编辑电子对于基因敲除和编辑的转基因小鼠制备,需要经过足够长的时间养护和观察,以鉴定是否成功。
为了确保小鼠的转基因性,可以通过检测其DNA进行验证。
9. 鉴定转基因小鼠通过PCR、Southern印迹和Western印迹等技术对转基因小鼠进行鉴定,以确保其基因表达状态符合预期。
检测结果对于小鼠繁殖和应用阶段的进行具有重要的指导意义。
10. 培育和应用转基因小鼠在检测合格后,需要对转基因小鼠进行养育和观察。
同时对于其应用也需要依据对小鼠目标的不同,进行个性化的实验设计和数据处理。


Cramp转基因小鼠的构建及鉴定石桂英;全雄志;陈显达;陈陟阳;董伟;张连峰;鞠振宇【摘要】目的建立系统性表达Cramp转基因模型小鼠,为研究Cramp在衰老中的作用提供模型动物.方法把Cramp cDNA插入系统性表达CMV启动子下游,构建转基因表达载体,显微注射法建立Cramp转基因小鼠.PCR鉴定转基因小鼠的基因型,用RT-PCR和Western blotting方法筛选高表达品系.结果成功构建Cramp cDNA转基因载体,建立了Cramp转基因小鼠,通过RT-PCR和Western blotting 方法筛选出3个高表达品系.结论建立了系统表达Cramp转基因小鼠,转入的Cramp基因在骨髓、脾脏、肝脏等组织高表达,为研究Cramp基因在衰老中的作用及机制提供了动物模型.【期刊名称】《中国比较医学杂志》【年(卷),期】2010(020)009【总页数】4页(P12-15)【关键词】Cramp;转基因小鼠;衰老【作者】石桂英;全雄志;陈显达;陈陟阳;董伟;张连峰;鞠振宇【作者单位】中国医学科学院北京协和医学院实验动物研究所,北京,100021;中国医学科学院北京协和医学院实验动物研究所,北京,100021;中国医学科学院北京协和医学院实验动物研究所,北京,100021;中国医学科学院北京协和医学院实验动物研究所,北京,100021;中国医学科学院北京协和医学院实验动物研究所,北京,100021;中国医学科学院北京协和医学院实验动物研究所,北京,100021;中国医学科学院北京协和医学院实验动物研究所,北京,100021【正文语种】中文【中图分类】R-33Cramp(cathelin-related antimicrobial peptide)基因,位于9号染色体,其编码蛋白为cathelin-related antimicrobial peptide,即cathelicidin。
该类蛋白是在哺乳动物体内发现的一类结构多变的抗微生物肽,因在表达的信号肽与成熟肽之间含有一高度保守的cathelin肽段而自成一家族[1]。
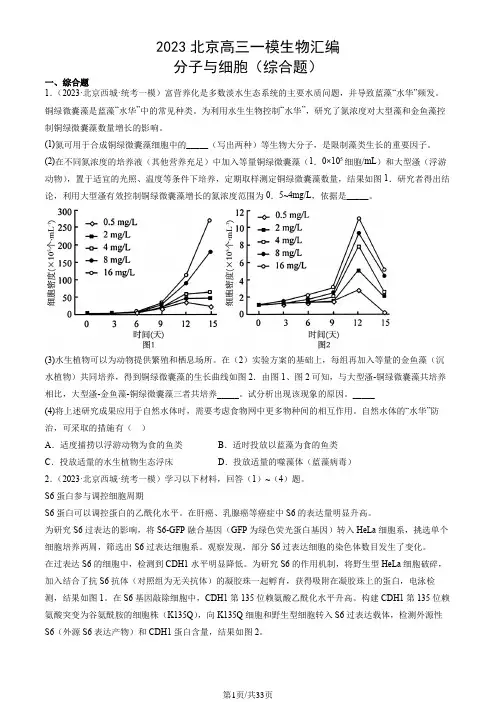
2023北京高三一模生物汇编分子与细胞(综合题)一、综合题1.(2023·北京西城·统考一模)富营养化是多数淡水生态系统的主要水质问题,并导致蓝藻“水华”频发。
铜绿微囊藻是蓝藻“水华”中的常见种类。
为利用水生生物控制“水华”,研究了氮浓度对大型藻和金鱼藻控制铜绿微囊藻数量增长的影响。
(1)氮可用于合成铜绿微囊藻细胞中的_____(写出两种)等生物大分子,是限制藻类生长的重要因子。
(2)在不同氮浓度的培养液(其他营养充足)中加入等量铜绿微囊藻(1.0×105细胞/mL)和大型溞(浮游动物),置于适宜的光照、温度等条件下培养,定期取样测定铜绿微囊藻数量,结果如图1.研究者得出结论,利用大型溞有效控制铜绿微囊藻增长的氮浓度范围为0.5~4mg/L,依据是_____。
(3)水生植物可以为动物提供繁殖和栖息场所。
在(2)实验方案的基础上,每组再加入等量的金鱼藻(沉水植物)共同培养,得到铜绿微囊藻的生长曲线如图2.由图1、图2可知,与大型溞-铜绿微囊藻共培养相比,大型溞-金鱼藻-铜绿微囊藻三者共培养_____。
试分析出现该现象的原因。
_____(4)将上述研究成果应用于自然水体时,需要考虑食物网中更多物种间的相互作用。
自然水体的“水华”防治,可采取的措施有()A.适度捕捞以浮游动物为食的鱼类B.适时投放以蓝藻为食的鱼类C.投放适量的水生植物生态浮床D.投放适量的噬藻体(蓝藻病毒)2.(2023·北京西城·统考一模)学习以下材料,回答(1)~(4)题。
S6蛋白参与调控细胞周期S6蛋白可以调控蛋白的乙酰化水平。
在肝癌、乳腺癌等癌症中S6的表达量明显升高。
为研究S6过表达的影响,将S6-GFP融合基因(GFP为绿色荧光蛋白基因)转入HeLa细胞系,挑选单个细胞培养两周,筛选出S6过表达细胞系。
观察发现,部分S6过表达细胞的染色体数目发生了变化。
在过表达S6的细胞中,检测到CDH1水平明显降低。

第1篇一、实验背景随着生物技术的飞速发展,转基因技术在医学、农业等领域发挥着越来越重要的作用。
小鼠作为生物医学研究中常用的实验动物,其基因编辑技术的应用为疾病模型构建、药物筛选和基因功能研究提供了有力工具。
本实验旨在通过基因编辑技术构建转基因小鼠模型,研究特定基因在小鼠体内的表达和功能。
二、实验材料1. 实验动物:C57BL/6小鼠,雄性,8周龄。
2. 基因构建材料:目的基因(GFP基因)、启动子(CMV启动子)、荧光素酶报告基因(Luc基因)、pEGFP-C1质粒载体、pGL3-Basic质粒载体。
3. 实验试剂:限制性内切酶、DNA连接酶、T4 DNA连接酶、DNA聚合酶、PCR引物、Trizol试剂、RNA提取试剂盒、反转录试剂盒、荧光定量PCR试剂盒、细胞培养试剂等。
4. 仪器设备:PCR仪、凝胶成像系统、实时荧光定量PCR仪、细胞培养箱、显微镜等。
三、实验方法1. 目的基因构建:将GFP基因和Luc基因分别插入到pEGFP-C1和pGL3-Basic质粒载体中,构建重组质粒。
2. 重组质粒转染:将构建好的重组质粒通过脂质体转染法转染C57BL/6小鼠胚胎干细胞(ES细胞)。
3. 转基因小鼠胚胎细胞筛选:通过GFP荧光筛选,得到阳性细胞克隆。
4. 胚胎细胞传代培养:将阳性细胞克隆进行传代培养,筛选出稳定表达的细胞系。
5. 胚胎细胞冻存:将稳定表达的细胞系进行冻存,以备后续实验使用。
6. 胚胎移植:将冻存后的胚胎细胞进行移植,获得转基因小鼠。
7. 转基因小鼠表型鉴定:通过GFP荧光显微镜观察转基因小鼠体内GFP表达情况,并通过实时荧光定量PCR检测GFP基因在转基因小鼠体内的表达水平。
四、实验结果1. 重组质粒构建:成功构建了含有GFP基因和Luc基因的重组质粒。
2. 转基因小鼠胚胎细胞筛选:通过GFP荧光筛选,得到阳性细胞克隆。
3. 胚胎细胞传代培养:成功传代培养出稳定表达的细胞系。
4. 胚胎移植:成功获得转基因小鼠。

制备转基因小鼠的原理
制备转基因小鼠的原理是通过基因工程技术将外源基因导入小鼠的基因组中。
具体步骤如下:
1. 选择目标基因:根据研究需求选择要导入小鼠基因组的外源基因。
这个外源基因可以来自其他物种,也可以是已存在于小鼠中但表达量较低的基因。
2. 构建质粒:将选择的目标基因与载体DNA(如质粒)连接。
质粒通常含有特定的启动子、终止子和选择性标记基因(如抗生素抗性基因),以便检测和筛选成功导入外源基因的小鼠。
3. 体外培养:将构建好的质粒导入细胞培养物中,利用细胞的自身复制和修复机制,使质粒与小鼠细胞的染色体发生重组,将外源基因导入到小鼠的基因组内。
4. 选择性筛选:为了筛选成功导入外源基因的细胞,可以添加抗生素等选择性标记物质,只有带有外源基因的细胞能够存活下来。
5. 胚胎干细胞注射:将筛选出的带有外源基因的细胞注射到小鼠的早期胚胎中。
这些细胞会参与胚胎发育,在小鼠的成体组织中形成细胞系,继续表达外源基因。
6. 交配和繁殖:将带有外源基因的小鼠进行交配和繁殖,使外源基因在小鼠种群中得以传递和稳定遗传。
通过以上步骤,外源基因成功导入小鼠基因组,并表达在小鼠的细胞和组织中,从而达到制备转基因小鼠的目的。

使用 CRISPR-Cas9 创建转基因小鼠的方案虽然近年来已经开发了几种基因组编辑工具,包括锌指结构和 TALENs(转录激活物样效应物核酸酶),但没有一种能像CRISPR/Cas9系统那样高效,该系统由一个RNA引导的DNA内切酶 (Cas9) 和对应的引导RNA(CRISPR) 组成。
利用该系统,研究人员能够实现一步敲除多个基因的等位基因的突变小鼠1。
只需两三周的时间,即可创造出子携带条件性等位基因和报告基因的小鼠2,并且该方案。
特别要注意的是,该过程不需要创建修改的小鼠ES细胞过程,该过程有时会十分困难3。
随着 Cas9 敲入和敲除小鼠的发展,预计越来越多的实验室将选择 CRISPR/Cas9 系统来生成转基因小鼠模型。
使用CRISPR-Cas9创建转基因小鼠的方案动物学研究。
2016 年 7 月 18 日;37(4): 205–213.利用 CRISPR/Cas9 和单倍体胚胎干细胞系统产生基因修饰的小鼠。
图 1.在小鼠胚胎上使用 CRISPR/Cas9 基因组编辑创建转基因小鼠的示意图。
通过共注射 Cas9 mRNA 和向指导 RNA,多个基因靶标可以在小鼠胚胎中一次敲除。
(改编自Yang H,Wang H 和 Jaenisch R. Nat Protoc。
2014 年 8 月;9(8):1956-68.)Sigma-Aldrich 是为基因组编辑提供工具和定制服务的领导者,包括 ZFN 和CRISPR/cas9。
默克还提供了广泛的小鼠胚胎验证培养基和试剂组合,用于储存、转移和扩增用于在EmbryoMAX™名下创建转基因小鼠模型的小鼠胚胎。
浏览所有的基因组编辑产品浏览所有经小鼠胚胎验证的试剂小鼠胚胎和ES细胞培养基小鼠ES细胞培养基实验方案和过程成功的小鼠模型项目的提示1.了解实验目的并开展研究。
生成正确的小鼠需要完全理解被测试依据的假设。
例如,研究者可能希望验证这样的假设:突变肝脏中的转运蛋白可能会减轻特定药物的肝毒性作用。

竭诚为您提供优质文档/双击可除小鼠基因型鉴定原理篇一:小鼠表型鉴定小鼠发育阶段特点出生为红色(若要换窝,要带一点周围的木屑,否则鼠妈不认识)→生后4-5天开始长毛→生后7天剪脚趾和剪尾巴做基因型鉴定→生后10天开眼→生后20天断奶→生后40天可以合笼→怀孕20天后产崽。
小鼠性别判断:雌鼠的后腹部左右两侧有明显的乳头。
小鼠发情判断:雌鼠一般出生后40天开始发情,发情时肛门(或阴道口)为红色。
之后一直处于可以生育阶段。
一般繁殖合笼为一雄配二三雌,一般不将两只雄鼠和一只雌鼠放在一起,因为两只雄鼠会打架。
在做完基因型鉴定之后要尽快把不需要的小鼠处死,因为小鼠太多雌鼠会奶水不足,当雌鼠奶水不足时,会吃掉鼠崽。
小鼠基因型鉴定配方:bufferA0.5meDTA(ph8.0)10mol/Lnaoh双蒸水定容到250mL室温储存100uL625uLbufferbTribase浓盐酸调ph到3.0室温储存40mm步骤:1.小鼠出生7天后剪尾巴(一小点就行),若出生30天后剪耳朵;2.75uLbufferA100℃煮40min,每20min摇一次;3.225uLbufferb12000r/min3min,上清为DnA,跑pcR 鉴定。
篇二:转基因小鼠鉴定实验转基因小鼠鉴定实验在刚出生产出的鼠仔中,属转基因小鼠者,约占全部仔小鼠的20%-30%。
因此,对转基因小鼠必须进行鉴定筛选。
1.转基因整合检测鉴定转基因小鼠最简单的方法是从小鼠尾尖提取基因组DnA,检测其基因型。
检测方法包括pcR和shouthern杂交。
(1)基因组DnA的提取:1)将离乳期小鼠(>4周龄)麻醉标记。
2)用一只手抓住小鼠,另一只手持消毒剪剪下约1cm的鼠尾。
(2)pcR检测:转基因的初始筛选通常采用pcR检测技术。
该技术操作简便、快速、费用低而有效,适合大量标本的分析。
由于该技术特别敏感,可能产生假阳性结果。
因此,在操作过程中必须特别小心,避免质粒DnA或其它标本的基因组DnA的污染。

实验动物按遗传特点分类近交系(Inbred Strain ) 封闭群(Closed Colony or Outbred Stock ) 杂交群(Hybrids) 1909年,莱托最早培育的近交系小鼠有DBA,DBA的名称取自淡化(dilute,d)、褐色化(Brown,b)、去杂色化(nonagouti, a)三种变异毛色的缩写。
C57 、C58,分别从编号为57、58的雌鼠培育而来。
1911年育成远交Wistar大鼠1918年以后,SD大鼠、Lewis大鼠、Long-Evans大鼠近交系( inbred strain)定义经至少连续20代的全同胞兄妹交配或亲子交配,近交系数(inbreeding coefficient)达到99%,品系内所有个体都可追溯到第20代或以后代数的一对共同祖先。
近交系数:群体中某个体通过遗传携带两个同源等位基因的概率。
近交系命名:一般以大写英文字母或大写英文字母加阿拉伯数字命名。
BALB ,DBA,TA1, C3H等。
一些历史较长,已经广泛使用并获得认可的品系除外,如129等。
亚系(Substrain)定义由同一个近交系分离出来的有不同特性的分支,这些分支间有遗传差异,称为该品系的亚系。
形成㈠在兄妹交配20-40代时形成的分支;主要原因是残留杂合(Residual heterozygosity);㈡某分支与其它分支分开繁殖超过100代。
主要原因是突变㈢发现一个分支与其它分支的差异。
原因为残留杂合、突变或遗传污染(Genetic contamination)。
命名在品系名称后加一道斜线(/),斜线后标明亚系的符号,亚系的符号可以是以下三种a) 数字,如DBA/1、DBA/2等b) 培育或产生亚系单位或人的缩写英文名称,第一个字母用大写,以后的字母用小写。
使用缩写文名称应注意不要和已公布过的名称重复。
例如:A/He,表示A近交系的Heston 亚系;CBA/J,表示由Jackson保持的CBA近交系的亚系c) 当一个保持者保持的一个近交系具有两个以上的亚系时,可在数字后再加保持者的缩写英文名称来表示亚系。

《中国癌症杂志》2012年第22卷第5期CHINA ONCOLOGY 2012 Vol.22 No.5321 CHINA ONCOLOGY红色荧光蛋白和荧光素酶双报告基因转基因小鼠的建立张余琴 林晓琳 贾俊双 谢饶英 樊全荣 赵尊兰 杨升 高飞 姚开泰 肖东△南方医科大学肿瘤研究所,△比较医学研究所暨实验动物中心,广东 广州 510515 [摘要] 背景与目的:活体动物体内光学成像(optical in vivo imaging)主要采用生物发光与荧光两种技术。
生物发光是用荧光素酶(luciferase,Luc)基因标记细胞或DNA,而荧光技术则采用荧光报告基团(GFP、RFP、Cyt及dyes等)进行标记,利用一套非常灵敏的光学检测仪器,能够直接监控活体生物体内的细胞活动和基因行为,生物发光成像具有高的灵敏度和特异性,同时生物发光信号可用于精确定量,而荧光成像具有方便、便宜、直观、标记靶点多样和易于被大多数研究人员接受的优点。
本研究基于慢病毒介导的转基因方法制备红色荧光蛋白(red fluorescent protein,RFP)和Luc双报告基因转基因小鼠(即RL转基因小鼠),将这两种技术融为一体。
方法:制备携带RFP和Luc基因(简写RL基因)的慢病毒,然后将携带RL基因的慢病毒注入小鼠单细胞受精卵卵周隙以感染受精卵,胚胎移植进假孕母鼠以获得仔鼠,应用小动物活体成像仪、体视荧光显微镜和PCR等在蛋白和DNA水平上筛选和鉴定,并获得RL转基因小鼠。
结果:移植卵周隙注射有慢病毒的胚胎125枚给6只假孕母鼠,其中4只假孕母鼠怀孕,共生仔鼠20只;利用小动物活体成像仪检测RFP和Luc表达,在蛋白水平证实20只F0代中,3只高表达RFP和Luc;DNA水平检测证实,3只RFP和Luc阳性的小鼠基因组中确实整合有外源转基因RL,预示基因型鉴定结果很好验证了小动物活体成像仪筛选和鉴定结果。
此外,RL转基因首建鼠基因组中整合的RL转基因可稳定遗传至下一代,并能正常表达。
转基因小鼠原理
转基因小鼠是通过将外源基因导入小鼠的基因组中,使其具备某种特定的基因表达或功能。
下面将介绍转基因小鼠的原理。
转基因小鼠的制备主要包括以下步骤:
1. 外源基因的选择:根据研究的需要,选择具有特定表达或功能的外源基因。
这些基因可以来自于同一物种的其他个体,也可以来自于不同物种。
外源基因通常与标记基因(如荧光蛋白)连在一起,以便在小鼠体内进行检测或追踪。
2. 载体构建:将外源基因插入到合适的载体中。
这个载体通常是一个环状DNA,能够在细菌中进行复制。
载体还包括选择
性标记基因,用于筛选带有外源基因的细菌。
3. 载体的导入:将构建好的载体导入到干细胞中。
这一步通常通过细菌转化或化学方法实现。
被导入的载体被融合到小鼠的染色体中,成为其基因组的一部分。
4. 选代与筛选:经过导入外源基因的干细胞进一步进行培养和筛选,确保外源基因被稳定地遗传给后代。
5. 建立转基因小鼠系:通过转基因小鼠的选择性繁殖,建立稳定的转基因小鼠系。
这些小鼠在其体细胞中都带有外源基因。
通过以上步骤,转基因小鼠就能够被制备出来。
这些小鼠可以被用于研究基因与某种生理或疾病相关的功能和表达。
转基因
小鼠的制备对于科学研究、药物开发和疾病治疗等领域具有重要意义。
转基因小鼠制备实验方法1、选取7~8周龄雌性小鼠,阴道口封闭,作为供体,下午3:00左右,每只小鼠腹腔注射PMSG(10 IU)。
2、 47~48小时后,每只小鼠腹腔注射HCG(0.8 IU),并与正常公鼠合笼;另取数只适龄母鼠(2月龄以上)作为受体,阴道口潮红,与结扎公鼠合笼。
3、第二天上午9:00前观察供体、受体,有精栓者拿出备用。
受体笼拿出作好隔离措施。
4、10:30左右,断颈处死供体,手术取出整个输卵管,放入透明质酸酶~0.3mg/M2液中。
显微镜下,用镊子撕开输卵管壶腹部,受精卵随同颗粒细胞即一同流出。
5、仔细观察放在透明质酸酶M2液中的受精卵,当受精卵周围的颗粒细胞脱离时,将受精卵吸出,放入M2液中洗涤,最后放在M16液中放入5% CO2,37C0培养箱培养。
6、在显微镜下观察,挑选细胞饱满,透明带清晰,雄原核清晰可见的受精卵待用。
7、安装持卵针和注射针,使其末端平行于载物台,在凹玻片的中央滴入一滴M2液,覆盖石蜡油,移入待注射的受精卵。
DNA在注射针中的气泡应在先前全部弹走。
8、在高倍镜下,将注射针轻触持卵管,使DNA缓慢流出并控制其流量;反复吹吸受精卵,使其处于最佳位置,将注射针刺入受精卵的雄原核,直至看到原核膨大即退出。
将注射过的和未注射过的受精卵上下分开放置,不致于混搅,注射完毕后,放入5% CO2,37C0培养箱培养。
9、将受体麻醉,注射计量为1%戊巴比妥钠0.01ml/g,腹腔注射。
手术取出卵巢连接输卵管,用脂肪镊固定,在显微镜下找到输卵管开口。
吸取注射后经培养成活的受精卵,吸取方法是先吸一段较长的M2,吸一个气泡,然后吸取受精卵,尽量紧密排列,再吸一段液体,吸一个气泡,再吸一段液体,共四段液体三个气泡。
除较长的那段液体,其余的液体大致1cm 左右,气泡0.2cm左右。
将移植管口插入输卵管口,轻轻将移植管内的液体吹入,看到输卵管壶腹部膨大并清晰地看到三个气泡,即移植成功。
转基因小鼠在生命科学中的研究进展毕业论文1 转基因小鼠技术概述自其诞生以来的30多年里,转基因动物技术经过世界各国生物学家们的不懈努力,已经成为一项非常成熟的技术手段,极大的促进了相关生命科学领域研究进展,至今已经取得了辉煌的成就并且在不断得到改进和发展[2]。
转基因技术运用于动物育种的研究始于70年代,经过近30多年的研究和不断发展,取得了突破性进展。
1974年Jaenish和MintzIZI[3]通过微注射法向移植前的小鼠注射SV40病毒DNA,后在实验小鼠部份细胞中检测到该病毒的DNA,首次成功获得转基因小鼠,虽然该转基因小鼠传代的几率小。
随着科学技术的不断进步,在1976年,Jaenish又通过反转录病毒感染小鼠的胚胎,将目标基因组整合到实验鼠中得到了能传代的转基因小鼠;1980年,Gordon等[1]首先用受精卵原核注射法,将疱疹病毒基因SV40DNA段和PBR32DNA段分别注射到小鼠原核期的胚胎中,获得了相应的转基因小鼠。
1982年美国科学家Palmiter将大鼠生长激素基因导人小鼠受精卵后,获得了首批被称为“硕鼠”的转基因动物[4]。
1985年,Hanahan等将SV40T抗原基因与大鼠胰岛素启动子(RIP)体外整合后导入小鼠早期胚胎细中,构建了SV40T抗原基因转基因小鼠,在小鼠体检测到特异性T抗原,T抗原表达时间的早晚影响转基因小鼠对T抗原的免疫应答:胚胎早期表达T抗原的小鼠对SV40T抗原发生免疫耐受,胰腺组织正常;胚胎晚期表达T抗原的小鼠体产生抗自身胰岛B细胞的抗体,出现自身免疫性糖尿病[5]。
近年来,随着现代分子生物学和转基因动物技术的日臻完善,转基因小鼠及其他转基因动物逐渐成为现代医学及其他学科研究中的一个十分重要的工具。
纵观此间发展历程,转基因动物带来的不仅仅是一种全新的药物生产模式,极大地降低生物药品的成本和投资风险,为人类社会带来了新的经济增长点,如今的动物乳腺反应器生产的药物占所有基因工程药物的95%,带来了巨大经济效益,潜藏巨大的市场价值,相信随着应用的不断革新,其必将逐渐形成具有高额利润的新兴产业。
一、概述二、显微注射法转基因小鼠模型制备,一般由专业技术人员来进行技术操作。
首先要设计好转基因的载体。
构建转基因载体,有几个必要的因素。
首先,要找到所需要表达蛋白的基因,或者是 CDNA 序列。
其次选择特异性的启动子,该特异性的启动子,可以决定基因的表达效果或者表达的组织。
如果要求超水平表达,还可以加增强子,提高启动子的活性,增加表达水平。
另外,还需要在所设计的 CDNA 的序列后面,加上 PolyA 尾巴,来增加表达的稳定性。
然后将这些 DNA 片段,共同构建入子粒载体。
上图是常规的转基因子粒载体,从图上可以看到,该载体包括增强子、启动子、CDNA 及 PolyA 。
将其串联起来,共同形成转基因载体。
(一)、启动子类型在设计单纯转基因动物的过程中,启动子的类型非常重要,因为根据实验的目的,如果超水平表达,可以选择构成性的表达启动子。
这类启动子可以不受调控,在所转入的细胞进行高水平的表达。
如 CMV 启动子,SV40 启动子,这两个启动子是常用于超水平表达特定的基因。
第二类是组织特异性表达启动子,这类启动子由于组织特异性活性,只在特定的组织细胞有活性,来启动特定基因的转录。
比较典型的有只在内皮细胞有活性的 TIE2 启动子,还有只在星形细胞有活性的GFAP 启动子。
如果需要制备一个只在某一个组织器官特异性表达的基因,可以首先去选择只在这个组织器官有特异性活性的启动子。
第三类,是诱导性表达的启动子。
有时需要表达的靶基因只是在某个时项,如在成年或者在某一阶段开始表达。
可以选择一些启动子,该启动子只是在外源性化合物,给入诱导的情况下,才能够具有表达活性。
如四环素诱导的启动子,只有给小鼠注入四环素的情况下才能够使该启动子具有表达活性,从而来控制靶基因的表达。
(二)、转基因注射流程上图是转基因小鼠制备的主要流程。
当构建转基因载体后,需要把转基因载体通过分子生物学的手段进行扩增、存放,然后将环状的质粒载体,进行线性化。
转基因小鼠的制备显微注射法这一方法的实验程序如下:⑴准备假孕母鼠(养母):将可育雌鼠与输精管结扎后绝育的雄鼠交配,剌激雌鼠发生一系列妊娠变化而得到假孕母鼠作为受精卵转基因后的养母;⑵受精卵的准备:可育雌鼠注射孕马血清与绒毛膜促性腺激素(hcg)促使超排卵。
处理后与可育雄鼠交配。
次日从输卵管收集受精卵备用;⑶基因导入:用显微注射装置将目的基因溶液导入受精卵雄性原核;⑷胚胎移植:将已转入基因的受精卵自背部植入假孕母鼠的输卵管,使胚胎在养母体发育成熟;⑸对幼鼠的鉴定:①幼鼠发生断乳后自尾部提取DNA,与目的基因探针作分子杂交,鉴定外源基因是否整合,有整合的鼠称为首建鼠(founder);②建立鼠系,将带有外源基因的小鼠与未经转基因的小鼠交配、传代后,后代有50%机率带有整合的基因供实验用。
也可将合适的组织进行细胞培养建立细胞系;③自小鼠脏提取rna,与目的基因探针做分子杂交,比鉴定外源基因的表达和表达的组织特异性。
表达产物可以测定活性的,也可直接自血液或组织测定活性蛋白质,常用的方法如酶联免疫吸附试验(elisa)或放射免疫测定(ria)等。
亦可取胚胎进行分析。
显微注射法简化的实验过程如图23-2所示。
我国已有少数实验室(如中国医学科学院基础医学研究所)应用此法进行载脂蛋白tgm研究。
基因打靶与基因剔除技术ES细胞是从哺乳动物早期胚胎发育产生的胚团(inner cell mass)中分离出来的。
它本身是二倍体,能在体外培养,具有高度的全能性,可以形成包括生殖细胞在的所有组织,并且在不同的培养条件下表现出不同的功能状态。
这种细胞有两个特点,一是它本身可以分裂、增殖,形成细胞集落;另一特点是经过发育可以形成正常的动物后代。
因此,借用ES细胞系可将人们企望的某种不完整的、无功能基因直接引入到ES细胞中,通过细胞增殖、筛选可得到丧失了某种基因功能的动物后代。
正是由于ES细胞的研究成功与广泛应用,才使得基因打靶与基因剔除技术在转基因动物中的应用成为可能而且近来取得长足发展。
培养转基因小鼠的原理
转基因小鼠是通过基因工程技术将外源基因导入小鼠体内,使其获得新的遗传特性。
培养转基因小鼠的原理主要包括以下几个步骤:选择目标基因、构建转基因载体、基因转导与定位、筛选转基因小鼠、鉴定转基因小鼠。
首先,在培养转基因小鼠之前要选择目标基因。
目标基因可以是与某种疾病相关的基因、某个特定细胞或组织中的基因、或是其他科学研究中感兴趣的基因。
根据不同的目标基因,可以确定不同的转基因策略。
然后,需要构建转基因载体。
转基因载体是将目标基因插入小鼠的基因组中的工具。
通常使用的载体是质粒或病毒。
在构建转基因载体时,将目标基因与适当的启动子、选择标记基因(如荧光蛋白基因)等组合在一起,形成一个完整的转基因载体。
接下来,进行基因转导与定位。
将构建好的转基因载体导入目标细胞或小鼠胚胎干细胞中。
有多种方法可以实现基因导入,如电穿孔、基因枪、病毒载体介导等。
在导入转基因载体后,通过细胞培养或小鼠胚胎植入等手段,让细胞或胚胎继续生长发育。
然后,需要筛选转基因小鼠。
通常会在小鼠体内引入一个选择标记基因,例如使小鼠表达荧光蛋白。
这样,在鼠标中选定了荧光基因以后,通过观察鼠标的组织片能够很方便的看到转基因的细胞和组织。
同时,通过PCR等技术方法进行基
因型鉴定,以确保转基因小鼠具备目标基因的插入。
最后,对转基因小鼠进行进一步鉴定。
通过深入的分子生物学研究技术,如Northern blot、Western blot、RT-PCR等,可以确定转基因小鼠的目标基因是否表达、表达水平以及转基因是否稳定遗传到后代等方面的问题。
此外,还可以通过观察转基因小鼠的生理特征和行为特征,进一步验证转基因小鼠的特性是否符合预期。
在以上步骤中,科学家们需要仔细设计实验、合理选择策略,并利用丰富的分子生物学技术手段进行实验操作和数据分析,以确保培养出的转基因小鼠能够稳定并准确地表达目标基因。
转基因小鼠的培养不仅是基础科学研究的重要手段,还能够在医学研究、药物研发等领域中发挥重要作用。