评说硫、氮的功与过方程式(50个)
- 格式:doc
- 大小:88.00 KB
- 文档页数:3

化学高一必修二硫和氮的有关方程式下载温馨提示:该文档是我店铺精心编制而成,希望大家下载以后,能够帮助大家解决实际的问题。
此文下载后可定制随意修改,请根据实际需要进行相应的调整和使用。
并且,本店铺为大家提供各种各样类型的实用资料,如教育随笔、日记赏析、句子摘抄、古诗大全、经典美文、话题作文、工作总结、词语解析、文案摘录、其他资料等等,如想了解不同资料格式和写法,敬请关注!Downloaded tips: This document is carefully compiled by the editor. I hope that after you download them, they can help you solve practical problems. The documents can be customized and modified after downloading, please adjust and use it according to actual needs, thank you!In addition, our shop provides you with various types of practical materials, such as educational essays, diary appreciation, sentence excerpts, ancient poems, classic articles, topic composition, work summary, word parsing, copy excerpts, other materials and so on, want to know different data formats and writing methods, please pay attention!硫和氮是化学中极为重要的元素,它们在自然界和工业生产中都有着广泛的应用。



第五章评说硫、氮的功与过化学方程式总结1.S +K 2S +3CO 2↑+N 2↑(黑火药爆炸) 2.Fe +S 3.2Cu +4.Hg +5.H 2+6.S +O 7.2H 2S +2H 2O (发出淡蓝色火焰) 8.2H 2S 2S +2H 2O (硫化氢不完全燃烧) 9.2H 2S +SO 23S +2H 2O 10.SO 2+H 2O H 2SO 3(二元中强酸) 11.2H 2SO 32H 2SO 4 12.2SO 2+2SO 3(二氧化硫的催化氧化) 13.SO 3+H 2O 14.NaCl +H 24+HCl ↑ 15.NaNO 3+NaHSO 4+HNO 3↑ 16. Cu +2H 24+SO 2↑+2H 2O17. C +2H 2SO 4(浓)CO 2↑+2SO 2↑+2H 2O 18. BaCl 2+H 2SO 4BaSO 4↓+2HCl19. BaCl 2+Na 2SO 4BaSO 4↓+2NaCl20. BaCl 2+Na 2CO 3BaCO 3↓+2NaCl21. BaCO 3+2HCl BaCl 2+H 2O +CO 2↑22. Ba 2++SO 42-BaSO 4↓在实验室里检验溶液中是否含有SO 42-时,常常先用盐酸把溶液酸化,以排除CO 32-、SO 32-、Ag +等干扰,再加入BaCl 2溶液,如果有白色沉淀出现,则说明原溶液中肯定存在SO 42-。
23. N 2+O 2NO24. 2NO +O 22NO 2(红棕色)25. 3NO 2+2HNO 3+NO26. N 2+3H 23(工业合成氨)27. NH 3+H 2O 3·H 2O (溶解平衡)28. 4NH 3+5O 4NO +6H 2O (氨气的催化氧化)29. NH 3+HCl NH 4Cl (产生白烟)30. 2NH 3(足量)+H 2SO 4(NH 4)2SO 4(不能用浓硫酸干燥氨气)31. NH 3+HNO 3NH 4NO 332. NH 3+H +33. NH 4Cl ++NH 3↑+H 2O 34. NH 4NO 33+NH 3↑+H 2O35. (NH 4)2SO Na 2SO 4+2NH 3↑+2H 2O36. NH 4++H 2O在溶液中加入NaOH 溶液,并加热,产生的气体能使湿润的红色石蕊试纸变蓝,则原溶液存在NH 4+。

11、硫及其化合物的转化关系①S +O 2 点燃SO 2②2H 2S +SO 2=3S +2H 2O※③SO 2+O 2 催化剂加热 2SO 3 ④SO 3+H 2O = H 2SO 4 ⑤SO 2+CaO△CaSO 3 或 SO 2+Ca(OH)2 = CaSO 3↓+H 2O⑥SO 3+CaO = CaSO 4 SO 2+Ca 2++2OH -=CaSO 3↓+H 2O SO 3+Ca(OH)2 = CaSO 4+H 2O ⑦2CaSO 3+O 2△2CaSO 4※⑧SO 2+Cl 2+2H 2O = H 2SO 4+2HCl ※⑨Cu +2H 2SO 4(浓) △CuSO 4+SO 2↑+2H 2OSO 2+Cl 2+2H 2O = 4H ++SO 42-+2Cl -Cu +2H 2SO 4(浓) △Cu 2++SO 42-+SO 2↑+2H 2O※⑩C +2H 2SO 4(浓)△CO 2↑+2SO 2↑+2H 2O2、氮及其化合物的转化关系 ※①N 2+O 22NO※②2NO +O 2 = 2NO 2※③3NO 2+H 2O = 2HNO 3+NO 3NO 2+H 2O =2H ++2NO 3-+NO以上三个反应为“雷雨发庄稼”原理 扩展反应有:4NO 2+O 2+2H 2O = 4HNO 3 4NO +3O 2+2H 2O = 4HNO 3 ※④Cu +4HNO 3(浓) = Cu(NO 3)2+2NO 2↑+2H 2O 上面两个反应主要用于气体溶于水时的计算Cu +4H ++2NO 3-=Cu 2++2NO 2↑+2H 2O 或 4HNO 3 4NO 2↑+ O 2↑+ 2H 2OC +4HNO 3(浓)△CO 2↑+2NO 2↑+2H 2O 浓硝酸见光易变黄的原因※⑤3Cu +8HNO 3(稀) = 3Cu(NO 3)2+2NO ↑+4H 2O ⑥N 2+3H 2催化剂 高温高压2NH 33Cu +8H ++2NO 3-=3Cu 2++2NO ↑+4H 2O 合成氨反应是人工固氮的主要途径 ⑦NH 3+HCl = NH 4Cl ⑧NH 4Cl△NH 3↑+HCl ↑NH 3+H += NH 4+(水溶液中) 补充:NH 4HCO 3 △NH 3↑+H 2O+CO 2↑氨气与酸均能反应生成铵盐,且与挥发性酸 铵盐受热都易分解,但并不是所有的铵盐 (如浓HCl 、浓HNO 3)相遇时空气中有白烟 都分解出氨气,如NH 4NO 3、(NH 4)2SO 4※⑧NH 4Cl +NaOH△NaCl +NH 3↑+H 2O NH 4++OH-△NH 3↑+H 2O所有的铵盐都能与碱作用放出氨气,可利用此反应鉴别铵离子。

评说硫氮的功与过一、硫硫在自然界中有两种存在状态、硫单质常存在于。
⑴物理性质硫单质俗称。
在通常状况下,它是一种色或色的固体;很脆、易研成粉末;溶解性:于水,于酒精,于二硫化碳;硫的熔点、沸点都不高。
联想:(1)如何除去试管上残留的硫?⑵化学性质①与金属反应铁与硫:。
反应现象:联想:a、铁与氯气的反应b、铁与氧气的反应总结:氯气、硫的氧化性强弱铜与硫:。
②与非金属反应H2 +S △H2S,该反应表现了硫的性。
S+O2△SO2,该反应表现了硫的性。
实验现象:在空气中燃烧时;在纯氧中燃烧时。
练习1、不能由单质直接化合而制得的是()A、SO2B、CuSC、H2SD、HCl总结:从化合价角度分析硫的化学性质,硫单质中硫元素化合价为,处于中间价态,既有又有。
③与某些化合物的反应S +2KNO3 +3C→ K2S +3CO2↑+N2↑(黑火药爆炸的反应)了解黑火药成分,一硫二硝三木炭与热的浓氢氧化钠反应:(3)硫的用途硫黄主要用于制造硫酸、化肥、火柴及杀虫剂等,还用于制造火药、烟火爆竹等。
练习2、下列说法正确的是()A.硫是一种淡黄色的能溶于水的固体 B.硫在自然界中仅以化合态存在C.铁与硫反应生成硫化亚铁D.硫在空气中燃烧产物是二氧化硫,在纯氧中的燃烧产物是三氧化硫E.单斜硫和斜方硫都是硫单质练习3、某同学做完硫的实验后,发现试管内壁上的硫很难除去,请利用所学知识,帮他除去。
另一位同学利用如下原理清洗:3S+6NaOH (热) =2Na2S+Na2SO3+3H2O在这一反应中,体现了硫的()A.氧化性 B.还原性 C.既有氧化性又有还原性 D.既无氧化性又无还原性4.将含4g硫粉和7.56g铁粉的混合物隔绝空气加热,产物冷却后为几克?在产物中加足量的稀硫酸,可得气体(标准状况)几升?第二课时令人生厌的硫化氢一、硫化氢的性质1、硫化氢的物理性质物性:色毒有气味的体,密度比空气大,溶于水2、分子结构特点:电子式:结构式:空间构型:3、硫化氢的化学性质(1)弱酸性硫化氢的水溶液称为_________,写出在水中的电离方程式_________________________硫化氢通入氢氧化钠的反应 _______所以可以用_______________吸收硫化氢(2)还原性①点燃硫化氢气体,使其充分燃烧,方程式:。

二氧化硫的性质及其应用教学设计一、教学目标:1.从多角度分析二氧化硫的化学性质;2.掌握二氧化硫的还原性及氧化还原方程式的书写;3.掌握二氧化硫的漂白性、漂白原理和应用。
二、教法思路二氧化硫在高中化学教材中占有特殊重要的位置,主要表现在以下几点:1.二氧化硫与当今世界的发展问题、环境问题有着密切联系。
在教学中,可以以此为契机,开展研究,目的是将课堂上或书本中的知识运用于实际,培养信息处理的能力,合作学习的能力,分析问题的综合能力,表达能力和社会责任感。
2.在教学思路上,应该从“从个别到一般”的归纳法,过渡到“从一般到个别”的演绎法。
也就是说二氧化硫的学习应该成为理论指导下的学习。
3.通过二氧化硫的教学,应该使学生建立“硫元素系统”的整体印象。
4.在教学中应该注意规律的应用,例如氧化还原反应规律、复分解反应规律、物质的分类与通性等等。
对二氧化硫而言:从物质分类的角度来分析,二氧化硫试酸性氧化物,具有酸性氧化物的性质:SO2+2NaOH=Na2SO3+H2O;CaO+SO2=CaSO3;H2O+SO2=H2SO3。
从氧化还原的角度来分析,二氧化硫中的硫元素处于“中间价态”,与强氧化剂反应是可以被氧化为+6价,在水溶液中通常以SO42-的形式存在,干态时可以以SO3的形式存在;与强还原剂反应时,可以被还原为0价,通常以单质的形式存在。
从物质的特殊性角度来分析,二氧化硫具有以下性质:漂白性。
二氧化硫的漂白机理与次氯酸有所不同。
次氯酸的漂白作用是利用其强烈的氧化性,将有色物质的分子破坏掉,变为无色的物质。
这个反应通常进行的比较完全,且为不可逆过程;二氧化硫的漂白作用是二氧化硫、水和有色物质发生化合反应生成无色物质,一般来说这种无色物质不稳定,受热或者长时间放置会将二氧化硫重新放出,使被漂白的物质恢复原来的颜色,二氧化硫的漂白作用是一个可逆的过程。
由于次氯酸具有较强的氧化性,容易毁坏被漂白的物质,因此在实际生活中,二氧化硫的漂白作用比次氯酸应用的场合多。

有关硫和氮的化学方程式知识点总结硫和氮是两种常见的非金属元素,它们在化学反应中具有多种重要的应用。
以下是关于硫和氮化学方程式的知识点总结。
(一)硫的化学方程式:1.硫燃烧反应:硫在氧气中燃烧时生成二氧化硫,化学方程式为:S+O2→SO22.硫与金属反应:硫可与金属发生反应,生成对应的金属硫化物。
例如,硫与铁反应生成硫化铁,化学方程式为:S+Fe→FeS3.硫与酸反应:硫可与酸反应生成相应的硫酸盐。
例如,硫与盐酸反应生成硫化氢气和氯化钠,化学方程式为:S+2HCl→H2S+2NaCl4.硫与水反应:硫与水反应生成亚硫酸和二氧化硫。
例如,硫与水反应生成亚硫酸和二氧化硫,化学方程式为:S+2H2O→H2SO3+SO2(二)氮的化学方程式:1.氮的燃烧反应:氮只有在高温高压条件下才能与氧气直接反应生成氮氧化物。
例如,氮燃烧反应生成氧化氮和二氧化氮,化学方程式为:N2+O2→2NO2.氮与氢气反应:氮与氢气反应生成氨气。
例如,氮与氢气反应生成氨气,化学方程式为:N2+3H2→2NH33.氮与金属反应:氮与金属反应生成相应的金属氮化物。
例如,氮与锂反应生成氮化锂,化学方程式为:3Li+N2→2Li3N4.氮与氯气反应:氮与氯气反应生成氮氯化物。
例如,氮与氯气反应生成四氯化二氮,化学方程式为:N2+Cl2→N2Cl4总结:硫和氮是非金属元素,它们在化学反应中具有多种重要的应用。
硫能够与氧气、金属、酸和水等发生反应,生成相应的化合物。
氮能够与氧气、氢气、金属和氯气等发生反应,生成相应的化合物。
这些反应有助于我们理解硫和氮的化学性质,并在实际应用中发挥重要作用,如制备化学品、肥料等。

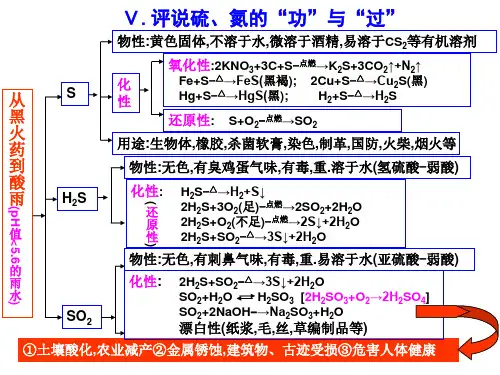
第五章评说硫、氮的“功”与“过”知识点梳理一、硫1、物理性质:硫是一种黄色或淡黄色的固体(俗称硫磺),不溶于水,微溶于酒精,易溶于CS2(可用于清洗除硫)。
2、化学性质:单质硫既有氧化性,又有还原性。
(1)氧化性:Fe + S Fe S 黑褐色2Cu + S Cu2S 黑色Hg + S→HgS (常温下反应, 实验室中用于处理散落的汞滴)2Ag + S→Ag2S (黑色, 银器变黑)S + H 2H2S(2)还原性:S + O 2SO2(3)硫与碱反应:3S + 6NaOH →2Na 2S + Na 2SO3 + 3H 2O(可用于清洗除硫)3、用途:是重要的化工原料,制硫酸、农药、火药、药品、硫化橡胶等。
二、硫化氢1、物理性质:无色、有臭鸡蛋气味的气体,有剧毒,密度比空气略大,能溶于水,其水溶液叫氢硫酸(氢硫酸露置于空气中易被氧化2H2S +O2→2S +2H2 O)。
2、化学性质(1)还原性:2H2S + SO2→3S +2H2 OH2S + X2→S+2HX (X = Cl, Br, I )H2S + H2SO4(浓) →S+SO2+2H2O(2)不稳定性:H2S H2 + S(3)可燃性:2H2S + O 22S +2H2O(空气不足, 不完全燃烧)2H2S + 3O 22SO2+ 2H2 O(空气充足, 完全燃烧)3、实验室制法:FeS+H2SO4→FeSO4+H2S↑其发生装置与H2、CO2、SO2相同。
4、其它(1)Cl2不溶于饱和食盐水中;CO2不溶于饱和NaHCO3溶液,但溶于Na2CO3溶液Na2CO3+CO2+H2O→2NaHCO3;SO2不溶于饱和NaHSO3溶液,但溶于Na2SO3溶液Na2SO3+SO2+H2O→2NaHSO3;H2S不溶于饱和NaHS溶液,但溶于Na2S溶液Na2S+ H2S→2NaHS。
(2)H2S+CuSO4→CuS↓+H2SO4(CuS不溶于酸,因此可用CuSO4除去少量的H2S)三、SO21、物理性质:无色、有刺激性气味的气体,有毒,密度比空气大,易液化,可溶于水(1 体积水可溶解40 体积二氧化硫)2、化学性质(1)具有酸性氧化物的通性SO2 + H2 O H 2SO3SO2 + 2NaOH→Na2SO3+H2OSO2+CaO →CaSO3(2)具有弱氧化性SO2 + 2H2S →3S +2H2O高温(3)有还原性:SO 2+ X 2→H 2SO 4+2HX (X = Cl, Br, I ) 因此,SO 2可使溴水(橙色或黄色)、氯水(淡黄绿色)、碘水(浅棕色)、酸性高锰酸钾溶液(紫红色)褪色,这是利用了SO 2的还原性,而不是漂白性。

高中化学无机方程式归纳汇总(非金属部分之硫和氮)三、硫及其重要化合物1、硫及其重要化合物之间的转化关系2、方程式再书写(写出下列反应的化学方程式,是离子反应的写出离子方程式)S+H2H2SSO2+H2O H2SO3H2SO3H++HSO3-;HSO3-H++SO32-H2O2H++HO-2,HO-2H++O2-2四、氮及其重要化合物1、氮及其重要化合物之间的转化关系2、方程式再书写(写出下列反应的化学方程式,是离子反应的写出离子方程式)2NO2N2O4△NH3+H2O NH3·H2O NH4++OH―4HNO32H2O+4NO2↑+O2↑43 碳与稀硝酸共热 3C +4HNO 3(稀)3CO 2↑+4NO↑+2H 2O44 硫与浓硝酸反应 S + 6HNO 3(浓)H 2SO 4+6 NO 2↑+4H 2O 45 红磷与浓硝酸反应 P + 5HNO 3(浓)H 3PO 4+5 NO 2↑+H 2O46 白磷与浓硝酸反应 P 4 + 20HNO 3(浓)4H 3PO 4+20 NO 2↑+4H 2O47 亚铁离子与硝酸反应 3Fe 2++NO 3-+4H +===3Fe 3++NO↑+2H 2O 48 亚硫酸钠与稀硝酸反应 3SO 32-+2NO 3-+2H +===3SO 42-+2NO↑+H 2O 49 硫化氢与稀硝酸反应 3H 2S +2HNO 3(稀)===3S ↓+2NO↑+4H 2O 50 溴化钠与稀硝酸反应 6Br -+2NO 3-+8H +===3Br 2+2NO↑+4H 2O 51 碘化钾与稀硝酸反应 6I -+2NO 3-+8H +===3I 2+2NO↑+4H 2O52 铜片与稀硝酸、稀硫酸反应 3Cu +2HNO 3+3H 2SO 4===3CuSO 4+2NO↑+4H 2O53苯与浓硝酸、浓硫酸反应CC SO H NO HO ︒︒−−−→−-+60~55242浓NO 2O H 2+54 甲苯与浓硝酸、浓硫酸反应△△△△。
高中硫氮化学方程式总结硫、氮是化学中十分重要的元素之一,它们在自然界中存在广泛,并且参与许多化学反应。
下面是一些高中化学中常见的硫、氮化学方程式的总结,帮助理解它们的反应性质和应用。
硫化学方程式:1.硫与氧反应硫在氧气中燃烧时产生二氧化硫(SO2):S+O2->SO22.硫酸的制备硫与浓硝酸反应产生硫酸:S+6HNO3->H2SO4+6NO2+2H2O3.硫酸钠的制备硫与硝酸钠反应产生硫酸钠:S+2NaNO3->Na2SO4+2NO2+O24.硫酸铜的制备硫与硫酸铜反应产生硫酸铜:4S+6H2SO4->4H2S+6SO2+3O25.硫酸铜溶液的还原硫酸铜溶液中加入锌粉,发生置换反应生成硫酸和铜:Zn+CuSO4->ZnSO4+Cu氮化学方程式:1.氨气制备氨气是一种广泛应用的化学物质,通过硝酸与铜的反应制备:2NH4NO3->2N2O+O2+4H2ON2O+2NH3->3N2+3H2O2.氨气和酸的反应氨气和盐酸发生酸碱反应生成氯化铵:NH3+HCl->NH4Cl3.硝酸和亚硫酸反应硝酸和亚硫酸反应产生亚硝酸:HNO3+H2SO3->HNO2+H2O4.硝酸和铜粉反应硝酸和铜粉反应生成亚硝酸铜:3Cu+8HNO3->3Cu(NO3)2+2NO+4H2O5.火药的爆炸反应硝酸和炭和硫的混合物在高温条件下发生剧烈爆炸反应:2KNO3+S+3C->K2S+N2+3CO2以上是一些高中硫、氮化学方程式的总结。
硫和氮在生活和工业上都有广泛应用,了解这些化学反应方程式,可以帮助我们理解它们的反应性质、制备方法以及一些实际应用。
同时了解化学方程式也有助于我们在化学实验和问题解决中的应用。
氮硫化学方程式汇总氮和硫是两个常见的化学元素,它们分别对应于周期表中的第7和第16族。
氮和硫的化学方程式可以描述它们在不同反应中的转化。
以下是氮和硫的一些常见化学方程式的汇总。
氮化学方程式:1.合成氮气:N2(g)+3H2(g)→2NH3(g)这是亨利·卡文迪许(Henry Cavendish)在1772年发现的氨气的合成反应,通常通过哈伯-博斯曼(Haber-Bosch)过程进行工业生产。
2.氧化氮:2NO(g)+O2(g)→2NO2(g)这是一种氮氧化物的生成反应,通常在发动机的高温环境中发生。
氮氧化物是导致酸雨和空气污染的主要原因之一3.还原氮:2NH3(g)→N2(g)+3H2(g)这是氨气在高温和高压下分解为氮气和氢气的反应。
这个反应也可以通过催化剂的存在来加快。
4.氧化硝酸铵:2NH4NO3(s)→2N2(g)+O2(g)+4H2O(g)这是硝酸铵分解的反应,通常用于制造火药和炸药。
5. 氨和硫酸反应:2NH3(aq) + H2SO4(aq) → (NH4)2SO4(aq)这是一种生成硫酸铵的反应,硫酸铵在农业中用于作为肥料。
硫化学方程式:1.硫燃烧:S(s)+O2(g)→SO2(g)这是硫在氧气中燃烧的反应,产生二氧化硫。
硫燃烧还可以产生三氧化硫和四氧化硫等硫氧化物。
2. 硫化氢生成:FeS(s) + 2HCl(aq) → FeCl2(aq) + H2S(g)这是硫化铁与盐酸反应产生硫化氢的反应。
硫化氢具有难闻的气味,通常被认为是恶臭气体。
3. 硫酸生成:SO2(g) + O2(g) + H2O(l) → H2SO4(aq)这是二氧化硫氧化为硫酸的反应,也是雨水的主要成分之一4.硫与金属反应:Cu(s)+S(s)→CuS(s)这是金属铜与硫反应生成硫化铜的反应。
硫化铜是一种黑色的化合物,广泛用于材料和化工工业。
总结:氮和硫化学方程式的汇总包括氮气的合成、氧化和还原,氨的反应,硝酸铵的分解,硫的燃烧和硫化氢的生成以及硫酸的生成等。
有关S 的化学方程式一、 硫(一)物理性质硫是(淡)黄色固体,不溶于水,微溶于酒精,易溶于二硫化碳(CS 2);熔、沸点较低,俗称硫磺。
(由于硫易溶于二硫化碳,所以粘在试管上的硫可用二硫化碳除去) (二)化学性质1. 硫与金属的反应(硫的氧化性)(1) 硫与铁反应: Fe + S F +e 2S (硫化亚铁,黑褐色) (2) 硫与铜反应: 2Cu+ SC +u 12S (硫化亚铜,黑色)(3) 硫与汞反应: Hg + S → HgS (硫化汞,黑色) 2. 硫与非金属的反应(1) 硫与氢气反应:H 2 + S 点燃→ H 2S (硫的氧化性) (2) 硫与氧气反应:S + O 2 点燃→ SO 2 (硫的还原性)现象:硫在空气中燃烧发出淡蓝色火焰,在氧气中燃烧发出蓝紫色火焰,有刺激性气味气体生成二、 硫化氢(一)物理性质无色有臭鸡蛋气味的气体,有毒,密度比空气大,能溶于水,水溶液叫氢硫酸,显弱酸性。
(二)化学性质1. 热稳定性:硫化氢在较高温度下分解H 2S △→ H 2 + S ↓2. 强还原性:H 2S 中S 显-2价,是硫元素的最低价,因此发生氧化还原反应时,S 的化合价只能升高,表现较强的还原性。
2H 2S+SO 2→3S↓+2H 2O现象:两种气体混合后,瓶壁有(淡)黄色固体和小水珠生成 3. 可燃性(还原性)(1) H 2S 在充足的氧气中完全燃烧:2H 2S + 3O 2 点燃→ 2H 2O + 2SO 2现象:发出淡蓝色火焰,有小水珠生成并产生有刺激性气味气体。
(2) H 2S 在氧气中不完全燃烧:2H 2S + O 2 点燃→ 2H 2O + 2S现象:发出淡蓝色火焰,有小水珠生成,且生成(淡)黄色固体。
注意:氢硫酸溶液易被空气中的氧气氧化,溶液变浑浊,氢硫酸使用时应现制现用,不能长期存放4. 弱酸性如与碱反应:H 2S + NaOH (少量)→ NaHS + H 2OH 2S + 2NaOH (足量) → Na 2S + 2H 2O三、二氧化硫(一)物理性质无色有刺激性气味的有毒气体,密度比空气大,易液化,易溶于水(在通常情况下,1体积水大约能溶解40体积的SO2)。
第五章 评说硫、氮的功与过化学方程式总结
1.
S +K 2S +3CO 2↑+N 2↑(黑火药爆炸) 2.
3.
2Cu 4.
Hg +S HgS 5. H 2+S 2S
6. S +O 2
(在氧气中发出蓝紫色火焰)
7. 2H 2S +3O +2H 2O (发出淡蓝色火焰)
8. 2H 2S +O 2(不足)
2S +2H 2O (H 2S 不完全燃烧) 9. 2H 2S +SO 23S +2H 2O
10. H 2S + CuSO 4 = CuS ↓(黑)+ H 2SO 4 (检验H 2S )
11. H 2S + Pb(NO 3)2 = PbS ↓(黑)+ 2HNO 3 (检验H 2S )
12. SO 2+H 2O
H 2SO 3 (二元中强酸) 13. 2H 2SO 3+O 2
2H 2SO 4 14. 2SO 2 + O 2 催化剂
加热
2SO 3 (SO 2的催化氧化) 15. SO 3+H 2O H 2SO 4
16. SO 2 + Br 2 + 2H 24 + 2HBr (使溴水或高锰酸钾溶液褪色)
17. NaCl +H 2SO 4(浓)
4+HCl↑
18. NaNO 3 + H 2SO 4+HNO 3↑ 19. Cu +2H 2SO 4(浓)CuSO 4+SO 2↑+2H 2O
剧烈反应,铜片表面产生气泡,溶液变成绿色,品红溶液褪色
20. C + 2H 2SO 4(浓)CO 2↑+2SO 2↑+2H 2O
21. BaCl 2 + H 2SO 4BaSO 4↓+2HCl
22. BaCl 2 + Na 2SO 4BaSO 4↓+2NaCl
23. BaCl 2 + Na 2CO 3BaCO 3↓+2NaCl
24. BaCO 3 +2HCl BaCl 2+H 2O +CO 2↑
25. Ba 2+ + SO 42-
BaSO 4↓
在实验室里检验溶液中是否含有SO 42-时,常常先用盐酸把溶液酸化,以排除CO 32-、
SO 32-、Ag +BaCl 2溶液,如果有白色沉淀出现,则说明原溶液中肯定存在SO 42-。
26. N 2+O 2
2NO
27. 2NO +O 2
2NO 2 (红棕色) 28. 3NO 2+H 2O
2HNO 3 + NO 29. N 2+3H 2 2NH 3 (工业合成NH 3)
30. NH 3+H 2O NH 3·H 2O (溶解平衡)
31. 4NH 3+5O 2 4NO +6H 2O (NH 3的催化氧化)
32. NH 3+HCl NH 4Cl (产生白烟)
33. 2NH 3(足量) + H 2SO 4(NH 4)2SO 4 (不能用浓H 2SO 4干燥NH 3)
34. NH 3+HNO 3NH 4NO 3
35. NH 3+H ++ ( NH 3和强酸反应的本质)
36.
NH 4Cl +NaOH +NH 3↑+H 2
O
37. NH 4NO 3
+
NaOH 3+NH 3↑+H 2O
38. (NH 4)2SO 4 Na 2SO 4+2NH 3↑+2H 2O
39. NH 4++OH NH 3↑+H 2O
在溶液中加入NaOH 溶液,并加热,产生的气体能使湿润的红色石蕊试纸变蓝,则原溶液存在NH 4+。
40. NH 4Cl
3↑+HCl↑
41. NH 4HCO 3
NH 3↑+H 2O +CO 2↑
42.
43. Cu + 4HNO 3(浓) = Cu(NO 3)2 + 2NO 2↑+ 2H 2O (氧化性,酸性)
44. 3Cu + 8HNO 3(稀) =3Cu(NO 3) + 2NO↑+ 4H 2O (氧化性,酸性)
Fe 、Al 钝化(表面生成一层致密的氧化膜)
45. C + 4HNO3 (浓) = 2H2O + 4NO2↑+ CO2↑
46. HNO 3工业: NH 3的催化氧化法
① 4NH 3 + 5O 2 4NO + 6H 2O
② 2NO + O 2 = 2NO 2
③ 3NO 2 + H 2O = 2HNO 3 + NO
47. 尾气(N0、NO 2)处理:碱液吸收法
NO + NO 2 + 2NaOH = 2NaNO 2 + H 2O
2NO 2 + 2NaOH = NaNO 3 + NaNO 2 + H 2O
48. 硝酸盐分解
K→Na ∶ 2NaNO 3
2NaNO 2+O 2↑ Mg→Cu ∶ 2Cu(NO 3)2
2CuO +4NO 2↑+O 2↑
Hg→Ag∶2AgNO32Ag+2NO2↑+O2↑
49.4NO + 3O2 +2H2O = 4HNO3
50.4NO2 + O2+ 2H2O = 4HNO3。