流式检测细胞周期和凋亡实验步骤
- 格式:docx
- 大小:16.23 KB
- 文档页数:1
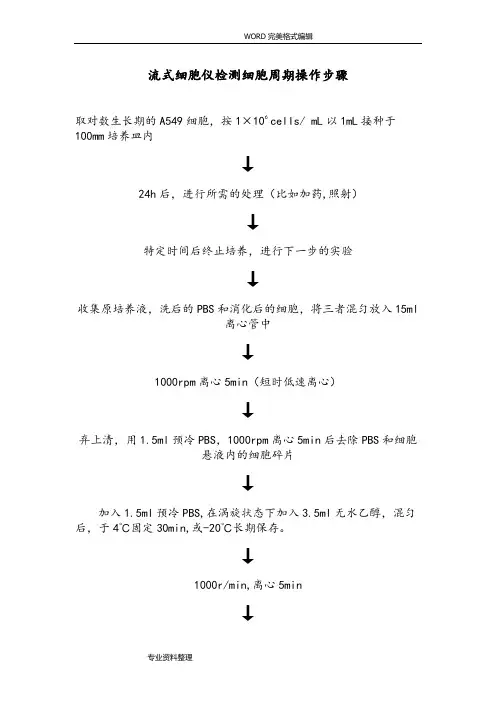
流式细胞仪检测细胞周期操作步骤取对数生长期的A549细胞,按1×106 cells/ mL以1mL接种于100mm培养皿内↓24h后,进行所需的处理(比如加药,照射)↓特定时间后终止培养,进行下一步的实验↓收集原培养液,洗后的PBS和消化后的细胞,将三者混匀放入15ml离心管中↓1000rpm离心5min(短时低速离心)↓弃上清,用1.5ml预冷PBS,1000rpm离心5min后去除PBS和细胞悬液内的细胞碎片↓加入1.5ml预冷PBS,在涡旋状态下加入3.5ml无水乙醇,混匀后,于4℃固定30min,或-20℃长期保存。
↓1000r/min,离心5min↓将乙醇吸除,加PBS清洗混匀↓1000r/min,5min再离心一遍,将残留在细胞上的乙醇除去↓吸除离心管内PBS,加入200ul PBS和2ul的RNA酶(0.25mg/ml)(37℃下孵育30min)↓加入0.5ml的50ug/ml的PI溶液室温下避光染色30min↓将离心管内的细胞过滤(300um尼龙网膜)至含有PBS的EP管中(PI 具有很强的粘附性,容易使细胞聚团),标记EP管↓提前一天网上预约↓开机(先开仪器后开软件)↓流式细胞仪的结构一般分为5部分:①流动室及液流驱动系统;②激光光源及光束成形系统;③光学系统;④信号检测、存贮、显示、分析系统;⑤细胞分选系统。
↓检测前先涡旋使细胞混匀悬浮呈单个细胞,然后插入流式细胞仪上↓流动室内充满鞘液,细胞排成单列由喷嘴中心喷出,形成细胞液柱↓液柱与激光束相交,细胞上的荧光染料被激发产生荧光(488nm激发光源)↓荧光信号变成电信号输出到计算机,软件分析(荧光染料和细胞DNA分子特异性结合,可以检测出细胞周期各时相细胞比例)↓在用第三方软件分析之前,将流式结果按如下所示导出结果分析——Modfit软件分析——Flowjo 软件分析图片拷贝:直接Ctrl+CFCM-DNA 量分析 1 个细胞增殖群时,可将DNA 含量分布组方图分为三部分,即 G0/1、S 、G2M 。

凋亡流式检测步骤凋亡是细胞生命的一个重要过程,它在生物体的正常发育和维持内稳态中起着关键作用。
凋亡的流式检测是一种常用的实验方法,通过分析细胞的染色性质和形态特征,可以快速准确地检测细胞的凋亡状态。
下面将介绍凋亡流式检测的具体步骤。
一、细胞样本的准备1. 收集需要检测的细胞样本,可以是细胞培养物或组织样本。
2. 用无菌PBS缓冲液洗涤细胞样本,去除培养基或组织液中的杂质。
3. 用离心机将细胞沉淀下来,去除上清液。
二、细胞的染色1. 用无菌PBS缓冲液重新悬浮细胞,使细胞浓度达到合适的浓度。
2. 加入适量的凋亡检测染料,常用的染料有Annexin V和PI。
3. 在室温下孵育一定时间,使染色剂与细胞充分反应。
三、流式细胞仪的设置1. 打开流式细胞仪,进行仪器的预热和校准。
2. 根据染色的荧光信号选择相应的检测通道,并设置适当的增益和门控。
3. 将已染色的细胞样本加入流式细胞仪的样本管中。
四、数据采集与分析1. 开始流式细胞仪的运行,以恒定的速度将细胞样本通过激光束。
2. 细胞在激光束中逐个通过,激光照射下的细胞会发出特定的荧光信号。
3. 流式细胞仪会记录下每个细胞的荧光信号,并将其转化为数字信号。
4. 利用流式细胞仪软件对采集到的数据进行分析和统计。
5. 根据细胞的荧光强度和染色的特征,可以判断细胞的凋亡状态。
通过以上步骤,我们可以快速准确地检测细胞的凋亡状态。
凋亡流式检测的优点是可以同时检测大量的细胞,具有高通量和高灵敏度的特点。
它在细胞生物学、免疫学和药物研发等领域都有广泛的应用。
值得注意的是,凋亡流式检测中的染色剂选择和流式细胞仪的设置对结果的准确性和可靠性有重要影响。
因此,在进行凋亡流式检测之前,需要仔细选择适合的染色剂和校准流式细胞仪。
同时,对于不同类型的细胞和凋亡机制,可能需要针对性地进行优化和调整。
凋亡流式检测是一种重要的实验方法,可以快速准确地检测细胞的凋亡状态。
通过合理的样本准备、细胞染色、仪器设置和数据分析,可以获得可靠的实验结果。

流式检测细胞凋亡
实验目的
用不同方法处理培养目的细胞,收集细胞,流式检测细胞凋亡
实验材料
1.目的细胞
2.凋亡检测试剂盒
3.流式仪器
实验步骤
1. 细胞培养:
5% CO2,37℃二氧化碳培养箱中培养。
2. 细胞铺板
•将目的细胞接种在6孔板中,37℃5%CO2培养箱培养24小时•不同的方法处理细胞
3. 细胞染色及流式检测
•用ep管分别收集各孔中的培养上清,1000rpm离心5分钟,收集培养上清中的细胞。
•同时,用胰酶消化底面贴壁的细胞,1000rpm离心5分钟,收集细胞,与步骤1)的细胞混合
•PBS洗涤细胞2次,1000rpm离心5分钟,收集细胞
•每个样品用300ul 1*binding buffer重悬细胞,轻轻吹匀
•加入APC/PI,轻轻混匀
•20℃左右孵育30分钟,注意避光
•上机流式检测
实验结果
1. 流式数据分析
对照组实验组
流式数据分析图
2.数据统计图
实验结论
由以上结果可知,处理组的目的细胞的凋亡率明显高于对照组。

流式检测细胞周期和凋亡实验步骤流式细胞技术检测细胞周期分布1) 已转染miRNA mimics的细胞培养达到85%融合时,用胰酶消化细胞。
1000 rpm,离心5min,收集细胞沉淀;2) 已消毒的PBS重悬细胞,1000 rpm/min,离心5 min,收集细胞。
重复此步骤2次,以除去胰酶;3) 加入预冷的70%乙醇固定细胞过夜;4) 第二天1000rpm,离心5 min,收集细胞沉淀,PBS重悬两次,以除去乙醇;5) 离心后加入500ul PBS重悬细胞,加入碘化丙锭(PI)染色液(含50mg/L PI,1g/L Triton X-100,100g/L RNase)混匀,4℃避光孵育30min。
6)流式细胞仪FACStar (美国BD公司) 检测。
接收的信号经Cellquest软件处理,对检测细胞的荧光强度进行分析。
实验重复3次。
2.11流式细胞技术检测细胞凋亡水平1) 已转染BART6-3p mimics的细胞培养达到85%融合时,将上清培养液收集至离心管内;常常2)PBS清洗贴壁细胞3次,用胰酶消化细胞(注意:消化时不可过度),收集于第一步的离心管内;3) 1000 rpm离心5min,弃上清收集细胞,PBS轻轻重悬后,加入195 ulAnnexin V-FITC结合液,吹打混匀,重悬细胞,加入5ul Annexin V,轻轻混匀。
避光室温孵育15min;4) 加入10 ul PI染色液,轻轻混匀,避光孵育;空白:Annexin V—FITC结合液200ul双染:185ul结合液+5 ulAnnexin V—FITC+10ul PI单染:195ul结合液+5ul Annexin V—FITC190ul结合液+10PI5) 进行流式细胞仪检测,Annexin V-FITC为绿色荧光,PI为红色荧光。

流式细胞术实验方法PI 染色操作步骤1、将单细胞悬液加入2ml圆底离心管中,离心,1500rpm , 5min,弃上清液。
2、加入PBS 1ml离心洗涤1次,弃上清。
3、加入2ml预冷的70%酒精,4℃固定30min,或是-20℃固定过夜。
4、离心,弃上清液。
5、用1×PBS 1ml洗涤1次,离心。
6、加入RNase A (工作浓度20ug/ml)于500ul 1×PBS中,37℃孵育30min,离心。
7、用1×PBS 1ml洗涤1次,离心。
8、加入PI(工作浓度50ug/ml) 于500ul 1×PBS中,室温避光孵育30min。
9、混匀,过300目筛网,置流式管中, 4℃冰箱保存,待测。
GFP PI染色操作步骤1、将单细胞悬液加入2ml圆底离心管中,离心,1500rpm , 5min,弃上清液。
2、加入PBS 1ml离心洗涤1次,弃上清。
3、加入2ml预冷PFA,PFA的浓度根据细胞的特点进行调节,4℃固定30min。
以下步骤同PI 染色操作步骤的(4-9)细胞表面直接免疫荧光染色操作步骤1、将单细胞悬液加入2ml圆底离心管中,离心,1500rpm , 5min,弃上清液。
2、以冷PBA 1ml,离心洗涤,弃上清液。
3、加入用PBA稀释的荧光素标记的抗体200ul。
用微量移液器轻轻吹打混匀,4℃或置冰上孵育30min-1h。
4、离心弃上清液。
5、加入冷PBS1ml,离心洗涤2次,以除去未结合的多余抗体成分。
6、向细胞中加入冷PBS 500ul,吹打混匀,置流式管中,4℃避光保存,待测。
细胞表面间接免疫荧光染色操作步骤1-2、同细胞表面直接免疫荧光染色操作步骤3、用PBA稀释的第一抗体200ul,对照管加入对应于一抗的正常实验动物IgG,轻轻吹打混匀,4℃或置冰上孵育1、5-2h。
离心,弃上清。
4、 PBS 1ml离心洗涤1次,以去除多余的未结合的特异性抗体。

流式检测细胞凋亡A n n e x i n V检测细胞凋亡 (2)实验原理 (2)实验用品 (2)操作步骤 (3)Annexin V Blocking (5)凋亡细胞的D N A断裂片段分析 (7)实验原理 (7)实验用品 (8)操作步骤 (9)B r d U F l o w K i t s检测细胞增殖 (12)实验原理 (12)BrdU Flow Kits 试剂盒 (12)结果分析 (17)流式仪器设置指南 (18)线粒体膜电位变化检测细胞凋亡 (22)实验原理 (22)实验用品 (22)样本制备 (23)结果分析 (24)注意事项 (24)A c t i v e C a s p a s e-3检测细胞凋亡 (26)实验原理 (26)实验步骤 (27)结果分析 (28)A n n e x i n V检测细胞凋亡实验原理Annexin V 是检测细胞凋亡的灵敏指标之一。
它是一种磷脂结合蛋白,可以与早期凋亡细胞的胞膜结合,而细胞质膜的改变是细胞发生凋亡时最早的改变之一。
在细胞发生凋亡时,膜磷脂酰丝氨酸(PS) 由质膜内侧翻向外侧。
Annexin V 与磷脂酰丝氨酸有高度亲和力,因而与细胞外侧暴露的磷脂酰丝氨酸结合。
由于在发生凋亡时,磷脂酰丝氨酸外翻的发生早于细胞核的改变,因此,与DNA 碎片检测比较,使用Annexin V 可以更早地检测到凋亡细胞。
因为细胞坏死时也会发生磷脂酰丝氨酸外翻,所以Annexin V 常与鉴定细胞死活的核酸染料(如PI 或7-AAD)合并使用,来区分凋亡细胞(Annexin V+/核酸染料-) 与死亡细胞(Annexin V+/核酸染料+)。
实验用品1. 一次性12⨯75mm Falcon试管。
2. PBS缓冲液:含0.1%NaN3,过滤后2-8︒C保存。
3. 微量加样器和加样头。
4. Annexin V Binding Buffer缓冲液(Cat. No. 66121E):浓度为10⨯,使用时,用稀释为1⨯浓度的应用液。

流式细胞凋亡检测步骤引言:细胞凋亡是一种正常的生理现象,它在维持机体稳态和调节细胞数量方面起着重要作用。
流式细胞凋亡检测是一种常用的方法,用于定量测量细胞凋亡程度。
本文将介绍流式细胞凋亡检测的步骤,并详细阐述每一步的操作方法和注意事项。
一、细胞准备在进行流式细胞凋亡检测之前,首先需要获得待检测的细胞样品。
这些细胞可以是体外培养的细胞系,也可以是从动物或人体组织中分离得到的原代细胞。
细胞样品应该在合适的培养条件下生长,确保其细胞活力和凋亡状态的稳定。
二、细胞收集细胞收集是流式细胞凋亡检测的关键步骤之一。
常用的方法有机械剥离、消化酶处理和离心等。
在收集过程中,需要注意尽量减少细胞损伤和凝聚物的形成。
收集的细胞应该进行适当的洗涤,以去除培养基中的残留物。
三、细胞固定细胞固定是为了防止细胞在后续处理过程中的损伤和凋亡。
常用的固定剂有甲醛、乙醛和乙酸等,可根据实验需要选择合适的固定剂和浓度。
固定处理后的细胞需要进行洗涤,以去除固定剂的残留物。
四、细胞染色细胞染色是流式细胞凋亡检测的核心步骤。
常用的染色剂有荧光素酶标记的Annexin V和PI(propidium iodide)等。
Annexin V 用于检测细胞外磷脂外翻的现象,而PI则用于判断细胞膜完整性。
染色剂的选择应基于实验目的和细胞类型,同时需要根据厂家提供的说明书进行操作。
五、流式细胞仪检测流式细胞仪是流式细胞凋亡检测的重要工具。
在进行检测之前,需要对流式细胞仪进行校准,包括激光功率、流速和检测通道的设置等。
校准后,将染色后的细胞悬浮液注入流式细胞仪中,通过激光的照射和细胞的流动,测量细胞的荧光强度和散射信号。
六、数据分析流式细胞仪检测得到的数据需要进行后续的分析和解释。
常用的数据分析软件有FlowJo、ModFit和Cyflogic等。
通过设置门,可以将细胞分为不同的亚群,分析细胞的凋亡率和凋亡类型等。
此外,还可以进行统计学分析,比较不同实验组之间的差异。

流式细胞仪检测细胞周期操作步骤取对数生长期的A549细胞,按1×106 cells/ mL以1mL接种于100mm培养皿内↓24h后,进行所需的处理(比如加药,照射)↓特定时间后终止培养,进行下一步的实验↓收集原培养液,洗后的PBS和消化后的细胞,将三者混匀放入15ml离心管中↓1000rpm离心5min(短时低速离心)↓弃上清,用1.5ml预冷PBS,1000rpm离心5min后去除PBS和细胞悬液内的细胞碎片↓加入1.5ml预冷PBS,在涡旋状态下加入3.5ml无水乙醇,混匀后,于4℃固定30min,或-20℃长期保存。
↓1000r/min,离心5min↓将乙醇吸除,加PBS清洗混匀↓1000r/min,5min再离心一遍,将残留在细胞上的乙醇除去↓吸除离心管内PBS,加入200ul PBS和2ul的RNA酶(0.25mg/ml)(37℃下孵育30min)↓加入0.5ml的50ug/ml的PI溶液室温下避光染色30min↓将离心管内的细胞过滤(300um尼龙网膜)至含有PBS的EP管中(PI 具有很强的粘附性,容易使细胞聚团),标记EP管↓提前一天网上预约↓开机(先开仪器后开软件)↓流式细胞仪的结构一般分为5部分:①流动室及液流驱动系统;②激光光源及光束成形系统;③光学系统;④信号检测、存贮、显示、分析系统;⑤细胞分选系统。
↓检测前先涡旋使细胞混匀悬浮呈单个细胞,然后插入流式细胞仪上↓流动室内充满鞘液,细胞排成单列由喷嘴中心喷出,形成细胞液柱↓液柱与激光束相交,细胞上的荧光染料被激发产生荧光(488nm激发光源)↓荧光信号变成电信号输出到计算机,软件分析(荧光染料和细胞DNA分子特异性结合,可以检测出细胞周期各时相细胞比例)↓在用第三方软件分析之前,将流式结果按如下所示导出结果分析——Modfit软件分析图片拷贝:直接Ctrl+C。

流式细胞仪检测细胞周期操作步骤取对数生长期的A549细胞,按1×106 cells/ mL以1mL接种于100mm培养皿内↓24h后,进行所需的处理(比如加药,照射)↓特定时间后终止培养,进行下一步的实验↓收集原培养液,洗后的PBS和消化后的细胞,将三者混匀放入15ml离心管中↓1000rpm离心5min(短时低速离心)↓弃上清,用1.5ml预冷PBS,1000rpm离心5min后去除PBS和细胞悬液内的细胞碎片↓加入1.5ml预冷PBS,在涡旋状态下加入3.5ml无水乙醇,混匀后,于4℃固定30min,或-20℃长期保存。
↓1000r/min,离心5min↓将乙醇吸除,加PBS清洗混匀↓1000r/min,5min再离心一遍,将残留在细胞上的乙醇除去↓吸除离心管内PBS,加入200ul PBS和2ul的RNA酶(0.25mg/ml)(37℃下孵育30min)↓加入0.5ml的50ug/ml的PI溶液室温下避光染色30min↓将离心管内的细胞过滤(300um尼龙网膜)至含有PBS的EP管中(PI 具有很强的粘附性,容易使细胞聚团),标记EP管↓提前一天网上预约↓开机(先开仪器后开软件)↓流式细胞仪的结构一般分为5部分:①流动室及液流驱动系统;②激光光源及光束成形系统;③光学系统;④信号检测、存贮、显示、分析系统;⑤细胞分选系统。
↓检测前先涡旋使细胞混匀悬浮呈单个细胞,然后插入流式细胞仪上↓流动室内充满鞘液,细胞排成单列由喷嘴中心喷出,形成细胞液柱↓液柱与激光束相交,细胞上的荧光染料被激发产生荧光(488nm激发光源)↓荧光信号变成电信号输出到计算机,软件分析(荧光染料和细胞DNA分子特异性结合,可以检测出细胞周期各时相细胞比例)↓在用第三方软件分析之前,将流式结果按如下所示导出结果分析——Modfit软件分析——Flowjo 软件分析图片拷贝:直接Ctrl+CFCM-DNA 量分析 1 个细胞增殖群时,可将DNA 含量分布组方图分为三部分,即 G0/1、S 、G2M 。

细胞凋亡流式检测实验方案掌握细胞凋亡的检测方法,了解细胞凋亡的发生机制。
二、实验原理细胞凋亡是一种程序性的细胞死亡过程,是正常细胞生长、发育和组织维持的重要机制。
细胞凋亡的发生涉及许多生物化学过程,包括蛋白酶的激活、蛋白磷酸化、核酸降解等。
目前,常用的细胞凋亡检测方法有DNA损伤、凋亡相关蛋白(如Caspase)的活性检测、Annexin V染色体外膜表面的磷脂酰胆碱变化等。
三、实验材料1. 细胞培养基、PBS缓冲液;2. Annexin V-PE/7-AAD染色试剂盒;3. 离心管、试管、离心机等。
四、实验步骤1. 将细胞接种于96孔或24孔板中,待细胞生长到适当密度后,按照不同处理方式分为不同组。
2. 处理细胞,如加入药物、病毒等,切换培养基等。
3. 用PBS缓冲液洗涤一次细胞,加入含Annexin V-PE/7-AAD染色试剂的PBS缓冲液,室温下酒暗处理15分钟。
4. 加入PBS缓冲液洗涤一次细胞,加入PBS缓冲液悬浮细胞,用流式细胞仪检测细胞的荧光强度。
五、实验结果分析1. Annexin V染色阳性、7-AAD染色阴性:表明细胞凋亡早期,细胞膜磷脂酰胆碱翻转,但细胞核仍完整无损。
2. Annexin V染色阳性、7-AAD染色阳性:表明细胞凋亡晚期,细胞膜磷脂酰胆碱翻转,细胞核已经破裂,DNA释放。
3. Annexin V染色阴性、7-AAD染色阴性:表明细胞无凋亡现象。
4. Annexin V染色阴性、7-AAD染色阳性:表明细胞处于坏死状态,细胞膜破裂,7-AAD染料可以进入细胞核结合DNA。
六、注意事项1. 实验过程中要注意无菌操作;2. 实验前要将所有实验材料消毒;3. 实验过程中要加强个人防护,穿戴实验室专用实验服、手套、口罩等;4. 实验结果分析时要注意对比组间差异明显性,结果分析应结合其他指标进行综合分析。

流式检测凋亡FITC/PI法
1、布板:将细胞PBS清洗,胰酶消化,离心1000g5分钟。
细胞计数,保证6孔板每
个孔30X104个细胞,2mL培养液。
过夜。
2、细胞换液,吸净旧培养液,PBS清洗,加2mL对照组和染氟组培养液。
24过夜。
3、收集细胞,PBS清洗,0.5ml胰酶消化,1mL终止消化,收集到2mL离心管里,
离心1000g5分钟。
4、用15ml管,PBS将浓缩结合缓冲液稀释至1x,可根据实际需要量稀释。
本周一
12mL,1.2mL原液+10.8mLPBS。
5、弃上清。
加入1mL的结合缓冲液到H1、H4、P1、P4,细胞计数,保证细胞浓度为20-50X104个细胞/mL。
转移到另一个管,结合缓冲液补到1mL。
6、离心,弃上清,加入0.190mL结合缓冲液,5ul的FITC,加入5ul的PI,混匀后
室温避光孵育15分钟。
7、离心,弃上清,加200ul结合缓冲液清洗,离心,弃上清,加入,200ul结合缓冲
液,混合均匀。
出细胞间,去B520.
8、流式细胞仪去离子水冲洗15分钟。
9、另标一管,200目滤网过滤,上流式细胞仪检测。
慢速。
凋亡流式检测步骤引言:凋亡流式检测是一种用于检测细胞凋亡的分析方法,通过检测细胞内凋亡标志物的变化来评估细胞是否处于凋亡状态。
本文将介绍凋亡流式检测的步骤,并详细解释每个步骤的操作原理和注意事项。
一、样本制备在进行凋亡流式检测之前,需要准备细胞样本。
首先,将需要检测的细胞分离并洗涤,去除外部污染物。
然后,将细胞悬浮液转移至离心管中,并进行离心,去除上清液。
最后,重新悬浮细胞并加入合适的缓冲液,使细胞适应流式细胞仪的操作条件。
二、细胞固定将悬浮的细胞样本进行固定,以保持细胞的形态和结构。
常用的固定方法包括用乙醇或甲醛进行固定。
将固定液加入细胞悬液中,充分混合后静置一段时间,使细胞得到固定。
三、膜破损为了使细胞内的凋亡标志物暴露在细胞外,需要对细胞进行膜破损。
常用的方法是使用洗脱缓冲液,将固定的细胞进行洗涤,去除固定液中的残留物质。
四、孔隙形成在凋亡流式检测中,需要使用荧光标记的抗体或荧光探针来检测凋亡标志物。
为了使这些荧光标记的物质能够进入细胞内,需要在细胞膜上形成孔隙。
孔隙形成的方法有多种,如使用洗脱缓冲液中的成分或特定的酶。
五、荧光标记在细胞凋亡检测中,常用的荧光标记物有PI、Annexin V等。
将荧光标记物添加到细胞悬液中,与凋亡标志物结合。
不同的荧光标记物对应不同的凋亡标志物,根据需要选择合适的标记物进行检测。
六、流式细胞仪检测将荧光标记过的细胞样本装入流式细胞仪,通过激光束的照射,荧光标记物会发出特定波长的荧光信号。
流式细胞仪会对这些荧光信号进行检测和记录,并生成相应的数据。
七、数据分析通过流式细胞仪检测得到的数据可以进行进一步的分析。
可以通过设置荧光信号的阈值来划分细胞的凋亡状态,将细胞分为未凋亡、早期凋亡和晚期凋亡三个亚群。
也可以通过计算荧光信号的强度来评估细胞凋亡的程度。
八、结果解读根据数据分析的结果,可以判断细胞样本中凋亡细胞的比例和凋亡程度。
通过与对照组的比较,可以进一步评估样本中的异常情况。
流式检测细胞凋亡Annexin V检测细胞凋亡Annexin V (2)实验原理 (2)实验用品 (2)操作步骤 (3)Annexin V Blocking (5)凋亡细胞的断裂片段分析 (7)DNA实验原理 (7)实验用品 (8)操作步骤 (9)BrdU Flow Kits检测细胞增殖BrdU Flow (12)实验原理 (12)BrdU Flow Kits试剂盒 (12)结果分析 (17)流式仪器设置指南 (18)线粒体膜电位变化检测细胞凋亡 (22)实验原理 (22)实验用品 (22)样本制备 (23)结果分析 (24)注意事项 (24)Active Caspase-3检测细胞凋亡Active (26)实验原理 (26)实验步骤 (27)结果分析 (28)A n n e x i n V检测细胞凋亡实验原理Annexin V是检测细胞凋亡的灵敏指标之一。
它是一种磷脂结合蛋白,可以与早期凋亡细胞的胞膜结合,而细胞质膜的改变是细胞发生凋亡时最早的改变之一。
在细胞发生凋亡时,膜磷脂酰丝氨酸(PS)由质膜内侧翻向外侧。
Annexin V与磷脂酰丝氨酸有高度亲和力,因而与细胞外侧暴露的磷脂酰丝氨酸结合。
由于在发生凋亡时,磷脂酰丝氨酸外翻的发生早于细胞核的改变,因此,与DNA碎片检测比较,使用Annexin V可以更早地检测到凋亡细胞。
因为细胞坏死时也会发生磷脂酰丝氨酸外翻,所以Annexin V常与鉴定细胞死活的核酸染料(如PI或7-AAD)合并使用,来区分凋亡细胞(Annexin V+/核酸染料-)与死亡细胞(Annexin V+/核酸染料+)。
实验用品1. 一次性12×75mm Falcon试管。
2. PBS缓冲液:含0.1%NaN3,过滤后2-8°C保存。
3. 微量加样器和加样头。
4. Annexin V Binding Buffer缓冲液(Cat. No. 66121E):浓度为10×,使用时,用稀释为1×浓度的应用液。
流式细胞仪检测细胞周期操作步骤流式细胞仪是一种能够对处在快速直线流动状态中的细胞或生物颗粒进行多参数、快速定量分析和分选的技术。
在细胞生物学研究中,流式细胞仪常用于检测细胞周期,这对于了解细胞的增殖、分化和凋亡等生理过程具有重要意义。
以下是流式细胞仪检测细胞周期的详细操作步骤:一、实验前准备1、细胞培养选择处于对数生长期的细胞进行实验,以保证细胞状态良好且增殖活跃。
根据细胞类型和实验要求,在合适的培养条件下培养细胞。
2、试剂和材料70%乙醇:用于固定细胞。
碘化丙啶(PI)染液:用于染色细胞核中的 DNA。
RNA 酶:用于去除 RNA 对染色的干扰。
磷酸盐缓冲液(PBS):用于洗涤细胞。
流式细胞仪专用的上样管。
3、仪器设备流式细胞仪,并确保仪器处于正常工作状态,包括光路校准、液流系统稳定等。
离心机:用于离心细胞。
二、细胞收集1、当细胞培养达到所需的密度和状态时,小心吸出培养基。
2、用 PBS 轻轻洗涤细胞两次,以去除残留的培养基和杂质。
3、加入适量的胰蛋白酶或其他细胞解离试剂,将细胞从培养容器表面解离下来。
4、加入含有血清的培养基终止胰蛋白酶的作用,防止过度消化细胞。
5、将细胞悬液转移到离心管中,离心(一般 1000 1500 rpm,510 分钟),使细胞沉淀。
三、细胞固定1、弃去上清液,留下细胞沉淀。
2、缓慢加入预冷的 70%乙醇,边加边轻轻涡旋或吹打细胞,使细胞充分分散在乙醇中。
乙醇的最终浓度应在 70%左右。
3、将细胞在 4°C 下固定至少 1 小时,可固定过夜以确保固定效果。
四、PI 染色1、离心固定后的细胞,弃去乙醇。
2、用 PBS 洗涤细胞两次,以去除残留的乙醇。
3、加入适量的 RNA 酶溶液,在 37°C 水浴中孵育 30 分钟,以去除 RNA 对染色的干扰。
4、加入 PI 染液,使其终浓度达到合适的范围(通常为 50 100μg/mL),在室温下避光孵育 30 分钟。
流式检测细胞周期与晚期凋亡样品处理流程原理:在生物细胞中,DNA含量是恒定的参量,DNA含量随着细胞增殖周期各时期不同而发生变化,G0期细胞被认为是不参与细胞周期循环的一群细胞,即为静止细胞,其细胞为恒定的二倍体DNA含量,G1期细胞具有增殖活性,参与细胞周期循环,G1和G0期细胞DNA 含量相同,均为二倍体,当细胞进入S期后,DNA含量逐渐增加,从二倍体到四倍体,一直到细胞DNA倍增结束,进入G2期,最终进入M期。
荧光染料和细胞DNA分子可特异性结合,具有一定的量效关系:DNA含量与荧光染料的结合成正比,荧光脉冲与直方图通道值成正比根据细胞凋亡时在细胞、亚细胞和分子水平上所发生的特征性改变。
这些改变包括细胞核的改变、细胞器的改变、细胞膜成分的改变和细胞形态的改变等,其中细胞核的改变最具特征性。
由于核的改变造成各种荧光染料对凋亡细胞DNA可染性发生改变,细胞凋亡时,核酸内切酶激活,导致DNA广泛断裂,这是细胞凋亡的特征性表现,由于细胞膜的通透性增加和固定剂的影响,使DNA不能完全封闭在细胞中,凋亡细胞DNA含量减少,DNA直方图上显示在G1期前面出现一个DNA含量减少的亚二倍体峰,又称凋亡峰!样品处理:1.胰蛋白酶消化法收集处理好的细胞,做成单细胞悬液2.1000r/min离心5min,收集沉淀。
3.沉淀用PBS洗2次,1000r/min离心5min,收集沉淀。
4.细胞沉淀用4℃预冷的70%的冰乙醇(预冷的70%酒精)1ml重悬,4℃过夜。
即可送检。
5.3000r/min离心1min离心去除固定液,用PBS洗2次,加入300ul -500ul PI与RNA酶混合液(PI 50ug/ml,RNA酶10ug/ml)6.将细胞沉淀弹散,放入37℃温箱中,孵育30min7.上机检测8. 结果判断:在前散射光对侧散射光的散点图或地形图上,凋亡细胞与正常细胞相比,前散射光降低,而侧散射光可高可低,与细胞的类型有关;在分析PI荧光的直方图时,先用门技术排除成双或聚集的细胞以及发微弱荧光的细胞碎片,在PI荧光的直方图上,凋亡细胞在G1/G0期前出现一亚二倍体峰。
流式细胞技术检测细胞周期分布
1) 已转染miRNA mimics的细胞培养达到85%融合时,用胰酶消化细胞。
1000 rpm,离心5min,收集细胞沉淀;
2) 已消毒的PBS重悬细胞,1000 rpm/min,离心5 min,收集细胞。
重复此步骤2次,以除去胰酶;
3) 加入预冷的70%乙醇固定细胞过夜;
4) 第二天1000rpm,离心5 min,收集细胞沉淀,PBS重悬两次,以除去乙醇;
5) 离心后加入500ul PBS重悬细胞,加入碘化丙锭(PI)染色液(含50mg/L PI,1g/L Triton X-100,100g/L RNase)混匀,4℃避光孵育30min。
6)流式细胞仪FACStar (美国BD公司) 检测。
接收的信号经Cellquest软件处理,对检测细胞的荧光强度进行分析。
实验重复3次。
2.11流式细胞技术检测细胞凋亡水平
1) 已转染BART6-3p mimics的细胞培养达到85%融合时,将上清培养液收集至离心管内;常常
2)PBS清洗贴壁细胞3次,用胰酶消化细胞(注意:消化时不可过度),收集于第一步的离心管内;
3) 1000 rpm离心5min,弃上清收集细胞,PBS轻轻重悬后,加入195 ulAnnexin V-FITC结合液,吹打混匀,重悬细胞,加入5ul Annexin V,轻轻混匀。
避光室温孵育15min;
4) 加入10 ul PI染色液,轻轻混匀,避光孵育;
空白:Annexin V—FITC结合液200ul
双染:185ul结合液+5 ulAnnexin V—FITC+10ul PI
单染:195ul结合液+5ul Annexin V—FITC
190ul结合液+10PI
5) 进行流式细胞仪检测,Annexin V-FITC为绿色荧光,PI为红色荧光。