高考化学复习无机化学工艺流程
- 格式:docx
- 大小:78.00 KB
- 文档页数:6

无机化学工艺流程主备人:审核人:1、无机化学工艺流程题的设计思路:2、无机化学工艺流程题的一般解题步骤:第一步:浏览全题,确定该流程的目的——由何原料获得何产物,对比原料和产物;第二步:精读局部,明确反应原理——确定各步反应物、产物(正、逆向推断法结合),尽量弄懂流程图,但不必将每一种物质都推出。
第三步:针对问题再读图,明确要求——结合基础理论和实际问题,科学表述,规范书写。
3、无机化学工艺流程题中涉及的问题:⑴原料的预处理①溶解:对金属及其氧化物通常采用酸溶,如用硫酸、盐酸、硝酸等,有时也常用碱溶(如铝及氧化铝等物质)。
(用酸或碱溶解盐主要是为了抑制盐水解)浸出:固体加水(或酸)溶解得到离子;浸出率:固体溶解后,离子在溶液中的含量的多少;②研磨:增大反应物接触面积,以加快反应速率或使反应更充分。
③灼烧、煅烧:使物质高温下分解,或高温氧化等。
⑵控制反应条件的方法①pH的控制:调节溶液的酸碱性使其中某些金属离子形成氢氧化物沉淀。
②加热的目的:加快反应速率或促进化学平衡的移动。
③降温的目的:防止某物质在高温下会分解,或为使平衡向需要的方向移动。
④趁热过滤:防止某物质降温时会析出。
⑤冰水洗涤:洗去晶体表面的杂质离子,并减少晶体在洗涤过程中的溶解损耗。
⑥利用有机溶剂(乙醇、乙醚等)洗涤:洗去晶体表面的杂质,降低晶体的溶解度,使晶体快速干燥。
⑦结晶过程的一般操作:蒸发浓缩→冷却结晶→过滤→洗涤→干燥。
例1、聚硅硫酸铁(PFSS)是新型无机高分子混凝剂,广泛应用于水的净化处理。
PFSS化学组成可表示为:[Fe2(OH)n(SO4)3-n/2(SiO2)x]m,由钢渣合成PFSS主要工艺流程如下:⑴酸浸时,采用100~140℃和2~3h,其目的是。
⑵氧化时,需将溶液冷却到40℃以下,其目的是。
⑶除Al3+时,先调节pH值到(参见右表),得Fe(OH)3沉淀,过滤除去滤液,再用硫酸溶解Fe(OH)开始沉淀pH沉淀完全pHAl3+Fe3+⑷Na2SiO3溶液可由SiO2渣除杂后与35%的NaOH溶液反应制备,该反应的离子方程式为。






2024版高考化学总复习无机化学工艺流程教学案一、教学目标:1.理解无机化学工艺流程的概念和作用;2.掌握无机化学工艺流程的基本规律和步骤;3.能够分析和设计无机化学工艺流程;4.培养学生对实际生产工艺的理解和技能。
二、教学内容:1.无机化学工艺流程的概念及作用;2.无机化学工艺流程的基本规律和步骤;3.无机化学工艺流程的实际案例。
三、教学过程:1.导入(10分钟)通过提问引导学生回忆无机化学的定义和特点,并引入无机化学工艺流程的概念和作用。
2.理论讲解(30分钟)(1)无机化学工艺流程的概念及作用讲解无机化学工艺流程是指将原料通过一系列化学反应和物理处理转化为所需产品的过程,并解释了无机化学工艺流程在工业生产中的重要性和作用。
(2)无机化学工艺流程的基本规律和步骤分析工艺流程的基本规律和步骤,包括:①原料的选择和准备;②反应的条件和控制;③产物的分离和提纯;④产物的收集和包装。
3.案例分析(40分钟)选择一个无机化学工艺流程案例进行详细分析,包括选择原料、设定反应条件、控制物料流动、分离提纯产品等步骤,并让学生参与讨论和设计。
4.小结(10分钟)总结无机化学工艺流程的概念、作用和步骤,并强调其在实际生产中的重要性和应用价值。
四、教学评价:1.参与讨论和分析案例,发表个人意见;2.提供给学生一些类似的案例进行讨论和设计;3.综合考察学生在课堂上的参与情况和对无机化学工艺流程的理解程度。
五、教学辅助手段:1.教学PPT;2.实例材料。
六、教学反思:本教学案的主要目标是让学生理解无机化学工艺流程的概念、作用和步骤,并培养他们分析和设计无机化学工艺流程的能力。
通过案例分析,让学生了解无机化学工艺流程在实际生产中的应用,并引导他们参与讨论和设计。
在教学过程中,教师需要引导学生主动思考,并与他们互动,激发他们的学习兴趣和积极性。
同时,教师还需根据学生的实际情况进行个性化辅导和指导,确保每个学生都能够掌握相关知识和技能。
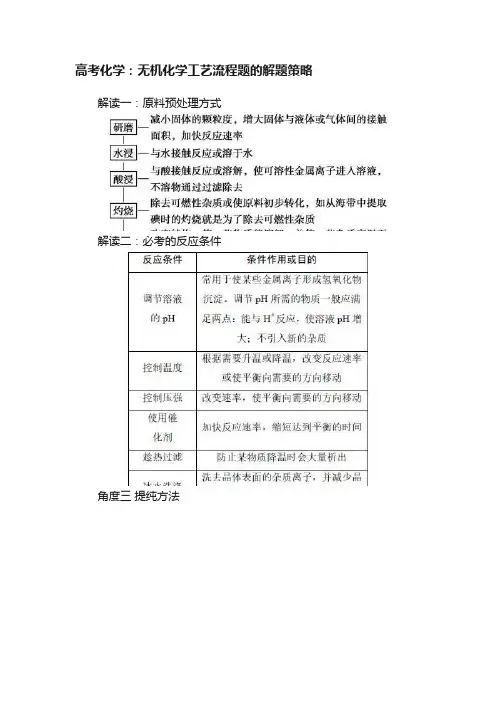
高考化学:无机化学工艺流程题的解题策略解读一:原料预处理方式解读二:必考的反应条件角度三提纯方法角度四分离方法(1)过滤:分离难溶物和易溶物,根据特殊需要采用趁热过滤或者抽滤等方法。
(2)萃取和分液:利用溶质在互不相溶的溶剂里的溶解度不同提取分离物质,如用CCl4或苯萃取溴水中的溴。
(3)蒸发结晶:提取溶解度随温度变化不大的溶质,如NaCl。
(4)冷却结晶:提取溶解度随温度变化较大的溶质、易水解的溶质或结晶水合物,如KNO3、FeCl3、CuCl2、CuSO4·5H2O、FeSO4·7H2O等。
(5)蒸馏或分馏:分离沸点不同且互溶的液体混合物,如分离乙醇和甘油。
(6)冷却法:利用气体易液化的特点分离气体,如合成氨工业采用冷却法分离氨气与氮气、氢气。
二、解答无机化工流程题的策略1.粗读题干,挖掘图示图示中一般会呈现超出教材范围的知识,但题目中往往会有提示或者问题中不涉及,所以一定要关注题目的每一个关键字,尽量弄懂流程图,但不必将每一种物质都推出,只需问什么推什么。
如制备类无机化工题,可粗读试题,知道题目制取什么、大致流程和有什么提示等。
2.携带问题,精读信息这里信息包括三个方面:一是主干,二是流程图示,三是设置问题。
读主干抓住关键字、词;读流程图,重点抓住物质流向(“进入”与“流出”)、实验操作方法等。
3.跳跃思维,规范答题答题时应注意前后问题往往没有“相关性”,即前一问未答出,不会影响后面答题。
要求用理论回答的试题,应采用“四段论法”:改变了什么条件(或是什么条件)→根据什么理论→有什么变化→得出什么结论。
相关练习1.以硅藻土为载体的五氧化二钒(V 2O 5)是接触法生产硫酸的催化剂。
从废钒催化剂中回收V 2O 5既避免污染环境又有利于资源综合利用。
废钒催化剂的主要成分为物质V 2O 5 V 2O 4 K 2SO 4 SiO 2 Fe 2O 3 Al 2O 3质量分数/% 2.2~ 2.9 2.8~ 3.1 22~ 28 60~ 65 1~2 <1 以下是一种废钒催化剂回收工艺路线:回答下列问题:(1)“酸浸”时V 2O 5转化为VO ,反应的离子方程式为________________,同时V 2O 4转化成VO 2+。


2020届高考化学总复习提升方案——无机化学工艺流程1.工艺流程题过程解读(1)读流程图①箭头:箭头进入的是投料(反应物)、出去的是主产物或副产物(生成物)。
②三线:出线和进线均表示物料流向或操作流程,可逆线表示物质循环。
(2)解题要点①审题要点:a.了解生产目的、原料及产品,b.了解题目提供的信息,c.分析各步的反应条件、原理及物质成分,d.理解物质分离、提纯、条件控制等操作的目的及要点。
②答题切入点:a.原料及产品的分离提纯,b.生产目的及反应原理,c.生产要求及反应条件,d.有关产率、产量及组成的计算,e.绿色化学。
2.工艺流程题常见答题方向工艺操作(结果) 目的评价(或操作名称)方法措施研磨(粉碎) 增大接触面积,加快反应(溶解)速率煅烧(焙烧) 矿物分解、燃烧,转化为易溶于酸、碱的物质水浸利用水溶性把物质进行分离酸浸(碱浸)利用物质与酸(碱)反应除掉杂质或把目标物质转化为可溶性离子控制条调节溶液pH 某些金属离子的沉淀,控制物质的溶解控制温度加快反应速率,促进平衡移动;物质的溶解、析出、挥发等件增大某反应物用量增大另一反应物的转化率(产率)某种试剂的选择是否带入杂质、是否影响产品的纯度分离提纯不相溶液体分液相溶性液体蒸馏难溶性固体过滤易溶性固体蒸发结晶、浓缩冷却结晶趁热过滤防止温度降低,某物质析出冰水洗涤减少晶体的溶解损失乙醇、有机溶剂洗涤减少晶体的水溶性损失考点指导1以物质制备为目的化学工艺流程【典例1】题头挖掘题头信息Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿(主要成分为FeTiO3,还含有少量MgO、SiO2等杂质)来制备,工艺流程如下:题干分析题干流程题尾知道题尾考查哪些问题回答下列问题:(1)“酸浸”实验中,铁的浸出率结果如下图所示。
由图可知,当铁的时,所采用的实验条件为__________________________________________________________ ______________。

高中化学无机化工流程常考点无机化工一般流程:原料→原料预处理→核心反应→产品分离提纯→目标产品,无机矿物含杂质多,预处理进行除杂、净化,通过核心反应制备粗产品后进行分离、提纯获取产品,解决该类题目关键是抓住核心元素,明确元素的流向,分析前后元素化合价变化判断反应类型,流程中采取的一系列操作都是为获得产品服务,物质的制备问题特别是盐类的制备要注意防水解、防氧化。
工艺流程题常见答题方向:预处理过程:1、研磨、粉碎、加热、搅拌、提高酸液或碱液的浓度等措施可提高反应速率、提高浸出率或原料的利用率,其中研磨、粉碎、雾化是通过增大反应物接触面积达到提高反应速率的目的。
2、浸取:加入试剂将固体矿物进行溶解,在溶液中便于物质的制备,浸取时不溶的物质通过过滤除去,浸取方式包括水浸、酸浸、碱浸、醇浸(提取有机物时用该方法较多)、盐浸等酸浸:溶解大部分金属单质、金属氧化物、碱、盐,盐酸、稀硫酸为非氧化性酸;浓硫酸、硝酸为强氧化性酸。
酸作用:预处理时加酸可考虑:溶解、去氧化膜,核心反应或分离提纯时可加入酸可考虑抑制某些金属阳离子水解、促使物质生成。
碱浸:溶解氧化铝、氢氧化铝、二氧化硅等可溶于碱的物质。
碱作用:预处理时加碱可考虑溶解、去油污、去铝片氧化膜,除杂过程、核心反应、分离提纯时加碱可考虑调节PH除杂、促进水解或促使沉淀生成。
盐浸:溶解能与盐反应的矿物或使微溶物、难溶物转化成能难溶的物质,提高某元素的利用率。
3、焙烧、灼烧、煅烧:使固体高温分解或改变结构,转化为易溶于酸或碱的物质,或使杂质高温氧化、分解,金属硫化物+O2=煅烧=金属氧化物+SO2↑。
除杂、净化过程:1、加入目标元素对应的氧化物、碱、碳酸盐等物质调节溶液PH,促使某些金属阳离子的水解平衡正向移动,在适宜的PH范围内形成氢氧化物沉淀除去。
2、加入氧化剂如O2、CI2(或氯水)、KMnO4、K2Cr2O7、H2O2、HNO3、NaCIO、NaCIO3等的作用:将具有还原性的物质氧化。
高考化学复习无机化学工艺流程集团档案编码:[YTTR-YTPT28-YTNTL98-UYTYNN08]课时4 无机化学工艺流程1.某一化工厂以废铁屑为原料制备FeCl3溶液,用作印刷电路铜板腐蚀剂,并对溶液B进行电解处理的实验流程如图:(1)试剂a应选用________(填写名称);(2)步骤Ⅰ用到的主要玻璃仪器有漏斗、________(填写仪器名称);(3)写出步骤Ⅱ中主要反应的化学方程式____________________;(4)实验室制取气体E的离子方程式是________________________,欲对气体E进行干燥和吸收,需选用下列装置中的________(填写序号);(5)如何用化学方法检验气体E?_______________________________。
解析分析流程中的物质及其化学反应,废铁屑加入热碱液是除去铁屑表面的油污,将Fe反应生成Fe2+的试剂只能选用HCl,才能由A经Cl2氧化后成FeCl3,若换成H2SO4、HNO3等其他酸,则引入SO、NO等杂质,过滤需用的玻璃仪器有:漏斗、烧杯、玻璃棒;2FeCl3+Cu===2FeCl2+CuCl2,则B中含有FeCl2、CuCl2、FeCl3等溶质,将其电解时,根据阳离子放电顺序先析出Cu,阳极生成Cl2,但是由于氧化性Fe3+>Cu2+,则Fe3+一定放电成Fe2+后才有Cu单质析出;Cl2的实验室制法为MnO2与浓盐酸反应,则Cl2中混有HCl、H2O等杂质,干燥Cl2用②,吸收Cl2用④;Cl2的检验方法是用湿润的淀粉-KI试纸。
答案(1)稀盐酸(2)烧杯、玻璃棒(3)2FeCl3+Cu===2FeCl2+CuCl2(4)MnO2+4H++2Cl-△,Mn2++Cl2↑+2H2O ②④(5)将湿润的KI-淀粉试纸靠近集气瓶口,试纸变蓝,证明该气体为Cl22.(2016·金考卷)镍电池广泛应用于混合动力汽车系统,电极材料由Ni(OH)2、碳粉和氧化铁等涂在铝箔上制成。
由于电池使用后电极材料对环境有危害,某兴趣小组对该电池电极材料进行回收研究,设计实验流程如下:已知:a.NiCl2易溶于水,Fe3+不能氧化Ni2+。
b.某温度下一些金属氢氧化物的K sp及开始沉淀和完全沉淀时的理论pH如表所示:(1)根据表中数据判断步骤②依次析出的沉淀Ⅱ________和沉淀Ⅲ________(填化学式),则pH1________pH2(填“>”、“=”或“<”),控制两种沉淀析出可利用________(填序号)。
A.pH试纸B.石蕊指示剂C.pH计(2)已知溶解度:NiC2O4>NiC2O4·H2O>NiC2O4·2H2O,则步骤③的化学方程式是________________________________________________。
步骤③后,过滤沉淀所需的玻璃仪器有____________。
若过滤时发现滤液中有少量浑浊,从实验操作的角度给出两种可能的原因:_________________________________________________________________ _____。
(3)④中阳极反应产生的气体E为________,验证该气体的试剂为__________________________________________________________。
(4)试写出步骤⑥的离子方程式:______________________________。
解析①注意电极材料的成分以及和盐酸反应后的离子;②A呈酸性,加入NiO的目的,是为了降低H+浓度,促进Fe3+、Al3+的水解,根据表中提供信息,Fe3+先形成沉淀;③只要注意到表中pH的数据,即可选出答案;④溶解度越小,越先形成沉淀;⑤注意只要求写出玻璃仪器;⑥注意D的成分为NaCl溶液;⑦看准要求。
答案(1)Fe(OH)3Al(OH)3< C(2)NiCl2+Na2C2O4+2H2O===NiC2O4·2H2O↓+2NaCl 漏斗、玻璃棒和烧杯玻璃棒划破滤纸、滤液超过滤纸边缘(3)Cl2湿润的淀粉-KI试纸(4)2Ni(OH)2+2OH-+Cl2===2Ni(OH)3+2Cl-3.(2015·福建理综,24)无水氯化铝在生产、生活中应用广泛。
(1)氯化铝在水中形成具有净水作用的氢氧化铝胶体,其反应的离子方程式为_________________________________________________________。
(2)工业上用铝土矿(主要成分为Al2O3,含有Fe2O3、SiO2等杂质)制取无水氯化铝的一种工艺流程示意如下:已知:物质SiCl4AlCl3FeCl3FeCl2沸点/℃57.6180(升华)300(升华)1023①步作用是_________________________________________(只要求写出一种)。
②步骤Ⅱ中若不通入氯气和氧气,则反应生成相对原子质量比硅大的单质是___________________________________。
③已知:Al2O3(s)+3C(s)===2Al(s)+3CO(g)ΔH1=+1344.1kJ·mol-12AlCl3(g)===2Al(s)+3Cl2(g)ΔH2=+1169.2kJ·mol-1由Al2O3、C和Cl2反应生成AlCl3的热化学方程式为_____________________________________________________。
④步骤Ⅲ的尾气经冷却至室温后,气体用足量的NaOH冷溶液吸收,生成的盐主要有3种,其化学式分别为_____________________________。
⑤结合流程及相关数据分析,步骤Ⅴ中加入铝粉的目的是_________________________________________________。
解析(1)AlCl3属于强酸弱碱盐,在溶液中Al3+发生水解反应生成Al(OH)3胶体:Al3++3H2O Al(OH)3(胶体)+3H+;(2)①步骤Ⅰ中焙烧使固体水分挥发、气孔数目增多,可以防止后续步骤生成的AlCl3水解,同时也增大了反应物的接触面积,从而加快反应速率。
②根据物质的组成元素可知:若步骤Ⅱ中不通入氯气和氧气,则反应生成相对原子质量比Si大的单质是Fe。
③对已知两个热化学方程式由上到下依次标记为(i)和(ii),根据盖斯定律,(i)-(ii)可得所求热化学方程式:Al2O3(s)+3C(s)+3Cl2(g)===2AlCl3(g)+3CO(g) ΔH=+174.9kJ·mol-1;④步骤Ⅲ经冷却至室温后,气体中含有Cl2、CO2、O2等,用足量的NaOH冷溶液吸收。
因此,得到的3种盐分别为NaCl、NaClO、Na2CO3。
⑤Al的活动性强于Fe,在步骤Ⅴ中加入Al粉与FeCl3发生置换反应,以除去FeCl3从而提高AlCl3的纯度。
答案(1)Al3++3H2O Al(OH)3(胶体)+3H+(2)①防止后续步骤生成的AlCl3水解或增大反应物的接触面积,加快反应速率②Fe或铁③Al2O3(s)+3C(s)+3Cl2(g)===2AlCl3(g)+3CO(g) ΔH=+174.9kJ·mol-1④NaCl、NaClO、Na2CO3⑤除去FeCl3,提高AlCl3纯度4.(2016·江苏化学,16)以电石渣[主要成分为Ca(OH)2和CaCO3]为原料制备KClO3的流程如下:(1)氯化过程控制电石渣过量、在75 ℃左右进行。
氯化时存在Cl2与Ca(OH)2作用生成Ca(ClO)2的反应,Ca(ClO)2进一步转化为Ca(ClO3)2,少量Ca(ClO)2分解为CaCl2和O2。
①生成Ca(ClO)2的化学方程式为____________________________________。
②提高Cl2转化为Ca(ClO3)2的转化率的可行措施有________(填序号)。
A.适当减缓通入Cl2速率B.充分搅拌浆料C.加水使Ca(OH)2完全溶解(2)氯化过程中Cl2转化为Ca(ClO3)2的总反应方程式为:6Ca(OH)2+6Cl2===Ca(ClO3)2+5CaCl2+6H2O氯化完成后过滤。
①滤渣的主要成分为_________(填化学式)。
②滤液中Ca(ClO3)2与CaCl2的物质的量之比n[Ca(ClO3)2]∶n[CaCl2]________1∶5(填“>”、“<”或“=”)。
(3)向滤液中加入稍过量KCl固体可将Ca(ClO3)2转化为KClO3,若溶液中KClO3的含量为100 g·L-1,从该溶液中尽可能多地析出KClO3固体的方法是________。
解析(1)①Cl2与Ca(OH)2反应生成Ca(ClO)2和CaCl2,配平。
②适当缓慢通氯气,气液充分接触,提高Cl2的吸收率,A正确;充分搅拌,增大气液接触面积,提高Cl2的吸收率,B正确;由于Ca(OH)2溶解度小,加水使Ca(OH)2溶解,生成Ca(ClO3)2浓度小,无法提高Cl2的转化率,错误。
(2)①电石渣中含有不溶于水的CaCO3及溶解度小的Ca(OH)2,滤渣为CaCO3、Ca(OH)2。
②因为Ca(OH)2与Cl2还可以发生反应生成Ca(ClO)2和CaCl2,Ca(ClO)2少量分解也会生成CaCl2,所以Ca(ClO3)2含量偏低。
(3)由溶解度图可知,KClO3随温度升高溶解度变大,可以采用蒸发浓缩,冷却结晶的方法生成沉淀。
答案(1)①2Cl2+2Ca(OH)2===Ca(ClO)2+CaCl2+2H2O ②AB(2)①CaCO3、Ca(OH)2②<(3)蒸发浓缩、冷却结晶。