反应热、中和热、燃烧热的联系和区别
- 格式:doc
- 大小:244.00 KB
- 文档页数:7

高三化学反应中的能量变化、燃烧热与中和热【本讲主要内容】化学反应中的能量变化、燃烧热与中和热【知识掌握】【知识点精析】1、反应热(1)化学反应中的能量变化常以热的形式表现出来。
分为吸热反应和放热反应。
(2)在化学反应过程中放出或吸收的热量通常叫做反应热。
用△H表示。
(1)用于表明反应所放出或吸收的热量的化学方程式,叫做热化学方程式。
(2)化学反应放出或吸收的热量,与参加反应的物质的多少和物质的状态有关。
热化学方程式书写要点:①必须注明每一种物质的状态;②热化学方程式中均写等号(可逆反应用可逆号);③方程式部分与△H用“;”分开;④放热反应△H<0,用“-;吸热反应△H>0,用“+”;⑤参加反应的物质的量必须与吸收或放出的热量相对应匹配;⑥注意在热化学方程式中△H的单位“KJ/mol”,表示的是反应物以“物质的量”为计量单位的热量变化。
3、燃烧热和中和热燃烧热和中和热都属于反应热。
(1)燃烧热是指1mol物质完全燃烧生成稳定氧化物所放出的热量。
这里要特别注意燃烧物质的用量和稳定的氧化物的含义。
碳燃烧可以生成CO、CO2。
CO2是稳定的氧化物。
碳的燃烧热是1mol碳燃烧生成CO2放出的热量。
(2)中和热是指“在稀溶液中酸跟稀碱发生中和反应生成1mol水放出的热量”。
在中学阶段,中和热是指可以用离子方程式 H++OH-=H2O表示的中和反应。
(3)书写燃烧热、中和热的热化学方程式时,必须是1mol物质完全燃烧或生成1mol 水放出的热量,不能随意改写计量数。
4、重点、难点突破(1)反应热与各物质能量的关系化学反应的过程,是反应物的化学键被破坏,生成物的化学键形成的过程。
破坏化学键要消耗能量,形成化学键要吸收能量。
△H=反应物总“键能”-生成物总“键能”。
所以,△H < 0 时,为放热反应;△H > 0时,为吸热反应。
对于放热反应,反应物的总能量高于生成物的总能量,△H < 0。



反应热、中和热、燃烧热的联系与区别反应热是近几年高考的重点内容之一,题型一般为选择和填空,考查的内容主要有:热化学方程需要加热才能进行,而有些吸热反应在常温下也可自发进行。
实际上反应热就是反应物分子中旧的化学键断裂时所吸收的总能量与形成的生成物分子中新的化学键所释放的总能量之差。
△H=∑E(反应物键能)-∑E(生成物键能)。
同样当“△H”为“-”即△H<0时为放热反应;反之,为吸热反应,这时“△H”为“+”即△H>0。
【例题1】(09重庆高考)下列热化学方程式书写正确的是(△H的绝对值均正确)A.C2H5OH(l)+3O2(g)==2CO2(g)+3H2O(g);△H=-1367.0 kJ/mol(燃烧热)B.NaOH(aq)+HCl(aq)== NaCl(aq)+H2O(l);△H=+57.3 kJ/mol(中和热)C.S(s)+O2(g)=== SO2(g);△H=-269.8 kJ/mol(反应热)D.2NO2== O2+2NO;△H=+116.2 kJ/mol(反应热)解析:A项燃烧热要求可燃物的物质的量必须为1mol,得到的氧化物必须是稳定的氧化物,即H2O 的状态必须为液态,因此A选项错误;中和反应是放热反应,△H应小于0,因此B选项错误;热化学反应方程式要注明物质在反应时的状态,因此D选项错误。
只有C选项正确。
答案:C 【例题2】(09四川高考)25℃,101 kPa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3 kJ/mol,辛烷的燃烧热为5518 kJ·mol-1。
下列热化学方程式书写正确的是()A.2H+(aq) +SO42-(aq)+Ba2+(aq)+2OH-(aq)=BaSO4(s)+2H2O(1);△H=-57.3 kJ·mol-1B.KOH(aq)+ H2SO4(aq) = K2SO4(aq)+H2O(l);△H=-57.3 kJ·mol-1C.C8H18(l)+ O2 (g) = 8CO2 (g)+ 9H2O(g);△H=-5518 kJ·mol-1D.2C8H18(g)+25O2 (g) =16CO2 (g)+18H2O(1);△H=-5518 kJ·mol-1解析:中和热的标准是生成1 mol H2O(l)时所放出的热量,A项不符合中和热的定义;燃烧热要求必须生成稳定的氧化物,C项中生成物水为气态,应该为液态。

反应热、中和热、燃烧热的联系与区别反应热是近几年高考的重点内容之一,题型一般为选择和填空,考查的内容主要有:热化学方程反应热中和热燃烧热含义化学反应过程中放出或吸收的热量在稀溶液中,强酸和强碱发生中和反应而生成1 mol H2O(l)时所放出的热量在101 kPa时,1 mol物质完全燃烧生成稳定的氧化物时所放出的热量反应特点任何反应中和反应燃烧反应物质状态物质的状态要确定稀溶液生成物在常温下为稳定态方程式配平标准任意物质的量以生成1 mol H2O(l)为标准以燃烧1 mol 可燃物为标准△H符号放热取负值、吸热取正值负值负值能量数值的描述必须指出是放热还是吸热或使用正负值或用△H表示直接描述热量的变化时不必再指明是放出的热量,可用△H表示说明①△H=∑E(生成物)-∑E(反应物)②△H值与书写形式有关,单位一般是“kJ·mol-1”①电离吸热、溶解时吸热或放热②稀强酸与稀强碱反应的中和热为57.3 kJ·mol-1稳定的氧化物如CO2、SO2、H2O、P2O5等①在中学阶段,如果不指明条件就默认为通常状况,比较△H的相对大小时要考虑其数值的“+”“-”的问题②用弱酸或弱碱的稀溶液进行中和反应时,每生成1 mol H2O(l)放出的热量小于57.3 kJ需要加热才能进行,而有些吸热反应在常温下也可自发进行。
实际上反应热就是反应物分子中旧的化学键断裂时所吸收的总能量与形成的生成物分子中新的化学键所释放的总能量之差。
△H=∑E(反应物键能)-∑E(生成物键能)。
同样当“△H”为“-”即△H<0时为放热反应;反之,为吸热反应,这时“△H”为“+”即△H>0。
【例题1】(09重庆高考)下列热化学方程式书写正确的是(△H的绝对值均正确)A.C2H5OH(l)+3O2(g)==2CO2(g)+3H2O(g);△H=-1367.0 kJ/mol(燃烧热)B.NaOH(aq)+HCl(aq)== NaCl(aq)+H2O(l);△H=+57.3 kJ/mol(中和热)C.S(s)+O2(g)=== SO2(g);△H=-269.8 kJ/mol(反应热)D.2NO2== O2+2NO;△H=+116.2 kJ/mol(反应热)解析:A项燃烧热要求可燃物的物质的量必须为1mol,得到的氧化物必须是稳定的氧化物,即H2O 的状态必须为液态,因此A选项错误;中和反应是放热反应,△H应小于0,因此B选项错误;热化学反应方程式要注明物质在反应时的状态,因此D选项错误。

反应热、燃烧热与中和热的区别及联系嘿,小伙伴们,咱们今天来聊聊化学里那些让人头大的热量问题——反应热、燃烧热与中和热!别一看到这些名词就头疼,其实它们挺有意思的,咱们慢慢道来。
咱们先说说反应热吧。
反应热啊,就像是化学反应过程中的“能量小闹钟”,它记录了反应过程中放出或吸收的热量。
无论是啥反应,只要发生了化学变化,都有可能伴随着热量的变化。
这就像咱们平时做饭,烧水会放热,冰块融化会吸热,道理是一样的。
接下来,咱们聊聊燃烧热。
燃烧热啊,简单说,就是物质跟氧气完全燃烧时放出的热量。
这就像是咱们冬天里的一把火,熊熊燃烧,温暖了整个心房。
不过,这里的燃烧热可是个讲究事儿,得在标准状况下,1mol物质完全燃烧生成稳定的氧化物才行。
比如说,咱们熟悉的氢气燃烧,生成液态水时放出的热量,那才是它的燃烧热。
最后,咱们来看看中和热。
中和热啊,就像是酸碱之间的“爱情火花”,它们在稀溶液中相遇,生成1mol液态水时放出的热量,就是中和热啦。
这就像是咱们平时喝的柠檬汁,酸酸甜甜,混合在一起,就产生了独特的味道和热量。
不过,要注意哦,这里可是稀溶液,浓酸浓碱可不算数,因为它们稀释时也会放热呢。
说了这么多,咱们来总结一下它们的区别和联系吧。
反应热是个大家庭,燃烧热和中和热都是它的成员。
燃烧热是物质与氧气完全燃烧时的热量,中和热则是酸碱中和生成水的热量。
它们都是反应热的一种表现形式,但各有特点。
怎么样,听了我的介绍,是不是觉得这些热量问题也没那么难懂了?其实啊,化学就像咱们的生活一样,充满了乐趣和惊喜。
只要咱们用心去感受,去发现,就能找到其中的奥秘和乐趣。
好了,今天的分享就到这里啦,希望小伙伴们都能喜欢化学,爱上化学!。


化学基本概念复习三――反应热诸城二中王洪兵[知识归纳]关于反应热的考点主要有:书写或判断热化学方程式的正误;反应热、燃烧热、中和热概念辨析;有关反应热的简单计算。
尤其需要注意的是,随着新教材的全面铺开,有关反应热的篇幅增多,难度加大,成为新教材的一大亮点。
一、放热反应和吸热反应由于各种物质所具有的能量是不同的。
如果反应物所具有的总能量高于生成物所具有的总能量,那么在发生化学反应时,有一部分能量就会转变成热能等形式释放出来,这就是放热反应。
如果反应物所具有的总能量小于生成物所具有的总能量,那么在发生化学反应时,反应物就需要吸收能量才能转化为生成物,这就是吸热反应。
对于可逆反应而言,如果其正反应为放热反应,则其逆反应一定是吸热反应。
二、热化学方程式表示反应所放出或吸收的热量的化学方程式叫热化学方程式。
书写热化学方程式应注意下列几点:1.要注明反应物和生成物的聚集状态;2.在化学方程式右端要注明反应热,反应热用符号△H 表示,并与热化学方程式间用“;”号隔开;△H 的单位一般采用kJ·mol—1。
当△H 为“—”或△H<0时,体系能量降低,为放热反应,当△H 为“+”或△H>0时,体系能量升高,为吸热反应;3.热化学方程式的化学计量数只表示物质的量,而不代表分子个数,因此可以写成分数。
4.同一热化学反应,如果方程式化学计量数不等,△H 也不等,但数值与反应物的化学计量数成正比。
如:2H2(g)十O2(g)=2H2O(g);△H=—483.6kJ·mol—1,而;△H=—241.8kJ·mol—1。
5.热化学方程式中△H 前必须注明符号“+”或“-”。
三、燃烧热和中和热在101kPa时,1mol物质完全燃烧生成稳定的氧化物时所放出的热量,叫做该物质的燃烧热。
例如:测得101kPa 时,1molC完全燃烧放出393.5kJ的热量,这就是C的燃烧热。
其热化学方程式为:C(s)十O2(g)=CO2(g);△H=—393.5kJ·mol—1在稀溶液中,酸跟碱发生中和反应而生成1mol水,这时的反应热叫做中和热。

化学反应热知识点小结化学反应热知识点小结化学(chemistry)是自然科学的一种,主要在分子、原子层面,研究物质的组成、性质、结构与变化规律,创造新物质(实质是自然界中原来不存在的分子)。
下面跟着店铺来看看化学反应热知识点小结吧!希望对你有所帮助。
一、反应热1、定义:在反应过程中放出或吸收的热量叫反应热。
放出热量的反应叫放热反应。
吸收热量的反应叫吸热反应(化学反应过程中,不仅有新物质生成,同时还伴随着能量的变化,并可以以热能、电能或光能等的形式表现出来。
当能量以热的形式表现时,我们把反应分为放热反应和吸热反应。
)2、符号:⊿H(大吸小放)3、单位:kJ/mol4、计算依据:⊿H=生成物的总能量-反应物的总能量=H(生成物)-H(反应物)⊿H=反应物的总键能–生成物的总键能5、书写热化学方程式的注意事项:(1)要标明反应的温度和压强,如不特别注明,即表示在101kPa 和298K。
(2)要标明反应物和生成物的聚集状态,因为物质在不同的聚集状态下所具有的能量是不相同的,对同一反应来说,物质聚集状态不同,反应热(⊿H)的数值不同。
(3)热化学方程式中的化学计量数不表示分子个数,而是表示物质的量,所以,它可以是整数,也可以是分数。
相同物质发生的同一个化学反应,当化学计量数改变时,其⊿H也同等倍数的改变,但⊿H的单位不变,仍然为kJ/mol。
若将化学方程式中反应物和生成物颠倒,则⊿H的数值和单位不变,符号改变。
(4)热化学方程式一般不需要写反应条件,也不用标“↑”和“ ”。
因为聚集状态已经表示出来了,固态用“s”液态用“l”,气态用“g”。
(5)⊿H要标注“+”或“-”,放热反应⊿H为“-”,吸热反应⊿H 为’+”.6、盖斯定律:一定条件下,某化学反应无论是一步完成还是分成几步完成,反应的总热效应相同,这就是盖斯定律。
盖斯定律的应用实际上是利用热化学方程式的加减。
(化学反应的'反应热只与反应体系的始态和终态有关,而与反应的途径无关)7、(1)常见的放热反应有:可燃物的燃烧,酸碱中和反应,大多数化合反应,金属跟酸的置换反应(2)常见的吸热反应有:大多数分解反应,以碳、氢气、一氧化碳作还原剂的氧化还原反应,铵盐与碱的反应。

2017年士兵军考化学考点:反应热与燃烧热、中和热的联系及区别反应热反应热,通常是指:当一个化学反应在恒压以及不作非膨胀功的情况下发生后,若使生成物的温度回到反应物的起始温度,这时体系所放出或吸收的热量称为反应热。
也就是说,反应热通常是指:体系在等温、等压过程中发生物理或化学的变化时所放出或吸收的热量。
化学反应热有多种形式,如:生成热、燃烧热、中和热等。
化学反应热是重要的热力学数据,它是通过实验测定的,所用的主要仪器称为“量热计”。
公式式中△U≡U终态-U始态≡U反应产物-U反应物,式中∑vB(g)=△n(g)/mol,即发生1mol 反应,产物气体分子总数与反应物气体分子总数之差。
由该式可见,对于一个具体的化学反应,等压热效应与等容热效应是否相等,取决于反应前后气体分子总数是否发生变化,若总数不变,系统与环境之间不会发生功交换,于是,Qp=QV;若总数减小,对于放热反应∣Qp ∣>∣QV∣,等压过程放出热多于等容过程放出热;若反应前后气体分子总数增加,对于放热反应,∣Qp∣<∣QV∣,反应前后内能减少释放的一部分能量将以做功的形式向环境传递,放出的热少于等容热效应。
同样的,对于吸热反应也可以类推得到。
将上式展开又可得到:Qp=△U+p△V=(U终态-U始态)+p(U终态-U始态)=(U终态+pU终态)-(U始态+pU始态)由于U、p、V都是状态函数,因此U+pV也是状态函数,为此,我们定义一个新的状态函数,称为焓,符号为H,定义式为H≡U+pV,于是:△H=H终态-H始态= Qp反应热、中和热、燃烧热的联系与区别不能根据反应条件是否需要加热来判断一个反应是放热反应还是吸热反应,因为有些放热反应需要加热才能进行,而有些吸热反应在常温下也可自发进行。
实际上反应热就是反应物分子中旧的化学键断裂时所吸收的总能量与形成的生成物分子中新的化学键所释放的总能量之差。
△H=∑E(反应物键能)-∑E(生成物键能)。
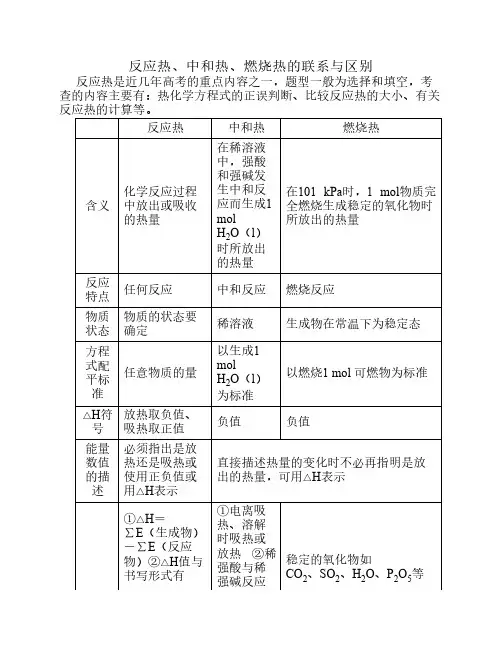
反应热、中和热、燃烧热的联系与区别反应热、中和热、燃烧热的联系与区别#TRS_AUTOADD_1295246084500 {MARGIN-TOP: 0px; MARGIN-BOTTOM: 0px}#TRS_AUTOADD_1295246084500 P {MARGIN-TOP: 0px; MARGIN-BOTTOM: 0px}#TRS_AUTOADD_1295246084500 TD {MARGIN-TOP: 0px; MARGIN-BOTTOM: 0px}#TRS_AUTOADD_1295246084500 DIV {MARGIN-TOP: 0px; MARGIN-BOTTOM: 0px}#TRS_AUTOADD_1295246084500 LI {MARGIN-TOP: 0px; MARGIN-BOTTOM: 0px}/**---JSON--{"":{"margin-top":"0","margin-bottom":"0"},"p":{ "margin-top":"0","margin-bottom":"0"},"td":{"margin-top":"0","margin-bottom":"0"},"div":{"margin-top":"0","margin-bottom" :"0"},"li":{"margin-top":"0","margin-bottom":"0"}}--**/#TRS_ AUTOADD_1276846558718 {MARGIN-TOP: 0px; MARGIN-BOTTOM: 0px}#TRS_AUTOADD_1276846558718 P {MARGIN-TOP: 0px; MARGIN-BOTTOM: 0px}#TRS_AUTOADD_1276846558718 TD {MARGIN-TOP: 0px; MARGIN-BOTTOM: 0px}#TRS_AUTOADD_1276846558718 DIV {MARGIN-TOP: 0px; MARGIN-BOTTOM: 0px}#TRS_AUTOADD_1276846558718 LI {MARGIN-TOP: 0px; MARGIN-BOTTOM: 0px}/**---JSON--{"":{"margin-top":"0","margin-bottom":"0"},"p":{"margin-top": "0","margin-bottom":"0"},"td":{"margin-top":"0","margin-botto m":"0"},"div":{"margin-top":"0","margin-bottom":"0"},"li":{"m argin-top":"0","margin-bottom":"0"}}--**/DIV.MyFav_1276846561307P.MsoNormal{TEXT-JUSTIFY: inter-ideograph; FONT-SIZE: 10.5pt; FONT-FAMILY: "Times New Roman"; TEXT-ALIGN: justify}DIV.MyFav_1276846561307LI.MsoNormal{TEXT-JUSTIFY: inter-ideograph; FONT-SIZE: 10.5pt; FONT-FAMILY: "Times New Roman"; TEXT-ALIGN: justify}DIV.MyFav_1276846561307DIV.MsoNormal{TEXT-JUSTIFY: inter-ideograph;FONT-SIZE: 10.5pt; FONT-FAMILY: "Times New Roman"; TEXT-ALIGN: justify}DIV.MyFav_1276846561307P.MsoHeader{BORDER-RIGHT: medium none;PADDING-RIGHT: 0cm; BORDER-TOP: medium none; PADDING-LEFT: 0cm; FONT-SIZE: 9pt;PADDING-BOTTOM: 0cm; BORDER-LEFT: medium none; LAYOUT-GRID-MODE: char; PADDING-TOP: 0cm; BORDER-BOTTOM: medium none; FONT-FAMILY: "Times New Roman"; TEXT-ALIGN:center}DIV.MyFav_1276846561307LI.MsoHeader{BORDER-RIGHT: medium none;PADDING-RIGHT: 0cm; BORDER-TOP: medium none; PADDING-LEFT: 0cm; FONT-SIZE: 9pt;PADDING-BOTTOM: 0cm; BORDER-LEFT: medium none;LAYOUT-GRID-MODE: char; PADDING-TOP: 0cm; BORDER-BOTTOM: medium none; FONT-FAMILY: "Times New Roman"; TEXT-ALIGN:center}DIV.MyFav_1276846561307DIV.MsoHeader{BORDER-RIGHT: medium none; PADDING-RIGHT: 0cm; BORDER-TOP: medium none; PADDING-LEFT: 0cm; FONT-SIZE: 9pt;PADDING-BOTTOM: 0cm; BORDER-LEFT: medium none; LAYOUT-GRID-MODE: char; PADDING-TOP: 0cm; BORDER-BOTTOM: medium none; FONT-FAMILY: "Times New Roman"; TEXT-ALIGN:center}DIV.MyFav_1276846561307 P.MsoFooter{FONT-SIZE: 9pt; LAYOUT-GRID-MODE: char; FONT-FAMILY: "Times New Roman"}DIV.MyFav_1276846561307LI.MsoFooter{FONT-SIZE: 9pt; LAYOUT-GRID-MODE: char; FONT-FAMILY: "Times NewRoman"}DIV.MyFav_1276846561307DIV.MsoFooter{FONT-SIZE: 9pt; LAYOUT-GRID-MODE: char; FONT-FAMILY: "Times NewRoman"}DIV.MyFav_1276846561307 A:link{COLOR: blue; TEXT-DECORATION: underline}DIV.MyFav_1276846561307 SPAN.MsoHyperlink{COLOR: blue; TEXT-DECORATION:underline}DIV.MyFav_1276846561307 A:visited{COLOR: purple; TEXT-DECORATION:underline}DIV.MyFav_1276846561307SPAN.MsoHyperlinkFollowed{COLOR: purple;TEXT-DECORATION: underline}DIV.MyFav_1276846561307 P.Char{TEXT-JUSTIFY: inter-ideograph; FONT-SIZE: 10.5pt; TEXT-INDENT: 10pt; LINE-HEIGHT: 125%; FONT-FAMILY: Verdana; TEXT-ALIGN: justify}DIV.MyFav_1276846561307 LI.Char{TEXT-JUSTIFY: inter-ideograph; FONT-SIZE: 10.5pt; TEXT-INDENT: 10pt; LINE-HEIGHT: 125%; FONT-FAMILY: Verdana; TEXT-ALIGN: justify}DIV.MyFav_1276846561307 DIV.Char{TEXT-JUSTIFY: inter-ideograph; FONT-SIZE: 10.5pt; TEXT-INDENT: 10pt; LINE-HEIGHT: 125%;FONT-FAMILY: Verdana; TEXT-ALIGN:justify}DIV.MyFav_1276846561307 DIV.Section1{page: Section1}反应热是近几年高考的重点内容之一,题型一般为选择和填空,考查的内容主要有:热化学方程式的正误判断、比较反应热的大小、有关反应热的计算等。
反应热、中和热、燃烧热的联系与区别反应热是近几年高考的重点内容之一,题型一般为选择和填空,考查的内容主要有:热化学方程式的正误判断、比较反应热的大小、有关反应热的计算等。
反应热中和热燃烧热含义化学反应过程中放出或吸收的热量在稀溶液中,强酸和强碱发生中和反应而生成1 mol H2O(l)时所放出的热量在101 kPa时,1 mol物质完全燃烧生成稳定的氧化物时所放出的热量反应特点任何反应中和反应燃烧反应物质状态物质的状态要确定稀溶液生成物在常温下为稳定态方程式配平标准任意物质的量以生成1 mol H2O(l)为标准以燃烧1 mol 可燃物为标准△H符号放热取负值、吸热取正值负值负值能量数值的描述必须指出是放热还是吸热或使用正负值或用△H表示直接描述热量的变化时不必再指明是放出的热量,可用△H表示说明①△H=∑E(生成物)-∑E(反应物)②△H值与书写形式有关,单位一般是“kJ·mol-1”①电离吸热、溶解时吸热或放热②稀强酸与稀强碱反应的中和热为57.3 kJ·mol-1稳定的氧化物如CO2、SO2、H2O、P2O5等①在中学阶段,如果不指明条件就默认为通常状况,比较△H的相对大小时要考虑其数值的“+”“-”的问题②用弱酸或弱碱的稀溶液进行中和反应时,每生成1 mol H2O(l)放出的热量小于57.3 kJ不能根据反应条件是否需要加热来判断一个反应是放热反应还是吸热反应,因为有些放热反应需要加热才能进行,而有些吸热反应在常温下也可自发进行。
实际上反应热就是反应物分子中旧的化学键断裂时所吸收的总能量与形成的生成物分子中新的化学键所释放的总能量之差。
△H=∑E(反应物键能)-∑E(生成物键能)。
同样当“△H”为“-”即△H<0时为放热反应;反之,为吸热反应,这时“△H”为“+”即△H>0。
高中化学三热(反应热、燃烧热、中和热)的比较1、反应热(1)在中学化学中,一般研究的是恒压反应热。
(2)规定放热反应的反应热为“-”,吸热反应的反应热为“+”。
反应物总能量和生成物总能量的大小决定了反应热的大小。
化学反应的反应热△H也等于断裂反应物中化学键需要吸收的能量与形成生成物中化学键放出的能量之差。
(3)反应热的单位常用,其中“mol”不表示参加反应的物质的物质的量,而表示1mol反应。
(4)反应热包含了燃烧热和中和热,它们不是并列关系,而是从属关系。
2、燃烧热(1)量的标准:必须是1 mol可燃物。
(2)必须完全燃烧,如碳的燃烧热是指1 mol C完全燃烧生成所放出的热量,而不是生成CO所放出的热量。
(3)必须生成稳定的化合物,如氢气的燃烧热是指1 mol氢气完全燃烧生成液态水所放出的热量,而不是生成气态水所放出的热量。
3、中和热(1)量的标准:中和反应时必须是生成1 mol水。
(2)在稀溶液中,强酸与强碱发生中和反应生成1 mol水时,放出的热量均为57.3kJ。
弱酸与弱碱发生中和反应生成1 mol水时,放出的热量应小于57.3kJ。
(3)反应物必须是酸和碱,并不是能反应生成水的物质都行。
4、“三热”的比较能量名称反应热燃烧热中和热概念一定温度下,在反应过程中所放出或吸收的热量在25℃、101kPa时,1mol纯物质完全燃烧生成稳定的化合物时所放出的热量在稀溶液中,强酸与强碱发生中和反应生成1mol水时所放出的热量变化类型放热反应或吸热反应 放热反应 放热反应△H 的正负 放热时, 吸势时,单位 反应条件 一定温度下25℃、101kPa 稀溶液 反应物的量 不限量1mol 可燃物 不限量 生成物的量 不限量 不限量 1 mol 水热文推荐:西红柿的创新做法,西红柿最营养健康的吃法 雷人学生小明VS 他的幽默老师爱上就不会轻易放弃的星座准妈妈早餐应该吃什么,简单又营养的孕妇早餐 矮个子这样穿,秒变大长腿穿衣搭配口诀矮个子女生穿什么鞋子汽车上这些设计原来是这样考虑!身边有4种朋友,生活才会越来越好(经典)你能控制情绪,才能控制人生这39个高分词,让你的英语作文每次20+,太有用了! 学会十句英语作文法,10分钟内拿满分!。
反应热、中和热、燃烧热的联系与区别反应热是近几年高考的重点容之一,题型一般为选择和填空,考查的容主要有:热化学方程式的反应热中和热燃烧热含义化学反应过程中放出或吸收的热量在稀溶液中,强酸和强碱发生中和反应而生成1 mol H2O(l)时所放出的热量在101 kPa时,1 mol物质完全燃烧生成稳定的氧化物时所放出的热量反应特点任何反应中和反应燃烧反应物质状态物质的状态要确定稀溶液生成物在常温下为稳定态方程式配平标准任意物质的量以生成1 mol H2O(l)为标准以燃烧1 mol 可燃物为标准△H符号放热取负值、吸热取正值负值负值能量数值的描述必须指出是放热还是吸热或使用正负值或用△H表示直接描述热量的变化时不必再指明是放出的热量,可用△H表示说明①△H=∑E(生成物)-∑E(反应物)②△H值与书写形式有关,单位一般是“kJ·mol-1”①电离吸热、溶解时吸热或放热②稀强酸与稀强碱反应的中和热为57.3 kJ·mol-1稳定的氧化物如CO2、SO2、H2O、P2O5等①在中学阶段,如果不指明条件就默认为通常状况,比较△H的相对大小时要考虑其数值的“+”“-”的问题②用弱酸或弱碱的稀溶液进行中和反应时,每生成1 mol H2O(l)放出的热量小于57.3 kJ需要加热才能进行,而有些吸热反应在常温下也可自发进行。
实际上反应热就是反应物分子中旧的化学键断裂时所吸收的总能量与形成的生成物分子中新的化学键所释放的总能量之差。
△H=∑E(反应物键能)-∑E(生成物键能)。
同样当“△H”为“-”即△H<0时为放热反应;反之,为吸热反应,这时“△H”为“+”即△H>0。
【例题1】(09高考)下列热化学方程式书写正确的是(△H的绝对值均正确)A.C2H5OH(l)+3O2(g)==2CO2(g)+3H2O(g);△H=-1367.0 kJ/mol(燃烧热)B.NaOH(aq)+HCl(aq)== NaCl(aq)+H2O(l);△H=+57.3 kJ/mol(中和热)C.S(s)+O2(g)=== SO2(g);△H=-269.8 kJ/mol(反应热)D.2NO2== O2+2NO;△H=+116.2 kJ/mol(反应热)解析:A项燃烧热要求可燃物的物质的量必须为1mol,得到的氧化物必须是稳定的氧化物,即H2O的状态必须为液态,因此A选项错误;中和反应是放热反应,△H应小于0,因此B选项错误;热化学反应方程式要注明物质在反应时的状态,因此D选项错误。
只有C选项正确。
答案:C 【例题2】(09高考)25℃,101 kPa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3 kJ/mol,辛烷的燃烧热为5518 kJ·mol-1。
下列热化学方程式书写正确的是()A.2H+(aq) +SO42-(aq)+Ba2+(aq)+2OH-(aq)=BaSO4(s)+2H2O(1);△H=-57.3 kJ·mol-1B.KOH(aq)+ H2SO4(aq) =K2SO4(aq)+H2O(l);△H=-57.3 kJ·mol-1C.C8H18(l)+ O2 (g) =8CO2 (g)+ 9H2O(g);△H=-5518 kJ·mol-1D.2C8H18(g)+25O2 (g) =16CO2 (g)+18H2O(1);△H=-5518 kJ·mol-1解析:中和热的标准是生成1 mol H2O(l)时所放出的热量,A项不符合中和热的定义;燃烧热要求必须生成稳定的氧化物,C项中生成物水为气态,应该为液态。
D项中辛烷的物质的量不是1 mol,D中△H=-11036 kJ·mol-1才正确。
所以ACD错误。
答案:B点拨:燃烧热、中和热概念的理解及热化学方程式的正确书写是解该题的关键。
【例题3】(08年高考)白磷与氧可发生如下反应:P4+ 5O2=== P4O10。
已知断裂下列化学键需要吸收的能量分别为:P-P a kJ·mol-1、P-O b kJ·mol-1、P=O c kJ·mol-1、O=O d kJ·mol-1。
根据图示的分子结构和有关数据估算该反应的△H,其中正确的是()A.(6a + 5d-4c-12b)kJ·mol-1B.(4c + 12b-6a-5d)kJ·mol-1C.(4c + 12b-4a-5d)kJ·mol-1D.(4a + 5d-4c-12b)kJ·mol-1解析:由图可以看出1 mol P4中有6 mol P-P键,5 mol O2中有5 mol O=O键,1 mol P4O10中有4 mol P=O键、12 mol P-O键,所以△H =(6a + 5d-4c-12b)kJ·mol-1。
答案:A点拨:化学反应的实质就是旧化学键的断裂和新化学键的形成,在断裂和形成的过程中伴随着能量的吸收和释放。
检测题1、下列说确的是()A. 在101kPa时,1mol物质完全燃烧时所放出的热量,叫做该物质的燃烧热B. 酸和碱发生中和反应生成1mol水,这时的反应热叫中和热C. 燃烧热或中和热是反应热的种类之一D. 在稀溶液中,1molCH3COOH和1mol NaOH完全中和时放出的热量为57.3kJ2、已知:2CO(g)+O2(g)=2CO2(g); △H=–566.0kJ/mol.由此判断CO的燃烧热是()A. -283.0kJ/molB. -566.0kJ/molC. 283.0kJD. 566.0kJ3、已知:①101kPa时,2C(s)+O2(g)=2CO(g)△H=-221kJ/mol②稀溶液中,H+ (aq)+OH-(aq)=H2O(1) △H=-57.3kJ/mol 下列结论正确的是()A、碳的燃烧热大于110.5 kJ/molB、①的反应热为-221 kJ/molC、稀硫酸与稀NaOH溶液反应的中和热为-57.3 kJ/molD、稀醋酸与稀NaOH溶液反应生成1mol 水,放出57.3kJ 的热量4、已知,在25℃、101kPa时,1mol C(石墨)完全燃烧生成CO2气体,放热393.5kJ,1mol CO完全燃烧生成CO2气体,放热283.0kJ。
下列说确的是( )A.在25℃、101kPa时,C(石墨)燃烧生成CO气体的热化学方程式是2C(石墨)+O2(g)=2CO(g);△H=-110.5kJ/ molB.C(石墨)不完全燃烧,生成CO2和CO混合气体时,少放热283.0kJC.C(石墨)和CO2(g)反应生成CO(g)的反应是吸热反应D.如果金刚石燃烧生成CO2放出的热量大于石墨,则从石墨转变成金刚石的变化需要吸热5、(08卷)下列关于热化学反应的描述中正确的是( )A.HCl和NaOH反映的中和热△H=-57.3kJ/mol,则H2SO4和Ca(OH)2反映的中和热△H=2×(-57.3)kJ/mol B.需要加热才能发生的反应一定是吸热反应C.CO(g)的燃烧热是283.0kJ/mol,则2CO2(g)===2CO(g)+O2(g)反应的△H=2×283.0kJ/molD.1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热知识要点:反应热是一个矢量,吸热为+号,放热为—号。
所以反应热必须带正负号,且只能用△H来表示。
在表述燃烧热和中和热时不带正负号,因为中和热和燃烧热不存在正负的问题,均用数值直接表达。
(反应热、中和热和燃烧热三者而言:即用△H 表示的时候标注+、—号,其余情况均都不标注)一、正确理解“三热”概念1、反应热:在化学反应过程中反应本身放出或吸收的热量。
在恒温恒压条件下的反应热用△H 表示,单位是kJ/mol ,并规定放热反应的△H<0,吸热反应的△H>0。
2、标准燃烧热与热值燃烧热是反应热的一种形式,使用燃烧热的概念时要理解下列要点。
① 规定是在101 kPa 压强下测出热量。
书中提供的燃烧热数据都是在101kPa 下测定出来的。
因为压强不同,反应热有所不同。
② 规定可燃物的物质的量为1mol (这样才有可比性)。
因此,表示可燃物的燃烧热的热化学方程式中,可燃物的化学计量数为1,其他物质的化学计量数常出现分数。
例如,C 8H 18的燃烧热为5518kJ ·mol -1,用热化学方程式表示则为C 8H 18(l )+252O 2(g )= 8CO 2(g )+9H 2O (l );△H=-5518 kJ ·mol -1③ 规定生成物为稳定的氧化物.例如C → CO 2、H →H 2O(l)、S →SO 2等。
C (s )+12O 2(g )=CO (g );△H=-110.5 kJ ·mol -1 C (s )+O 2(g )=CO 2(g );△H=-393.5 kJ ·mol -1C 的燃烧热为393.5 kJ ·mol -1,而不是110.5 kJ ·mol -1。
④ 叙述燃烧热时,用正值,在热化学方程式中用△H 表示时取负值。
例如,CH 4的燃烧热为890.3kJ ·mol -1,而△H =-890.3 kJ ·mol -1且必须以1mol 可燃物燃烧为标准。
⑤要与热值概念进行区别。
热值:1g 物质完全燃烧的反应热叫该物质的热值。
3、中和热:把在稀溶液中酸跟碱发生中和反应而生成1molH 2O 时的反应热叫中和热,单位是kJ/mol 。
燃烧热和中和热都属于反应热。
二、正确书写热化学方程式1、ΔH 只能写在标有反应物和生成物状态的化学方程式的右边,并用“;”隔开。
若为放热反应,ΔH 为 <0:若为吸热反应,ΔH 为>0 。
ΔH 的单位一般为kJ/mol 。
2、注意热化学方程式中各物质化学式前面的化学计量数仅表示该物质的物质的量,并不表示物质的个数。
因此化学计量数可以是整数、也可以是分数。
3、反应物和产物的聚集状态不同,反应热数值以及符号都可能不同。
因此,必须注明物质的聚集状态(s 、l 、g)才能完整地体现出热化学方程式的意义。
热化学方程式中不用↑和↓。
4、由于ΔH 与反应完成物质的量有关,所以方程式中化学式前面的化学计量数必须与ΔH 相对应,如果化学计量数加倍,则ΔH 也要加倍。
5、当反应向逆向进行时,其反应热与正反应的反应热数值相等,符号相反。
6、用中文表示焓变时数值没有正负号,而用符号表示焓变时数值必须注明正负号。
如H 2的燃烧热...为285.8kJ/mol ,△.H .=-285.8kJ/mol 。