10燃烧热 中和热和大小比较
- 格式:ppt
- 大小:285.00 KB
- 文档页数:23

考点三中和热【考点定位】本考点考查中和热,进一步理解中和热的概念及影响中和热数据的因素,并能书写表示中和热的热化学方程式及有关计算.【精确解读】1.定义:稀溶液中,强酸和强碱发生中和反应生成1mol水时的反应热.2.注意事项:①稀溶液是指物质溶于大量水,即大量水中物质的溶解热效应忽略不计;一般是指酸、碱的物质量浓度均小于或等于1mol•L-1;②中和热不包含离子在水中的生成热、物质的溶解热、电解质电离的吸热所伴随的热效应;③中和反应的实质是H+和OH-化合生成水;若反应过程中有其他物质生成(生成沉淀的反应一般为放热反应),这部分反应热也不包含在中和热内.H+(aq)+OH-(aq)=H2O(l);△H=—57.3kJ/mol表示强酸强碱稀溶液反应的中和热;④弱酸弱碱因为电离时要吸热或电离出的H+和OH—物质的量小于对应酸碱的物质的量,所以弱酸弱碱参加的中和反应,其中和热△H >-57。
3kJ/mol,表示中和热偏小;若采用浓硫酸或固体NaOH进行反应,中和热△H>—57。
3kJ/mol,中和热偏大,因为浓硫酸和固体NaOH溶解放热。
3.中和热热化学方程式的书写:中和热是以生成1molH2O所放出的热量来定义的,因此,书写中和热的热化学方程式时,以生成1molH2O为标准来配平其余物质的化学计量数。
【精细剖析】1.燃烧热和中和热的比较:①相同点:都是放热反应的反应热,△H<0,单位都是kJ/mol;②不同点:燃烧热是以1mol可燃物完全燃烧放出的热量定义的,生成物不一定是1mol;中和热反应物不一定为1mol,但生成物水必须为1mol。
【典例剖析】下列关于中和热的说法中正确的是( )A.10 L 0。
05 mol•L-1Ba(OH)2溶液与20 L 0。
05 mol•L-1 HNO3反应时的反应热是中和热B.1 mol HCl气体通入1 L 0。
01 mol•L-1 NaOH溶液中反应时的反应热是中和热C.1 mol HClO与2 mol NaOH溶液反应时的反应热也可能是中和热D.只要强酸与强碱在稀溶液中反应生成1 mol水时的反应热就是中和热【剖析】A。


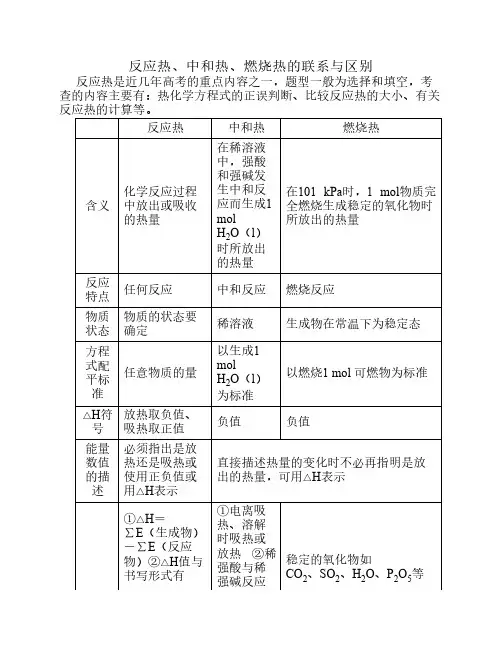
反应热、中和热、燃烧热的联系与区别反应热是近几年高考的重点内容之一,题型一般为选择和填空,考查的内容主要有:热化学方程反应热中和热燃烧热含义化学反应过程中放出或吸收的热量在稀溶液中,强酸和强碱发生中和反应而生成1 mol H2O(l)时所放出的热量在101 kPa时,1 mol物质完全燃烧生成稳定的氧化物时所放出的热量反应特点任何反应中和反应燃烧反应物质状态物质的状态要确定稀溶液生成物在常温下为稳定态方程式配平标准任意物质的量以生成1 mol H2O(l)为标准以燃烧1 mol 可燃物为标准△H符号放热取负值、吸热取正值负值负值能量数值的描述必须指出是放热还是吸热或使用正负值或用△H表示直接描述热量的变化时不必再指明是放出的热量,可用△H表示说明①△H=∑E(生成物)-∑E(反应物)②△H值与书写形式有关,单位一般是“kJ·mol-1”①电离吸热、溶解时吸热或放热②稀强酸与稀强碱反应的中和热为57.3 kJ·mol-1稳定的氧化物如CO2、SO2、H2O、P2O5等①在中学阶段,如果不指明条件就默认为通常状况,比较△H的相对大小时要考虑其数值的“+”“-”的问题②用弱酸或弱碱的稀溶液进行中和反应时,每生成1 mol H2O(l)放出的热量小于57.3 kJ需要加热才能进行,而有些吸热反应在常温下也可自发进行。
实际上反应热就是反应物分子中旧的化学键断裂时所吸收的总能量与形成的生成物分子中新的化学键所释放的总能量之差。
△H=∑E(反应物键能)-∑E(生成物键能)。
同样当“△H”为“-”即△H<0时为放热反应;反之,为吸热反应,这时“△H”为“+”即△H>0。
【例题1】(09重庆高考)下列热化学方程式书写正确的是(△H的绝对值均正确)A.C2H5OH(l)+3O2(g)==2CO2(g)+3H2O(g);△H=-1367.0 kJ/mol(燃烧热)B.NaOH(aq)+HCl(aq)== NaCl(aq)+H2O(l);△H=+57.3 kJ/mol(中和热)C.S(s)+O2(g)=== SO2(g);△H=-269.8 kJ/mol(反应热)D.2NO2== O2+2NO;△H=+116.2 kJ/mol(反应热)解析:A项燃烧热要求可燃物的物质的量必须为1mol,得到的氧化物必须是稳定的氧化物,即H2O 的状态必须为液态,因此A选项错误;中和反应是放热反应,△H应小于0,因此B选项错误;热化学反应方程式要注明物质在反应时的状态,因此D选项错误。

一、燃烧热1. 定义:在25 ℃、101 kPa时,1mol纯物质完全燃烧生成稳定的氧化物时所放出的热量。
注意:完全燃烧时产物必须是稳定的氧化物。
如:氢元素转化为H2O(l),碳元素转化为CO2(g),硫元素转化为SO2(g)。
2. 单位:kJ·mol-1。
3. 意义:C(碳)的燃烧热为393.5 kJ·mol-1,表示在25 ℃、101 kPa条件下,1 mol C完全燃烧生成CO2气体时放出的热量为393.5 kJ,用热化学方程式表示为:C(s)+O2(g)=CO2(g)ΔH=-393.5 kJ·mol-1。
4. 特点:物质燃烧一定放热,所以物质燃烧的反应热ΔH一定为负值。
二、中和热1. 定义:在稀溶液中,强酸和强碱发生中和反应生成1mol水所放出的热量。
2. 特点:①热化学方程式中只能生成1mol水。
②强酸和强碱的中和热的离子表示式为H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3kJ/mol。
注意:中和热的产物中除水和其他溶于水的盐外,不能有沉淀生成。
如:0.5mol硫酸溶液和0.5molBa(OH)2溶液反应放出的热量就不是中和热。
四、中和反应反应热的测定1. 装置如下图:量热计2. 原理:Q =-C(T 2-T 1)或Q =-mc(T 2-T 1)Q :中和反应放出的热量。
C :反应混合物的热容。
m :反应混合液的质量。
c :反应混合液的比热容。
T 1、T 2:分别指反应前、后溶液温度。
3. 步骤(1)药品取用用一个量筒量取50 mL 0.50 mol/L 盐酸,倒入小烧杯中,并用温度计测量盐酸的温度, 记入下表。
然后把温度计上的酸用水冲洗干净。
用另一个量筒量取50 mL 0.55 mol/L NaOH 溶液,并用温度计测量NaOH 溶液的温度,记入下表。
(2)酸碱混合把量筒中的NaOH 溶液迅速倒入量热计(注意不要洒到外面)。
立即盖上盖板,用环形玻璃搅拌棒轻轻搅动溶液,并准确读取混合溶液的最高温度,记为终止温度,记入下表。

高中化学中和热和燃烧热的知识点化学的学习中,有很多的知识点,学生想要学好化学需要了解各方面的知识点,下面店铺的小编将为大家带来中和热和燃烧热的知识点的介绍,希望能够帮助到大家。
高中化学中和热和燃烧热的知识点介绍重点:中和热的测定实验原理的理解和操作要点的把握燃烧热的概念,有关燃烧热计算难点:中和热的测定,中和热和燃烧热的有关计算[知识分析]一、中和热:强酸和强碱的稀溶液完全中和生成1mol水时所放出的热量称为中和热;常温常压下,酸和碱的稀溶液反应产生的中和热为△H=-57.4kJ/mol。
中和热的测定:在50mL烧杯中加入20mL 2mol/L的盐酸,测其温度。
另用量筒量取20mL 2mol/L NaOH溶液,测其温度,并缓缓地倾入烧杯中,边加边用玻璃棒搅拌。
观察反应中溶液温度的变化过程,并作好记录。
数据处理:△H=-Q/n=-cm△t/n水其中:c=4.18J/(g?℃),m为酸碱溶液的质量和,△t=t2-t1,t1是盐酸温度与NaOH溶液温度的平均值,n水为生成水的物质的量。
说明:1. 燃烧不一定要有氧气参与,如氢气在氯气中燃烧,钠在氯气中燃烧等。
2. 物质在氧气中燃烧的条件是:要与空气(即氧气)接触;并且温度要达到物质的着火点;而燃料充分燃烧的条件则是:要有适当过量的氧气,可燃物与空气要有足够多的接触面积。
以上两者既有相同的地方,也有不同的地方。
3. 燃料不完全燃烧时主要存在以下问题:浪费能源的同时可能对环境产生污染。
4. 理解燃烧热时,我们要从四个方面入手:①25℃、101kPa;②1mol纯物质;③完全燃烧;④稳定的化合物。
5. 一般情况下,物质燃烧生成的稳定的化合物有:C→CO2;H→H2O(液态);S→SO2。
6. 燃烧热表示的意义:C的燃烧热为393.5kJ/mol,表示在25℃、101kPa时,1molC完全燃烧生成CO2时放出393.5kJ的热量。
7. 书写热化学方程式时,燃烧热是以1mol物质完全燃烧所放出的热量来定义的,因此在书写它的热化学方程式时,应以1mol可燃物为标准来配平其余物质的化学计量数。




第二节燃烧热能源[学习目标定位] 1.正确认识燃烧热的概念,学会利用燃烧热进行相关的计算。
2.知道能源是人类生存和社会发展的重要基础,知道使用化石燃料的利弊和新能源的开发。
一燃烧热1.反应热是化学反应过程中吸收或放出的热量,常用符号ΔH表示。
燃烧反应都是放热反应,其反应热为负值。
已知4g硫粉完全燃烧放出37 kJ热量,则该反应的热化学方程式是S(s)+O2(g)===SO2(g)ΔH=—296 kJ·mol—1。
2.1.00 L 1.00 mol·L—1H2SO4溶液与2.00 L 1.00 mol·L—1NaOH溶液完全反应,放出114.6 kJ热量,该反应的中和热为57.3kJ·mol—1,表示其中和热的化学方程式是错误!H2SO4(aq)+NaOH(aq)===错误!Na2SO4(aq)+H2O(l)ΔH =—57.3kJ·mol—1。
3.已知2H2(g)+O2(g)===2H2O(l)ΔH=—571.6 kJ·mol—1,该反应中ΔH表示的意义是燃烧2mol H2生成液态H2O,放出571.6 kJ的热量。
若燃烧1mol 氢气生成液态水时的反应热为ΔH1, 生成气态水时的反应热为ΔH2,则ΔH1和ΔH2的大小关系是ΔH1<ΔH2;ΔH1=—285.8 kJ·mol—1,表示的意义是1mol H2完全燃烧生成稳定的液态水,放出285.8 kJ的热量。
4.燃烧热的概念及其计算(1)燃烧热的概念是25℃、101kPa时,1mol纯物质完全燃烧生成稳定的氧化物时所放出的热量。
燃烧热的单位是kJ·mol—1。
(2)燃烧热的意义:甲烷的燃烧热为890.31kJ·mol—1,或ΔH=—890.31kJ·mol —1,它表示25℃、101kPa时,1mol CH4完全燃烧生成CO2和液态H2O时放出890.31kJ的热量。

第五节燃烧热和中和热由于反应的情况不同,反应热可以分为许多种,如燃烧热、中和热,等等。
一、燃烧热许多单质和化合物在燃烧时放出热量,生成稳定的氧化物如二氧化碳、水等。
在101kPa时,1mol物质完全燃烧生成稳定的氧化物时所放出的热量,叫做该物质的燃烧热。
燃烧热通常可由实验测得。
例如,测得101 kPa时1molC完全燃烧放出393.5kJ的热量,这就是C的燃烧热。
C(s)+O2(g)CO2(g);ΔH=-393.5 kJ/mol又如,由实验测得,101 kPa时 1molH2完全燃烧生成液态水,放出 285. 8 kJ /mol的热量,这就是H2 的燃烧热。
由于燃烧热的定义规定可燃物是以1mol作为标准来进行测量的,因此在计算燃烧热时,热化学方程式里的化学计量数常用分数表示。
无论从实践的观点还是从科学研究的观点来看,利用热化学方程式进行计算都是很重要的。
通过计算,可以知道某个化学反应完成时需要吸收或放出多少热量,以便更好地控制反应条件,充分利用能源。
对于可燃物的燃烧反应来讲,由于它们都是放热反应,因此可以通过对燃烧热的计算,来了解燃烧反应为我们所提供的热量。
【例题1】在 101 kPa时,1mol CH4完全燃烧生成CO2和液态H2O,放出890 kJ的热量,CH4的燃烧热为多少? 1000 L CH4(标准状况)燃烧后所产生的热量为多少?【解】根据题意,在 101 kPa时,1mol CH4完全燃烧的热化学方程式为:CH4(g)+2O2(g)CO2(g)+ 2H2O(l);ΔH=-890 kJ/mol即CH4的燃烧热为 890 kJ/mol。
1000 L CH4(标准状况)的物质的量为:=44.6mol1mol CH4完全燃烧放出 890 kJ的热量,44.6 molCH4完全燃烧放出的热量为:44.6 mol×890 kJ/mol=3.97×104kJ答:CH4的燃烧热为 890 kJ/mol,1000 L CH4(标准状况)完全燃烧产生的热量为 3.97×104kJ。
反应热、中和热、燃烧热的联系与区别河北省宣化县第一中学栾春武反应热是近几年高考的重点内容之一,题型一般为选择和填空,考查的内容主要有:热化学方程式的正误判断、比较反应热的大小、有关反应热的计算等。
不能根据反应条件是否需要加热来判断一个反应是放热反应还是吸热反应,因为有些放热反应需要加热才能进行,而有些吸热反应在常温下也可自发进行。
实际上反应热就是反应物分子中旧的化学键断裂时所吸收的总能量与形成的生成物分子中新的化学键所释放的总能量之差。
△H=∑E(反应物键能)-∑E(生成物键能)。
同样当“△H”为“-”即△H<0时为放热反应;反之,为吸热反应,这时“△H”为“+”即△H>0。
【例题1】(09重庆高考)下列热化学方程式书写正确的是(△H的绝对值均正确)A.C2H5OH(l)+3O2(g)==2CO2(g)+3H2O(g);△H=-1367.0 kJ/mol(燃烧热)B.NaOH(aq)+HCl(aq)== NaCl(aq)+H2O(l);△H=+57.3 kJ/mol(中和热)C.S(s)+O2(g)=== SO2(g);△H=-269.8 kJ/mol(反应热)D.2NO2 == O2+2NO;△H=+116.2 kJ/mol(反应热)解析:A项燃烧热要求可燃物的物质的量必须为1mol,得到的氧化物必须是稳定的氧化物,即H2O 的状态必须为液态,因此A选项错误;中和反应是放热反应,△H应小于0,因此B选项错误;热化学反应方程式要注明物质在反应时的状态,因此D选项错误。
只有C选项正确。
答案:C(09四川高考)25℃,101 kPa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3 kJ/mol,【例题2】辛烷的燃烧热为5518 kJ·mol-1。
下列热化学方程式书写正确的是A.2H+(aq) +SO42-(aq)+Ba2+(aq)+2OH-(aq)=BaSO4(s)+2H2O(1);△H=-57.3 kJ·mol-1B.KOH(aq)+ H2SO4(aq) =K2SO4(aq)+H2O(l);△H=-57.3 kJ·mol-1C.C8H18(l)+ O2 (g) =8CO2 (g)+ 9H2O(g);△H=-5518 kJ·mol-1D.2C8H18(g)+25O2 (g) =16CO2 (g)+18H2O(1);△H=-5518 kJ·mol-1解析:中和热的标准是生成1 mol H2O(l)时所放出的热量,A项不符合中和热的定义;燃烧热要求必须生成稳定的氧化物,C项中生成物水为气态,应该为液态。
专题10 燃烧热能源【知识回顾】一、燃烧热1.概念:在101 kPa时,1mol纯物质完全燃烧生成稳定的氧化物所放出的热量,叫做该物质的燃烧热。
单位:kJ/mol表示。
燃烧热的限定词有恒压(101 kPa时)、可燃物的物质的量(1 mol)、完全燃烧、稳定的氧化物等,例如:C→CO2,H→H2O(l),S→SO2等。
2.书写热化学方程式:燃烧热是以1 mol物质完全燃烧所放出的热量来定义的,因此在书写它的热化学方程式时,应以燃烧1 mol物质为标准来配平其余物质的化学计量数。
3.燃烧热的计算:可燃物完全燃烧放出的热量的计算方法为Q放=n(可燃物)×ΔH。
式中:Q放为可燃物燃烧反应放出的热量;n为可燃物的物质的量;ΔH为可燃物的燃烧热。
二、中和热1.概念:在稀溶液中,强酸跟强碱发生中和反应生成1mol液态水时的反应热。
2.注意几个限定词:稀溶液;产物是1 mol液态H2O;用离子方程式可表示为OH-(aq)+H+(aq)=H2O(l)ΔH=-57.3 kJ·mol-1。
3. 中和热的测定(1)实验目的:测定强酸、强碱反应的中和热,体验化学反应的热效应。
(2)测定原理:ΔH=m酸+m碱c t终-t始n;c=4.18 J·g-1·℃-1=4.18×10-3kJ·g-1·℃-1;n为生成H2O的物质的量。
(3)实验用品:仪器:大烧杯(500 mL)、小烧杯(100 mL)、温度计、量筒(50mL)两个、泡沫塑料或纸条、泡沫塑料板或硬纸板(中心有两个小孔)、环形玻璃搅拌棒;试剂:0.50 mol/L盐酸、0.50 mol/LNaOH溶液。
(4)实验步骤:①在大烧杯底部垫泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平。
然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过。
高中化学三热(反应热、燃烧热、中和热)的比较1、反应热(1)在中学化学中,一般研究的是恒压反应热。
(2)规定放热反应的反应热为“-”,吸热反应的反应热为“+”。
反应物总能量和生成物总能量的大小决定了反应热的大小。
化学反应的反应热△H也等于断裂反应物中化学键需要吸收的能量与形成生成物中化学键放出的能量之差。
(3)反应热的单位常用,其中“mol”不表示参加反应的物质的物质的量,而表示1mol反应。
(4)反应热包含了燃烧热和中和热,它们不是并列关系,而是从属关系。
2、燃烧热(1)量的标准:必须是1 mol可燃物。
(2)必须完全燃烧,如碳的燃烧热是指1 mol C完全燃烧生成所放出的热量,而不是生成CO所放出的热量。
(3)必须生成稳定的化合物,如氢气的燃烧热是指1 mol氢气完全燃烧生成液态水所放出的热量,而不是生成气态水所放出的热量。
3、中和热(1)量的标准:中和反应时必须是生成1 mol水。
(2)在稀溶液中,强酸与强碱发生中和反应生成1 mol水时,放出的热量均为57.3kJ。
弱酸与弱碱发生中和反应生成1 mol水时,放出的热量应小于57.3kJ。
(3)反应物必须是酸和碱,并不是能反应生成水的物质都行。
4、“三热”的比较能量名称反应热燃烧热中和热概念一定温度下,在反应过程中所放出或吸收的热量在25℃、101kPa时,1mol纯物质完全燃烧生成稳定的化合物时所放出的热量在稀溶液中,强酸与强碱发生中和反应生成1mol水时所放出的热量变化类型放热反应或吸热反应 放热反应 放热反应△H 的正负 放热时, 吸势时,单位 反应条件 一定温度下25℃、101kPa 稀溶液 反应物的量 不限量1mol 可燃物 不限量 生成物的量 不限量 不限量 1 mol 水热文推荐:西红柿的创新做法,西红柿最营养健康的吃法 雷人学生小明VS 他的幽默老师爱上就不会轻易放弃的星座准妈妈早餐应该吃什么,简单又营养的孕妇早餐 矮个子这样穿,秒变大长腿穿衣搭配口诀矮个子女生穿什么鞋子汽车上这些设计原来是这样考虑!身边有4种朋友,生活才会越来越好(经典)你能控制情绪,才能控制人生这39个高分词,让你的英语作文每次20+,太有用了! 学会十句英语作文法,10分钟内拿满分!。
二、燃烧热和中和热的比较精美句子1、善思则能“从无字句处读书”。
读沙漠,读出了它坦荡豪放的胸怀;读太阳,读出了它普照万物的无私;读春雨,读出了它润物无声的柔情。
读大海,读出了它气势磅礴的豪情。
读石灰,读出了它粉身碎骨不变色的清白。
2、幸福幸福是“临行密密缝,意恐迟迟归”的牵挂;幸福是“春种一粒粟,秋收千颗子”的收获. 幸福是“采菊东篱下,悠然见南山”的闲适;幸福是“奇闻共欣赏,疑义相与析”的愉悦。
幸福是“随风潜入夜,润物细无声”的奉献;幸福是“夜来风雨声,花落知多少”的恬淡。
幸福是“零落成泥碾作尘,只有香如故”的圣洁。
幸福是“壮志饥餐胡虏肉,笑谈渴饮匈奴血”的豪壮。
幸福是“先天下之忧而忧,后天下之乐而乐”的胸怀。
幸福是“人生自古谁无死,留取丹心照汗青”的气节。
3、大自然的语言丰富多彩:从秋叶的飘零中,我们读出了季节的变换;从归雁的行列中,我读出了集体的力量;从冰雪的消融中,我们读出了春天的脚步;从穿石的滴水中,我们读出了坚持的可贵;从蜂蜜的浓香中,我们读出了勤劳的甜美。
4、成功与失败种子,如果害怕埋没,那它永远不能发芽。
鲜花,如果害怕凋谢,那它永远不能开放。
矿石,如果害怕焚烧(熔炉),那它永远不能成钢(炼成金子)。
蜡烛,如果害怕熄灭(燃烧),那它永远不能发光。
航船,如果害怕风浪,那它永远不能到达彼岸。
5、墙角的花,当你孤芳自赏时,天地便小了。
井底的蛙,当你自我欢唱时,视野便窄了。
笼中的鸟,当你安于供养时,自由便没了。
山中的石!当你背靠群峰时,意志就坚了。
水中的萍!当你随波逐流后,根基就没了。
空中的鸟!当你展翅蓝天中,宇宙就大了。
空中的雁!当你离开队伍时,危险就大了。
地下的煤!你燃烧自己后,贡献就大了6、朋友是什么?朋友是快乐日子里的一把吉它,尽情地为你弹奏生活的愉悦;朋友是忧伤日子里的一股春风,轻轻地为你拂去心中的愁云。
朋友是成功道路上的一位良师,热情的将你引向阳光的地带;朋友是失败苦闷中的一盏明灯,默默地为你驱赶心灵的阴霾。