目标导航 预习导引 一 二
自主预习 合作探究 触类旁通
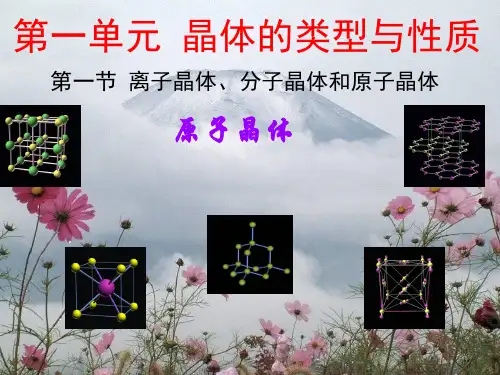
二、典型原子晶体的结构 1.金刚石 C—C—C夹角为109°28',成键碳原子采取sp3杂化。 (1)硬度最大,熔点高; (2)不溶于一般的溶剂; (3)不能导电。
2.SiO2 把金刚石晶体中的碳原子换为硅原子,每两个硅原子之间增加一 个氧原子,即成SiO2的晶体结构。
的共价键网状结构的晶体才是原子晶体。
一二
自主预习 合作探究 触类旁通
知识精要 典题例解 迁移应用
一、原子晶体的结构和性质 1.结构特点 原子晶体中原子之间以共价键形成空间网状结构,在原子晶体中不 存在单个分子。由于共价键键能较大,所以原子晶体具有较高的熔、 沸点,较大的硬度。 2.性质 由于原子晶体中原子间以共价键相连,所以原子晶体发生化学变化 时都必须破坏化学键,由于共价键的键能较大,所以原子晶体一般 熔、沸点很高,硬度很大,不同的原子晶体中共价键的键能越大,对 应的原子晶体的熔、沸点越高。
目标导航 预习导引 一 二
自主预习 合作探究 触类旁通
“具有共价键的晶体叫原子晶体”这种说法对吗?为什么? 答案:不对。如HCl、H2O、CO2、CH3CH2OH分子中都有共价键, 而它们都是分子晶体。金刚石、晶体Si、SiC、SiO2中都有共价键, 它们却都是原子晶体。只有相邻原子间以共价键相结合形成三维
自主预习 合作探究 触类旁通
一二
知识精要 典题例解 迁移应用
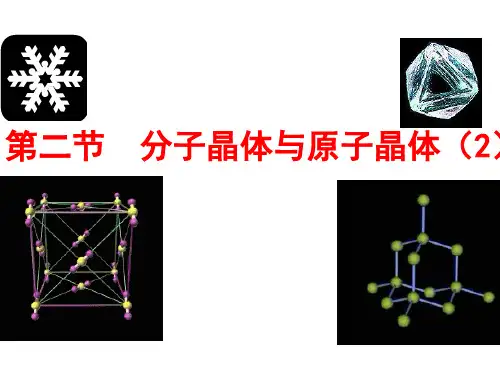
【例1】 碳化硅(SiC)晶体有类似金刚石的结构,其中碳原子和硅 原子的位置是交替的。它与晶体硅和金刚石相比较,正确的是 ( ) (导学号52700043)
A.熔点从高到低的顺序:碳化硅>金刚石>晶体硅 B.熔点从高到低的顺序:金刚石>晶体硅>碳化硅 C.三种晶体中的单元都是正四面体结构 D.三种晶体都是原子晶体且均为电的绝缘体 解析:依题意,金刚石、碳化硅和晶体硅都是原子晶体,且都有类 似于金刚石的正四面体结构单元,因为原子半径:r(C)<r(Si),所以键 长:C—C<C—Si<Si—Si,键能:C—C>C—Si>Si—Si,键能越大,原子 晶体的熔点越高,故熔点从高到低的顺序:金刚石>碳化硅>晶体硅, 三种晶体中晶体硅具有特殊性,是半导体。 答案:C