检验室洁净区沉降菌测试记录表
- 格式:doc
- 大小:39.00 KB
- 文档页数:3

洁净室沉降菌的测试方法本页仅作为文档封面,使用时可以删除This document is for reference only-rar21year.March1.目的:本文规定了洁净室沉降菌的测试方法,以达到对其空气洁净度的评定。
2. 适用范围:适用于洁净区中沉降菌的监测和对洁净区等级的验证。
3. 检测仪器:高压消毒锅、恒温培养箱。
4. 检测依据:GB/T 16294—2010医药工业洁净室(区)沉降菌的测试方法5. 测试前准备:洁净室的温度应控制在18℃~26℃,相对湿度应控制在45%~65%之间。
风速或压差的测试应符合要求。
静态测试时,室内测试人员不得多于2人。
对单向流测试应在洁净空气调节系统正常运行时间不少于10min后开始。
对非单向流测试应在洁净空气调节系统正常运行时间不少于30min后开始。
采样点数目见下表采样点的位置一般在离地面0.8m高度的水平面上均匀布置。
采样点的布置,见下图洁净室(区)采样点布置力求均匀,避免采样点在某局部区域过于稀疏。
下列采样点的图示可作参考。
洁净棚(层流罩),洁净工作台等局部空气净化设施的采样点布置:1. 水平单向流2.垂直单向流最少培养皿数:见表洁净度级别所需90mm培养皿(以沉降计)10014100002100000230000026. 测试要求:将已制备好的培养皿按要求的位置放置足够的数量,打开培养皿盖,使培养皿表面暴露,再将培养皿盖盖上后倒置。
在30℃~35℃的培养箱中培养不少于48h。
每批培养基应选三只作对照培养,以鉴别培养基本身是否有污染。
菌落计数,严防遗漏。
7. 结果计算和判断:M1+M2+……Mn平均菌落数=——————————nMn—n号培养皿菌落数n—培养皿的总数8. 结果评定:每个测点的沉降菌平均菌落数必须低于所选定的评定标准中的界限。
在静态测试时,若某测点的沉降菌平均菌落数超过评定标准,则应重新采样两次,两次测试结果均合格才能判为符合。

微生物检测一、沉降菌:用标准提及的方法收集到的活微生物粒子,通过专用的培养基,在适宜的生长条件下繁殖到可见的菌落数。
二、测试方法:采用沉降法,即通过自然沉降原理收集在空气中的生物粒子于培养基平皿(一般多采用90mm直径硼硅酸玻璃培养皿,俗称沉降碟),经若干时间,在适宜的条件下让其繁殖到可见的菌落数进行计数,以平板培养皿中的菌落数来判定洁净环境内的活微生物数,并以此来评定洁净室的洁净度。
三、采集的沉降菌为静态检测。
四、所需物料:(1)90mm培养皿:72个;(2)棉拭子:10个;五、沉降菌检测步骤:1、检测布点:生物安全柜(6个);水平层流台(6个);调配间(8个);一更(3个);二更(3个);清洗间(3个);2、通常的检测应在风机开启至少30min以上,紫外线照射30min,关闭紫外灯后开始采样。
3、将培养皿按采样点布置逐个放置,从内向外放置,摆放距离地面不低于60cm,培养皿暴露时间不得少于30min,不得大于4h。
操作台调配间一更/二更/清洗4、全部采样结束后,将二批杨敏倒置放置,随后送至检验科进行培养(2小时内送检);每批均应有培养基对照实验,检验培养基本身是否污染,可每批做对照实验,与采样皿同法操作但不需暴露采样。
5、注意事项:(1)布置采样点时,至少应尽量避免尘粒较集中的回风口,采样时,测试人员应站在采样口的下风侧,并尽量减少走动;(2)采样前应仔细检查每个培养皿的质量,如发现变质、破损或污染的应剔除;(3)采样时摆放顺序为从里向外,净化台-调配间-二更-清洗间-一更。
回收培养皿时顺序相反。
(4)从检验科取来的培养皿不用时应在冷藏柜(2-8℃)保存。
(5)净化台沉降菌检测可轮流做,不必每个净化台都做检测;(6)二更和调配间均为万级,可轮流做检测;一更和清洗间为十万级,也可轮流做检测。
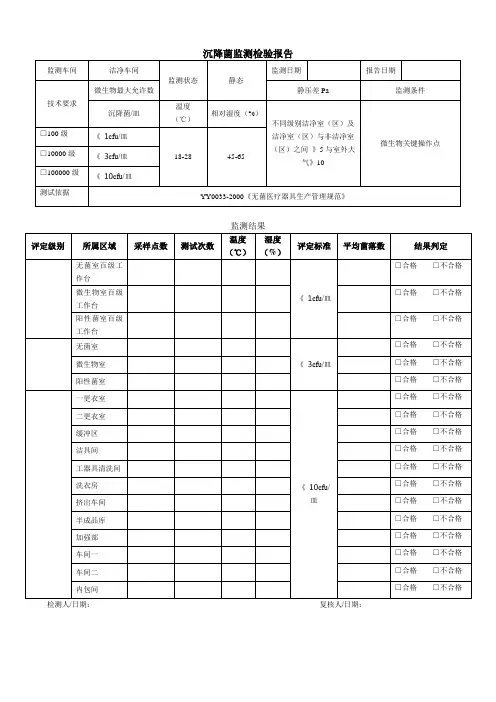
6、结果测定:(1)每个测点的沉降菌平均菌落数必须低于所选定评定标准的界限;(2)在静态测试时,若某测点的沉降菌平均菌落数超过评定标准,则应重新采样两次,两次结果均为合格才能判为符合;(3)洁净室沉降技术要求:洁净室沉降菌技术要求六、物体表面检测项目:1、物体表面检测:对静配中心洁净区内的各物体表面(操作台面、门把手、传递窗、大小推车、洁净服等)存在的病原微生物进行监控,达到规定标准,以保证所调配的输液质量。


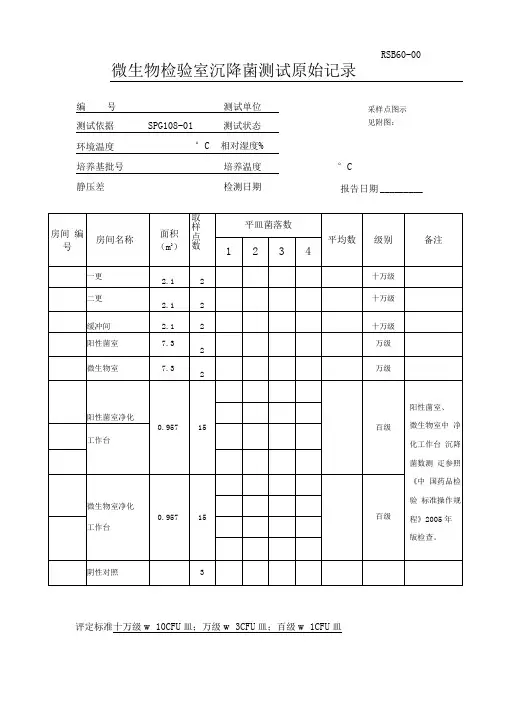
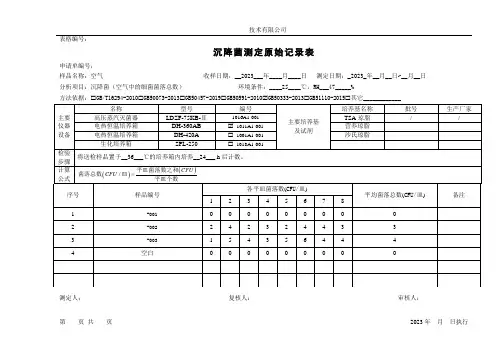
微生物检验室沉降菌测试原始记录评定标准十万级w 10CFU 皿;万级w 3CFU 皿;百级w 1CFU 皿RSB60-00°C采样点图示 见附图:报告日期 _________结 论 _______________________ 检验者 ____________ 复核者 ___________________RSB64-00固体制剂车间沉降菌测试原始记录(2)编 号______________________ 测试依据SPG108-01环境温度________________ °C培养基批号__________________ 测试单位 ______________ 测试状态 ______________ 相对湿度% _____________培养温度 ______________采样点图示 见附图:评定标准:十万级w 10CFU皿;万级w 3CFU皿;百级w 1CFU皿结论___________________检验者_________________ 复核者______________RSB63-00 固体制剂车间沉降菌测试原始记录(1 )评定标准: 十万级w 10CFU/皿; 万级w 3CFU/皿; 百级w 1CFU/皿 结 论 检验者 复核者 _____________________RSB61-00原料车间沉降菌测试原始记录编 号 ______________________ 测试单位 ________________ 测试依据SPG108-01 测试状态 _______________环境温度 _______________ ° C 相对湿度% ______________ 培养基批号 _________________ 培养温度 _________________ °C 静压差 ___________________ 检测日期 __________________ 报告采样点图示 见附图:日期评定标准:十万级w 10CFU/皿;万级w 3CFU/皿;百级w 1CFU/皿检验者复核者RSB62-00 原料车间沉降菌测试原始记录评定标准:十万级w 10CFU皿;万级w 3CFU皿;百级w 1CFU皿结论检验者复核者____________________RSB61-01 原料车间沉降菌测试原始记录编号测试单位测试依据SPG108-01 测试状态环境温度°C相对湿度% 培养基批号培养温度静压差检测日期采样点图示见附图:报告日期 _________评定标准:十万级w 10CFU/皿;万级w 3CFU/皿;百级w 1CFU/皿结论________________ 检验_______________ 复核者_______________。
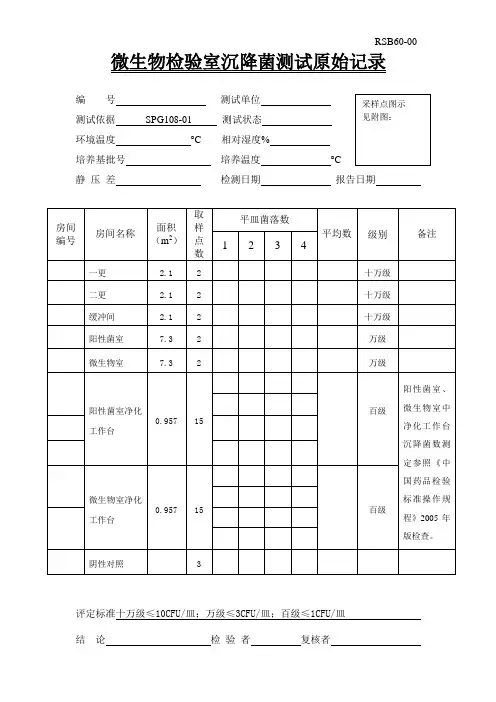
RSB60-00 微生物检验室沉降菌测试原始记录测试依据SPG108-01 测试状态环境温度°C 相对湿度%培养基批号培养温度°C静压差检测日期报告日期评定标准十万级≤10CFU/皿;万级≤3CFU/皿;百级≤1CFU/皿结论检验者复核者RSB64-00 固体制剂车间沉降菌测试原始记录(2)测试依据SPG108-01 测试状态环境温度°C 相对湿度%培养基批号培养温度°C静压差检测日期报告日期评定标准:十万级≤10CFU/皿;万级≤3CFU/皿;百级≤1CFU/皿结论检验者复核者RSB63-00 固体制剂车间沉降菌测试原始记录(1)测试依据SPG108-01 测试状态环境温度°C 相对湿度%培养基批号培养温度°C静压差检测日期报告日期评定标准:十万级≤10CFU/皿;万级≤3CFU/皿;百级≤1CFU/皿结论检验者复核者RSB61-00 原料车间沉降菌测试原始记录测试依据SPG108-01 测试状态环境温度°C 相对湿度%培养基批号培养温度°C静压差检测日期报告日期评定标准:十万级≤10CFU/皿;万级≤3CFU/皿;百级≤1CFU/皿结论检验者复核者RSB62-00 原料车间沉降菌测试原始记录测试依据SPG108-01 测试状态环境温度°C 相对湿度%培养基批号培养温度°C静压差检测日期报告日期评定标准:十万级≤10CFU/皿;万级≤3CFU/皿;百级≤1CFU/皿结论检验者复核者RSB61-01原料车间沉降菌测试原始记录编 号 测试单位 测试依据 SPG108-01 测试状态 环境温度 °C 相对湿度% 培养基批号 培养温度 °C静 压 差 检测日期 报告日期评定标准: 十万级≤10CFU/皿; 万级≤3CFU/皿; 百级≤1CFU/皿 结 论 检 验 者 复核者。

GB/T 16294--1996 医药工业洁净室(区)沉降菌的测试方法前言本标准依照国内外药品生产管理规范(GMP)的要求,非等效采用美国国家航空及宇宙航行局NASA标准NHB5340--2关于洁净室和洁净工作台微生物的控制标准&;,并参考JGJ--90洁净室施工验收规范制定。
悬浮粒子和微生物的测试是评价医药工业洁净室和洁净区空气洁净度的主要指标.本标准用沉降菌评价洁净室和洁净区空气中的微生物。
医药工业洁净室(区)沉降菌的测试应采用本标准的规定。
本标准的附录A、附录B、附录C都是标准的附录。
本标准的附录D是提示的附录。
本标准由国家医药管理局提出并归口。
本标准起草单位:上海市医药管理局药品测试所。
本标准主要起草人:钱周、步伯荪、沈建华、顾锋、唐小珍。
1、范围本标准规定了医药工业洁净室和洁净区中沉降菌的测试条件、测试方法。
本标准适用于医药工业洁净室和洁净区,无菌室或无菌区域(包括洁净工作台)的沉降菌的测定和环境的验证。
2、引用标准下列标准所包含的条文,通过在本标准中引用而构成为本标准的条文。
本标准出版时,所示版本均为有效。
所有标准都会被修订,使用本标准的各方应探讨使用下列标准最新版本的可能性。
YY/T0188.6---1995药品检验操作规程第6部分:药品生物测定法3、定义本标准采用下列定义。
3.1 洁净室(区) clean roon(area)对尘粒及微生物污染规定需进行环境控制的房间或区域。
其建筑结构、装备及其使用均具有减少对该区域内污染源的介入、产生和滞留的功能。
3.2 洁净工作台cleaning work station一种工作台或者与之类似的一个封闭围挡工作区。
其特点是自身能够供给经过过滤的空气或气体,如垂直层流置、垂直层流洁净工作、水平层流洁净工作台、自净器等。
3.3 洁净度 cleanliness洁净环境内单位体积空气中含大于或等于某一粒径的悬浮粒子的允许统计数。
3.4 菌落colony forming units细菌培养后,由一个或几个细菌繁殖而形成的一细菌集落,简称CFU。
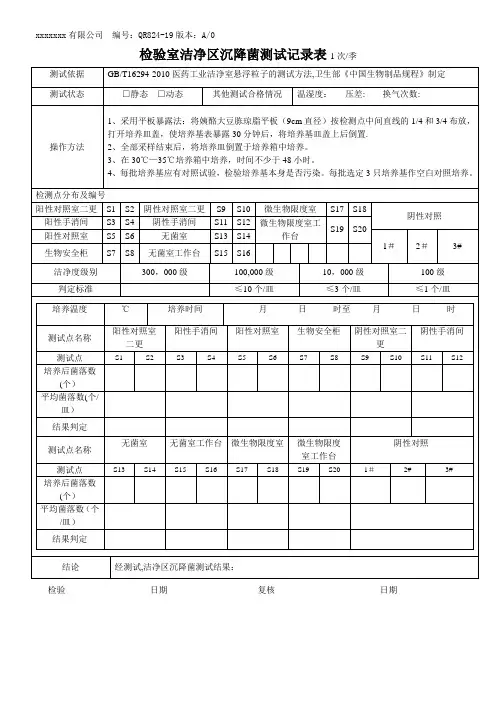
****医院静脉用药配置中心洁净区沉降菌测试方案范围适用于****医院静配中心洁净室和洁净区,无菌室或局部空气净化区域(包括洁净工作台)沉降菌测试和环境的验证。
引用文件《GB/T 16294-2010 医药工业洁净室(区)沉降菌的测试方法》测试方法1 方法提要:本测试方法采用沉降法,即通过自然沉降原理收集在空气中的生物粒子于培养基平皿,经若干时间,在适应的条件下让其繁殖到可见菌落进行计数,以平板培养皿中的菌落数来判定洁净环境内的活微生物数,并以此评定洁净室(区)的洁净度。
2 仪器2.1 培养皿培养基2.2.1培养皿一般采用90mm*15mm规格的培养皿,由医院检验科提供。
2.2.2培养基大豆酪蛋白琼脂培养基(TSA),由医院检验科制备并提供3 测试步骤3.1普通药物调配间:1.清洁调配间的所有卫生,全部工作人员离场。
2.启动调配间的净化系统自净30min,记录温度、相对湿度、风速、静压差。
开启9台水平层流洁净台紫外灯30min后,关闭紫外灯,启动水平层流洁净台的通风系统10min,记录温度、相对湿度、风速、静压差值。
3.将培养皿按采样顺序依次置于水平层流洁净台的α(如:图二),调配间的1st、2ed、3rd、4th、5th,二更室的1st、2ed、3rd,一更室的1st、2ed、3rd,清洁间的1st、2ed、3rd (如:图一),距地面0.8~1m。
4.依次打开水平层流洁净台、调配间、一更室、二更室、清洁间的培养皿盖,使培养基充分暴露0.5h。
5.依次盖上水平层流洁净台、调配间、二更室、一更室、清洁间的培养皿盖,回收培养皿。
6.将培养皿送到检验科,待检。
3.2抗生素配药间:1.清洁调配间及winnas机器人的卫生,全部工作人员离场。
2.启动调配间的净化系统,自净30min,记录温度、湿度、风速、静压差值。
开启A2型生物安全柜,winnas(1)、(2)机器人紫外灯30min,启动A2型生物安全柜及winnas机器人通风系统30min,记录风速、静压差、温度、湿度值。
文件制修订记录1.目的:洁净区是药品生产及药品微生物检测的重要场所,为确保药品生产及检测环境符合要求,因此需要对洁净区(室)、层流工作台环境进行定期监测。
2.适用范围:适用于洁净区(室)、层流工作台环境的监测。
3.职责:质量管理部QA、QC以及生产人员对本规定的实施负责。
4.内容:4.1 区域划分: D级,口服液体和口服固体制剂的暴露工序区域;C级,主要用于物料微生物检测背景区域;A级,微生物检测暴露操作区域;4.2 监测项目:尘埃粒子数、微生物、温度、相对湿度、换气次数、压差、照度;沉降菌测试按国家标准GB/T 16294-2010执行,浮游菌测试按国家标准GB/T 16293-2010执3000LX,其他工作区域不低于300LX。
行;灯检区照度应在2000~4.4 监测状态:压差、温、湿度的监测应动态测试,换气次数、尘埃粒子和微生物在静态条件下测试;照度每班需检查灯管是否完整,如发现灯管损坏或更坏需仪器检测。
4.5 洁净区空调系统,在非生产班次时,空调系统作值班运行,使室内保持正压并防止结露;4.6 各项指标监测工具、标准、监测点及监测周期见表1;4.7 空气洁净度超过标准时的纠正措施4.7.1 当空气洁净度中的悬浮粒子数量超过规定的标准时,由质量部联合设备部查明原因,如果换气次数和风速均正常,则可通过进行洁净环境重新清洁,按要求净化至少半小时,依法测定,应符合规定;如属过滤器问题,由设备部对初效、中效过滤器进行处理或更换高效过滤器;4.7.2 当微生物数量超标时,则必须对此区域进行重新进行清洁,然后重新监测,测试结果应符合规定。
4.7.3 若仍旧不符合规定,则彻底调查分析原因,并采取措施经过重新监测合格后方可继续使用或生产。
4.7.4 若相对湿度及压差不符合要求,由设备部对空气净化系统进行调整,确保符合规定要求。
4.8 当生产间断10天以上,必须在生产前对洁净室进行清洁消毒,并监测悬浮粒子及微生物,应符合规定。