二氧化硅的结构
- 格式:ppt
- 大小:1.54 MB
- 文档页数:7

二氧化硅的晶体结构
二氧化硅是正四面体空间网状结构。
SiO2晶体有多种晶型,其基本结构单元是四面体,每个Si周围结合4个O,Si 在中心,O在四个顶角;最小环上有6个硅原子和六个氧原子。
许多这样的四面体又通过顶角的O相连接,每个O为两个四面体所共有,即每个O与2个Si相结合。
实际上,SiO2晶体是由Si和O按1:2的比例所组成的立体网状结构的晶体。
因此,通常用SiO2来表示二氧化硅的组成。
扩展资料:制造玻璃、石英玻璃、水玻璃、光导纤维、电子工业的重要部件、光学仪器、工艺品和耐火材料的原料,是科学研究的重要材料。
除此之外,二氧化硅还可以作为润滑剂,是一种优良的流动促进剂,主要作为润滑剂、抗粘剂、助流剂。
特别适宜油类、浸膏类药物的制粒,制成的颗粒具有很好的流动性和可压性。
还可以在直接压片中用作助流剂。

SiO2晶体结构描述
二氧化硅晶体中,硅原子的4个价电子与4个氧原子形成4个共价键,硅原子位于正四面体的中心,4个氧原子位于正四面体的4个顶角上。
化学式SiO2,式量60.08。
也叫硅石,是一种坚硬难溶的固体。
它常以石英、鳞石英、方石英三种变体出现。
从地面往下16千米几乎65%为二氧化硅的矿石。
天然的二氧化硅分为晶态和无定形两大类,晶态二氧化硅主要存在于石英矿中。
纯石英为无色晶体,大而透明的棱柱状石英为水晶。
二氧化硅是硅原子跟四个氧原子形成的四面体结构的原子晶体,整个晶体又可以看作是一个巨大分子,SiO2是最简式,并不表示单个分子。
二氧化硅晶内Si原子均以sp3杂化,分别与4个O原子成键,构成Si-O四面体(如图B所示)并占据四面体中心位置,配位数为4;O位于四面体的角顶。
如图A、B所示的SiO
晶体结构属于等轴晶系,对称型为3L44L36L29PC,点
2
群为m-3m,空间群为中心对称。
在二氧化硅晶胞中,有8个硅原子位于立方晶胞的8个角顶,有6个硅原子位于晶胞的6个面心,还有4个硅原子与16个氧原子在晶胞内构成4个硅氧四面体,它们均匀错开排列于晶胞内。
通过电负性数据计算可知,在二氧化硅晶体中,Si-O键各含50%共价键和50%离子键。
Si与4个O共用4个电子,所以化合价为+4;O的化合价则为-2。
二氧化硅晶体中,由于Si的sp3杂化致使4个Si-O键键能相同,Si-O四面体没有极化和畸变,结构稳定。
Si-O四面体通过共用角顶的O连接,在空间形成三维网状结构。

二氧化硅的晶体结构二氧化硅的晶体结构是原子组成的,硅原子有四个最外层电子,硅原子核带正电荷,质子带负电荷。
你会好奇吧!质子和电子到底谁带正电呢?这么说吧:如果你想把一块石头放在热水里煮,你只要使它稍微融化一点儿,就可以了。
而且,再加点盐就更容易煮沸了。
这是因为石头里含有许多杂质——金属离子、有机物等等。
当这些杂质遇到高温后,就变成了气体,升上来了。
石头被烧得通红通红的,表面变得非常光滑,能当镜子用。
另外,热水煮沸后还会产生大量的水蒸气,变成小水珠挂在石头表面上,还有许多小泡泡冒出来,多美啊!不仅石头可以通过热水煮沸变软,我们人类也能通过热水煮沸变软呢!比如:身体感觉僵硬时,将手浸泡在热水中一段时间,让肌肉得到舒缓,然后再拿起来,会发现整只手都很软。
98 ℃时,骨头里的钙开始熔化,镁开始蒸发, 99 ℃时,骨头里的骨髓都化成了液体,人体软化的速度越来越快。
10 ℃左右时,皮肤和肌肉已经没有什么活力了,像没有骨头的软木塞一样,全身变得极其松软。
100 ℃时,肌肉里的所有蛋白质都消失了,脂肪也融化了。
23 ℃时,二氧化硅从固态变成了液态, 100 ℃时,它又变成了气态。
但这种气体只要遇到一点水蒸气,它又会变成坚硬的固体。
为什么会出现这样奇怪的现象呢?这是因为二氧化硅的原子是由四个电子构成的,是个很稳定的结构。
其中,每个硅原子都有四个电子,但原子外围却被一层强大的共价键紧紧地包裹着。
当温度超过临界点时,分子间的吸引力大于分子内部的排斥力,分子间相互结合,形成许许多多的聚合物,不易散开。
形成了不可摧毁的物体。
加热后,原子间的键被破坏,聚合物变成了原来的单个分子,即二氧化硅。
二氧化硅是一种半导体材料,电阻率很小,仅为金刚石的十万分之一。
这意味着我们可以用它做许多器件,而且体积很小,具有优良的电学性能。
例如:日光灯中,就是利用了它良好的导热性能。
而用来制造太阳能电池的基本材料,就是它。
二氧化硅很少单独使用,多数用来制造高性能玻璃,作为制造太阳能电池的重要原料,它广泛应用于建筑、运输、国防、冶金、仪器、纺织、食品等领域。

(2)乙酸与醇反应生成乙酸酯,若产物为(CCH 3O O n R ,变式为(CH 2CO )n ·R (OH )n ,从式子可看出,生成的酯比相应的醇的分子量增加42n ,若为一元醇则增加42。
五、从反应前后碳链结构看在下列一系列变化中,分子中的碳链结构不变化:醇醛羧酸酯所以酯中酯键两侧的碳骨架仍保持着醇的碳骨架和酸的碳骨架。
醇与它自身氧化成的羧酸酯化反应生成的酯,酯键两侧碳数相同,碳骨架也相同。
六、从酯的特殊性看甲酸酯中仍有醛基:HC OO R ,所以甲酸酯能够发生银镜反应,等等,表现出醛的一些性质,同时它有酯的通性。
另外,甲酸酯水解生成甲酸或甲酸盐,所以其产物仍能发生银镜反应。
二氧化硅晶体结构湖南衡阳县一中(421200) 陈吉秋 一、二氧化硅晶体平面示意图高级中学课本化学第二册P6有二氧化硅晶体平面示意图(见图1)。
该图说明二氧化硅不是由单个“SiO 2”的分子所组成的分子晶体,而是一种原子晶体。
一个Si 原子跟4个O 原子形成4个共价键。
同时,一个氧原子又跟两个Si 原子形成两个共价键。
但该图也有两处不足:①该图并没有反映出二氧化硅真实的三维空间结构。
②该图中最小环上是4个Si 原子与4个O 原子交替连结,而实际上二氧化硅晶体中,最小环上是6个Si 原子与6个O 原子交替连接。
二、二氧化硅晶体空间结构1.硅晶体结构硅晶体结构与金刚石结构相似(见图2),在硅晶体中,每个硅原子都被相邻的4个硅原子包围,处于4个硅原子的中心,以共价键跟这4个硅原子结合,成为正四面体结构,这些正四面体结构向空间发展,构成一种坚实的,彼此联结的空间网状晶体。
2.二氧化硅晶体结构如果在硅的晶体结构示意图中,将所有的Si -Si 键断裂,再在Si 原子与Si 原子之间连一个原子(每个O 原子形成的两个Si -O 键的键角不是180°)就可得到二氧化硅晶体结构示意图(见图3)。
因此,在二氧化硅晶体中,每个硅原子被相邻的4个氧原子包围,处于4个O 原子中心,以共价键跟这4个氧原子结合,成为正四面体结构(见图4)。

二氧化硅的性质探秘1.二氧化硅的存在在自然界中,二氧化硅在地壳中广泛存在,主要存在硅石、石英、硅藻、水晶、沙子里,以结晶形和无定形两种形态广泛存在自然界里。
无色透明的六棱柱形、末端具有六面角锥的晶体,叫水晶;普通的黄沙是含铁化合物的石英,石英也是花岗石、片麻石等的组分之一。
硅藻土是一种无定形态的二氧化硅,它是死亡的硅藻和其他微小生物的遗体,经沉积胶结成为多孔、质轻、松软的固体物质,表面积很大,吸附能力很强。
2.二氧化硅的结构、物理性质和化学性质:⑴二氧化硅的结构:晶体二氧化硅是硅原子和氧原子以共价键形成立体网状的晶体,晶体中不存在单个的二氧化硅分子,二氧化硅的硅原子处于正四面体的中心,分别以共价单键跟处于正四面体顶角的4个氧原子结合形成[SiO4]正四面体,Si-O键在空间重复,形成体型“大分子”。
晶体中,最小的环上有6个硅原子和6个氧原子,共12个原子,硅氧原子个数比为1:2,所以组成最简式为SiO2,晶体中不存在单个的分子。
⑵物理性质:二氧化硅晶体是一种坚硬、有脆性、不导电、难熔(熔点1710℃)也难溶于水的无色固体。
⑶化学性质:二氧化硅是硅酸的酸酐,但其不能与水反应生成硅酸。
由于硅氧键较牢固,化学性质十分稳定。
是一种酸性氧化物,具有酸性氧化物的一些性质,如在高温下能与碱性氧化物、碱、纯碱等起反应而生成硅酸盐;二氧化硅不与一般的酸反应,有较好的抗酸性,但能被氢氟酸腐蚀,所以人们常用氢氟酸来雕刻玻璃;能被强还原剂(碳)在高温下还原得粗硅。
有关反应如下:SiO2+4HF= SiF4↑+2H2OSiO2+2NaOH= Na2SiO3+2H2OSiO2+Ca(OH)2=CaSiO3+H2OSiO2+CaO ==高温== CaSiO3SiO2+2C ==高温== Si+2CO↑SiO2+ Na2CO3 ==高温== Na2SiO3+CO2↑SiO2+ CaCO3==高温== CaSiO3+ CO2↑SiO2+ Na2SO3==高温== Na2SiO3+SO2↑3.二氧化硅的用途(1)SiO2是制造光导纤维的主要原料。

二氧化硅的结构和组成二氧化硅,化学式为SiO2,是一种广泛存在于自然界中的化合物。
它是地球上最普遍的物质之一,也是大自然中最基础的化学元素之一。
由于它的普遍存在及具有多种独特的物理化学性质,二氧化硅在科技、工业、医学等领域都发挥着巨大的作用。
在本文中,我们将详细了解二氧化硅的结构和组成,并探究其在各种领域中的重要应用。
结构和组成二氧化硅的结构和组成是由硅原子和氧原子组成的。
在其晶体形态下,硅原子和氧原子采取一定的空间排列方式,形成SiO4的四面体单元,单元之间通过共享氧原子连接在一起,构成了稳定结构。
这种结构因硅原子与氧原子之间的杂化成键而获得了强烈的化学键合。
同时,二氧化硅在自然界中还存在于多种形态。
除了固态晶体结构外,像石英、玻璃等二氧化硅也存在于非晶态形式中,并且其物理性质与晶体结构有较大的差异。
根据这些特征,科学家们也将二氧化硅分为晶质与非晶质两大类。
其中,晶质结构附带有很强的特异性和规律性,是材料科学、物理化学领域应用最广泛的类型。
应用领域二氧化硅广泛存在和应用于各领域。
在只有有节制地使用的前提下,它对环境和健康危害较小,可以通过物理或化学方法与其他物质掺杂,形成各种不同性质的新材料和新产品。
材料科学晶体二氧化硅具有独特的物理和化学性质,因此它在材料科学领域中占有非常重要的地位。
通过控制晶体二氧化硅的结构、形状和纯度,可以制备出各类高科技材料。
例如,硅片可以被制作成电子元件、光电器件、晶体管、计算机芯片等电子产品。
在建筑行业中,二氧化硅作为建筑物外墙保温材料、玻璃纤维建材等中的重要组成部分,其防火、防水等特性得到大量应用。
食品与制药作为增稠剂、乳化剂、润滑剂、抗结剂等,二氧化硅在食品制造和制药行业中有着广泛的应用。
通过这些作用,二氧化硅可以改善药品和食品的加工性能,同时保证其更加适合消费者味蕾和身体。
另外,一种名为“硅藻土”的物质,是由海洋中的藻类死亡后形成的,经过治理后可以提取出二氧化硅等多种有用化合物,广泛应用于食品和化妆品等领域。

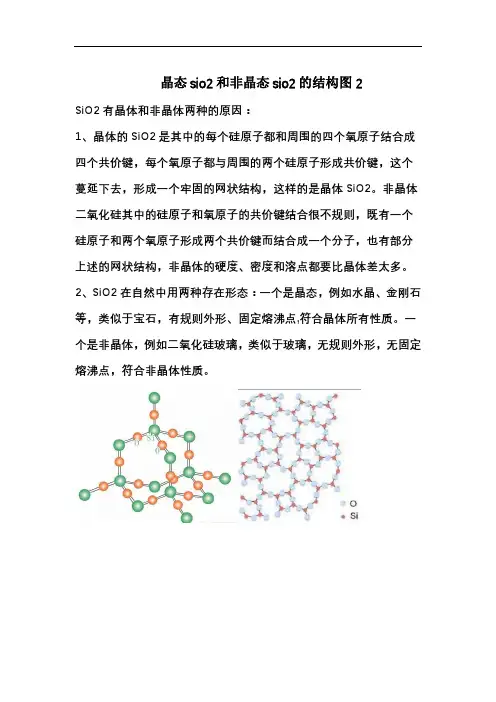
晶态sio2和非晶态sio2的结构图2
SiO2有晶体和非晶体两种的原因:
1、晶体的SiO2是其中的每个硅原子都和周围的四个氧原子结合成四个共价键,每个氧原子都与周围的两个硅原子形成共价键,这个蔓延下去,形成一个牢固的网状结构,这样的是晶体SiO2。
非晶体二氧化硅其中的硅原子和氧原子的共价键结合很不规则,既有一个硅原子和两个氧原子形成两个共价键而结合成一个分子,也有部分上述的网状结构,非晶体的硬度、密度和溶点都要比晶体差太多。
2、SiO2在自然中用两种存在形态:一个是晶态,例如水晶、金刚石等,类似于宝石,有规则外形、固定熔沸点,符合晶体所有性质。
一个是非晶体,例如二氧化硅玻璃,类似于玻璃,无规则外形,无固定熔沸点,符合非晶体性质。

1摩尔二氧化硅的球棍模型一、引言二氧化硅是一种常见的无机化合物,由硅和氧两种元素组成。
它的化学式为SiO2,是一种无色无味的固体。
本文将以1摩尔二氧化硅的球棍模型为切入点,介绍二氧化硅的结构、性质及其在日常生活中的应用。
二、二氧化硅的结构二氧化硅的球棍模型由硅原子和氧原子构成。
硅原子是一个大球,氧原子是一个小球。
在球棍模型中,每个硅原子以共价键与四个氧原子相连,形成了一个四面体结构。
每个氧原子也以共价键与两个硅原子相连,使得硅原子和氧原子交替排列,形成了稳定的网络结构。
三、二氧化硅的性质1. 物理性质:二氧化硅是一种高熔点的固体,熔点约为1713℃,沸点约为2230℃。
它具有高热稳定性和高电绝缘性,可以在高温环境下长期稳定存在。
2. 化学性质:二氧化硅是一种无机物,不溶于水和大多数有机溶剂。
它具有良好的化学稳定性,不易与其他物质发生反应。
然而,在一些特殊条件下,如浓碱溶液中,二氧化硅可以与一些金属离子形成络合物。
3. 结构性质:二氧化硅的球棍模型呈现出一种三维网状结构,其中硅原子和氧原子通过共价键连接在一起。
这种结构使得二氧化硅具有高硬度、高强度和高耐磨性。
同时,由于硅-氧键的极性,二氧化硅还具有一定的电性质。
四、二氧化硅的应用1. 工业应用:二氧化硅是一种重要的工业原料,广泛应用于玻璃制造、陶瓷制造、水泥生产等领域。
由于其高熔点和高硬度,二氧化硅可以增加材料的硬度和耐磨性,提高产品的品质。
2. 化妆品行业:二氧化硅常用作化妆品中的填充剂和吸油剂。
它可以提供产品的质感和稳定性,并具有吸附油脂的作用,使肌肤保持清爽。
3. 食品工业:二氧化硅被用作食品中的防潮剂和增稠剂。
它可以吸湿和防止食品变质,同时还可以增加食品的稠度和质感。
4. 医疗应用:二氧化硅在医疗领域中有广泛的应用。
它可以作为药物载体,用于药物的缓释和控制释放。
此外,二氧化硅还可以用于制备生物材料,如人工骨骼和人工关节等。
五、结论通过对1摩尔二氧化硅的球棍模型的介绍,我们了解了二氧化硅的结构、性质及其在不同领域的应用。

二氧化硅晶格常数
二氧化硅(SiO2)是一种重要的无机化合物,广泛应用于各种领域。
晶体的晶格常数是描述晶体结构的重要参数之一。
二氧化硅的晶体结构属于非常典型的四面体型硅氧网状结构。
在这种结构中,硅原子和氧原子交替排列形成四面体型的结构单元,构成了一个三维的网状结构。
二氧化硅的晶体结构常数包括晶格常数a、b、c和晶胞角度α、β、γ。
其中,a、b、c分别表示晶胞在三个晶轴方向上的长度,α、β、γ表示三个晶轴之间的夹角。
对于二氧化硅,其晶格常数为a=b=0.491 nm,c=0.540 nm,α=β=γ=90°。
需要注意的是,晶格常数是晶体物理性质的重要参数之一,它不仅与晶体的结构有关,还与其性质密切相关。
因此,在应用中需要对晶格常数进行准确的测量和分析。

二氧化硅类型
二氧化硅类型
二氧化硅是一种常见的无机化合物,也是地球上最常见的化合物之一。
它有许多不同的形式和用途。
在本文中,我们将探讨几种不同类型的
二氧化硅。
晶体二氧化硅
晶体二氧化硅是一种高度有序的结构,具有非常明显的晶体结构。
它
通常以石英、玻璃和其他矿物形式存在。
晶体二氧化硅具有非常高的
熔点和沸点,并且在高温下非常稳定。
它还具有一些特殊的电学性质,使其成为电子器件中广泛使用的材料。
非晶态二氧化硅
与晶体二氧化硅相比,非晶态二氧化硅没有明显的长程有序性。
相反,它是由大量小团块组成的无规则结构。
这使得非晶态二氧化硅比其晶
体形式更加柔软和可塑,并且可以用于制造各种各样的产品,如光纤、涂料、垫片等。
纳米颗粒二氧化硅
纳米颗粒二氧化硅是指其直径小于100纳米的二氧化硅颗粒。
由于其
极小的尺寸和特殊的表面性质,纳米颗粒二氧化硅具有许多独特的性质,如增强材料的强度和硬度、改善润滑剂的性能、提高药物吸收率等。
多孔二氧化硅
多孔二氧化硅是指其结构中存在大量孔隙和空隙的二氧化硅。
这些孔
隙可以通过控制制备条件来调节大小和形状,并且可以用于吸附、分离、催化等应用中。
多孔二氧化硅还可以作为载体来支持其他催化剂
或药物分子。
总结
在本文中,我们介绍了几种不同类型的二氧化硅,包括晶体二氧化硅、非晶态二氧化硅、纳米颗粒二氧化硅以及多孔二氧化硅。
每种类型都
具有不同的特点和应用,这使得它们成为许多不同行业中广泛使用的
材料。
二氧化硅能带结构二氧化硅是一种重要的无机材料,具有广泛的应用领域。
在理解二氧化硅的性质和应用中,了解其能带结构是至关重要的。
本文将介绍二氧化硅的能带结构以及相关的理论基础。
一、能带理论简介能带理论是固体物理学中的一个重要理论,用于描述固体材料中电子的能量分布和导电特性。
根据能带理论,固体中的电子被分布在一系列能量带中,称为能带。
在这些能带之间存在禁带,即能量间隔,正是这种禁带结构的存在使得固体物质表现出不同的导电性质。
二、二氧化硅的晶体结构二氧化硅的晶体结构可以大致分为两类,分别是石英结构和滑石结构。
石英结构是β-二氧化硅晶体的一种亚稳结构,它由SiO4四面体构成,中心的硅原子和周围的四个氧原子相连。
滑石结构是二氧化硅的一种高压相,由Si2O7四面体构成。
三、二氧化硅的能带结构了解二氧化硅的能带结构对于研究其导电性质和光学性质至关重要。
二氧化硅的能带结构与其晶体结构密切相关。
根据理论计算和实验研究,二氧化硅的能带结构具有以下特点:1. 禁带宽度:二氧化硅的禁带宽度较大,约为9电子伏特。
这使得二氧化硅具有较好的绝缘性能,适用于制备绝缘材料。
2. 价带和导带:根据能带理论,电子占据能量较低的价带,而导电需要电子跃迁到能量较高的导带。
在二氧化硅中,价带主要由氧原子的2p轨道形成,导带主要由硅原子的3p轨道形成。
3. 能带形态:由于二氧化硅的晶体结构的不同,其能带结构也会有所差异。
石英结构的二氧化硅具有较为复杂的能带结构,而滑石结构的二氧化硅较为简单。
四、二氧化硅的应用二氧化硅作为一种重要的无机材料,具有广泛的应用领域。
基于对其能带结构的理解,可以进行以下应用探索:1. 绝缘材料:由于二氧化硅的较大禁带宽度,它具有优异的绝缘性能,常被用作绝缘材料。
例如,二氧化硅可用于制备绝缘薄膜,用于电子元件的绝缘保护。
2. 光电材料:二氧化硅在光学领域有着广泛应用。
通过调控二氧化硅的能带结构和光学性质,可以制备光波导器件、光纤传感器等。
二氧化硅晶体结构模型一、引言二氧化硅是一种常见的无机化合物,具有广泛的应用领域。
它在材料科学、化学、电子工程、光学等领域都有重要的应用。
二氧化硅的晶体结构模型是研究其性质和应用的基础。
二、晶体结构基础知识1. 晶体结构定义晶体是由原子或分子按照一定规律排列而成的固态物质,其结构具有周期性和三维性。
2. 晶体结构分类晶体结构按照其周期性可以分为点阵和空间点阵两类;按照原子或分子间排列方式可以分为简单立方晶系、面心立方晶系、体心立方晶系等七类。
3. 晶格与晶胞晶格是指由重复排列的点组成的空间点阵,它描述了整个晶体中原子或分子之间的关系。
而晶胞则是指最小重复单元,在三维空间中由三个互相垂直的轴和长度确定。
三、二氧化硅晶体结构模型1. 二氧化硅基本信息二氧化硅(SiO2)是一种无机化合物,由硅和氧组成。
其晶体结构为立方晶系,空间群为P3121或P3221。
2. 二氧化硅晶体结构模型二氧化硅的晶体结构是由SiO4四面体和O-Si-O链构成的。
SiO4四面体是指一个硅原子周围有四个氧原子组成的正四面体,它们共享顶点形成了一种三维网状结构。
而O-Si-O链则是指一个氧原子与两个相邻的硅原子之间形成的链状结构。
3. 二氧化硅晶胞参数二氧化硅的晶胞参数为a=b=c=0.491 nm,α=β=γ=90°。
四、二氧化硅晶体结构模型应用1. 材料科学领域二氧化硅在材料科学中具有重要应用价值,如在光学玻璃、陶瓷、电子器件等领域都有广泛应用。
2. 化学领域二氧化硅也被广泛应用于催化剂、吸附剂等领域。
3. 光学领域由于其高折射率和低散射率,在光学领域中也有重要应用,如透镜、棱镜等。
五、结论二氧化硅晶体结构模型是研究其性质和应用的基础。
了解其晶体结构模型对于理解其性质和应用具有重要意义。