云南省师范大学附属中学高三高考适应性月考卷(六)理综化学试题
- 格式:doc
- 大小:863.35 KB
- 文档页数:8

云南省高三上学期高考适应性月考卷(六)化学试题 Word 版含答案7.化学与生活和生产亲密有关。
以下说法正确的选项是A. 臭氧 -生物活性碳用于自来水的深度水办理,利用了活性碳的复原性B.被蜂蚊蛰咬后,可涂抹稀氨水或小苏打溶液减少痛苦C.向汽油中增添甲醇后,该混淆燃料的热值不变D.氢氧化铝可作塑料的阻燃剂,由于它受热融化放出大批的热8.N A为阿伏加德罗常数,以下说法正确的选项是A. 标准状况下, 22.4L NO 和 11.2LO 2 混淆后气体的分子总数为 N AB.1L1mol · L -1的 Na2CO3溶液中含有的阴离子数量大于N AAC.100mL 112mol · L-1浓盐酸与足量的MnO 2共热,转移的电子数为 0.6ND. 所含共价键数均为0.4N A的白磷 (P4)和甲烷的物质的量相等9.按如图 1 所示装置进行实验,以下说法不正确的选项是A.利用图甲装置,能够防备铁钉生锈B.利用图乙装置,能够用乙醇和浓硫酸制备乙烯C.利用图丙装置,能够加热NH 4Cl 固体系 NH 3D. 利用图丁装置,能够研究Ca(OH)2的溶解度随温度的变化10.俗称“一滴香”的有毒物质被人食用后会损害肝脏,还可以致癌。
“一滴香”的分子构造如图 2 所示,以下说法不正确的选项是A.1mol 该有机物最多能与3mol H 2发生加成反响B. 该有机物能与Na 反响C.该有机物能发生取代、加成、氧化和复原反响D.该有机物的一种芬芳族同分异构体能发生银镜反响11.一种全天候太阳能电池的工作原理如图3 所示,以下说法正确的选项是A. 光照时, b 极四周 pH 增大B. 光照时, H +由 a 极室透过质子膜进入 b 极室C.夜间无光照时, a 极的电极反响式为V 2+-e- = V 3+D. 该电池与硅太阳能供电原理同样12.图 4 是从元素周期表中截取的一部分,已知X 、Y 、Z、 W 为四种短周期主族元素,以下说法正确的选项是A. 四种元素的原子有可能均能与氢原子形成18 电子分子B. Z 元素可能为金属C. Z 的原子半径不必定比Y 的原子半径大D. W 的原子序数不行能是X 的原子序数的 3 倍13.化学上常用 AG 表示溶液的lg c(H )。
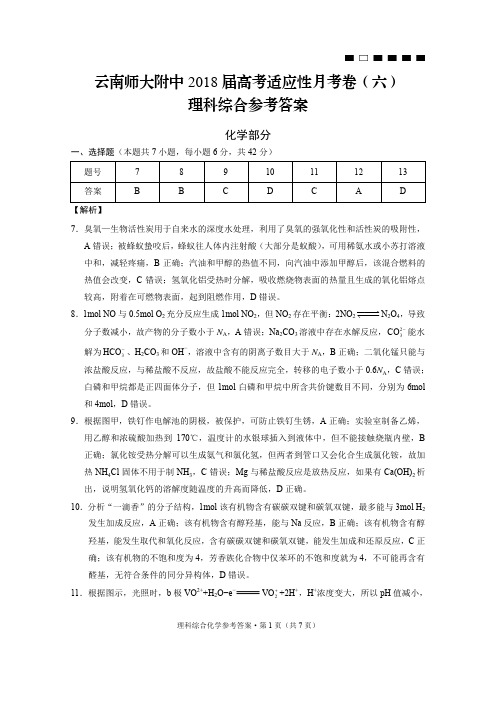
理科综合化学参考答案·第1页(共7页)云南师大附中2018届高考适应性月考卷(六)理科综合参考答案化学部分一、选择题(本题共7小题,每小题6分,共42分) 题号 7 8 9 10 11 12 13 答案 B B C D C A D 【解析】7.臭氧—生物活性炭用于自来水的深度水处理,利用了臭氧的强氧化性和活性炭的吸附性,A 错误;被蜂蚁蛰咬后,蜂蚁往人体内注射酸(大部分是蚁酸),可用稀氨水或小苏打溶液中和,减轻疼痛,B 正确;汽油和甲醇的热值不同,向汽油中添加甲醇后,该混合燃料的热值会改变,C 错误;氢氧化铝受热时分解,吸收燃烧物表面的热量且生成的氧化铝熔点较高,附着在可燃物表面,起到阻燃作用,D 错误。
8.1mol NO 与0.5mol O 2充分反应生成1mol NO 2,但NO 2存在平衡:2NO 2 N 2O 4,导致分子数减小,故产物的分子数小于N A ,A 错误;Na 2CO 3溶液中存在水解反应,23CO -能水解为3HCO -、H 2CO 3和OH −,溶液中含有的阴离子数目大于N A ,B 正确;二氧化锰只能与浓盐酸反应,与稀盐酸不反应,故盐酸不能反应完全,转移的电子数小于0.6N A ,C 错误;白磷和甲烷都是正四面体分子,但1mol 白磷和甲烷中所含共价键数目不同,分别为6mol 和4mol ,D 错误。
9.根据图甲,铁钉作电解池的阴极,被保护,可防止铁钉生锈,A 正确;实验室制备乙烯,用乙醇和浓硫酸加热到170℃,温度计的水银球插入到液体中,但不能接触烧瓶内壁,B 正确;氯化铵受热分解可以生成氨气和氯化氢,但两者到管口又会化合生成氯化铵,故加热NH 4Cl 固体不用于制NH 3,C 错误;Mg 与稀盐酸反应是放热反应,如果有Ca(OH)2析出,说明氢氧化钙的溶解度随温度的升高而降低,D 正确。
10.分析“一滴香”的分子结构,1mol 该有机物含有碳碳双键和碳氧双键,最多能与3mol H 2发生加成反应,A 正确;该有机物含有醇羟基,能与Na 反应,B 正确;该有机物含有醇羟基,能发生取代和氧化反应,含有碳碳双键和碳氧双键,能发生加成和还原反应,C 正确;该有机物的不饱和度为4,芳香族化合物中仅苯环的不饱和度就为4,不可能再含有醛基,无符合条件的同分异构体,D 错误。

理科综合试卷(化学部分)可能用到的相对原子质量:H-1 C-12 O-16一、选择题:本题共13小题,每小题6分。
在每小题给出的四个选项中,只有一项是符合题目要求的。
7.化学与生产、生活、环境密切相关。
下列说法错误的是A.手机外壳上贴的碳纤维外膜是一种新型的无机非金属材料B.“煮豆持作羹,漉菽以为汁。
萁在釜下燃,豆在釜中泣”,文中“漉”涉及的化学实验基本操作是过滤C.二氧化硫有毒所以不能作食品防腐剂D.新能源汽车的推广与使用有助于减少光化学烟雾的产生8下列关于 (螺[2,2]戊烷)的说法正确的是A.一氯代物的结构只有一种B.与戊烯互为同分异构体C.所有碳原子均处同一平面D.能使酸性高锰酸钾溶液褪色9.第三周期的元素X、Y、Z、W的最高价氧化物溶于水可得四种溶液,常温下,0.010ml/L的这四种溶液pH 与该元素原子半径的关系如图3所示。
下列说法错误的是A.简单离子半径:Y>Z>W>XB.Y元素存在同素异形体C.气态氢化物的稳定性:Y>Z>WD.X和Y的最高价氧化物对应的水化物恰好中和时,溶液呈碱性10.常温下,在下列溶液中一定能大量共存的离子组是A.含有0.1mol·L-1Fe2+的溶液:Na+、ClO-、SO42-、Cl-B.滴加石蕊试剂呈红色的溶液:Na+、Al3+、SO42-、Cl-C.无色透明溶液:MnO4-、SO42-、K+、NO3-D.水电离产生的c(H+)=1×10-13mol·L-1的溶液:CO32-、NH4+、CI-、Ca2+11.下列有关实验室的制备方法中,不能达到实验目的的是12.新型NaBH4/H2O2燃料电池(DBFC)的结构如图4,该电池总反应方程式为NaBH4+4H2O2===NaBO2+6H2O,下列有关说法错误的是A.放电过程中,Na+向B极区迁移B.电池A极区的电极反应式为BH4-+8OH――8e-===BO2-+6H2OC.外电路中,电子的流向为B经过导线到AD.在电池反应中,每消耗1L 6mol·L-1H2O2溶液,理论上流过电路中的电子数为12N A13.常温下,K sp(CaF2)=4x10-9,K sp(CaSO4)=9.1×10-6。

云南师大附中2014届高考适应性月考卷(六)理科综合化学参考答案7 8 9 10 11 12 13C AD C C B D7.C选项料酒的主要成分为乙醇,与水垢的主要成分碳酸钙不反应。
8.B选项氯乙烯不属于烃;C选项苯与溴水不反应;D选项油脂不属于高分子化合物。
9.A选项Fe3+、I-发生氧化还原反应;B选项MnO-4有色且不与SO2−3共存;C选项 Al3+与CO2−3发生双水解反应;D选项能共存。
10.A选项氢氧化钠溶液的pH变化大;B选项铁作负极;C选项正确;D选项还可能是SO2−3。
11.a的最高价氧化物对应的水化物是H3PO4为弱酸;同周期元素从左到右,气态氢化物的稳定性逐渐增强,原子半径逐渐减小,B、D项错误;答案为C项。
12.A选项pH的大小关系为②>③>①;B选项根据电荷守恒和物料守恒进行运算,正确;C选项c(CH3COO-)<c(Na+);D选项实际为Na2CO3溶液,故正确的表达式为c(Na+)=2c(HCO−3)+2c(H2CO3)+2c(CO2−3)。
13.根据题干和图象,a曲线为NaOH与HCl的反应,b和c曲线为Na2CO3与HCl反应产生NaHCO3的过程。
由纵坐标可知,Na2CO3、NaOH的物质的量均为0.05mol,NaOH完全反应时,消耗HCl溶液50mL,故HCl溶液的浓度为1mol·L−1。
D选项反应时有气泡产生。
26.(除特殊标注外,每空2分,共15分)(1)NaClO(2)漏斗下端尖嘴未紧贴烧杯内壁(1分)(3)将试纸放在表面皿上,用玻璃棒蘸取少量待测量液,点在pH试纸上,与标准比色卡对照得出pH Fe(OH)3、Mn(OH)2(4)Na2CO3(5)MgCO 3+H 2O=====△Mg(OH)2↓+CO 2↑(6)H 2O (1分) CO 2(1分) 3MgCO 3·Mg(OH)2·3H 2O【解析】(1)为了除去Fe 2+需要选择一种氧化剂,在不影响实验效果同时考虑试剂的价格,故选择NaClO 。

理科综合参考答案·第1页(共12页)一、选择题:本题共1361 2 3 4 5 6 7 8 9 10 11 12 13二、选择题:本题共86分。
在每小题给出的四个选项中,第项符合题目要求;第6314 15 16 17 18 19 20 2112345A/a B/b212367理科综合参考答案·第2页(共12页)8221822222218222182+222224333223232323229222333103323种,但链上的两个碳碳双键存在共轭结构14加成,因此共4113434属于共价晶体,2324312242理科综合参考答案·第3页(共12页)1322032322223222332 233233223323332322 33333 23232211432332327333 5.610 1.3104.31010-4141520120121225m/s 020m/s 00理科综合参考答案·第4页(共12页)1660217根据共点力平衡和三角形定则,易知18 1920002203300200020033300300320 3.6 2.50.222121222理科综合参考答案·第5页(共12页)26022232(共174222分,共6232分,共121422 213 34210 510499213 316016.82504510499理科综合参考答案·第6页(共12页)241012)沿轴线方向液滴做匀加速直线运动。
根据牛顿第二定律有222评分标准:本题共1021 251410.022212320.4m/s2m/s评分标准:本题共1412理科综合参考答案·第7页(共12页)262015m/s 2m/s 15202012201220010.64221125 2200112232222111122222.5m/s和弹簧第一次滑上斜面过程,根据动能定理213702和弹簧第一次滑下斜面过程,根据动能定理213720.45评分标准:本题共2021理科综合参考答案·第8页(共12页)272分,共14 11 2 3451 3 6 1 2 343533 61630.2282分,共151 1 322 22223 244432324242 5656 11228244共价键,共价键数目是8432理科综合参考答案·第9页(共12页)2232+2+3232222222222364224433623424)第一步沉镁是将443324432324242 5342224324224653246001 292分,共1412242 221 30.141 321 22 0.9 1 2222422+2+102理科综合参考答案·第10页(共12页)32 2 4215 50 0 0 4 2 15 504 22222641641422210210510 14222223212222 2 4 21 4 0 0 4 2 1 4 22 2 21 4 0 0 1 4 220.840.80.640.80.16 1.4410.24 1.280.162 1.440.90.2 1.28理科综合参考答案·第11页(共12页)302分,共151 23421591631234中最多共面的原子有24225796,共9311分,共1112352322分,共1111234 4331分,共121234 2.5104 22 341分,共1012222 1 2351分,共101222334理科综合参考答案·第12页(共12页)。

云南师大附中2019届高考适应性月考卷(六)理科综合化学部分1.化学与生产、生活、环境密切相关。
下列说法错误的是A. 手机外壳上贴的碳纤维外膜是一种新型的无机非金属材料B. “煮豆持作羹,漉菽以为汁。
萁在釜下燃,豆在釜中泣”,文中“漉”涉及的化学实验基本操作是过滤C. 二氧化硫有毒所以不能作食品防腐剂D. 新能源汽车的推广与使用有助于减少光化学烟雾的产生【答案】C【解析】【详解】A项、手机外壳上贴的碳纤维外膜是一种新型无机非金属材料,故A正确;B项、煮豆持作羹,漉豉以为汁意思是煮熟豆子来做豆豉而使豆子渗出汁水,所以漉豉以为汁相当于采用了过滤的方法把豆豉和豆汁分开,故B正确;C项、二氧化硫有还原作用,可消耗果蔬组织中的氧,可以抑制氧化酶的活性,从而抑制酶性褐变,有抗氧化作用,所以二氧化硫能作食品防腐剂,但不能超量,故C错误;D项、机动车尾气含有氮的氧化物能形成光化学烟雾,新能源汽车的推广,减少了氮的氧化物,有助于减少光化学烟雾的产生,故D正确。
故选C。
【点睛】本题考查物质的性质及应用,侧重于分析与应用能力的考查,注意把握物质的性质、发生的反应、化学与生活的关系为解答该题的关键。
2.下列关于(螺[2,2]戊烷)的说法正确的是A. 一氯代物的结构只有一种B. 与戊烯互为同分异构体C. 所有碳原子均处同一平面D. 能使酸性高锰酸钾溶液褪色【答案】A【解析】【分析】由键线式可知螺[2,2]戊烷分子式与为C5H8,分子中所有碳原子均为单键饱和碳原子,碳原子上连有的氢均等效。
【详解】A项、螺[2,2]戊烷()中的氢均等效,其一氯代物只有一种,故A错误;B项、根据螺[2,2]戊烷()的键线式可知其分子式与为C5H8,戊烯的分子式为C5H10,两者分子式不同,不可能互为同分异构体,故B错误;C项、螺[2,2]戊烷()中所有碳原子分子中所有碳原子均为单键饱和碳原子,所有碳原子不可能共面,故C错误;D项、螺[2,2]戊烷()中所有碳原子均为单键饱和碳原子,不可能使酸性高锰酸钾溶液褪色,故D错误。
【最新】云南师大附属中学高三上适应性月考理综化学试卷 学校:___________姓名:___________班级:___________考号:___________一、单选题1.下列用品的主要成分及其用途对应不正确的是2.化学用语是学习化学的工具和基础。
下列有关化学用语的表达正确的是A .质量数为37的氯原子:Cl B .Al (OH )3的电离方程式:C .CO 2的结构式:O =C =OD .次氯酸分子的电子式: 3.常温下,下列各组离子在指定溶液中一定能大量共存的是A .pH =1的溶液中:Ca 2+、Fe 2+、-3NO 、2-3CO B .()-2w -=10mol/L c OH K 的溶液中:Na +、+4NH 、Cl -、-3NO C .c(Fe 3+)=0.1mol/L 的溶液中:K +、SCN -、2-4SO 、Cl -D .由水电离的c(H +)=1×10-14mol/L 的溶液中:Na +、-2AlO 、-3HCO 、OH -4.由一种阳离子与两种酸根离子组成的盐称为混盐。
如CaOCl 2是由Ca 2+、Cl 一、ClO 一组成的混盐,在酸性条件下可以产生C12。
下列有关判断不正确的是A .CaOCl 2属于混合物B 、CaOCl 2具有较强的氧化性C 、CaOCl 2的水溶液呈碱性D .CaOCl 2与硫酸反应转移1mol 电子时生成71g Cl 25.下列关于有机物的说法正确的是A.乙烷、苯、葡萄糖溶液均不能使酸性高锰酸钾溶液褪色B.CH CH和互为同系物C.乙酸乙酯在碱性条件下的水解反应称为皂化反应D.2,2一二甲基丁烷与2,4一二甲基戊烷的一氯代物种类相同6.下列有关说法正确的是A、一定条件下反应,达到平衡时,B.10mL浓度为1mol/L的盐酸与过量的Zn粉反应,若加入适量的CH3COONa溶液,既能减慢反应这率,又不影响H2的生成C.将PH=a十l的氨水稀释为pH=a的过程中,变小D.常温下,向浓度为0.1 mol/L的CH3COONa溶液中加入等体积等浓度的CH3COOH,混合溶液的pH=77.对下列实验装置图中所示的实验操作评价合理的是A.可能证明非金属性强弱:Cl>C>SiB.装置可用来制备少量氧气,并且控制反应的发生与停止C.配制一定物质的量浓度的硫酸溶液不能直接在容量瓶中进行D.制备并收集少量NO2气体二、填空题8.铁是目前人类使用量最大的金属,它能形成多种化合物.(l)工业上,向炽热铁屑中通入氯化氢可生成无水氯化亚铁,若操作不当,制得的FeCl2会含有少量FeCl3,检验FeCl3,常用的试剂是;为防止FeC12溶液中含有FeCl3,最好在FeCl2溶液中加入(2)LiFePO4(难溶于水)材料被视为最有前途的锂离子电池材料之一。
理科综合试卷化学部分可能用到的相对原子质量: H-1 C-12 N-14 O-16 Na-23 S-32 Cl-35.5 Fe-567.化学与生产生活息息相关,下列说法正确的是A.合金具有许多优良的物理、化学或机械性能,青铜是我国使用最早的合金B.煤的气化是将煤通过物理变化转化为气态的过程C.绿色化学的核心是利用化学原理处理工业生产污染物并将其转化为有用物质D.棉、麻、毛、丝完全燃烧都只生成CO 2和H 2O8.某有机化合物X 的结构简式如图3所示,下列说法正确的是A. X 中所有碳原子可能共面B.1mol X 最多消耗2mol NaOHC. X 的分子式为C 16H 12O 4。
D.X 能使酸性高锰酸钾溶液褪色9. N A 是阿伏加德罗常数的值,下列说法正确的是A.常温下,密闭容器中4mol NO 与2mol O 2完全反应,产物的分子数为4N A 、B. NH:的电子式为, 27g NH;中的电子数为12N AC.标准状况下,将22. 4L SO 4溶于水配成IL 溶液,所得H2SO 4溶液的浓度为lmol/LD.标准状况下,46g C 2H 5OH 中含有的共用电子对数目为8N A10.下列实验能达到实验目的的是11.下列离子方程式正确的是A.在强碱性溶液中,用NaClO 将Fe(OH)3氧化为高铁酸钾:2Fe(OH)3+3ClO - +4OH -=2FeO 42 -+3Cl -+5H 2OB.物质的量为 1 : 2的NH 4Al(SO 4)2溶液与Ba(OH)2溶液反应: Al 3++2SO 42-+2Ba 2+ +4OH -=2BaSO 4 ↓+AlO 2+2H 2OC. NaOH 与过量H 2C 2O 4溶液反应: H 2C 2O 4+2OH -== C 2O 42- +2H 2OD.电解MgCl 2水溶液: 2C1- +2H 2O ===通电2OH - +Cl 2↑+H 2↑ 12.短周期元素A. B 、C 、D 、E 的原子序数依次增大且满足A+E=B+D,已知A 与E 同族,B 的单质能与硫酸铜溶液反应生成蓝色沉淀,E 的氢化物能与硫酸铜溶液反应生成黑色沉淀。
高中化学学习材料云南省师范大学附属中学2015届高三高考适应性月考(六)理科综合化学试题答案7.Na24A项错误;食盐的主要成分是氯化钠,味精的主要成分是谷氨酸钠,都含有钠离子,B项正确;氨溶于水时与水发生了化学反应,所得氨水为混合物,不是电解质,C项错误;羊毛的主要成分是蛋白质,组成元素中含氮元素,燃烧产物不只是CO2和H2O,D项错误。
8.对甲基苯甲酸属于酯类并含有苯环的同分异构体的书写按照取代基的多少分类,2个取代基的有甲酸与邻(间、对)甲基苯酚生成的酯3种,1个取代基的有甲酸与苯甲醇、乙酸与苯酚、苯甲酸与甲醇生成的酯3种,共6种,故选A。
9.向5.6g铁粉中加入280mL 1.0mol·L-1稀硝酸,所得溶液为Fe(NO3)2、Fe(NO3)3的混合溶液,故A项错误;0.05mol Na2CO3应消耗0.10mol HCl,但30mL 3.0mol·L-1稀盐酸中只含0.09mol HCl,故所得溶液中含有NaCl和NaHCO3,B项错误;计算得n(MnO2)=0.3mol,n(HCl)=0.6mol,由于浓盐酸随着反应的进行逐渐变成稀盐酸,而稀盐酸不与MnO2反应,故反应中一定有盐酸剩余,C项错误;计算得n(CuSO4)=n(H2SO4)=0.1mol,n[Ba(OH)2]=0.3mol,故Ba(OH)2过量,最终所得溶液中溶质中只有Ba(OH)2,故D项正确。
10.氨气极易溶于水而难溶于CCl4中,所以A装置可以用来吸收氨气,并防止倒吸,故A 项实验能达到目的;Na与水反应为放热反应,放出的热量使大试管中的空气受热膨胀,导致U形管红墨水的液面形成高度差,由此可验证Na和水反应的热效应,B项实验也能达到目的;实验中通过关闭止水夹,由长颈漏斗向烧瓶中加入水,若装置不漏气,则会在长颈漏斗中形成一段稳定的水柱,因此可以用来检验装置的气密性,故C项实验能达到目的;电解池中Fe作为阴极不能失去电子变为Fe2+进入溶液中与OH−反应生成Fe(OH)2,故D 项的实验不能达到目的。
云南师大附中2022届高考适应性月考卷(六)理科综合参考答案一、选择题:本题共13小题,每小题6分。
二、选择题:本题共8小题,每小题6分。
在每小题给出的四个选项中,第14~18题只有一项符合题目要求;第19~21题有多项符合题目要求,全部选对的给6分,选对但不全的给3分,有选错的给0分。
【解析】1.颤藻是原核生物,细胞中没有细胞核。
2.原癌基因和抑癌基因发生突变,导致细胞癌变。
3.缺碘导致甲状腺激素的合成和分泌不足,通过反馈调整会促进促甲状腺激素的分泌,从而导致其含量高于正常水平。
4.木糖不能被根毛细胞吸取是由原生质层的选择透过性打算的。
木糖溶液的渗透压等于细胞液时,有水分子通过原生质层,只是水分子的净集中量为0。
木糖不能被细胞吸取,所以木糖溶液的渗透压大于细胞液时细胞只会发生质壁分别。
5.当种群格外大,全部的雌雄个体间都能自由交配并产生后代,没有迁入和迁出,自然选择对该对相对性状没有作用,且基因不发生突变的前提下,种群的基因频率不会发生转变。
细菌在接触抗生素之前,可能已经产生抗药性突变。
新物种的形成不肯定经过地理隔离。
6.上清液32P 放射性过高与搅拌无关。
7.臭氧—生物活性炭用于自来水的深度水处理,利用了臭氧的强氧化性和活性炭的吸附性,A 错误;被蜂蚁蛰咬后,蜂蚁往人体内注射酸(大部分是蚁酸),可用稀氨水或小苏打溶液中和,减轻苦痛,B 正确;汽油和甲醇的热值不同,向汽油中添加甲醇后,该混合燃料的热值会转变,C 错误;氢氧化铝受热时分解,吸取燃烧物表面的热量且生成的氧化铝熔点较高,附着在可燃物表面,起到阻燃作用,D 错误。
8.1mol NO 与0.5mol O 2充分反应生成1mol NO 2,但NO 2存在平衡:2NO 2 N 2O 4,导致分子数减小,故产物的分子数小于N A ,A 错误;Na 2CO 3溶液中存在水解反应,23CO -能水解为3HCO -、H 2CO 3和OH −,溶液中含有的阴离子数目大于N A ,B 正确;二氧化锰只能与浓盐酸反应,与稀盐酸不反应,故盐酸不能反应完全,转移的电子数小于0.6N A ,C 错误;白磷和甲烷都是正四周体分子,但1mol 白磷和甲烷中所含共价键数目不同,分别为6mol 和4mol ,D 错误。
7.化学与生活和生产密切相关。
下列说法正确的是A.臭氧-生物活性碳用于自来水的深度水处理,利用了活性碳的还原性B.被蜂蚊蛰咬后,可涂抹稀氨水或小苏打溶液减轻疼痛C.向汽油中添加甲醇后,该混合燃料的热值不变D.氢氧化铝可作塑料的阻燃剂,因为它受热熔化放出大量的热8.NA为阿伏加德罗常数,下列说法正确的是A.标准状况下,22.4L NO和11.2LO2混合后气体的分子总数为NAB.1L1mol·L-1的Na2CO3溶液中含有的阴离子数目大于NAC.100mL 112mol·L-1浓盐酸与足量的MnO2共热,转移的电子数为0.6NaD.所含共价键数均为0.4NA的白磷(P4)和甲烷的物质的量相等9.按如图1所示装置进行实验,下列说法不正确的是A.利用图甲装置,可以防止铁钉生锈B.利用图乙装置,可以用乙醇和浓硫酸制备乙烯C.利用图丙装置,可以加热NH4Cl固体制NH3D.利用图丁装置,可以研究Ca(OH)2的溶解度随温度的变化10.俗称“一滴香”的有毒物质被人食用后会损伤肝脏,还能致癌。
“一滴香”的分子结构如图2所示,下列说法不正确的是A.1mol该有机物最多能与3mol H2发生加成反应B.该有机物能与Na反应C.该有机物能发生取代、加成、氧化和还原反应D.该有机物的一种芳香族同分异构体能发生银镜反应11.一种全天候太阳能电池的工作原理如图3所示,下列说法正确的是A.光照时,b极周围pH增大B.光照时,H+由a极室透过质子膜进入b极室C.夜间无光照时,a极的电极反应式为V2+-e-= V3+D.该电池与硅太阳能供电原理相同12.图4是从元素周期表中截取的一部分,已知X、Y、Z、W为四种短周期主族元素,下列说法正确的是A.四种元素的原子有可能均能与氢原子形成18电子分子B. Z元素可能为金属C. Z的原子半径不一定比Y的原子半径大D. W的原子序数不可能是X的原子序数的3倍13.化学上常用AG表示溶液的lg)(c)(c-+OHH。
25℃时,用0.100mol·L-1的NaOH溶液滴定20.00mL0.1mol·L-1的HNO2溶液。
AG与所加NaOH溶液的体积(V)的关系如图5所示,下列说法不正确的是A.C点时,加入NaOH溶液的体积不为20mLB.D点溶液的pH=11.25C.B点溶液中存在2c(H+)-2c(OH-)=c(ON2-)-c(HNO2)D.25℃时,HNO2的电离常数Ka=1.0×10-5.526.(14分)烟气脱硫能有效减少二氧化硫的排放。
目前最常用的脱硫技术是湿法石灰石—石膏脱硫,即利用石灰石和烟气中的SO2反应生成石膏一脱除SO2。
某研究性学习小组在实验室利用如图7所示装置制备模拟烟气(主要成分为SO2、CO2、N2、O2),并测定烟气中SO2的体积分数以及研究烟气通过转化器的脱硫效率。
回答下列问题:Ⅰ.模拟烟气的制备。
(1)装置A中盛装浓硫酸的仪器名称是,写出装置A中发生反应的化学方程式:。
Ⅱ.测定烟气中SO2的体积分数。
(2)已知装置C、D中盛有的药品分别是酸性KMnO4溶液、饱和NaHCO3溶液,写出装置C 的作用:,装置D中饱和NaHCO3溶液中的离子浓度由大到小的关系为。
(3)①甲同学认为应该在装置C、D之间增加一个盛有品红溶液的洗气瓶,理由是。
②乙同学根据模拟烟气的流速a mL/min和t1分钟后测得的量筒内液体的体积VmL,计算烟气中二氧化硫的体积分数。
为保证准确读取量筒读数应注意:a.将装置冷却至室温;b. ;c.平视。
Ⅲ.模拟烟气通过转化器的脱硫效率研究。
(4)将模拟烟气通过装置E,其中盛有FeCl2、FeCl3的混合溶液,它可以催化SO2与氧气的反应以达到脱硫的目的。
写出催化剂参与反应过程中的离子方程式:SO2+2H2O+2Fe3+=SO42-+2Fe2++4H+、。
(5)若模拟烟气仍以amL/min的流速通过转化器E装置,t2分钟后,向E装置中加入酸化的BaCl2溶液,得到白色浑浊液,经过滤、洗涤、干燥、称量,得到m g固体。
若实验测得的气体体积已折算为标准状况下的体积,则该转化器的脱硫效率是。
27. (15分)空气质量评价的主要污染物为PM 10、PM2.5、SO2、NO2、O3、CO等物质。
烟气的脱硝(除NOx)技术和脱硫(除SO2)技术都是环境科学研究的热点,选择性催化还原法(SCR)是目前最成熟的烟气脱硝技术,即在催化剂的作用下,用还原剂选择性地与NOx反应生成N2和H2O。
(1)在催化剂存在的条件下,用H2将NO还原为N2。
已知:则氢气和一氧化氮反应生成氮气和水蒸气的热化学方程式是。
(2)用热炭还原NO的反应为2NO(g)+C(s)N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为T1℃、T1℃、T2℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:②若乙容器在200min达到平衡状态,则0~ 200min内用CO2的浓度变化表示的平均反应速率v(CO2)= 。
(3)用焦炭还原NO2的反应为2NO2(g)+2C(s)N2(g)+2CO2(g),在恒温条件下,lmolNO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图18所示:①A、B两点的浓度平衡常数关系:Kc(A) (填“<”、“>”或“=”)②A、B、C三点中NO2的转化率最低的是(填“A”、“B”或“C”)点。
③计算C点时该反应的压强平衡常数Kp(c)= (Kp是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(4)在催化剂的作用下,尿素可以与NOx反应生成N2、H2O和CO2。
写出CO(NH2)2与NO2反应的化学方程式:。
(5)氮的化合物应用广泛。
氯胺(NH2Cl)是常用的饮用水二级消毒剂,可作长效缓释消毒剂,已知NH2Cl易水解生成强氧化性的物质,写出NH2Cl与水反应的化学方程式:。
28. (14分)锑(Sb)及其化合物的用途广泛。
锑与砷同族,以辉锑矿为原料制备金属锑,其中一种工艺流程如图19甲所示:已知部分信息如下:Ⅰ.辉锑矿(主要成分为Sb2S3,还含有As2S5、PbS、CuO和SiO2等);Ⅱ.浸出液主要含盐酸和SbCl3,还含SbCl5、CuCl2、AsCl3和PbCl2等杂质;Ⅲ.常温下,Ksp(CuS)=10×10-36、Ksp(PbS)=9.0×10-29Ⅳ.H3PO2是一元中强酸。
回答下列问题:(1)锑在周期表中的位置是,NaH2PO2的名称为。
(2)“酸浸”过程中SbCl5和Sb2S3反应有S生成,滤渣1的主要成分是(填化学式)。
(3)写出“还原”过程中反应的化学方程式:。
(4)已知浸出液中:c(Cu2+)=0.01mol·L-1、c(Pb2+)=0.10mol·L-1。
在沉淀铜、铅过程中,缓慢滴加极稀的硫化钠溶液,先产生的沉淀是(填化学式);加入硫化钠的量不宜过多,原因是。
(5)在“除砷”过程中,氧化产物为H3PO4。
该反应中还原剂、氧化剂的物质的量之比为。
(6)“电解”中锑的产率与电压大小关系如图乙所示。
当电压超过U0V时,锑的产率降低的原因可能是。
35.[化学一一选修3:物质结构与性质](15分)已知某有机物的结构简式为,回答下列问题。
(1)基态氧原子价层电子的轨道表达式(电子排布图)为。
该有机物组成元素中,电负性由大到小的前三种元素是。
(用元素符号回答,下同)(2)该有机物中,中心原子杂化轨道类型为sp2的原子有。
(3)KCN可被H2O氧化为KOCN (氰酸钾)。
①KOCN可作制药原料,其晶体类型是,碳原了采取sp杂化,则1mol 该物质中含有的π键数目为。
②常温下H2O2是液体,沸点相对较高,其主要原因是。
(4)H2SeO3的酸性H2SeO4 (填“强于”或“弱于”),原因是。
(从分子结构的角度回答)。
(5)石墨是碳的一种同素异形体,其晶体结构如图26甲所示,虚线勾勒出的是其晶胞(如图乙)。
则石墨晶胞中含碳原子数个。
已知石墨的密度为ρg·cm-3,C-C键的键长为rcm,设阿伏加德罗常数的值为NA,则石墨晶体的层间距为cm。
36.[化学一一选修5:有机化学基础] (15分)己知化合物N是一种对氨基苯甲酸酯类物质,可作局部麻醉药。
合成N的一种路线如图27:已知以下信息:①核磁共振氢谱显示B只有一种化学环境的氢,H苯环上有两种化学环境的氢;②③E为芳香烃,其相对分子质量为92;④(苯胺,易被氧化)。
回答下列问题:(1)A 的化学名称是 ,检验B 中官能团的试剂是 ,中官能团的名称是 。
(2)由E 生成F 的化学方程式为 。
(3)由F 生成C 的反应类型为 ,H 在一定条件下可以发生聚合反应,写出该聚合反应的化学方程式: 。
(4)D 的同分异构体中不能与金属钠反应生成氢气的共有 种(不考虑立体异构)。
(5)参照上述合成路线,以乙烯、干醚和环氧乙烷为原料(无机试剂任选)制备1,6-已二醛,设计合成路线: 。
答案7.B 8.B 9.C 10.D 11.C 12.A 13.D 26.(除特殊标注外,每空2分,共14分)(1)圆底烧瓶(1分) C+2H2SO4(浓)=====△CO2↑+2SO2↑+2H2O(2)吸收烟气中的SO2气体(1分) c(Na+)>c(3HCO -)>c(OH -)>c(H+)>c(23CO -)(3)①检验SO2是否被完全吸收②上下移动量筒使得量筒液面与广口瓶D 中液面相平 (4)4Fe2++O2+4H+=2H2O+4Fe3+ (5)12122400100%233()t mt at V ⨯-g g g27.(除特殊标注外,每空2分,共15分)(1)2NO(g)+2H2(g)=N2(g)+2H2O(g) ∆H=−665kJ ·mol−1 (2)①<(1分) <(1分) ②0.0015mol ·L−1·min−1 (3)①=(1分) ②B ③2MPa(4)4CO(NH2)2+6NO2=====催化剂7N2+4CO2+8H2O(或4CO(NH2)2+6NO2――――→催化剂7N2+4CO2+8H2O) (5)NH2Cl+H2O NH3+HClO(或NH2Cl+2H2O NH3·H2O+HClO)28.(除特殊标注外,每空2分,共14分) (1)第五周期第ⅤA 族(l 分) 次磷酸钠(l 分) (2)SiO2和S(3)3SbCl5+2Sb=5SbCl3(4)CuS 避免锑离子沉淀,使锑的产率降低 (5)3︰4(6)H +参与了电极反应35.(除特殊标注外,每空2分,共15分)(1) (l 分) F > O >N(2)C 、N(3)①离子晶体(l 分) 2NA(l 分) ②分子间存在氢键(4)弱于(l 分) 硒的含氧酸中非羟基氧原子数目越多,中心硒原子价态越高,导致Se —O —H 中的O 的电子更向Se 偏移,越易电离出H+(5)4(l 分)36.(除特殊标注外,每空2分,共15分)(1)2−甲基丙烯(l 分) NaOH 溶液、稀HNO3、AgNO3溶液 氨基、酯基(2)(3)氧化反应(l 分)(4)15 (5)。