化学反应中的能量关系
- 格式:ppt
- 大小:3.53 MB
- 文档页数:22

化学反应中的能量变化:内能焓与热容化学反应中的能量变化:内能、焓与热容在化学反应中,物质发生变化时伴随着能量的转化和释放。
能量的变化是化学反应中重要的研究内容之一,它揭示了化学反应的动力学特征和热力学规律。
本文将介绍化学反应中的能量变化,重点讨论内能、焓与热容的概念、计算方法和实际应用。
一、内能(U)内能是指物质微观粒子的动能和势能之和,是描述系统热力学状态的重要参量。
化学反应中的内能变化可以通过实验测定或计算得到。
根据能量守恒定律,反应过程中的能量转化可表达为以下方程式:ΔU = Q - W其中,ΔU表示内能变化;Q表示系统与外界间的热量交换;W表示系统与外界间的功交换。
当Q和W都为正值时,系统吸热和做功;当Q和W都为负值时,系统放热和受到外界做功;当Q和W一正一负时,系统既吸热又放热,或既做功又受到外界做功。
内能是一个状态函数,与路径无关,只与起始状态和结束状态有关。
二、焓(H)焓是指在恒压条件下,系统与外界之间进行的热量变化,常用符号H表示。
在化学反应中,若反应为恒压反应,内能变化和焓变之间存在以下关系式:ΔH = ΔU + PΔV其中,ΔH为焓变;ΔU为内能变化;PΔV为压力与体积间的做功。
当ΔH为正值时,化学反应为吸热反应,系统获取热量;当ΔH为负值时,化学反应为放热反应,系统释放热量。
与内能不同,焓是一个状态函数,在化学反应中常用来表示反应的热力学性质。
三、热容(C)热容是指物质吸热或放热时温度变化的量度,常用符号C表示。
热容可分为恒容热容(Cv)和恒压热容(Cp)。
恒容热容指的是在等体积条件下,物质对热量的吸收或释放所引起的温度变化;恒压热容指的是在等压条件下,物质对热量的吸收或释放所引起的温度变化。
热容与物质的性质有关,同一物质在不同的物理状态下具有不同的热容。
热容可用于计算物质的温度变化和热量变化之间的关系,符合以下公式:Q = CΔT其中,Q表示吸热或放热的热量;C表示热容;ΔT表示温度变化。

化学反应与能量知识点总结一、化学反应与能量变化的关系化学反应过程中,不仅有物质的变化,还伴随着能量的变化。
能量变化通常表现为热量的变化,有时也会以光能、电能等形式表现出来。
从化学键的角度来看,化学反应的本质是旧化学键的断裂和新化学键的形成。
旧键断裂需要吸收能量,新键形成会释放能量。
如果反应物总能量高于生成物总能量,反应就会放出能量;反之,如果反应物总能量低于生成物总能量,反应则需要吸收能量。
例如,燃烧反应一般都是放热反应,因为燃料和氧气的化学键断裂所吸收的能量小于燃烧产物化学键形成所释放的能量。
而像碳酸钙高温分解这样的反应则是吸热反应,因为分解所需的能量大于生成的氧化钙和二氧化碳形成新键释放的能量。
二、常见的吸热反应和放热反应1、吸热反应(1)大多数分解反应,如氯化铵受热分解。
(2)一些需要持续加热才能进行的反应,比如碳和二氧化碳在高温下反应生成一氧化碳。
(3)以碳、氢气、一氧化碳为还原剂的氧化还原反应,例如氢气还原氧化铜。
2、放热反应(1)所有的燃烧反应,如甲烷的燃烧。
(2)酸碱中和反应,比如盐酸和氢氧化钠的反应。
(3)金属与酸的置换反应,例如锌与稀硫酸反应生成氢气。
(4)大多数化合反应,比如二氧化硫和氧气生成三氧化硫。
三、反应热反应热是指化学反应在一定条件下放出或吸收的热量。
通常用符号ΔH 表示,单位是 kJ/mol。
如果ΔH 为正值,表示反应吸热;如果ΔH 为负值,表示反应放热。
例如,对于反应 H₂(g) + Cl₂(g) = 2HCl(g),ΔH =-1846 kJ/mol,表示每生成 2 mol HCl 气体,放出 1846 kJ 的热量。
四、热化学方程式热化学方程式是表示化学反应与反应热关系的化学方程式。
它不仅表明了化学反应中的物质变化,还表明了能量变化。
热化学方程式与普通化学方程式的区别在于:1、要注明反应的温度和压强(如果是在 25℃、101 kPa 下进行的反应,可以不注明)。


化学反应与能量变化知识点总结一、化学反应中的能量变化。
1. 化学反应的实质。
化学反应的过程是旧化学键断裂和新化学键形成的过程。
旧键断裂需要吸收能量,新键形成会释放能量。
2. 反应热与焓变。
反应热:化学反应过程中吸收或放出的热量。
焓变(ΔH):在恒压条件下进行的化学反应的热效应。
- 吸热反应:ΔH > 0。
- 放热反应:ΔH < 0。
3. 常见的吸热反应和放热反应。
吸热反应:大多数分解反应、氯化铵与氢氧化钡的反应、以 C、CO、H₂为还原剂的氧化还原反应等。
放热反应:大多数化合反应、酸碱中和反应、燃烧反应、活泼金属与酸或水的反应等。
二、热化学方程式。
1. 定义。
表示参加反应物质的量和反应热的关系的化学方程式。
2. 书写注意事项。
要注明反应物和生成物的状态(g、l、s)。
要注明反应的温度和压强(若在 25℃、101kPa 条件下进行,可不注明)。
要注明ΔH 的正负号、数值和单位。
化学计量数只表示物质的量,可以是整数,也可以是分数。
三、燃烧热和中和热。
1. 燃烧热。
定义:101kPa 时,1mol 纯物质完全燃烧生成稳定的氧化物时所放出的热量。
单位:kJ/mol。
注意:燃烧热是以 1mol 可燃物为标准进行测量的。
2. 中和热。
定义:在稀溶液中,强酸跟强碱发生中和反应生成 1mol 液态水时所释放的热量。
单位:kJ/mol。
注意:强酸与强碱的稀溶液反应,若有弱酸或弱碱参与,中和热数值偏小。
四、盖斯定律。
1. 内容。
化学反应的反应热只与反应的始态(各反应物)和终态(各生成物)有关,而与具体反应进行的途径无关。
2. 应用。
可以通过已知反应的热化学方程式,进行相应的加减运算,得到目标反应的热化学方程式和反应热。
五、能源。
1. 分类。
一次能源:直接从自然界获取的能源,如煤、石油、天然气、风能、水能等。
二次能源:由一次能源经过加工、转化得到的能源,如电能、氢能等。
2. 新能源。
太阳能、风能、地热能、海洋能、生物质能等,具有资源丰富、可再生、对环境影响小等优点。


化学反应的能量变化与焓变化学反应是指物质之间发生的化学变化过程。
在化学反应中,原子之间的键重新组合,形成新的化学物质。
而在这个过程中,会伴随着能量的变化。
能量变化的大小与反应物和生成物之间的关系密切相关,可以通过焓变来描述。
焓变是指在恒定压力下,反应物转化为生成物时系统所吸收或释放的热量变化。
它用ΔH表示,H代表焓。
焓变可以为正或为负,分别表示反应吸热或放热。
在化学反应中,能量变化与焓变之间存在着以下关系:1. 反应吸热时,焓变为正值。
这意味着反应需要从外部吸收热量才能进行,反应后系统的能量增加。
2. 反应放热时,焓变为负值。
这意味着反应释放热量,反应后系统的能量减少。
焓变与能量变化之间的关系可以通过下式表示:ΔH = ΔE + PΔV其中,ΔH表示焓变,ΔE表示内能变化,P表示压力,ΔV表示体积变化。
根据该式子,当压力恒定时,焓变与能量变化相等。
焓变的大小可以通过实验测定得到。
实验中常使用量热器来测定反应的焓变。
量热器是一种专门用于测量热量变化的设备,它可以精确记录反应前后的温度变化,通过计算温度差来得到焓变的数值。
焓变有许多重要的应用。
其中一项重要的应用是在燃烧反应中。
燃烧是指物质与氧气发生反应并释放大量热能的过程。
燃烧反应的焓变可以通过测定燃烧反应释放的热量来计算。
这对于燃料的选择和利用非常重要,可以帮助我们了解不同燃料之间的能量转化效率。
除了燃烧反应,焓变还可以用来计算其他化学反应的能量变化。
通过测定反应前后的焓变,可以了解化学反应的放热或吸热性质,从而进一步研究反应的特性和条件。
总之,化学反应中的能量变化与焓变密切相关。
焓变可以描述反应吸热或放热的性质,并通过实验测定得到。
焓变的应用范围广泛,对于理解化学反应、燃烧等过程有重要意义,也对于能源利用和选择具有指导作用。
通过深入研究和掌握焓变的性质,我们能更好地理解化学反应的本质,为化学科学的发展做出贡献。
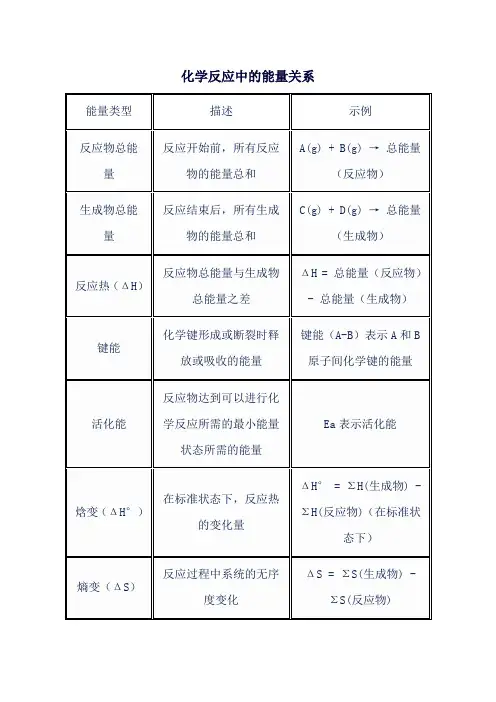
化学反应中的能量关系
说明:
反应物总能量:在化学反应开始之前,所有参与反应的物质的能量总和。
生成物总能量:在化学反应结束后,所有生成的物质的能量总和。
反应热(ΔH):反应物总能量与生成物总能量之差,表示反应是放热还是吸热。
如果ΔH为负,则反应是放热的;如果ΔH为正,则反应是吸热的。
键能:化学键形成或断裂时涉及的能量。
键能越大,表示化学键越稳定。
活化能:反应物达到活化状态所需的能量,是反应进行的一个关键能量障碍。
焓变(ΔH°):在标准状态下(即特定温度、压力和浓度),反应热的变化量。
熵变(ΔS):反应过程中系统的无序度或混乱度的变化。
如果ΔS为正,表示系统变得更加混乱;如果ΔS为负,表示系统变得更加有序。
自由能变化(ΔG):反应在恒温恒压下进行的自发性指标。
如果ΔG为负,则反应在给定条件下是自发进行的;如果ΔG为正,则反应不是自发进行的。



化学反应中的能量变化化学反应是指物质之间发生的转化,其中伴随着能量的变化。
能量在化学反应中的转化包括放出或吸收热量(热变化)以及放出或吸收光线(光变化)。
在本文中,我们将深入探讨化学反应中的能量变化以及其原因。
一、热变化热变化是化学反应中最常见的能量变化形式之一。
化学反应放热时,被称为放热反应;而吸热反应指的是化学反应吸收热量。
这种热变化与反应物的能量以及化学键的形成和断裂有关。
当化学反应中分子间的键断裂时,需要消耗能量,称为吸热反应。
相应地,当新的化学键形成时,会释放能量。
这种放热反应可以通过实验测量反应物和生成物的温度变化来观察。
如果温度升高,说明反应是放热的;如果温度降低,说明反应是吸热的。
例如,燃烧反应是一种典型的放热反应。
当燃料与氧气反应时,产生的新化学键释放出大量能量,使周围温度升高。
而在吸热反应中,常见的例子是溶解盐类物质时所观察到的温度下降现象。
二、光变化光变化是化学反应中另一种常见的能量变化形式。
在一些化学反应中,能量的转化还伴随着光线的放出或吸收。
光变化可以是可见光、紫外线、红外线或其他电磁波的辐射。
光变化是由电子在化学反应过程中跃迁能级而引起的。
特定的能级差决定了光的能量。
光变化对于许多生物化学过程至关重要,如光合作用。
光合作用是植物利用光能将二氧化碳和水转化为有机物质和释放氧气的过程。
在这个过程中,光合色素吸收光能,驱动光化学反应,并将光能转化为化学能。
除了光合作用,其他一些化学反应也伴随着光变化,如发光反应和荧光反应。
这些反应通常涉及特定的物质或分子结构,在外加能量的激发下释放光线。
三、能量变化的应用化学反应中的能量变化有着广泛的应用。
首先,热变化在生活中有着重要的作用。
例如,火焰的产生和维持是燃烧反应的结果,而燃烧反应释放出的能量被用于供暖、烹饪等方面。
其次,光变化在化学和材料科学中也有着广泛应用。
例如,发光二极管(LED)利用半导体材料的光变化原理,在电流的激发下产生可见光。

第一章化学反应中的质量关系和能量关系首先阐述化学中的计量,以巩固高中化学中的有关概念,在此基础上引入化学计量数,反应进度函数,标准态核反应焓变等重要概念,以阐明化学反应中的质量关系和能量关系。
在中学化学和大学化学中起承上启下关系。
重点要求的是会应用热化学方程式和物质的量标准摩尔生成焓计算标准摩尔反应焓变。
化学是研究物质的组成、结构、性质及化学变化的科学。
化学变化又称化学反应,是化学研究的核心部分。
物质发生化学反应,常伴随有质量和能量的变化。
例如,在空气中燃烧24.3g镁条,不仅会发出耀眼的白光,释放出热能,而且最终生成了40.3g的氧化镁。
本章专门就化学反应中的质量关系和能量关系进行讨论。
1-1 化学中的计量在化学领域中往往要测定或计算物质的质量、溶液的浓度、反应的温度以及气体的压力和体积等,为此,首先需要掌握化学中常用的量和单位以及有关的定律。
[粗略计算相对分子质量时,相对原子质量只需取至小数点后两位数即可。
]1-1-1相对原子质量和相对分子质量元素是具有相同质子数的一类单核粒子的总称。
具有确定质子数和中子数的一类单核粒子称为核素。
质子数相等而中子数不等的同一元素的一些原子品种互称为同位素。
自然界中氧就有三种同位素:、、,他们在氧气中的含量分别为99.759%、0.037%和0.204%;碳有两种同位素:和, 它们的相对存在量分别为98.892%和1.108%。
相对原子质量(Ar)被定义为元素的平均原子质量与核素12C原子质量的1/12之比,以往被称为原子量。
例如:Ar(H) = 1.0079 Ar(O) = 15.999英国人道尔顿(J.Dalton, 1766~1844年)是第一个测定原子量的人。
现在通过质谱仪测定各核素的原子质量及其在自然界的丰度后,可以确定各元素的相对原子质量。
北京大学张青莲教授等测定的铟(In)、锑(Sb)、铱(Ir)及铕(Eu)相对原子质量值先后被国际原子量委员会采用为国际标准,说明我国原子量测定的精确度已达到国际先进水平。
化学反应平衡与能量变化的关系在化学领域中,反应平衡是指当化学反应达到一定条件下,反应物与生成物之间的浓度或者压强保持稳定的状态。
反应平衡的过程中,能量也会发生变化,这种变化被称为能量变化。
本文将探讨化学反应平衡与能量变化之间的关系。
一、热力学基本概念在讨论化学反应平衡与能量变化的关系之前,我们首先需要了解一些基本的热力学概念。
1. 反应焓变(ΔH)反应焓变(ΔH)是指化学反应过程中吸热或放热的量。
吸热反应的焓变为正值,放热反应的焓变为负值。
反应焓变可以通过实验测定得到,也可以根据反应物与生成物的标准生成焓进行计算。
2. 反应熵变(ΔS)反应熵变(ΔS)是指化学反应过程中体系混乱程度的变化。
反应物与生成物之间的反应熵变可以通过实验数据或者熵表进行查找得到。
3. 反应自由能变(ΔG)反应自由能变(ΔG)是指化学反应在一定温度下能够释放的自由能。
能在一定温度下进行自发反应的反应自由能变为负值,而需要外界输入能量才能进行的反应自由能变为正值。
二、反应平衡与能量变化的关系反应平衡是在化学反应中达到动态稳定状态的处理。
一般来说,反应物与生成物之间的能量差异会导致反应的进行,而达到平衡状态时,能量差异被消除。
这表明在反应平衡位置处,反应物与生成物之间的能量变化趋向于零。
由于化学反应平衡与能量变化之间的关系较为复杂,无法用简单的公式来表示。
根据热力学基本概念,我们可以通过反应焓变(ΔH)、反应熵变(ΔS)和反应温度(T)来分析反应平衡与能量变化之间的关系。
根据吉布斯自由能方程(ΔG = ΔH - TΔS),当ΔG = 0时,反应达到平衡。
在这种情况下,可以推导出以下两个常见的情况:1. 当ΔH < 0且ΔS > 0时这表示反应具有负的焓变和正的熵变。
当温度较高时,焓变项对自由能变化的贡献更为显著,此时反应平衡位置偏向生成物。
2. 当ΔH > 0且ΔS < 0时这表示反应具有正的焓变和负的熵变。
第五章化学反应中的能量关系化学反应总是伴随着吸热或放热现象,称所吸收、放出的热为反应的热效应(反应热)并把研究化学反应中热与其他能量变化的定量关系的学科叫做热化学。
本章主要讨论化学反应和相变化过程中的热效应以及反应热的热化学计算。
5.1基本概念和术语5.1.1体系和环境1、体系:研究的对象。
(1)、隔离体系(无能量与物质的交换);(2)、封闭体系(有能量交换,无物质交换);(3)、敞开体系(有能量与物质的交换)。
2、环境:体系以外的物质。
5.1.2状态函数体系的状态:体系一切宏观性质的总和。
(T、P、V、n等)例:对某一气体(CO2)的状态,可用给定的压力、体积、温度和物质的量来描述。
当体系处于一定的状态时,体系的性质只决定于它现在所处的状态而与其过去的历史无关。
若外界条件不变,体系的各种性质就不会发生变化。
而当体系的状态发生变化时,它的一系列性质也随之而改变。
改变多少,只取决于体系的开始和终了状态,而与变化时所经历的途径无关。
无论经历多么复杂的变化,只要体系恢复原状,则这些性质也恢复原状。
在热力学中,把具有这种特性的物理量叫做状态函数。
状态函数:描述体系给定状态的个别性质或物理量。
它可用其它物理量的函数关系式来表示(状态方程)。
状态函数的特征:决定于状态本身,而与变化过程的具体途径无关。
例:1mol理想气体由始态(P1=101325Pa,V1=22.4L,T1=273K)变到终点(P2=1013250Pa,V2=4.48L,T2=546K),无论中间经历过些什么过程,这些状态函数的改变量均为:ΔP=p2-P1=(1013250-101325)Pa=911925Pa, ΔV=V2-V1=(4.48-22.4)L=-17.9L, ΔT=T2-T1=(546-273)K=273K5.1.3功和热1、热(q)体系与环境之间因温度不同而传递的能量形式称为热。
一个给定的体系若不发生变化,就不会有热这种能量转换和传递的形式表现出来。
第一章化学反应中的能量关系【教学基本要求】(1)理解热、功、热力学能、焓和焓变的概念及其物理意义。
(2)掌握状态函数的定义及特征。
(3)理解化学计量数和反应进度的概念及特征。
(4)理解并掌握热力学第一定律的数学表达式及其物理意义。
(5)熟悉热化学反应方程式的书写,理解恒压反应热与焓变的关系。
(6)掌握赫斯定律的应用,会用标准摩尔生成焓计算反应热。
【重点和难点】重点(1)化学方程式的计算(2)化学计量数和反应进度(3)状态函数的定义及特征(4)标准生成焓和标准焓变的区别(5)化学方程式的书写,恒压反应热与焓变的关系盖斯定律的应用以及用标准生成焓计算反应的标准焓变。
难点:(1)化学计量数和反应进度(2)状态函数的定义及特征(3)标准生成焓和标准焓变的区别【引言】化学反应过程不仅有质量的变化,而且总伴随着有能量的吸收或释放。
例如,煤燃烧时放热,氮的氧化要吸热;原电池反应能产生电能,电解饱和食盐水则消耗电能。
热力学是专门研究能量相互转换规律的一门科学。
利用热力学的原理、定律和方法去研究化学反应,讨论化学变化过程中所伴随的能量变化的学科称为化学热力学。
热力学所讨论的是大量质点的平均行为,即物质的宏观性质,而不涉及个别或少数分子、原子的微观性质。
这样,应用热力学研究化学反应时,只需要知道过程进行的条件及过程的始态和终态,而无须知道化学反应具体的历程是什么。
因此,化学热力学只研究反应的可能性。
化学热力学研究解决的问题主要有:(1)化学反应或与化学反应密切相关的物理过程中的能量变化。
(2)判断化学反应进行的方向和限度。
由于在后续课程中,将会系统地学习化学热力学,因此本章的主要目的是介绍一些热力学原理在无机化学中的基本应用,从而利用化学热力学的基本原理分析、研究无机物的基本性质及反应性。
本章主要介绍化学反应中的能量关系。
本章讨论的核心内容是化学反应和相变过程中的热效应,以及反应热的热化学计算。
在学习过程中,如何把握重点、理解难点是一个关键性的问题。