武汉大学物理化学PPT习题整理简洁版资料
- 格式:pptx
- 大小:1015.54 KB
- 文档页数:124





武⼤物理化学练习题⼀、(45分)填空及单项选择1.18℃时在厚度为1 cm的惰性多孔板两边,放置扩散系数为1.19×10-9 m2 ★ s-1的NaCl稀⽔溶液,⼀边浓度为0.4 mol★dm-3,另⼀边为0.2 mol★dm-3。
两边溶液量很⼤,且⼀直在搅拌。
则溶质NaCl的物质通量为 NaCl的浓度在板内的分布为2.反应A─→2B在温度T时的速率⽅程为 d[B]/d t=k B[A],则此反应的半衰期为:( )(A) ln 2/k B(B) 2ln 2/k B (C) k B ln2 (D) 2k B ln23.True or false(a)Elementary reactions with molecularity greater than 3 generally don't occur;(b)Knowledge of the rate law of a reaction allows us decide unambiguously what the mechanismis;(c)Activation energies are never negative;(d)For an elementary reaction, the partial orders are determined by the reaction stoichiometry;4. 简单碰撞理论属基元反应速率理论,以下说法不正确的是:( )(A) 反应物分⼦是⽆相互作⽤的刚性硬球(B) 反应速率与分⼦的有效碰撞频率成正⽐(C) 从理论上完全解决了速率常数的计算问题(D) 反应的判据之⼀是联线上的相对平动能⼤于某临界值5. 反应 A + B AB AB + C D (决速步) 其表观活化能与基元反应活化能的关系为 ________________ ,因为 ___________ 。
6. 在300 K时, 鲜⽜奶5 h后即变酸, 但在275 K的冰箱⾥,可保存50 h, ⽜奶变酸反应的活化能是______________________________________。

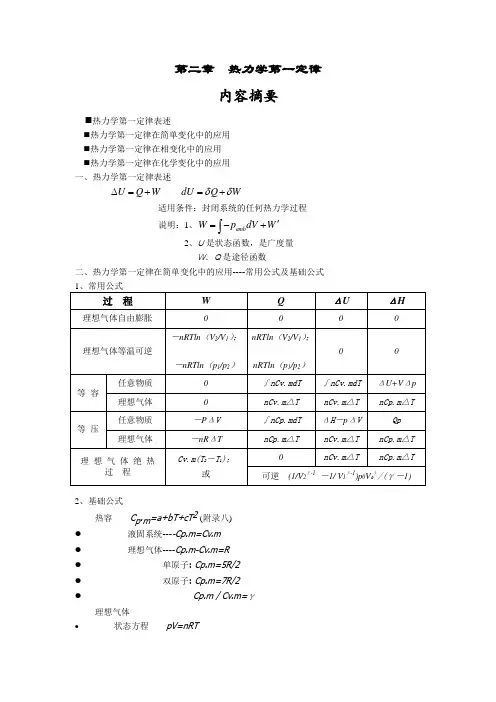
第二章 热力学第一定律内容摘要⏹热力学第一定律表述⏹热力学第一定律在简单变化中的应用 ⏹热力学第一定律在相变化中的应用 ⏹热力学第一定律在化学变化中的应用 一、热力学第一定律表述U Q W ∆=+ dU Q W δδ=+适用条件:封闭系统的任何热力学过程 说明:1、amb W p dV W '=-+⎰2、U 是状态函数,是广度量W 、Q 是途径函数 二、热力学第一定律在简单变化中的应用----常用公式及基础公式2、基础公式热容 C p .m =a+bT+cT 2 (附录八) ● 液固系统----Cp.m=Cv.m ● 理想气体----Cp.m-Cv.m=R ● 单原子: Cp.m=5R/2 ● 双原子: Cp.m=7R/2● Cp.m / Cv.m=γ理想气体• 状态方程 pV=nRT• 过程方程 恒温:1122p V p V = • 恒压: 1122//V T V T = • 恒容: 1122/ / p T p T =• 绝热可逆: 1122 p V p V γγ= 111122 T p T p γγγγ--=111122 TV T V γγ--= 三、热力学第一定律在相变化中的应用----可逆相变化与不可逆相变化过程1、 可逆相变化 Q p =n Δ相变H m W = -p ΔV无气体存在: W = 0有气体相,只需考虑气体,且视为理想气体ΔU = n Δ相变H m - p ΔV2、相变焓基础数据及相互关系 Δ冷凝H m (T) = -Δ蒸发H m (T)Δ凝固H m (T) = -Δ熔化H m (T) Δ凝华H m (T) = -Δ升华H m (T)(有关手册提供的通常为可逆相变焓)3、不可逆相变化 Δ相变H m (T 2) = Δ相变H m (T 1) +∫Σ(νB C p.m )dT 解题要点: 1.判断过程是否可逆;2.过程设计,必须包含能获得摩尔相变焓的可逆相变化步骤;3.除可逆相变化,其余步骤均为简单变化计算.4.逐步计算后加和。



实验一燃烧热的测定一、实验目的1. 通过萘的燃烧热测定,了解氧弹量热计各主要部件的作用,掌握燃烧热的测定技术;2. 掌握恒压燃烧热与恒容燃烧热的区别与联系;3. 学会应用图解法校正温度改变值。
二、实验原理燃烧热是指1摩尔物质完全燃烧时所放出的热量。
在恒容条件下测得的燃烧热称为恒容燃烧热(Qv),其值等于这个过程的内能变化(ΔU)。
在恒压条件下测得的燃烧热称为恒压燃烧热(Qp),它等于这个过程的焓变(ΔH)。
若把参与反应的气体作为理想气体处理,则存在下列关系式:Qp=Qv+∆n⋅RT (1-1)式中,Δn为产物中气体的摩尔数之和与反应物中气体的摩尔数之和的差值;R为气体常数;T为反应的绝对温度。
若测得某物质恒压燃烧热或恒容燃烧热中的任何一个,就可根据式(1-1)计算另外一个。
化学反应的热效应通常是用恒压热效应来表示的,而且习惯上用ΔH表示。
测量化学反应热效应的仪器称为量热计。
本实验采用XRY-1A型数显氧弹式热量计测量萘的燃烧热。
由于氧弹量热计测定物质的燃烧热是在恒容条件下进行的,故为恒容燃烧热。
其原理是将一定量待测物样品在氧弹中完全燃烧时放出的热量使量热计(包括周围介质)的温度升高,通过测定燃烧前、后量热计温度的变化值,就可以计算出样品的燃烧热。
其关系式如下:C∆T=-(mQv+Q点火丝ρ点火丝l点火丝) (1-2)式中,m为标准物质的质量(g);Qv为1g标准物质恒容燃烧放出的热(J·g-1); Q 点火丝= -1.02×10-3kJ·g-1;l点火丝为点火丝的长度(cm);ρ点火丝为单位长度点火丝的质量(g·cm-1),其值为4.00×10-4 g·cm-1;ΔT为样品燃烧前后量热计温度的变化值(K) (需用校正法校正);C为量热计的热容,即量热计每升高1K所需要吸收的热量(J·K-1)。
本实验的标准物质为苯甲酸,它的恒容燃烧热为Qv = -26.43×103 J·g-1。
《物理化学》练习册(2012.12)编者的话:为了更好地帮助同学复习巩固所学的基本概念、为了更好地帮助同学复习巩固所学的基本概念、基本理论和基本知识,基本理论和基本知识,我们选编了一些“复习思考题”供同学们选作,请同学们发现问题或者错误后及时与我们联系,以便进一步修订和完善第一章 热力学第一定律一、判断题(共16题):1、在定温定压下,、在定温定压下,CO CO CO22由饱和液体转变为饱和蒸气,因温度不变,由饱和液体转变为饱和蒸气,因温度不变, CO CO CO22的热力学能和焓也不变。
的热力学能和焓也不变。
( )2、2525℃时℃时H 2(g)(g)的标准摩尔燃烧焓等于的标准摩尔燃烧焓等于2525℃时℃时H 2O(g)O(g)的标准摩尔生成焓。
的标准摩尔生成焓。
的标准摩尔生成焓。
(( ))3、稳定态单质的Δf H m Θ(800K)=0 (800K)=0 。
( )4、d U =nC v ,m d T 公式对一定量的理想气体的任何pVT 过程都适用。
过程都适用。
( ) ( )5、系统处于热力学平衡态时,其所有的宏观性质都不随时间而变。
、系统处于热力学平衡态时,其所有的宏观性质都不随时间而变。
(( ))6、若系统的所有宏观性质均不随时间而变,则该系统一定处于平衡态。
、若系统的所有宏观性质均不随时间而变,则该系统一定处于平衡态。
(( ))7、Q 和W 不是体系的性质,与过程有关,所以Q + W 也由过程决定。
也由过程决定。
( ) ( )8、焓的定义式H = U + pV 是在定压条件下推导出来的,所以只有定压过程才有焓变。
是在定压条件下推导出来的,所以只有定压过程才有焓变。
( ) ( )9、焓的增加量D H 等于该过程中体系从环境吸收的热量。
等于该过程中体系从环境吸收的热量。
( ) ( )1010、一个绝热过程、一个绝热过程Q = 0 = 0,但体系的,但体系的,但体系的 D T 不一定为零。