5大类质子泵抑制剂的比较
- 格式:doc
- 大小:36.00 KB
- 文档页数:3

1作用机制胃酸分泌分别受胃壁细胞上乙酰胆碱、胃泌素及组胺3个受体的调节,它们互相影响,最终都通过H+/K+-ATP酶(质子泵,proton pump)释放H+和cl一才能形成胃酸。
PPI正是抑制了胃酸分泌的最后步骤,所以比别的抑酸药作用都强。
对于较常用的PPI来说,这种结合是不可逆的,质子泵一直被抑制,直到新的H十/K+一ATP酶合成后才能恢复分泌胃酸作用。
因此,尽管PPI的血浆半衰期短,其药效作用时间却较长。
兰索拉唑因在毗啶环4位侧链导入氟(F3,),有三氟乙氧基取代基(-OCH2CF3),其生物利用度较奥美拉唑提高30%,可作用于H+/K+一ATP酶的3个部位。
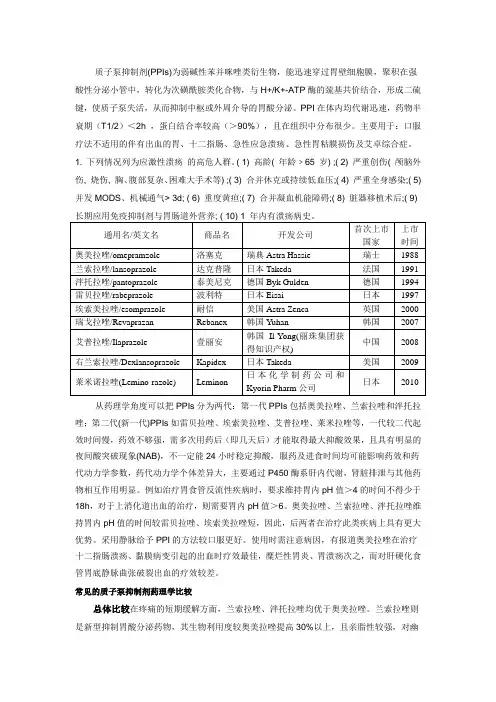
代表药物:奥美拉唑(1987年,瑞典),兰索拉唑(1992,法国),泮托拉唑(1994,德国),和雷贝拉唑(1998,日本)。
药代动力学特点:吸收:小肠中吸收,存在肝首过消除效应。
PPI不耐酸肠溶包衣分布:与血浆蛋白结合率均在95%以上。
动物研究中发现,静脉注射奥美拉唑后分布浓度最高器官:肝、肾、十二指肠、胃和甲状腺。
奥美拉唑难以透过血脑屏障。
所有PPI均可通过胎盘。
奥美和泮托拉唑在乳汁中分布较低,慎用于妊娠和哺乳期妇女。
代谢:肝内细胞色素P450酶区别:泮托拉唑:与肝脏细胞色素P450的亲和力较低,因而与通过此酶代谢的其他药物相互影响较奥美拉唑及兰索拉唑少。
雷贝拉唑:代谢主要经非酶途径(自动还原为硫醚化合物),对细胞色素P450依赖程度均较低。
埃索美拉唑是单一的S型奥美拉唑,对CYP2C19的依赖性下降,而经CYP3A4途径代谢增加。
肝脏首过效应较低肝功能损害病人的清除半衰期增加,需要减少剂量或慎用。
排泄:主要以代谢物形式经尿排泄,其余随粪便排泄。
肾功能不全无须调整剂量。
服药时间:宜在晨起餐前半小时为佳。
此时壁细胞处于兴奋期,产生大量“活性泵”,故服用PPI抑酸作用最强。
早晨食物摄入所产生的对质子泵的激活,也正与早晨餐前服用PPI的吸收峰相吻合,能发挥最大的抑酸作用。

雷贝拉唑、奥美拉唑、埃索美拉唑的区别竟然是这样!质子泵抑制剂(PPIs)是继H2受体阻断药后的一类重要的抑制胃酸分泌药,也是目前抑制胃酸分泌作用最强的一类药物。
目前临床常见的本类药物有奥美拉唑,兰索拉唑,泮托拉唑,雷贝拉唑和艾司奥美拉唑等。
在临床上主要用于治疗消化性溃疡、胃食管反流性疾病、卓艾综合征以及上消化道出血,现已成为胃酸分泌异常及相关疾病的一线药物。
与阿莫西林、克拉霉素等药物联用治疗幽门螺杆菌感染。
雷贝拉唑、奥美拉唑和埃索美拉唑是临床常用的PPIs,这三种药物他们都有哪些区别呢?一、作用机制胃壁细胞分泌酸是通过膜上的H,K-ATP酶,以H对K 交换的方式,将细胞内H泵出。
该药吸收入血后,弥散进人胃壁细胞内,与H-K-ATP酶共价结合,不可逆地使泵分子失活。
只有当新的泵分子合成并插入到细胞膜上后,胃酸分泌才重新开始。
因此,该类药物抑制胃酸的作用强而持久,同时可以使胃蛋白酶的分泌减少。
该类药物作用于胃酸分泌的最后一个环节,因此无论是否存在其他刺激胃酸分泌的因素,本类药物均可以有效抑制胃酸的分泌。
但是质子泵抑制剂不耐酸,容易在酸性环境中被降解,为避免这种情况,口服剂型多采用胶囊剂、肠溶片等多种制剂,以避开胃酸的破坏。
二、作用特点奥美拉唑,主要经CYP2C19代谢,个体差异大;埃索美拉唑为奥美拉唑的左旋异构体,经CYP3A4和CYP2C19代谢,抑酸作用强于其它PPIs;雷贝拉唑主要为非酶代谢途径,不依赖于CYP2C19,抑酸作用强,起效更快。
三、服药时间胃酸可破坏PPIs,口服制剂均为肠溶片,不能嚼碎和压碎后服用;晨起时胃壁细胞上新生质子泵最多,因此建议晨起服用;进餐可使质子泵活化,因此建议早餐前0.5~1h服用,如每日2次,另一次应在晚餐前0.5~1h 服用。
四、与氯吡格雷的相互作用奥美拉唑和埃索美拉唑可对CYP2C19有较强的抑制作用,应避免与氯吡格雷合用;雷贝拉唑对CYP2C19的影响不明显,可与氯吡格雷合用。
质子泵抑制剂(PPIs)为弱碱性苯并咪唑类衍生物,能迅速穿过胃壁细胞膜,聚积在强酸性分泌小管中,转化为次磺酰胺类化合物,与H+/K+-ATP酶的巯基共价结合,形成二硫键,使质子泵失活,从而抑制中枢或外周介导的胃酸分泌。
PPI在体内均代谢迅速,药物半衰期(T1/2)<2h ,蛋白结合率较高(>90%),且在组织中分布很少。
主要用于:口服疗法不适用的伴有出血的胃、十二指肠、急性应急溃疡、急性胃粘膜损伤及艾卓综合症。
1. 下列情况列为应激性溃疡的高危人群。
( 1) 高龄( 年龄﹥65 岁) ;( 2) 严重创伤( 颅脑外伤, 烧伤, 胸、腹部复杂、困难大手术等) ;( 3) 合并休克或持续低血压;( 4) 严重全身感染;( 5) 并发MODS、机械通气> 3d; ( 6) 重度黄疸;( 7) 合并凝血机能障碍;( 8) 脏器移植术后;( 9)从药理学角度可以把PPIs分为两代:第一代PPIs包括奥美拉唑、兰索拉唑和泮托拉唑;第二代(新一代)PPIs如雷贝拉唑、埃索美拉唑、艾普拉唑、莱米拉唑等,一代较二代起效时间慢,药效不够强,需多次用药后(即几天后)才能取得最大抑酸效果,且具有明显的夜间酸突破现象(NAB),不一定能24小时稳定抑酸,服药及进食时间均可能影响药效和药代动力学参数,药代动力学个体差异大,主要通过P450酶系肝内代谢,肾脏排泄与其他药物相互作用明显。
例如治疗胃食管反流性疾病时,要求维持胃内pH值>4的时间不得少于18h,对于上消化道出血的治疗,则需要胃内pH值>6。
奥美拉唑、兰索拉唑、泮托拉唑维持胃内pH值的时间较雷贝拉唑、埃索美拉唑短,因此,后两者在治疗此类疾病上具有更大优势。
采用静脉给予PPI的方法较口服更好。
使用时需注意病因,有报道奥美拉唑在治疗十二指肠溃疡、黏膜病变引起的出血时疗效最佳,糜烂性胃炎、胃溃疡次之,而对肝硬化食管胃底静脉曲张破裂出血的疗效较差。
常见的质子泵抑制剂药理学比较总体比较在疼痛的短期缓解方面,兰索拉唑、泮托拉唑均优于奥美拉唑。

质子泵抑制剂长期大剂量应用的不良反应及药学监护摘要】目的:对质子泵抑制剂长期大剂量应用的不良反应及药学监护进行探讨。
方法:选取我院收治的116例长期大剂量应用质子泵抑制剂致不良反应患者进行统计分析。
结果:在116例质子泵抑制剂所致不良反应患者中,男性占比62.07%高于女性的37.93%;年龄段为≥61岁的老年患者占比最高,为32.76%;引起不良反应的质子泵抑制剂品种有5类,尤以奥美拉唑、泮托拉唑占比较高,分别为48.28%与20.69%;质子泵抑制剂致不良反应涉及机体的多个系统,其中胃肠系统占比最高,占比为22.41%,其次为全身性损害,占比为19.83%。
结论:长期大剂量应用质子泵抑制剂可增加不良反应发生风险,且多发于老年男性人群,故应加强对质子泵抑制剂不良反应的重视程度,并认识到药学监护的重要性,以保障患者用药安全。
【关键词】质子泵抑制剂;不良反应;药学监护【中图分类号】R573.1 【文献标识码】A 【文章编号】1007-8231(2018)01-0075-02质子泵抑制剂是现阶段治疗消化道溃疡的一类常用处方药,品种包括奥美拉唑、泮托拉唑、雷贝拉唑、兰索拉唑及埃索美拉唑等。
此类药物属于H+/K+-ATP酶抑制剂,具有抑酸作用强、特异性高及药效持久等治疗优势。
当药物进入机体后,可显著减少胃酸分泌,快速清除幽门螺旋杆菌,从而达到治愈疾病的目的[1]。
但由于当前部分临床医师对质子泵抑制剂潜在的不良反应缺乏认识,导致临床应用质子泵抑制剂的安全隐患逐渐增加,甚至超过其益处。
因此,应加强药学监护,以降低不良反应发生风险[2]。
本研究统计分析2015年12月—2017年5月我院收治的116例长期大剂量应用质子泵抑制剂致不良反应患者的临床资料,以为指导临床合理用药,现报道如下。
1.资料与方法1.1 资料在2015年12月至2017年5月这一时间段,我院共收治长期大剂量应用质子泵抑制剂致不良反应患者116例,并归纳分析患者一般资料(性别、年龄等)、用药情况、损害系统及临床表现等相关信息。


质子泵抑制剂(PPIs)为弱碱性苯并咪唑类衍生物,能迅速穿过胃壁细胞膜,聚积在强酸性分泌小管中,转化为次磺酰胺类化合物,与H+/K+-ATP酶的巯基共价结合,形成二硫键,使质子泵失活,从而抑制中枢或外周介导的胃酸分泌。
PPI在体内均代谢迅速,药物半衰期(T1/2)<2h ,蛋白结合率较高(>90%),且在组织中分布很少。
主要用于:口服疗法不适用的伴有出血的胃、十二指肠、急性应急溃疡、急性胃粘膜损伤及艾卓综合症。
1. 下列情况列为应激性溃疡的高危人群。
( 1) 高龄( 年龄﹥65 岁) ;( 2) 严重创伤( 颅脑外伤, 烧伤, 胸、腹部复杂、困难大手术等) ;( 3) 合并休克或持续低血压;( 4) 严重全身感染;( 5) 并发MODS、机械通气> 3d; ( 6) 重度黄疸;( 7) 合并凝血机能障碍;( 8) 脏器移植术后;( 9)从药理学角度可以把PPIs分为两代:第一代PPIs包括奥美拉唑、兰索拉唑和泮托拉唑;第二代(新一代)PPIs如雷贝拉唑、埃索美拉唑、艾普拉唑、莱米拉唑等,一代较二代起效时间慢,药效不够强,需多次用药后(即几天后)才能取得最大抑酸效果,且具有明显的夜间酸突破现象(NAB),不一定能24小时稳定抑酸,服药及进食时间均可能影响药效和药代动力学参数,药代动力学个体差异大,主要通过P450酶系肝内代谢,肾脏排泄与其他药物相互作用明显。
例如治疗胃食管反流性疾病时,要求维持胃内pH值>4的时间不得少于18h,对于上消化道出血的治疗,则需要胃内pH值>6。
奥美拉唑、兰索拉唑、泮托拉唑维持胃内pH值的时间较雷贝拉唑、埃索美拉唑短,因此,后两者在治疗此类疾病上具有更大优势。
采用静脉给予PPI的方法较口服更好。
使用时需注意病因,有报道奥美拉唑在治疗十二指肠溃疡、黏膜病变引起的出血时疗效最佳,糜烂性胃炎、胃溃疡次之,而对肝硬化食管胃底静脉曲张破裂出血的疗效较差。
常见的质子泵抑制剂药理学比较总体比较在疼痛的短期缓解方面,兰索拉唑、泮托拉唑均优于奥美拉唑。



质子泵抑制剂(PPI)的开发第一代1.1 奥美拉唑(omepramzole)奥美拉唑是第一个用于临床的苯丙咪唑类PPI,为单烷氧基吡啶化合物,服药2h后血浆浓度达高峰,半衰期约1h。
单剂量的生物利用度为35%,多剂量生物利用度增至60%。
由于其强力抑酸作用,使一些以前需要手术治疗的溃疡病经过这种药物治疗即可得到治愈。
近年来开发的奥美拉唑口服混悬剂是首个和唯一的PPI口服迅速释放制剂,是唯一获准用于临床危重患者使用的口服PPI,可通过口胃管或鼻胃管给药,用于减少危重患者上消化道出血、短期(4~6周)治疗良性活动期胃溃疡。
其起效快、作用强,能持续控制胃酸分泌,使胃液pH保持在4.0以上达18.6h。
该制剂血药浓度达峰值时间约在El服后30min内,可整日有效控制胃酸。
每日口服1次Zegerid 40 mg除可控制白天胃酸分泌外,还可有效地控制夜间胃酸(夜间平均pH 4.1,24h内为pH4.7)。
1.2 兰索拉唑(lansoprazole)兰索拉唑在吡啶环4位侧链导入氟原子(F3),以三氟乙氧基为取代基,亲脂性较强,可迅速透过壁细胞膜转变为次磺酸和次磺酰衍生物而发挥作用,生物利用率较奥美拉唑提高了30%。
单剂给药后,平均半衰期为1.3~1.7h。
动物实验表明,该化合物对大白鼠的酸分泌抑制作用比奥美拉唑强2~3倍,并且对大白鼠的胃、十二指肠溃疡有明显的损伤预防作用,对慢性溃疡、受体拮抗剂难以治愈的溃疡病有明显的治愈促进作用。
新的兰索拉唑分散片剂型生物利用度和兰索拉唑胶囊相似,服用方便,可快速地在口腔中分解,易于吞咽,可随患者唾液一起咽下,有水或无水时均可服用,无水口服和有水口服时生物利用度相似,特别适用于那些吞咽困难和老年患者,服用方便,可提高患者依从性1.3 泮托拉唑(pantoprazole)泮托拉唑为合成的二烷氧基吡啶化合物,在吡啶环4位上去甲基并与磺酸盐结合,在壁细胞小管中转化为环状次磺酰胺。

老年人质子泵抑制剂合理应用质子泵抑制剂(proton pumpinhibitors,PPIs)自上世纪80年代问世至今20多年来,显着地改善了酸相关性疾病的临床结局,对酸相关性疾病的治疗具有里程碑式的意义。
由于其突出的疗效和良好的安全性,在临床上的应用范围不断扩大,处方量与日俱增。
但是近几年来,PPIs过度使用(超适应证、超剂量、超疗程)的问题日益突出,潜在的不良反应也备受重视。
PPIs是老年人的常用药物之一,老年人共病多,常多重用药,药物间相互作用机会多,药物不良反应发生率高。
因此,老年患者如何科学、合理应用PPIs也尤为重要。
常用PPIs的标准剂量(常规剂量)分别为:奥美拉唑20 mg/d,兰索拉唑30mg/d,泮托拉唑40mg/d,雷贝拉唑10 mg/d,埃索美拉唑20 mg/d;艾普拉唑10 mg/d。
一、老年人PPIs的药代动力学特点及作用机制老年肝脏对药物的代谢转化能力降低,肾脏对药物的清除能力降低,药物半衰期延长、肾毒性增加。
PPIs在体内代谢迅速,血浆半衰期在2 h以内,蛋白结合率均在90%以上。
PPIs 主要通过细胞色素P450系统中的CYP2C19和CYP3A4在肝内代谢,并经肾脏清除。
CYP2C19是大部分PPIs在肝内代谢的主要途径,80%以上的奥美拉唑、50%以上的埃索美拉唑和兰索拉唑经CYP2C19代谢,其次是经CYP3A4、CYPlA2代谢;泮托拉唑虽主要经CYP2C19代谢,但对其亲和力较低,且其特有的二相代谢,也降低了其对CYP2C19的依赖性;雷贝拉唑要经烟酰胺嘌呤二核苷酸磷酸(NADP)代谢,其次经CYP3A4、CYP2C19代谢;由此可见,常用的5种PPls对CYP2C19的依赖性存在差异,泮托拉唑和雷贝拉唑对CYP2C19的依赖性较低[昏7。
老年人肾功能不全和轻中度肝功能不全患者的PPIs药代动力学与青年人相似,所以无需调整剂量;但严重肝功能不全患者,其最大曲线下面积(AUCmax)值为肝功能正常者的2~3倍,血浆半衰期明显延长,应用PPIs应相应减量。

质子泵抑制剂临床药理全解析作者:杜文琪来源:中国医学论坛报日期:2011-06-16梁茂植,教授,临床药理学、体内药物分析及药代动力学领域研究员,研究生导师,四川大学华西医院国家药品临床试验机构副主任兼Ⅰ期临床试验研究室主任,临床药理研究室主任,中国药理学会临床药理专委会委员,中华医学会四川省分会第六届理事,中国药学会四川省分会临床药学专委会副主任委员,中华医学会四川省分会医院药学专业委员会委员,中国色谱学会四川省分会副秘书长,中国西部地区有机质谱委员会理事,国家食品药品监督管理局新药审评专家库成员,四川省国家食品药品监督管理局新药评审委员,四川省药品安全评价专家库成员。
主要研究方向为生物药物分析、手性药物代谢动力学和代谢物组学。
质子泵抑制剂(PPI)的诞生是消化系统疾病尤其酸相关疾病治疗史的一个里程碑。
尽管PPI在临床应用已有20年的历史,但临床医师对其的认识仍存在多种误区,如不同PPI 制剂的个体差异性、代谢途径及PPI是否与氯吡格雷存在相互作用等,这些困惑或多或少对PPI临床合理应用造成了影响。
近日,本报记者就上述问题对临床药理专家、四川大学华西医院梁茂植教授进行了专访。
《中国医学论坛报》(以下简称《论坛报》):药物代谢特征与其临床疗效和副作用均有密切关系,请介绍一下PPI的代谢特征。
梁茂植:多数药物在体内的代谢转化主要在肝脏进行,可分为第一相代谢反应和第二相代谢反应。
第一相代谢反应包括氧化、去甲基化和水解反应。
药物经过第一相的氧化、去甲基化等代谢作用后,非极性脂溶性化合物变为极性和水溶性较高而活性较低的代谢物。
涉及的药物代谢酶95%以上是细胞色素P450(CYP)类酶,主要有CYP2C、CYP2D6、CYP2E1和CYP3A。
第二相反应是结合反应,指药物或其第一相代谢物与内源性结合剂的结合反应。
结合后药物毒性或活性降低、极性增加而易于被排出,以葡萄糖醛酸结合反应为最常见,此外的结合剂还有硫酸和谷胱甘肽。
PPI之大不同人体胃黏膜壁细胞分泌小管膜上的H+/K+-ATP酶又称质子泵或酸泵,能选择性地抑制H+/K+-ATP酶的药物——质子泵抑制剂( proton-pump inhibitors,PPIs)已成为一代新型抑酸药物,对胃酸分泌均有显著的抑制作用,是目前治疗酸相关疾病(消化性溃疡、反流性食管炎等)的首选药物。
(一)分类及作用机制:PPIs 的分类,按照其结构特点可分2 种。
类型1: 苯并咪唑类衍生物( 结构式见图1) ,不可逆PPIs,也就是传统的质子泵抑制剂,代表药为:奥美拉唑、兰索拉唑、泮托拉唑、雷贝拉唑(部分可逆)。
作用机制:PPI为弱碱性化合物,在碱性环境中不易解离,为非活性状态的前药,可通过细胞膜进入到壁细胞分泌管内,遇到PH为2以下的酸性环境,PPI可转化为次磺酸活性体,与H+/K+-ATP酶不可逆结合从而使其失活,从而抑制胃酸的分泌,直到新的质子泵产生,壁细胞才能恢复泌酸功能,从而使pH值24h维持稳定。
由于PPIs是作用于壁细胞胃酸分泌的最后步骤,因此是目前已发现的作用最强的一类胃酸分泌抑制剂。
类型2: 咪唑吡啶替代物( 结构式见图2) ,可逆型PPIs(reversible proton pump inhibitions,RPPIs)新型质子泵抑制剂,代表药: 盐酸瑞伐拉赞(国内未上市),作用机制: 可竞争性抑制胃壁细胞上质子泵中高亲和部位的钾离子结合位点,抑制细胞浆中的H + 与胃分泌管中的K + 间的相互交换,而达到抗胃酸分泌的作用。
(二)药代动力学不同PPI药代动力学比较不同PPI在特殊人群中的药动学特点和剂量调整(三)药理学特点:不同PPI药理作用特点(四)相互作用PPI与药物相互作用主要有以下两种因素:1、抑制胃酸分泌,胃内PH值升高,影响其他药物吸收;固体食物的胃排空涉及一系列消化水解过程,PPI 抑制酸依赖的消化活性,从而延缓胃排空,影响药物的吸收、分布。
对所有的PPIs:①影响抗真菌药物吸收(伊曲康唑、酮康唑:伊曲康唑、酮康唑只有在上消化道的酸性环境中才能吸收);②影响铁剂吸收(铁剂以亚铁离子形式在十二指肠及空肠近端吸收,胃酸有助于铁吸收,PH升高,铁吸收减少)③增加地高辛吸收:降低胃液酸度, 可能减少地高辛水解,增加其吸收,加重地高辛中毒的危险2、通过肝药酶CYP450 ,影响经其代谢的其他药物。
质子泵抑制剂的分类及药理学特性陈坚【期刊名称】《上海医药》【年(卷),期】2013(000)021【摘要】Proton pump inhibitors bind covalently to the gastric H+/K+-ATPase via disulfide bond. Proton pump inhibitors are the most potentanti-secretary agent for gastric acid and they are the ifrst choice of acid-related disorders such as peptic ulcer and gastro-esophageal relfux disease or non-steroidal anti-inlfammatory drugs-induced gastrointestinal lesions. Omeprazole is the first proton pump inhibitor marketed in 1988, followed by pantoprazole, lansoprazole, rabeprazole, esomeprazole, revaprazan, ilaprazole and dexlansoprazole. Though these proton pump inhibitors share the core structures of benzimidazole and pyridine, they possess a little bit difference in pharmacokinetics and pharmacodynamics. Pharmacological characteristics of some proton pump inhibitors marketed in China are brielfy introduced so as to promote their rational use in clinic.%选择性抑制胃壁细胞上H+/K+-ATP酶的药物--质子泵抑制剂已成为一代新型抑酸药物,是目前治疗酸相关疾病(消化性溃疡、反流性食管炎等)以及非甾体类抗炎药相关胃肠病变的首选药物。