高考化学 醇羟基、酚羟基与羧羟基的区别和联系(1)四十大考点学案
- 格式:doc
- 大小:556.50 KB
- 文档页数:12
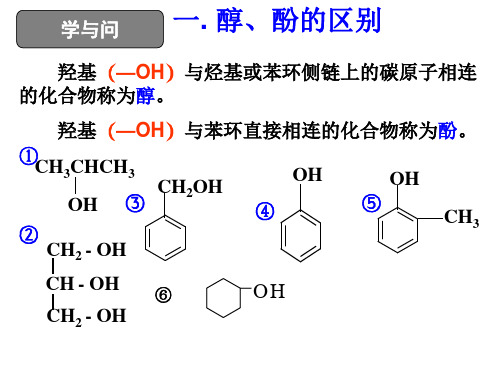
醇、酚1.掌握乙醇的主要化学性质;2.了解醇类的结构特点、一般通性和几种典型醇的用途;3.掌握苯酚的主要化学性质;4.了解酚类的结构特点和苯酚的物理性质及用途;5.认识有机物中原子与原子团之间的相互影响。
烃的衍生物:烃分子中的H被其它原子或原子团代替所得物质。
根据官能团的种类可分为:一、醇、酚的定义:(注意它们的区别)醇:酚:二、醇类1、醇的分类一元醇:按羟基数目分二元醇:多元醇:醇饱和脂肪醇:脂肪醇按烃基的类别分不饱和脂肪醇:芳香醇:2、醇的命名CH2OH CH3CH2CHCH3OH CH3CHCH2OHOH1,2,3—丙三醇(甘油)3、醇的同分异构体醇类的同分异构体可有碳链异构、羟基的位置异构,相同碳原子数的饱和一元醇和醚是类别异构。
思考:写出C4H10O的同分异构体。
4、醇的物理通性:⑴熔沸点:a比相应的烃高(分子间形成氢键);b随n(C)的增大熔沸点升高;c同n(C)时,-OH数目越多熔沸点越高。
⑵溶解性:低级醇与水互溶(与水分子能形成氢键),随n(C)的增大溶解性减小。
5、乙醇的化学性质(醇类的重要代表物)⑴乙醇分子结构与化学性质的关系在乙醇分子中,氧原子吸引电子的能力比氢原子和碳原子强,O—H键和C—O键的电子对都向氧原子偏移。
因而醇在起反应时,O—H键容易断裂,同样C—O键也容易断裂。
置换、酯化———断裂取代(HX)——断裂催化氧化——断裂分子内脱水(消去)——断裂分子间脱水(取代)——断裂⑵化学性质①置换反应:(乙醇与金属钠的反应)②消去反应:说明:a.浓H2SO4的作用:、b.混合液的配制:乙醇与浓硫酸体积比1:3(如何混和?)c.温度控制:迅速将温度升到170℃,不能过高或过低(原因)温度计的水银球在d.加热前加几粒碎瓷片,防止暴沸。
③取代反应:(酸与醇的反应不都是酯化反应)④氧化反应:a.燃烧氧化:b.催化氧化:c.强氧化剂氧化:酸性KMnO4、K2Cr2O7(橙色→绿色)小结:有机氧化还原反应:氧化反应:加氧或去氢,还原反应:加氢或去氧,⑤酯化反应:三、酚类1、酚类知识:⑴代表物:苯酚⑵苯酚的同系物:C n H2n—6O,如:CH3—C6H4—OH①酚中烃基异构⑷酚的同分异构体②与芳香醇异构③与芳香醚练习:写出C8H10O,分子中含有苯环的有机物的同分异构体2、物性:⑴色、态、味: ⑵熔沸点:43℃(保存,使用) ⑶溶解性: ⑷毒性:有毒,对皮肤有腐蚀性(不慎沾到皮肤上应立即用 洗涤)说明:在溶液中生成的苯酚一般以水合物的形式存在,呈液态,不溶于水,ρ>1g ·cm -3 3、结构特点: ⑴苯环与—OH 互相影响苯环对—OH 的影响:C —O 极性减弱,O —H 极性增强——酸性,显色—OH 对苯环的影响:邻、对位H 活泼性增强——取代⑵苯酚—OH 中的H 原子与苯环不在同一平面内。

目录第一章化学反应及能量变化第一课时氧化还原反应第二课时离子反应第三课时化学反应中的能量变化燃烧热和中和热第二章碱金属第一课时钠及其化合物第二课时碱金属元素第三章物质的量第一课时物质的量和气体摩尔体积第二课时物质的量浓度第三课时有关物质的量的计算第四章卤素第一课时氯气及其化合物第二课时卤族元素第五章物质结构元素周期律第一课时原子结构第二课时元素周期律元素周期表第三课时化学键和分子结构第四课时非极性分子和极性分子第五课时晶体的类型和性质第六章氧族元素硫酸工业第一课时氧族元素第二课时硫硫酸第三课时接触法制硫酸第四课时环境保护绿色化学第七章碳族元素无机非金属材料第一课时碳族元素第二课时硅二氧化硅无机非金属材料第八章氮族元素第一课时氮与磷第二课时氨铵盐第三课时硝酸第九章化学反应速率化学平衡第一课时化学反应速率第二课时化学平衡影响化学平衡的条件第三课时合成氨工业有关化学平衡的计算第十章电离平衡第一课时电离平衡第二课时水的电离和溶液的pH值第三课时盐类的水解第四课时酸碱中和滴定第十一章几种重要的金属第一课时金属的概述第二课时镁铝及其化合物第三课时铁及其化合物第四课时金属的冶炼第十二章烃第一课时甲烷的性质与“四同”规律第二课时不饱和烃的性质与空间构型第三课时苯及其同系物的结构和性质第四课时有机物的燃烧规律及有机计算第十三章电化学原理第一课时原电池原理及其应用第二课时电解原理及其应用第三课时胶体的性质及应用第十四章烃的衍生物第一课时卤代烃的两大反应和基团的移动和保护第二课时醇羟基、酚羟基与羧羟基的区别和联系(1)第三课时醇羟基、酚羟基与羧羟基的区别和联系(2)第四课时羟基酸、氨基酸、脂肪酸的性质第五课时醛、酯的重要性质与拓展第六课时有机化学实验探究第十五章糖类蛋白质第一课时糖类第二课时油脂第三课时蛋白质第十六章合成材料第一课时有机反应规律第二课时有机合成方法第十七章化学实验方案的设计第一课时物质的制备和性质实验方案的设计第二课时物质的检验前言本教学案是依据高考化学考试大纲及新课程标准的精神编写的,覆盖了整个高一、高二、高三的学习、教学与备考。

高中常用官能团知识点在高中化学中,官能团是有机化学部分的重要知识点,它们决定了有机化合物的性质和反应类型。
接下来,让我们一起深入了解一下高中常见的官能团。
一、羟基(—OH)羟基是醇和酚类化合物的官能团。
醇中的羟基与脂肪烃基相连,而酚中的羟基直接与苯环相连。
醇羟基具有一定的活泼性,能与活泼金属(如钠)反应产生氢气。
例如乙醇与钠反应:2CH₃CH₂OH +2Na → 2CH₃CH₂ONa + H₂↑ 。
醇羟基在一定条件下还能发生消去反应生成烯烃,比如乙醇在浓硫酸加热的条件下发生消去反应:CH₃CH₂OH →(浓硫酸,170℃)CH₂=CH₂↑ + H₂O 。
此外,醇羟基也能被氧化,比如乙醇在铜或银作催化剂加热的条件下被氧化为乙醛:2CH₃CH₂OH + O₂ →(Cu或 Ag,加热) 2CH₃CHO + 2H₂O 。
酚羟基由于苯环的影响,比醇羟基更活泼。
酚羟基能与氢氧化钠溶液反应,而醇羟基一般不能。
酚羟基还能使苯环上的邻、对位氢原子更容易发生取代反应。
二、醛基(—CHO)醛基存在于醛类化合物中。
醛基具有较强的还原性,能与新制氢氧化铜悬浊液反应生成砖红色沉淀,与银氨溶液发生银镜反应。
这两个反应常用于醛基的检验。
例如,乙醛与新制氢氧化铜反应:CH₃CHO + 2Cu(OH)₂+NaOH → CH₃COONa + Cu₂O↓ + 3H₂O ;乙醛与银氨溶液反应:CH₃CHO + 2Ag(NH₃)₂OH → CH₃COONH₄+2Ag↓ + 3NH₃+H₂O 。
醛基还能被氢气还原为醇羟基,例如乙醛与氢气反应:CH₃CHO + H₂ →(催化剂,加热) CH₃CH₂OH 。
三、羧基(—COOH)羧基是羧酸的官能团。
羧基具有酸性,能与碱发生中和反应,与活泼金属反应产生氢气。
例如,乙酸与氢氧化钠反应:CH₃COOH +NaOH → CH₃COONa + H₂O ;乙酸与钠反应:2CH₃COOH +2Na → 2CH₃COONa +H₂↑ 。

酚羟基和醇羟基
酚羟基和醇羟基是化学中非常重要的两种羟基,在很多领域都有着广泛的应用。
酚羟基是有电荷的醇羟基的衍生物,其分子结构中含有羟基和一个官能团,官能团形式由一个氧原子与一个具有电荷的碳原子组成,由此可以看出,这样的羟基具有电荷,称为正羟基或负羟基。
酚羟基在各种反应中都起着改变还原性质的作用,是生物体新陈代谢中重要的组成部分。
此外,酚羟基还可以用作药物活性物质的重要组分,可作为缓冲剂来控制酸碱度和电荷,还可以作为氧化剂或还原剂来影响化学反应的速度。
醇羟基(アルコール基)是一类植物油脂,它们具有一个带有芳香尾部的醇基结构,再加上一个羟基,最常见的羟基是由氫的正电荷组成的羟基—OH基,植物
油脂主要是由醇羟基组成的,所以也被成为醇羟基油脂。
这些油脂可以分解成三个主要部分:碳链,由一系列碳原子键连起来即烃部分;氢原子,根据它们是互相连接的形式,可以分解成脂肪酸和醇基;羟基部分,即醇羟基的羟基部分,包含一个氫原子和一个氧原子之间的共价键,这是它具有抗氧化性能的主要原因。
类似这样的醇羟基遍布在生物体中各处,具有改变生物体物质组成的作用,并参与多种新陈代谢过程中的重要反应或反应网络。
综上所述,酚羟基和醇羟基历来是化学研究中重要的化合物,并为人类提供了许多有用的产品,可以用于物质组成的改变,新陈代谢,抗氧化以及其他多种领域,其重要性无可置疑。
![[原创]醇羟基和酚羟基的化学活性比较doc高中化学](https://img.taocdn.com/s1/m/2d7831b64431b90d6d85c70f.png)
[原创]醇羟基和酚羟基的化学活性比较doc 高中化学——乙醇、苯酚与钠反应的实验分析及改进江正玲1 林海斌1* 陈美英2〔1.浙江省温岭市温岭中学 317500;2.浙江省温岭市新河中学 317502〕摘要:乙醇、苯酚与金属钠反应是比较醇羟基和酚羟基化学活性的常用方法之一。
通过对苏教版实验化学教材中设计的实验进行尝试并分析其不足,认为这种比较必须满足3个条件:乙醇、苯酚溶液的物质的量浓度相等,金属钠完全浸没在溶液中,溶剂能及时溶解反应产生乙醇钠和苯酚钠。
在此基础上提出乙醇、苯酚与金属钠反应的对比实验方法并进行实验验证。
关键词:醇羟基 酚羟基 化学活性 实验比较1 咨询题提出苏教版«实验化学»专题2课题2〝乙醇和苯酚的性质〞中设计了〝乙醇、苯酚与金属钠的反应〞的实验:在两只干燥的试管里各加入2mL乙醚,向其中一支试管加入1mL 乙醇,向另一支试管中加入约1.5g 苯酚,振荡。
在向上述两支试管中各加一小块〔绿豆大小〕吸干煤油的金属钠,观看、比较实验现象。
该实验试图通过金属钠分不与乙醇、苯酚反应放出气体的速度快慢来比较醇羟基和酚羟基的活性。
我们按照上述要求进行了多次实验,但结果均出乎意料:金属钠沉入乙醇的乙醚溶液底部,且产生较多的气泡;金属钠浮在苯酚的乙醚溶液液面上,且产生的气泡不如乙醇的乙醚溶液多〔图1、表1〕。
表 1 乙醇、苯酚的乙醚(2mL)溶液分不与金属钠反应试管编号与金属钠反应的溶液 实验现象 1-A1mL 乙醇+2mL 乙醚 金属钠沉在液体底部,生成气泡的速率较快 1-B 1.5g 苯酚+2mL 乙醚 金属钠浮在液面上,生成气泡的速率较慢基的活性大于酚羟基,这与已有的体会〔酚羟基的化学活性大于醇羟基〕是相违抗的。
是实验设计有咨询题,依旧另有内情?2 咨询题分析要比较醇羟基和酚羟基的活性,第一要保证醇羟基和酚羟基的浓度相等,即乙醇的浓度与苯酚的浓度相等。
1mL 乙醇的物质的量约为0.017mol ,1.5g 苯酚的物质的量约为0.016mol ,可见溶质的物质的量差不多相同。
渤海石油第一中学2011-2012学年度高二化学第二学期导学案 课题:烃的含氧衍生物(第六课时) 主备:孙丽楠 审核:谢学志 使用时间: 使用者: 编码:19第1页学案19:专题复习 醇羟基、酚羟基、羧基例1、在某有机物A 的分子中,具有酚羟基、醇羟基、 羧基等官能团,其结构简式如右图。
请写 出以下化学反应的方程式。
①A 跟NaOH 溶液反应:。
②A 跟NaHCO 3溶液反应:。
③A 在一定条件下跟Na 反应:。
练习1:已知苯酚能跟碳酸钠溶液反应而溶解于碳酸钠溶液中。
在下图所示的转化关系中,括号内编号①-⑤表示某种化学试剂:用化学式填空:①是___ __②是___ __③是____ __④是__ ⑤是____ 【练习2】有机物A 分子结构为, 写出A 实现下列转变所需的药品(1)A 转变为(2)A 转变为(3)A 转变为【练习3】将COONaOCOCH 3转变为COONaOH的方法为 ( )A .与稀H 2SO 4共热后,加入足量的Na 2CO 3B .溶液加热,通入足量的HClC .与足量的NaOH 溶液共热后,再通入CO 2D .与稀H 2SO 4共热后,加入足量的NaOH【练习4】已知A 物质的分子结构简式如下: , lmol A 与足量的NaOH 溶液混合共热,充分反应后最多消耗NaOH 的物质的量为 ( ) A .6mol B .7mol C .8mo1 D .9mo1 【练习5】咖啡鞣酸具有较广泛的抗菌作用,其结构简式如下所示:关于咖啡鞣酸的下列叙述不正确的是 ( )A .分子式为C l6H 18O 9B .与苯环直接相连的原子都在同一平面上C .1 mol 咖啡鞣酸水解时可消耗8 mol NaOHD .与浓溴水既能发生取代反应又能发生加成反应 【练习6】、有关下图所示化合物的说法不正确的是( ) A.既可以与Br 2的CCl 4溶液发生加成反应,又可以在光照下与Br 2发生取代反应 B.1mol 该化合物最多可以与3molNaOH 反应 C.既可以催化加氢,又可以使酸性KMnO 4溶液褪色D.既可以与FeCl 3溶液发生显色反应,又可以与NaHCO 3溶液反应放出CO 2气体。
酚羟基和羟基有什么区别?广义的羟基包括酚羟基和醇羟基,狭义的羟基可以仅指醇羟基。
酚羟基比醇羟基活泼,有一定酸性,如苯酚的羟基可以和碱反应;另外酚羟基的还原性也较强,易被氧化为有颜色的醌类化合物,醇羟基无此性质。
另外:酚羟基可以电离出H+,而羟基是不可以的。
其他回答共6条2010-05-03 13:02戴蝴蝶结的小猪|十二级广义的羟基包括酚羟基和醇羟基,狭义的羟基可以仅指醇羟基。
酚羟基比醇羟基活泼,有一定酸性,如苯酚的羟基可以和碱反应;另外酚羟基的还原性也较强,易被氧化为有颜色的醌类化合物,醇羟基无此性质。
[提问者认可]|9|评论2007-08-01 23:17simbalong|十一级脂肪链上的羟基电离氢离子的能力比较差而份羟基上的羟基,由于氧的电子与芳香环电子共轭的影响,对氢离子的束缚能力减弱,相对容易电离出氢离子[提问者认可]|5|评论2007-08-01 23:19rachel0829|四级酚羟基也是羟基,只是是与苯环直接相连的,是酚类的官能团。
不与苯环直接相连的是醇羟基,是醇类的官能团。
4|评论2010-05-03 12:58竹蜻蜓的记忆|三级酚羟基容易被氧化。
能够和NAOH反应酚羟基的临间对位如果没有取代基占位一般可以与饱和溴水发生取代反应典型反应是生成三溴苯酚的那个1|评论2010-05-03 13:03EViolent|六级羟基在溶液中没有酸性,若相连碳上有氢,则可以被催化氧化成醛基酚羟基溶液有弱酸性,可以和碱发生中和反应1|评论高中酚羟基与醇羟基有什么相似的化学性质,他们又有什么区别如都可以跟Na反应放出氢气,但醇羟基现象比较明显,谢谢2010-01-06 21:28酚羟基的氢比醇羟基的更容易电离,或者说酚羟基的酸性更强原理对一般高中生来说有点复杂,简而言之是苯环(芳环)的共轭体系减少了氧的负电荷首先强调一点就是:Na与酚、醇反应时,酚现象更明显。
因为,Na和这些物质(包括水,酸等)反应时,速率取决于该物质电离出氢离子的能力(或者说是某些基团上氢的活性大小),而这个能力大小为:酸〉酚〉水〉醇(以乙醇为例,高中阶段把乙醇看成非电解质),故醇与Na反应现象是:缓慢放出气体。
无师自通四十大考点高考化学学案:醇羟基、酚羟基与羧羟基的区别和联系(1)【考纲要求】1.掌握乙醇、苯酚、乙酸的结构、性质及醇、酚、羧酸相互转变关系。
2.理解官能团或基团间的相互影响对有机物性质的影响。
教与学方案【自学反馈】1.乙醇的分子结构:结构简式:官能团:【拓展】饱和一元醇的通式:饱和二元醇的通式:例:饱和三元醇的通式:例:芳香一元醇的通式:例:2.乙醇的物理性质3.乙醇的化学性质⑴跟金属的反应方程式:⑵跟氢卤酸的反应方程式:⑶氧化反应(A)燃烧(B)催化氧化【规律】⑷脱水反应方程式【规律】4.乙酸的结构和性质⑴乙酸的结构结构简式:官能团:【拓展】饱和一元酸的通式:饱和二元酸的通式:。
⑵乙酸的化学性质(a)酸性:【拓展】相同条件下常见的物质的酸性强弱比较:(b)酯化反应【规律】5酚、苯、环己醇的性质⑴与金属Na反应类别芳香烃醇酚物质反应现象方程式原因⑵与氢氧化钠反应类别芳香烃醇酚物质]反应现象方程式原因⑶与溴反应类别芳香烃醇酚物质反应条件反应现象方程式原因(4)与KMnO4(H+)反应类别芳香烃醇酚物质反应现象⑸与硝酸或氢溴酸反应⑹特性6.醇羟基、酚羟基与羧羟基的性质所属类别醇酚羧酸与羟基连接的基团官能团名称官能团化学式常见代表物主要化学性质与Na反应[]与NaOH(碱)反应与NaHCO3反应与Na2CO3反应脱水反应氧化反应原因类别芳香烃醇酚物质[, HNO3 ,HBr ,HNO3反应条件方程式原因物质特性类别芳香烃醇酚酯化反应【例题解析】【例1】甲酸的下列性质中,可以证明它是弱电解质的是A.1mol/L甲酸溶液的pH值约为2B.甲酸能与水以任何比例互溶C.10mL1mol/L甲酸恰好与10mL1mol/LNaOH溶液完全反应D.在相同条件下,甲酸溶液的导电性比强酸溶液弱解题思路: 。
易错点: 。
【例2】已知乙醇可以与氯化钙反应生成微溶于水的CaCl2·6C2H5OH。
有关有机试剂的沸点如下:CH3COOC2H5为77.1℃,C2H5OH为78.3℃,C2H5OC2H5为34.5℃,CH3COOH为118℃。
实验室中制取乙酸乙酯的粗产品的步骤如下:在蒸馏烧瓶中将过量的乙醇与少量的浓硫酸混合,然后经分液漏斗边滴加醋酸,边加热蒸馏,由上面的实验可得到含有乙醇、乙醚、醋酸和水的粗产品。
(1)反应中加入乙醇是过量的,其目的是。
(2)边滴加醋酸,边加热蒸馏的目的是。
将粗产品再经下列步骤精制(3)为了除去粗产品中的醋酸,可向产品中加入。
A.无水乙醇 B.碳酸钠粉末 C.无水醋酸钠(4)向粗产品中加入饱和的氯化钙溶液,振荡、分离的目的是。
(5)向粗产品中加入无水硫酸钠,振荡的目的是。
解题思路: 。
易错点: 。
【考题再现】1. 2,4,5-三氯苯酚和氯乙酸反应可制造除草剂2,4,5 三氯苯氧乙酸。
某生产该除草剂的工厂曾在一次事故中泄漏出一种有毒的二恶英,简称TCDD。
有关物质的结构式如下:请写出:(1)生成2,4,5 三氯苯氧乙酸反应的化学方程式(2)由2,4,5 三氯苯酚生成TCDD反应的化学方程式思维方法: 。
展望高考:2. 松油醇是一种调香香精,它是α、β、γ三种同分异构体组成的混合物,可由松节油分馏产品A(下式中的18是为区分两个羟基而人为加上去的)经下列反应制得:试回答:(1)α—松油醇的分子式(2)α—松油醇所属的有机物类别是(多选扣分)(a)醇(b)酚(c)饱和一元醇(3)α—松油醇能发生的反应类型是(多选扣分)(a)加成(b)水解(c)氧化(4)在许多香料中松油醇还有少量的以酯的形式出现,写出RCOOH和α—松油醇反应的化学方程式。
(5)写结简式:β—松油醇,γ—松油醇。
思维方法: 。
展望高考:【针对训练】A.基础训练1.下列说法错误..的是A.乙醇和乙酸都是常用调味品的主要成分B.乙醇和乙酸的沸点和熔点都比C2H6、C2H4的沸点和熔点高C.乙醇和乙酸都能发生氧化反应D.乙醇和乙酸之间能发生酯化反应,酯化反应和皂化反应互为逆反应2.分子式为C4H10O并能与金属钠反应放出氢气的有机化合物有A.3种B.4种C.5种D.6种3.香兰素是重要的香料之一,它可由丁香酚经多步反应合成。
OHOCH3 CH2CH CH2OHOCH3 CHO丁香酚香兰素有关上述两种化合物的说法正确的是A.常温下,1mol丁香酚只能与1molBr2反应B.丁香酚不能FeCl3溶液发生显色反应C .1mol 香兰素最多能与3mol 氢气发生加成反应D .香兰素分子中至少有12个原子共平面4.(08江苏卷)布噁布洛芬是一种消炎镇痛的药物。
它的工业合成路线如下:CHCN HOCH 3HNO 3CH 3COOHCHCN HO CH 3O 2NH 2Pd/C 催化剂C 9H 10N 2O1)盐酸2)调节pHC 9H 11NO 31)C 2H 5OH ,H +2)调节pHCHCOOC 2H 5HOCH 3H 2NClCOCl吡啶C 18H 16NO 3Cl1)NaOH 2)H +NOCHCOOH CH 3Cl布噁布洛芬ABCD EFG请回答下列问题:⑴A 长期暴露在空气中会变质,其原因是 。
⑵有A 到B 的反应通常在低温时进行。
温度升高时,多硝基取代副产物会增多。
下列二硝基取代物中,最可能生成的是 。
(填字母)a .OHO 2NNO 2CH CN CH 3b .OHO 2NCH CN CH 3O 2Nc .OHNO 2O 2NCH CN CH 3d .OHO 2NNO 2CH CN CH 3⑶在E 的下列同分异构体中,含有手性碳原子的分子是 。
(填字母)a .HO CH 2CHCOOCH 3H 2NCH 3b .HO CH 2COOCH(CH 3)2H 2Nc .HOCHCHCOOH H 2NCH 3CH 3d .HOH 2NCCH 2COOH CH 3CH 3⑷F 的结构简式 。
⑸D 的同分异构体H 是一种α-氨基酸,H 可被酸性KMnO 4溶液氧化成对苯二甲酸,则H 的结构简式是 。
高聚物L 由H 通过肽键连接而成,L 的结构简式是 。
B .提高训练5.(08江苏卷)某有机样品3.1g 完全燃烧,燃烧后的混合物通入过量的澄清石灰水,石灰水共增重7.1g ,经过滤得到10g 沉淀。
该有机样品可能是( ) A .乙二醇 B .乙醇C .乙醛D .甲醇和丙三醇的混合物6.醇氧化成醛的反应是药物、香料合成中的重要反应之一。
(1)苯甲醇可由C4H5CH2Cl在NaOH水溶液中发生取代反应而得,反应方程式为。
(2)醇在催化作用下氧化成醛的反应是绿色化学的研究内容之一。
某科研小组研究了把催化剂在氧气气氛中对一系列醇氧化成醛反应的催化效果,反应条件为:K2CO3、363K、甲苯(溶剂)。
实验结果如下:分析表中数据,得到把催化剂催化效果的主要结论是 (写出2条)。
(3)用空气代替氧气气氛进行苯甲醇氧化生成苯甲醛的反应,其他条件相同,产率达到95%时的反应时间为7.0小时。
请写出用空气代替氧气气氛进行反应的优缺点:。
(4)苯甲醛易被氧化。
写出苯甲醛被银氨溶液氧化的反应方程式 (标出具体反应条件)。
(5)在药物、香料合成中常利用醛和醇反应生成综醛来保护醛基,此类反应在酸催化下进行。
例如:①在以上醛基保护反应中要保证反应的顺利进行,可采取的措施有 (写出2条)。
②已知具有五元环和六元环结构的缩醛比较稳定。
写出用乙二醇(HOCH2CH3OH)保护苯甲醛中醛的反应方程式。
C.能力训练7.下列各组物质不属于...同分异构体的是A.2,2-二甲基丙醇和2-甲基丁醇B.邻氯甲苯和对氯甲苯C.2-甲基丁烷和戊烷D.甲基丙烯酸和甲酸丙酯8. A、B、C、D、E、F和G都是有机化合物,它们的关系如下图所示:(1)化合物C 的分子式是C 7H 8O ,C 遇FeCl 3溶液显紫色,C 与溴水反应生成的一溴代物只有两种,则C 的结构简式为 。
(2)D 为一直链化合物,其相对分子质量比化合物C 的小20,它能跟NaHCO 3反应放出CO 2,则D分子式为,D具有的官能团是 。
(3)反应①的化学方程式是 。
(4)芳香化合物B 是与A 具有相同官能团的同分异构体,通过反应②化合物B 能生成E 和F ,F 可能的结构简式是 。
(5)E 可能的结构简式是 。
9.下列各化合物的命名中正确的是10.霉酚酸酯(MMF)是器官移植中抑制细胞增殖最常用的药物。
下列关于MMF 的说法正确的是A .MMF 能溶于水B .MMF 能发生取代反应和消去反应C .1molMMF 能与6mol 氢气发生加成反应D .1molMMF 能与含3molNaOH 溶液完全反应11.大脑营养学研究发现,大脑的生长发育与不饱和脂肪酸有密切的关系,从深海鱼油中提取的,被称为“脑黄金”的DHA 就是一种不饱和程度很高的脂肪酸,它的分子中含6个碳碳双键,学名二十六碳六烯酸,它的分子组成应是A .C 25H 50COOH B.C 25H 39COOH C .C 26H 41COOH D .C 26H 47COOH D .奥赛一瞥12.以CH 2 = CH 2 和H 218O 为原料,自选必要的其他无机试剂合成 。
用化学方程式表示实现上述合成最理想的反应步骤。
C 2H 5C CH 3O O1813.羧酸酯RCOOR′在催化剂存在时可以跟醇R″OH发生如下反应(R′、R″是两种不同的烃基):RCOOR′+ R″OH RCOOR″+ R′OH,此反应称为酯交换反应,常用于有机合催化剂成中。
在合成维纶的过程中,有一个步骤是把聚乙酸乙烯酯转化成聚乙烯醇,这一步就是用过量的甲醇进行酯交换反应来实现的。
(1)反应中甲醇为什么要过量?(2)写出聚乙烯醇的结构简式。
(3)写出聚乙酸乙烯酯与甲醇发生酯交换反应的化学方程式。
第二课时醇羟基、酚羟基与羧羟基的区别和联系(1)【例题解析】1. 【解析】本题以有机酸--甲酸为背景,考查学生的电解质溶液知识。
弱酸不能完全电离,故1mol/L时PH大于0,且在相同条件下,溶液的导电性比强酸溶液弱。
【答案】A、D2. 【解析】醇与酸发生的酯化反应是可逆反应,因此,加入过量的乙醇和边加热蒸馏的目点均是为了使平衡向生成酯的方向移动。
除去醋酸可用碱性物质,故应选用碳酸钠粉末。
利用题中乙醇可以与氯化钙反应生成微溶于水的CaCl2·6C2H5OH的信息可知,其目点是除去乙醇。
无水硫酸钠可以吸水成芒硝,故加入它的目的是除水。
【答案】(1)增大乙醇的浓度,使平衡向生成酯的方向移动。
(2)增大乙酸的浓度,减小生成物乙酸乙酯的浓度,使平衡向生成酯的方向移动。
(3) B(4)除去粗产品中的乙醇。
(5)除去粗产品中的水。
[考题再现]1. (1)(2)2.(1)C10H1818O(2)a(3)a、c(4)RCOOH+→ +H2O(5)【针对训练】1、解析:皂化反应是指高级脂肪酸甘油酯在碱性条件下的水解反应,而酯化反应是有机酸或无机酸与醇发生的反应,所以皂化反应为酯的水解反应的一部分。