生物物理技术章
- 格式:ppt
- 大小:2.40 MB
- 文档页数:46

《生物物理学》自学指导书一、课程编码及适用专业课程编码:1010引211总学时:108面授学时:36口学学时:72适用专业:生物类本科各专业(函授本科)二、课程性质、地位和作用《生物物理学》是生物类函授本科专业的专业课,是培养生命科学专业人才的需要。
牛物物理学属于牛物学和物理学的交叉学科,近一个吐纪以来,许多生物学的里程碑性的发现,均山于这种学科交叉而取得成果。
通过本课程的学习,可以使学生了解和掌握必要的生物物理学方面的基木知识,将物理科学与生命科学相结合,拓宽学生的知识面,为今后继续深造和投身工作打下基础。
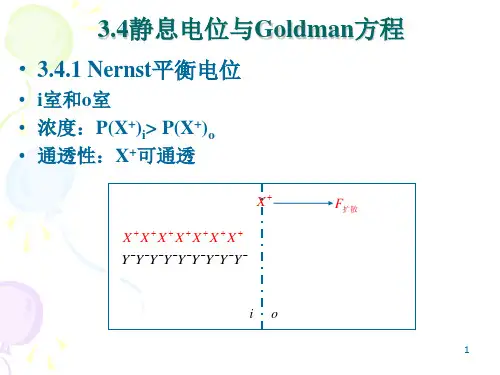
三、内容提要与指导绪论(一)本章内容牛物物理学定义,牛物物理学的发展史,牛物物理学的研究内容及其分支领域,我国生物物理学的发展与现状。
(二)本章重点生物物理学定义,生物物理学的发展史,生物物理学的研究内容及其分支领域。
(三)本章考点1.生物物理学的概念2.生物物理学的研究内容及其分支领域。
第一章分子生物物理学(一)本章内容分子牛物物理学的物理基础,蛋白质分子的结构基础,核酸分子的结构基础,测定生物人分子结构的物理方法,蛋白质的折叠与蛋白质工程,核酸与蛋白质的相互作用。
(二)本章重点蛋白质分子和核酸分子的结构与功能,测定生物大分子结构的物理方法,蛋H质的折叠,蛋白质工程研究的主要内容。
(三)本章难点生物人分子一级结构与髙级的关系,测定生物人分子结构的物理方法的原理,蛋白质折叠的热力学制约和动力学的驱动和控制,蛋口质工程中的定位突变技术。
(四)本章考点蛋口质分子和核酸分子的结构基础,蛋口质一级结构的比较研究,一级结构与高级的关系,测定生物大分子结构的物理方法,蛋白质的折叠密码,蛋白质工程研究的主要内容。
(五)学习指导分子生物物理的一个重要命题是蛋白质的一级结构决定其高级结构,涉及热力学、动力学、和互助蛋白的作用等基础理论问题。
一个蛋白质的多肽链在生物体正常的温度和pH条件下,只有一种或很少儿种构象。





第一章生物大分子:蛋白质、核酸、多糖和脂质。
生物大分子特定的生物学功能取决于其特定的空间构象。
蛋白质的意义:是生命活动的物质基础,是细胞和生物体的主要组成成分。
蛋白质的化学组成:构成元素:碳C,氢H,氧O,氮N,硫S等。
N的含量一般较恒定:平均为16%,每克样品中含氮克数×6.25×100即为100克样品中蛋白质含量等电点:将氨基酸水溶液的酸碱度加以适当调节,使羧基与氨基的电离程度相等,即氨基酸所带正、负电荷数目正好相等,此时溶液的pH称为该氨基酸的等电点,用pI表示。
中性溶剂中,羟基的电离程度略大于氨基,溶液呈微弱酸性蛋白质:在水溶液中形成的颗粒具有胶体溶液的特征(布朗运动、丁道尔现象、不能透过半透膜、吸附能力等)。
按形状分类:球状蛋白质、纤维蛋白质按化学结构分:简单蛋白质、结合蛋白质根据溶解度分类:可溶蛋白质、醇溶性蛋白质、不溶性蛋白质蛋白质的一级结构:由共价键结合在一起的氨基酸残基的排列序列。
一级结构是蛋白质功能的基础蛋白质的二级结构:指多肽链向单一方向卷曲而形成的有周期性重复的主体。
α-螺旋、β-片层、无规卷曲、回折。
作用力:以肽链内或各肽间的氢键。
α螺旋:肽链骨架形成每周3.6个氨基酸的右手螺旋上升0.54nm,每个残基旋转100度。
蛋白质的三级结构:是线状、螺旋片状结构的进一步卷曲和折叠,形成球形或椭圆形的结构,它是蛋白质分子在二级结构的基础上进一步卷曲折叠,构成一个很不规则的具有特定构象的蛋白质分子。
α螺旋、β折叠、β卷曲及无规卷曲等二级结构的多肽链在三维空间的排列方式。
作用力:疏水作用(主要)、氢键、离子键、偶极与偶极间的相互作用、二硫键。
若蛋白质分子仅有一条多肽链组成,三级结构就是它的最高结构层次。
蛋白质的四级结构:具有三级结构的蛋白质亚单位通过非共价键缔合的结果。
亚基之间(维持蛋白质四级结构)的结合力主要是疏水作用,其次是氢键和离子键。
氨基酸链接的基本方式:肽键—CO—NH—结构域:是蛋白质构象中二级结构与三级结构之间的一个层次蛋白质特定的构象和功能是由其一级结构所决定的。




光⽣物物理复习资料第⼆章1、分⼦动量由四部分组成,它们分别是、、、2、简述分⼦的能量组成部分及它们对应的波长区域。
分⼦的能量由四部分组成:分⼦平动的能量,电⼦的能量,分⼦振动的能量,分⼦转动的能量。
分⼦平动能量,是⾮量⼦化的,可以⽤经典⼒学的⽅法来解;电⼦能级的跨度最⼤,覆盖了从远紫外⾄近红外之间的光谱区域;振动能级的跨度在中红外⾄远红外之间;转动能级的跨度则在微波频段。
3、简述分⼦轨道理论的主要要点。
1)分⼦中任何电⼦可看成是在所有核和其余电⼦所构成的势场中的运动,描述分⼦中单个电⼦运动状态的波函数称为分⼦轨道2)分⼦轨道理论认为,只有能量近似,并且对称性相匹配的原⼦轨道才能有效地组合成分⼦轨道。
分⼦轨道是由原⼦轨道线性组合⽽成3)轨道最⼤重叠原则。
组成分⼦轨道的两个原⼦轨道重叠程度越多越好。
4)分⼦轨道中电⼦排布原则,仍遵守最低能量原理和泡利不相容原理5)分⼦轨道的数⽬等于产⽣分⼦轨道的基组集合中原⼦轨道的总数。
4、名词解释成键轨道:在产⽣分⼦轨道时,原⼦轨道的线性组合中系数符号相同,是正交叠两个原⼦的电⼦波函数同相交叠,使得两个原⼦核之间的电⼦密度增加,电⼦密度增加平衡了原⼦核之间的斥⼒,使分⼦轨道能量低于原来原⼦轨道,这样的分⼦轨道称为成键分⼦轨道。
σ电⼦:如果原⼦轨道的交叠是沿着核间轴线的称为σ键,相应的电⼦称为σ电⼦;π电⼦:如果原⼦轨道的重叠是侧向交叠的称为π键,相应的电⼦称为π电⼦反成键分⼦轨道:在产⽣分⼦轨道时,原⼦轨道的线性组合中系数符号相反,是负交叠两个原⼦的电⼦波函数反相交叠,会造成两个原⼦核之间节⾯处的电⼦密度为零,所得分⼦轨道的能量⾼于相应原⼦轨道,这样的分⼦轨道称为反成键分⼦轨道。
⾮成键轨道:⼀些原⼦轨道(内层轨道)并没有明显的参加成键。
所以,这些轨道的能量和未成键的时候基本相同、这些叫做⾮成键分⼦轨道,⽤n表⽰。
如HF中,F的内层轨道1s就是⼀个⾮成键轨道。
原⼦轨道的杂化:所谓杂化是指原⼦在化合成分⼦的过程中,根据原⼦的成键要求,在周围原⼦的影响下,先将原有的若⼲个不同类型能量相近的原⼦轨道进⾏线性组合成⼀组新的轨道。