外源性dna残留量测定法
- 格式:doc
- 大小:53.00 KB
- 文档页数:3

通则3407 外源性DNA 残留量测定法第三法公示稿定量PCR 法PCR 反应过程中可通过荧光标记的特异性探针或荧光染料掺入而检测PCR产物量,通过连续监测反应体系中荧光数值的变化,可即时反映特异性扩增产物量的变化。
在反应过程中所释放的荧光强度达到预设的阈值时,体系的PCR 循环数(Ct 值)与该体系所含的起始DNA 模板量的对数值呈线性关系。
采用已知浓度的DNA 标准品,依据以上关系,构建标准曲线,对特定模板进行定量分析,测定供试品中的外源DNA 残留量。
试剂(1)PCR 反应预混液(2×) 含MgCl2、扩增酶、dNTPs 等,按试剂使用说明书要求配制,或符合条件的其它配方预混液。
(2)TE 缓冲液(pH 8.0)同方法一。
(3)荧光标记探针用TE 缓冲液稀释至100μmol/L,-20℃保存。
(4)正向和反向序列检测引物用TE 缓冲液稀释至100μmol/L,-20℃保存。
(5)碘化钠溶液(6mol/L 碘化钠,15 mmol/L EDTA,0.5%月桂酰肌氨酸钠,25mmol/L Tris-HCl pH 8.0 以及35µg/ml 糖原):配制100ml 碘化钠溶液,先取干净的烧杯置于磁力搅拌器上,依次加入以下成分,同时用搅拌子不断搅拌混匀:50ml 的无核酸酶水,3.0 ml 的0.5 mol/L EDTA 溶液,2.5ml 的1 mol/L Tris-HCl pH 8.0,缓慢加入89.93g 的碘化钠,加入适量的无核酸酶水至100 ml(可根据需要等比增加或减少)。
用0.2 微米孔径的尼龙膜过滤溶液。
避光4℃储藏。
(6)2%蛋白酶K 溶液同方法一。
(7)蛋白酶K 缓冲液(10×),同方法一但不加氯化钠,或按蛋白酶K 试剂说明书要求配制。
(8)推荐的检测探针及引物CHO 细胞探针: 5ˊFAM-ACTCGCTCTGGAGACCAGGCTGGC-TAMRA3ˊ正向引物: 5ˊ-TGTGTAGCTTTGGAGCCTATCCT-3ˊ反向引物: 5ˊ-CAGCACTCGGGAGGCAGA-3ˊ大肠杆菌。


外源性DNA残留量测定法在进行外源性DNA残留量测定时,可根据供试品具体情况选择下列任何一种方法进行测定。
第二法荧光染色法应用双链DNA荧光染料与双链DNA特异结合形成复合物,在波长480nm激发下产生超强荧光信号,可用荧光酶标仪在波长520nm出进行检测,在一定的DNA浓度范围内以及在该荧光染料过量的情况下,荧光强度与DNA浓度成正比,根据供试品的荧光强度,计算供试品中的DNA残留量。
试剂:1. 1mol/L三羟甲基氨基甲烷(Tris)溶液(pH7.5)用盐酸调pH至7.5。
2.0.5mol/L乙二胺四乙酸二钠溶液(pH7.5)用10mol/L的NaOH溶液调pH至7.5。
3.TE 缓冲液(pH7.5)1mol/L Tris溶液(pH7.5)1.0ml、0.5mol/L 乙二胺四乙酸二钠溶液(pH7.5)0.2ml,加灭菌水至100ml。
4.双链DNA荧光染料按试剂使用说明配置5.DNA标准品取适量DNA标准品溶于TE缓冲液中,制成100昭/ml DNA标准品,于-20°C保存。
DNA标准品浓度计算:DNA浓度(pg/ml)=50 x A260DNA标准品溶液制备用TE缓冲液将DNA标准品配成0ng/ml、1.25ng/ml、2.5ng/ml、5.0ng/ml、10ng/ml、20ng/ml、40ng/ml、80ng/ml 的标准品溶液。
测定法:1.精密量取DNA标准品溶液和供试品溶液各400pl于1.5ml离心管中,分别加入新配制的双链DNA荧光染料400pl,混匀,避光室温放置5min。
2.取250pl上述反应液于96孔黑色酶标板中,并作3个复孔。
用荧光酶标仪在激发波长480nm、发射波长520nm处测定荧光强度。
3.以TE缓冲液测得的荧光强度为本底,测定和记录各测定孔的荧光值。
以标准品溶液的浓度对其相应的荧光强度作直线回归,求得直线回归方程(相关系数应不低于0.99),将供试品溶液的荧光强度代入直线回归方程,求出供试品中DNA残留量。

外源性DNA残留量检测1.目的描述外源性DNA残余量检定(地高辛法)的操作过程和注意事项。
2.材料及设备2.1试剂试液无水乙醇。
Tris饱和酚。
三氯甲烷。
异戊醇。
吐温20。
20%十二烷基硫酸钠(SDS)溶液,用盐酸调pH至7.2。
0.2mol/L乙二胺四乙酸二钠溶液(pH8.0)。
3mol/L醋酸钠溶液。
20×SSC溶液:0.3mol/L柠檬酸钠,3mol/L NaCl,调pH至7.0。
Buffer I (0. lmol/L Tris-HCl,0.15mol/L NaCI,用固体NaOH调pH7. 5)。
Buffer Ⅲ (100mmo1/L Tris-HCl 100mmo1/L NaCI, 50mmo1/LMgCl2,pH9. 5)。
TE缓冲液(pH8.0):量取1mol/L Tris溶液(pH8.0)10ml,0.5mol/L EDTA溶液(pH8.0)2ml, 加灭菌水至1000ml。
ECORI内切酶(宝生物工程(大连)有限公司)BamHI内切酶(宝生物工程(大连)有限公司)2.2材料和用具细菌基因组DNA提取试剂盒(天根生物)批号H6611琼脂糖凝胶DNA回收试剂盒(天根生物)批号I7908外源DNA残留量检测试剂盒(Roche)货号:11745832910和1109365791尼龙膜(PALL 0.45微米)点样器(Bio-RAD;Model No:Bio-Dot SF Cell;Serial No:160BR07680)、移液器、tip 头、恒温水浴锅、超净工作台、冰盒、离心机、三维旋混仪、电磁炉3.操作原理用随机启动法,将地高辛甙元标记的脱氧尿苷三磷酸掺入未标记DNA,通过一个手臂将dUTP与载体半抗原地高辛甙元连接起来(dig-dUTP)。
与目的DNA杂交后,杂交分子用酶联免疫法检测;应用抗体-酶联接物(抗地高辛甙元-碱性磷酸酶复合物)和随后用酶促颜色反应使5-溴-4-氯-3-吲哚磷酸(BCIP)和氮蓝四唑(NBT)显色。

生物制品中外源DNA残留外源DNA为残留宿主细胞的DNA片段。
这些残留DNA可能带来传染性或致瘤性风险,比如残留DNA可能携带HIV病毒或Ras癌基因。
由于微生物来源的基因组DNA 富含CpG和非甲基化序列,增加了重组蛋白药物在体内的免疫源性风险。
方法:1.首先要确认检测方法能适用于DNA残留量的测定。
药典方法有DNA探针杂交法、荧光染色法、定量PCR法。
并且需要用已上市的药物进行对照,来排除本身药物对这个方法的影响。
有必要时可用三种方法进行检测,来确认方法的可行性。
2.确认蛋白质对检测方法没有影响,可以通过蛋白酶K进行水解,再进行DNA残留量检测,蛋白酶K水解前后,DNA残留量应该不变或者变化很少,并且需要判断蛋白酶K的加入对检测方法有没有影响。
或者用核酸酶进行水解残留的DNA,此时DNA残留量应该检测不出来的,并且需要判断核酸酶的加入对检测方法有没有影响。
若有影响可以通过碘化钠沉淀或者其他商业的方法(质粒提取试剂盒或者胶回收试剂盒等等)进行除去蛋白质来纯化或者富集DNA,来进行检测DNA含量。
3.DNA的等电点较低,约在2~4左右,带有大量的负电荷,可以用阴离子填料Q、DEAE、adhere等进行层析,因为具有蛋白纯化作用,并且载量高,可以通过控制上样条件、洗脱条件进行层析,但是DNA含量很难达到pg级别。
还有膜层析,是上面带有阴离子配基,具有吸附带负电荷的物质,但载量较小,可以在最后用于蛋白质过滤来达到DNA除去效果和澄清除菌的效果。
4.阴离子聚合物进行吸附,可能会吸附目的蛋白,这时候要进行计算目的蛋白回收率。
阴离子聚合物有聚乙烯亚胺、聚丙烯酰胺等,要考虑一下有无细胞毒性,残留量的问题。
优点是价格比较便宜,可以用于前期处理,有澄清样品的作用。
5.鱼精蛋白为碱性蛋白,带有大量的正电荷,能够与DNA结合产生沉淀,从而将DNA去除。
该方法操作简便、迅速,能有效降低DNA残留量。
缺点是需要使用大量的鱼精蛋白,容易造成鱼精蛋白残留,很难达到DNA残留量到pg级别。
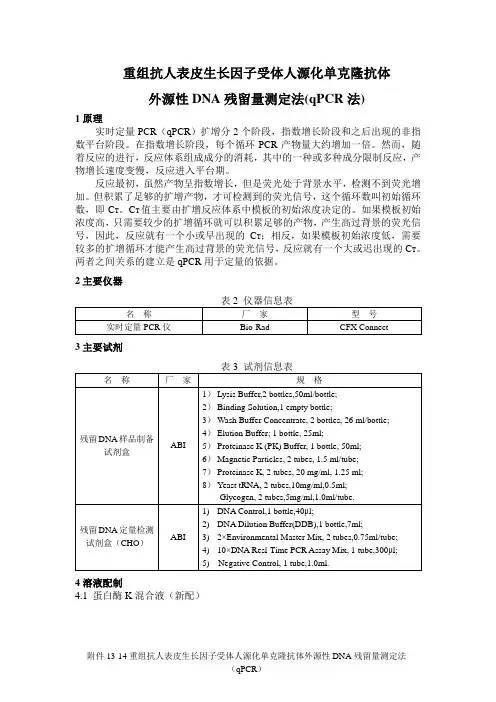
重组抗人表皮生长因子受体人源化单克隆抗体外源性DNA残留量测定法(qPCR法)1原理实时定量PCR(qPCR)扩增分2个阶段,指数增长阶段和之后出现的非指数平台阶段。
在指数增长阶段,每个循环PCR产物量大约增加一倍。
然而,随着反应的进行,反应体系组成成分的消耗,其中的一种或多种成分限制反应,产物增长速度变慢,反应进入平台期。
反应最初,虽然产物呈指数增长,但是荧光处于背景水平,检测不到荧光增加。
但积累了足够的扩增产物,才可检测到的荧光信号,这个循环数叫初始循环数,即C T。
C T值主要由扩增反应体系中模板的初始浓度决定的。
如果模板初始浓度高,只需要较少的扩增循环就可以积累足够的产物,产生高过背景的荧光信号,因此,反应就有一个小或早出现的C T;相反,如果模板初始浓度低,需要较多的扩增循环才能产生高过背景的荧光信号,反应就有一个大或迟出现的C T。
两者之间关系的建立是qPCR用于定量的依据。
2主要仪器3主要试剂4溶液配制4.1 蛋白酶K混合液(新配)附件13-14重组抗人表皮生长因子受体人源化单克隆抗体外源性DNA残留量测定法(qPCR)4.2 裂解混合液(新配)4.3 DNA标准品稀释5测定方法5.1样品处理5.1.1除蛋白1)在2ml离心管中加入100μl样品;2)每100μl的样品中加入70μl的蛋白酶K混合液,混合均匀,56℃水浴30min;3)每100μl的样品中加入360μl的裂解液,室温裂解2小时以上。
5.1.2 DNA的纯化1)磁珠使用前于37℃温浴10min,高速涡旋,彻底悬浮磁珠;2)每100μl的样品加入30μl的磁珠悬浮液;3)每100μl的样品加入300μl的Binding Solution,涡旋混合5min;4)12000r/min离心30sec,将离心管放置于磁力架上,静置5min直至溶液清澈,弃上清;5)从磁力架上取下离心管,加入300μl的Wash Buffer,涡旋混合5 sec;6)12000r/min离心30sec,将离心管放置于磁力架上,静置2min,弃上清;7)重复步骤6)1次,打开离心管的盖子,室温下风干;8)加入50μl的Elution Buffer,高速涡旋10 sec,70℃处理10min,在温浴过程中,涡旋2~3次;9)12000r/min离心30sec,将离心管放置于磁力架上,静置2min,将含有洗脱DNA的液体转移到新的1.5ml的离心管中,用于进行qPCR反应。

生物制品宿主细胞残留DNA检测限定标准及方法浅析贾惠言;姚雪静【摘要】近年来热度骤增的生物制品药物对诸多疾病疗效斐然,在药品市场中所占比重也是节节攀升.于是生物制品与之俱来的生物安全性问题被渐渐提上日程,其中宿主细胞残留DNA由于可能会传递肿瘤或病毒相关基因,存在潜在的危险性,各国药品监督管理机构对其残留量有着严格的限度控制.同时,各国药典也陆续提供数种关于宿主细胞残留DNA检测经典的方法,目前以实时定量聚合酶链式反应(PCR)方法为最优,因其专一性强、灵敏度高、快速且可实现高通量.本文介绍了一些国内与国外监管机构出台的关于生物制品宿主细胞残留DNA检测的限定规定,并对现有的常见检测方法进行描述、总结和比较.【期刊名称】《药学研究》【年(卷),期】2018(037)002【总页数】4页(P115-118)【关键词】生物制品;宿主细胞残留DNA;实时定量聚合酶链式反应【作者】贾惠言;姚雪静【作者单位】荣昌生物制药<烟台>有限公司,山东烟台264006;荣昌生物制药<烟台>有限公司,山东烟台264006【正文语种】中文【中图分类】R392-33哺乳动物细胞系如今已经成为表达制备生物制品最广泛的宿主[1]。
在已经上市和正在进行临床试验的生物制品中,70%来源于哺乳动物细胞系。
其中数种细胞系为制药同行所熟知,如幼仓鼠肾细胞系、中国仓鼠卵巢细胞(CHO)、小鼠骨髓瘤NS0细胞系以及人胚肾细胞系(HEK-293)。
中国仓鼠卵巢细胞尤为广泛,至少在最近很长一段时间,CHO将继续作为生产生物制品的黑马宿主细胞[2]。
众所周知,通过细胞培养生产生物制品时,需要在下游工艺中去除所有的源于宿主细胞残留的杂质,如胞质蛋白、基因及潜在病毒等。
其中宿主细胞DNA残留问题受到了制药同行很大的关注。
究其原因,在于生物制品中即便是微量地来源于宿主细胞的外源性DNA都有传递肿瘤或病毒相关基因的可能性。
如果生物制品在携带残留DNA的情况下注射进入患者的体内,如果细胞DNA为致癌基因,具有致瘤性,在患者体内生成肿瘤;如果为病毒基因,不排除该基因扩增并组装的可能,威胁患者的健康。
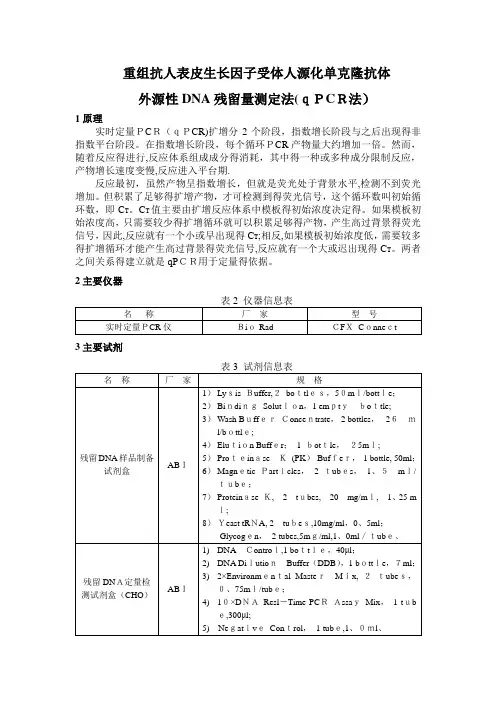
重组抗人表皮生长因子受体人源化单克隆抗体外源性DNA残留量测定法(qPCR法)1原理实时定量PCR(qPCR)扩增分2个阶段,指数增长阶段与之后出现得非指数平台阶段。
在指数增长阶段,每个循环PCR产物量大约增加一倍。
然而,随着反应得进行,反应体系组成成分得消耗,其中得一种或多种成分限制反应,产物增长速度变慢,反应进入平台期.反应最初,虽然产物呈指数增长,但就是荧光处于背景水平,检测不到荧光增加。
但积累了足够得扩增产物,才可检测到得荧光信号,这个循环数叫初始循环数,即C T。
C T值主要由扩增反应体系中模板得初始浓度决定得。
如果模板初始浓度高,只需要较少得扩增循环就可以积累足够得产物,产生高过背景得荧光信号,因此,反应就有一个小或早出现得C T;相反,如果模板初始浓度低,需要较多得扩增循环才能产生高过背景得荧光信号,反应就有一个大或迟出现得C T。
两者之间关系得建立就是qPCR用于定量得依据。
2主要仪器3主要试剂4溶液配制4、1 蛋白酶K混合液(新配)裂解混合液(新配)4、2注:DNA标准品溶液4℃放置保存1天,—20℃放置保存1周.5测定方法5、1样品处理5.1.1除蛋白1)在2ml离心管中加入100μl样品;2)每100μl得样品中加入70μl得蛋白酶K混合液,混合均匀,56℃水浴30min;3)每100μl得样品中加入360μl得裂解液,室温裂解2小时以上。
5.1.2 DNA得纯化1)磁珠使用前于37℃温浴10min,高速涡旋,彻底悬浮磁珠;2)每100μl得样品加入30μl得磁珠悬浮液;3)每100μl得样品加入300μl得BindingSolution,涡旋混合5min;4)12000r/min离心30sec,将离心管放置于磁力架上,静置5min直至溶液清澈,弃上清;5)从磁力架上取下离心管,加入300μl 得Wash Bu ffer ,涡旋混合5 sec ;6)12000r/min 离心30sec ,将离心管放置于磁力架上,静置2min,弃上清; 7)重复步骤6)1次,打开离心管得盖子,室温下风干;8)加入50μl 得Elution Bu ffer ,高速涡旋10 sec,70℃处理10min ,在温浴过程中,涡旋2~3次; 9)12000r/mi n离心30sec,将离心管放置于磁力架上,静置2min,将含有洗脱DNA 得液体转移到新得1、5ml 得离心管中,用于进行qP CR反应。

组织工程医疗产品第25部分动物源性生物材料DNA残留量测定法ICSC中华人民共和国医药行业标准YY/T XXXX.3,20XX组织工程医疗产品第25部分动物源性生物材料DNA残留量测定法:荧光染色法Quantification of Residues DNA in Biological Materials:Fluorescence Method(送审稿)20XX-XX-XX 发布 20XX-XX-XX 实施国家食品药品监督管理局发布YY/T XXXX.3,20XX目次前言------------------------------------------------------------------------------------------------------------------------2 引言------------------------------------------------------------------------------------------------------------------------3 1 范围--------------------------------------------------------------------------------------------------------------- -----4 2 规范性引用文献------------------------------------------------------------------------------------------------------4 3术语、定义及缩略词------------------------------------------------------------------------------------------------4 4 实施标准概要---------------------------------------------------------------------------------------------------------5 5 意义和使用------------------------------------------------------------------------------------------------------------6 6 实验方案和技术依据------------------------------------------------------------------------------------------------6 7 试剂和仪器------------------------------------------------------------------------------------------------------------7 7.1 试剂------------------------------------------------------------------------------------------ 7.2 仪器和器材----------------------------------------------------------------------------------------------- 8 试验过程--------------------------------------8.1蛋白酶K消化-------------------------8.2 DNA纯化-----------------------------------8.3 DNA含量测定(荧光染色法)---------------------------9 结果计算----------------------------------10 结果判定--------------------11 生物材料残留DNA限量的讨论--------------------------------------参考文献---------------------------------------------------------------------------------------------------1YY/T XXXX.3,20XX前言本标准的编写格式贯彻了GB/T 1.1-2009《标准化工作导则第1部分:标准的结构和编写》。

《中国药典》2020版—通则3407外源性DNA残留量测定法第三法公示稿通则3407 外源性DNA 残留量测定法第三法公示稿定量PCR 法PCR 反应过程中可通过荧光标记的特异性探针或荧光染料掺入而检测PCR产物量,通过连续监测反应体系中荧光数值的变化,可即时反映特异性扩增产物量的变化。
在反应过程中所释放的荧光强度达到预设的阈值时,体系的PCR 循环数(Ct 值)与该体系所含的起始DNA 模板量的对数值呈线性关系。
采用已知浓度的DNA 标准品,依据以上关系,构建标准曲线,对特定模板进行定量分析,测定供试品中的外源DNA 残留量。
试剂(1)PCR 反应预混液(2×) 含MgCl2、扩增酶、dNTPs 等,按试剂使用说明书要求配制,或符合条件的其它配方预混液。
(2)TE 缓冲液(pH 8.0)同方法一。
(3)荧光标记探针用TE 缓冲液稀释至100μmol/L,-20℃保存。
(4)正向和反向序列检测引物用TE 缓冲液稀释至100μmol/L,-20℃保存。
(5)碘化钠溶液(6mol/L 碘化钠,15 mmol/L EDTA,0.5%月桂酰肌氨酸钠,25mmol/L Tris-HCl pH 8.0 以及35μg/ml 糖原):配制100ml 碘化钠溶液,先取干净的烧杯置于磁力搅拌器上,依次加入以下成分,同时用搅拌子不断搅拌混匀:50ml 的无核酸酶水,3.0 ml 的0.5 mol/L EDTA 溶液,2.5ml 的1 mol/L Tris-HCl pH 8.0,缓慢加入89.93g 的碘化钠,加入适量的无核酸酶水至100 ml(可根据需要等比增加或减少)。
用0.2 微米孔径的尼龙膜过滤溶液。
避光4℃(6)2%蛋白酶K 溶液同方法一。
(7)蛋白酶K 缓冲液(10×),同方法一但不加氯化钠,或按蛋白酶K 试剂说明书要求配制。
(8)推荐的检测探针及引物CHO 细胞探针: 5ˊFAM-ACTCGCTCTGGAGACCAGGCTGGC-TAMRA3ˊ正向引物: 5ˊ-TGTGTAGCTTTGGAGCCTATCCT-3ˊ反向引物: 5ˊ-CAGCACTCGGGAGGCAGA-3ˊ大肠杆菌探针: 5ˊ FAM-CGGTGCTGCGACGGCGGAGT-TAMRA3ˊ正向引物: 5ˊ-GAAAGTAACACCAGCGTGCG-3ˊ反向引物: 5ˊ-CCAATGCATTAACGCTGGCA-3ˊ毕赤酵母探针: 5ˊ FAM-TAACTACGGTTGATCGGACGGGAAA-TAMRA3ˊ正向引物: 5ˊ-ACACTACTCGGTCAGGCTCT-3ˊ反向引物: 5ˊ-TTTCGGTTGCGGCCATATCT-3ˊNS0 细胞探针: 5ˊ FAM-AGGGCCCCCAATGGAGGAGCT-T AMRA3ˊ正向引物: 5ˊ-CCCCTTCAGCTCCTTGGGTA-3ˊ反向引物: 5ˊ-GCCTGGCAAATACAGAAGTGG-3ˊVero 细胞探针: 5ˊ FAM-CCTTCAAGAAGCCTTTCGCTAAG-TAMRA3ˊ正向引物: 5ˊ-GCTTTCTGAGAAACTGCTCTGTGT-3ˊ反向引物: 5ˊ-GGAAGATATTTCCTTTTTCACCATAGC-3’(9)DNA 共沉淀染色剂(10)清洗液A 按试剂(5)方法配制,含碘化钠37.5g,1 mol/L Tris 缓冲液(pH8.4)) 2.0ml,0.5M EDTA 溶液(pH8.4) 2.0ml,异丙醇50ml,N-月桂酰肌氨酸钠0.5% (w/v),加去离子水至总体积(11)清洗液B 含有35 μg/ml 糖原的乙醇(70%)水溶液。

生物制品中DNA残留检测系列1. 生物制品中残留DNA检测标准的变化2015年3月底,中国食品药品检定研究院网站的国家药品标准物质目录中新增加了一个编号为410001的产品:CHO宿主细胞DNA残留检测试剂盒(PCR-荧光探针法)。
这个由中检院与中科院联合研发,由生物制药企业参与标定的试剂盒与现行美国药典(USP)建议的检测方法同步,但与2010版药典附录中外源性DNA 残留量测定法有所不同,可能会对国内生物制品的研发和生产的上下游企业产生影响。
生物制品中宿主细胞残留DNA具有潜在致瘤和传染风险,所以各国药品监管部门对DNA杂质的限量要求非常严格。
美国药典在General Chapter <1130>介绍了三种常用技术,但将在2015年颁布的新版(USP38–NF33)中增加全新章节(General Chapter <30>)来进一步规范残留DNA检测的方法和标准物质。
与1000号以上的章节不同的是,USP编号1000以内的章节详细规定了检测技术、系统适应性标准和标准物质。
新版USP中将唯一推荐qPCR法作为生物制品中宿主残留DNA的标准方法。
qPCR法的技术优势在于序列特异性高、灵敏度高、重现性好,可以为生物制药工业在工艺研究和成品质量控制方面提供可靠的检测手段。
我国参照WHO、FDA和欧盟的标准,很早以前开始就对生物制品中残余DNA 含量进行限制。
从卫生部颁布的《人用重组DNA制品质量控制要点》到近年的《中国生物制品规程》都对DNA含量做了严格要求,部分标准高于国际标准。
2010年版中国药典附录收录了DAN探针杂交法和荧光染料法,这两种方法都存在技术缺陷,很难达到杂质限量检测的灵敏度,已经被欧美药典摒弃。
目前,仍有很多国内企业沿用这两种方法检测残留DNA,致使生产工艺和产品质量很难达到国际一流水平。
根据残余DNA检测技术的发展趋势,小编预计我国2015版药典或增补版本中将出现qPCR方法。
门冬胰岛素外源性DNA残留量的荧光法检测目的建立门冬胰岛素外源性DNA残留量的荧光检测方法,用于门冬胰岛素的质量控制。
方法参照《中国药典》三部附录及相关资料方法,对门冬胰岛素外源性DNA残留的荧光检测法进行研究,确定检测方法的最适条件,并对方法的线性、加样回收率、精密度、耐用性、重复性等方面进行方法学验证。
结果建立了门冬胰岛素原料药中外源性DNA残留量的荧光检测方法,并进行了方法学验证。
结论该方法操作简便、准确快捷,且无需标准宿主DNA,可用于门冬胰岛素质量标准中外源性DNA残留量的检测方法。
[Abstract] Objective To develop a fluorescence method of determining residual DNA in recombinant Insulin Aspart for its quality control. Methods According to CP (2010 edition) and relative methods, fluorescence method was researched .The method validation was studied from standard curve,recovery,precision,reproducibility etc. Results Fluorescence method of determining residual DNA was developed and the method was valided. Conclusion This method is convenient,fast and good reproducibility, it can be used determination of residual DNA in recombinant insulin aspart .[Key words] Fluorescence method;Residual exogenous DNA;Insulin aspart;Quality control门冬胰岛素是一种新型的人胰岛素改构产物,通过基因工程重组技术、利用大肠杆菌或酵母表达得到的一种重组蛋白类药物。
外源D N A残留量测定(荧光定量P C R 法)标准操作规程S O P(总9页)--本页仅作为文档封面,使用时请直接删除即可----内页可以根据需求调整合适字体及大小--外源性DNA残留量测定法(荧光定量PCR法)标准操作规程文件编码: XXXXXX目录1. 目的.................................................. 错误!未定义书签。
2. 范围.................................................. 错误!未定义书签。
3. 职责.................................................. 错误!未定义书签。
4. 依据.................................................. 错误!未定义书签。
5. 定义.................................................. 错误!未定义书签。
6. 内容.................................................. 错误!未定义书签。
. 原理............................................. 错误!未定义书签。
. 实验材料......................................... 错误!未定义书签。
. 操作步骤......................................... 错误!未定义书签。
. 结果计算......................................... 错误!未定义书签。
. 判定标准......................................... 错误!未定义书签。
. 注意事项......................................... 错误!未定义书签。
甘精胰岛素外源性DNA残留量的荧光染色法检测研究柳常青;王霞;汲生芝;公伟广;张贵民【期刊名称】《中国医药生物技术》【年(卷),期】2017(012)005【总页数】4页(P453-456)【作者】柳常青;王霞;汲生芝;公伟广;张贵民【作者单位】273400临沂,山东新时代药业有限公司;273400临沂,山东新时代药业有限公司;273400临沂,山东新时代药业有限公司;273400临沂,山东新时代药业有限公司;276006临沂,鲁南制药集团股份有限公司【正文语种】中文甘精胰岛素是一种通过基因工程重组技术,利用大肠杆菌或酵母表达得到的一种重组蛋白类药物,是具有长效作用的人胰岛素类似物。
该药物在皮下注射后立即聚合,溶解度降低,形成微沉淀物,使吸收、分解和作用时间延长,相当于基础胰岛素的无峰值分泌,发挥长效平稳降血糖的作用[1]。
宿主细胞残留 DNA 因有潜在的致癌或传染风险,是基因工程重组产品需要严格控制的杂质。
《中国药典》2015 年版收载了 2 种外源性 DNA 残留检测方法:DNA 探针杂交法和荧光染色法。
DNA 探针杂交法操作周期较长,干扰因素多,重复性较差,宿主菌 DNA 的种属和质量直接影响检测结果的准确性[2]。
荧光染色法是利用双链 DNA 荧光染料与双链DNA 特异结合形成复合物,在波长 480 nm 激发下产生超强荧光信号,用荧光酶标仪在波长 520 nm 处进行检测,在一定的 DNA 浓度范围内以及荧光染料过量的情况下,荧光信号与 DNA 浓度成正比[3-4]。
荧光染色法操作简单快速,不需要宿主 DNA 作为模板,能够检测出重组制品中全部 DNA 污染,因而可广泛用于重组蛋白药物残余 DNA 的检测。
由于荧光试剂盒的缓冲液 pH 值接近甘精胰岛素等电点,容易导致样品溶液浑浊进而影响检测,同时从相关文献可知胰岛素或其类似物本身可能对荧光法检测产生干扰[5-6],本文对甘精胰岛素 DNA 检测的样品处理方法进行详细研究,并对检测方法进行了方法学验证。
门冬胰岛素外源性DNA残留量的荧光法检测吕萍;王洪明;辛中帅;李晶;梁成罡【期刊名称】《中国医药科学》【年(卷),期】2012(2)5【摘要】目的建立门冬胰岛素外源性 DNA 残留量的荧光检测方法,用于门冬胰岛素的质量控制.方法参照<中国药典> 三部附录及相关资料方法,对门冬胰岛素外源性 DNA 残留的荧光检测法进行研究,确定检测方法的最适条件,并对方法的线性、加样回收率、精密度、耐用性、重复性等方面进行方法学验证.结果建立了门冬胰岛素原料药中外源性 DNA 残留量的荧光检测方法,并进行了方法学验证.结论该方法操作简便、准确快捷,且无需标准宿主 DNA,可用于门冬胰岛素质量标准中外源性 DNA 残留量的检测方法.【总页数】2页(P36-37)【作者】吕萍;王洪明;辛中帅;李晶;梁成罡【作者单位】中国食品药品检定研究院,北京,100050;山东省滨州市药品检验所,山东滨州,256618;中国食品药品检定研究院,北京,100050;中国食品药品检定研究院,北京,100050;中国食品药品检定研究院,北京,100050【正文语种】中文【中图分类】R927.2【相关文献】1.高效液相色谱-荧光法同时检测蔬菜中阿维菌素、甲氨基阿维菌素苯甲酸盐和伊维菌素的多残留量 [J], 赵莉;谢显传;占绣萍2.甘精胰岛素外源性DNA残留量的荧光染色法检测研究 [J], 柳常青;王霞;汲生芝;公伟广;张贵民3.超高效液相色谱荧光法检测调味品中罗丹明B残留量 [J], 缪璐;郭振华;莫佳琳;温韬;干宁军4.重组人胰岛素外源性DNA的荧光法测定 [J], 辛中帅;吕萍;王洪明;梁成罡5.增敏荧光法测定血浆中亚甲蓝含量及其残留量检测 [J], 李皓琳;朱朝艳因版权原因,仅展示原文概要,查看原文内容请购买。
外源性DNA残留量测定法
第一法 DNA探针杂交法
供试品中的外源性DNA经变性为单链后吸附于固相膜上,在一定温度下可与相匹配的单链DNA复性而重新结合成为双链DNA,称为杂交。
将特异性单链DNA探针标记后,与吸附在固相膜上的供试品单链DNA杂交,并使用与标记物相应的显示系统显示杂交结果,与已知含量的阳性DNA对照比对后,可测定供试品中外源性DNA的含量。
试剂(1)DNA标记和检测试剂盒
(2)DNA杂交膜尼龙膜或硝酸纤维素膜。
(3)2%蛋白酶K溶液称取蛋白酶K 0.20g,溶于灭菌水10ml中,分装后储藏于-20℃备用。
(4)3%牛血清白蛋白溶液称取牛血清白蛋白0.30g,溶于灭菌水10ml中。
(5)1mol/L三羟甲基氨基甲烷(Tris)溶液(pH8.0)用盐酸调pH值至8.0。
(6)5.0mol/L氯化钠溶液
(7)0.5mol/L乙二胺四乙酸二钠溶液(pH8.0)用10mol/L 氢氧化钠溶液调节pH 至8.0。
(8)20%十二烷基硫酸钠(SDS)溶液用盐酸调pH至7.2。
(9)蛋白酶缓冲液(pH8.0)量取1mol/L Tris溶液1.0ml(pH8.0),5mol/L 氯化钠溶液2.0ml,0.5mol/L乙二胺四乙酸二钠溶液(pH8.0)2.0ml,20%SDS溶液2.5 ml,加灭菌水至10ml。
(10)TE缓冲液(pH8.0)量取1mol/L Tris溶液(pH8.0)10ml,0.5mol/L乙二胺四乙酸二钠溶液(pH8.0)2ml,加灭菌水至1000ml。
(11)1%鱼精DNA溶液精密称取鱼精DNA 0.10g,置10ml量瓶中,用TE缓冲液溶解并稀释至刻度,摇匀,用7号针头反复抽打以剪切DNA成为小分子,分装后贮藏于-20℃备用。
(12)DNA稀释液取1%鱼精DNA溶液50μl,加TE缓冲液至10ml。
用于探针标记和阳性对照的DNA制备用于探针标记和阳性对照的DNA,由生产供试品用的传代细胞、工程菌或杂交瘤细胞提取纯化获得,其提纯和鉴定可参考下述推荐方案进行,具体方法可参考《分子克隆实验指南》([美]J.萨姆布鲁克等著,黄培堂等译,科学出版社,2002)或《精编分子生物学实验指南》([美]F.奥斯伯等著,颜子颖、王海林译,科学出版社,1998)。
将待提取的细胞基质悬液的细胞浓度调整为每1ml含107个细胞,如果为细菌,则将其
浓度调整为每1ml含1081ml,离心,在沉淀中加裂解液400μl混匀,37℃作用12~24小时后,加入饱和酚溶液450μl,剧烈混合,以每分钟10000转离心10分钟,转移上层液体,以饱和酚溶液450μl重复抽提一次;转移上层液体,加入三氯甲烷450μl,剧烈混匀,以每分钟10000转离心10分钟;转移上层液体,加入pH 5.2的3mol/L 醋酸钠溶液40μl,充分混合,再加入-20℃以下的无水乙醇1ml,充分混合,-20℃以下作用
2小时,以每分钟15000转离心15分钟;用适量-20℃70%乙醇溶液洗涤沉淀1次,以每分钟15000转离心15分钟,弃上清液,保留沉淀,吹至干燥后,加适量灭菌TE缓冲液溶解,RNase酶切,酚/三氯甲烷抽提,分子筛纯化DNA,即得。
用1%琼脂糖凝胶电泳法和分光光度法鉴定阳性对照品的DNA纯度:应无RNA和寡核苷酸存在;A260/A280比值应在1.8~2.0之间(测定时将供试品稀释至A260为0.2~1.0)。
用于阳性对照和标记探针的DNA在使用前应进行酶切或超声波处理,使其片断大小适合于DNA杂交和探针标记。
阳性对照品的DNA浓度根据下式计算
DNA浓度(ng/μl)= 50×A260
阳性对照品可分装于适宜的小管中,-20℃以下保存,长期使用。
探针的标记按试剂盒使用说明书进行。
测定法(1)蛋白酶K预处理按下表对供试品、阳性和阴性对照进行加样,混合后
注意事项:供试品的稀释
根据成品最大使用剂量,用DNA稀释液将供试品(原液)稀释至每100μl 含1人份剂量;如成品最大使用剂量较大,而供试品的蛋白含量较低,可用DNA稀释液将供试品稀释至每100μl 含1/10人份剂量或每100μl含1/100人份剂量。
D1、D2、D3为稀释的阳性DNA对照。
用DNA稀释液稀释至每1ml中含DNA 1000ng。
然后依次10倍稀释成10ng/100μl (D1)、1ng/100μl (D2)、100pg/100μl (D3)三个稀释度;如成品使用剂量较大,而且DNA限量要求(100pg/剂量)较严格时,则需要提高DNA检测灵敏度,相应的阳性DNA对照应稀释成100pg /100μl (D1)、10pg /100μl (D2)、1pg/100μl (D3)三个稀释度。
阴性对照为DNA稀释液,空白对照为未进行蛋白酶K预处理的TE缓冲液。
当供试品1/100人份剂量大于100μl时,终体积也随之增大,一般终体积为供试品体积的一倍左右,供试品体积和终体积相差过小,可能会影响蛋白酶K的活性。
2%蛋白酶K溶液和蛋白酶缓冲液的比例为1/20,蛋白酶缓冲液和终体积的比例为1/10。
加入3%牛血清白蛋白溶液适量,是为了使阳性对照和阴性对照中含有一定的蛋白质与供试品(通常为蛋白质)的酶切条件保持一致;如供试品为其他物质,则应改用其他相应物质。
若预处理后的供试品溶液中的蛋白质干扰本试验,可用上述饱和酚溶液抽提法或其他适
宜方法提取供试品DNA(阳性对照、阴性对照也应再次提取DNA,与供试品溶液平行)。
(2)点膜用TE缓冲液浸润杂交膜后,将预处理的供试品、阳性对照、阴性对照与空白对照置100℃水浴加热10分钟,迅速冰浴冷却,以每分钟8000转离心5秒。
用抽滤加样器点样于杂交膜(因有蛋白质沉淀,故要视沉淀多少确定加样量,以避免加入蛋白质沉淀。
所有供试品与阳性对照、阴性对照、空白对照加样体积应一致,或按同样比例加样)。
晾干后置80℃真空干烤1小时以上。
(3)杂交及显色按试剂盒使用说明书进行。
结果判定阳性对照应显色,其颜色深度与DNA含量相对应,呈一定的颜色梯度;阴性、空白对照应不显色,或显色深度小于阳性DNA对照D3,试验成立。
将供试品与阳性对照进行比较,根据显色的深浅判定供试品中外源性DNA的含量。
第二法荧光染色法(新增)
PicoGreen是一种高灵敏度双链DNA荧光染料。
该染料与双链DNA特异结合形成复合物,在波长480 nm激发下产生超强荧光信号,可用荧光酶标仪在波长520 nm处进行检测,在一定的DNA浓度范围内以及在该荧光染料过量的情况下,荧光强度与DNA浓度成正比,根据供试品的荧光强度,计算供试品中的DNA残留量。
试剂(1)20×TE缓冲液(200 mM Tris-HCl,20 mM EDTA,pH7.5)加灭菌水配置成1×TE。
(2)PicoGreen染料用1×TE缓冲液将PicoGreen染料稀释200倍,应现用现配,并注意避光。
(3)DNA标准品取DNA标准品适量溶于TE中,制成100 μg/ml DNA标准品,于-20℃条件下保存。
标准品溶液的制备用1×TE缓冲液将DNA标准品配成0ng/ml、1.25ng/ml、2.5ng/ml、5.0ng/ml、10ng/ml、20ng/ml、40ng/ml、80 ng/ml的标准品溶液。
测定法精密量取标准品溶液和供试品溶液各400μl于1.5ml 离心管中,分别加入稀释后的PicoGreen染料400 μl,混匀后,避光室温放置5 分钟。
取250μl上述反应液于96孔板黑色酶标板中,并做3个复孔。
用荧光酶标仪于激发波长480nm、发射波长520nm处测定荧光强度。
以1×TE缓冲液测得的荧光强度为本底,测定和记录各测定孔的荧光值。
用标准品溶液的浓度(ng/ml)对其相应的荧光强度作直线回归(相关系数应不低于?),将供试品溶液的荧光强度代入回归方程,求出供试品的残余DNA含量(ng/ml)。
注意事项(1)该法DNA检出限为0.3 ng/ml。
DNA含量在1.25-80 ng/mL范围线性较好,因此供试品DNA含量在该范围内可定量测定;当DNA含量低于1.25 ng/mL时应为限量测定,表示为小于1.25 ng/mL。
(2)若供试品对回收率和精密度无干扰,则可直接测定。
(3)若精密度好,但供试品轻微干扰回收率时,无需对供试品DNA做进一步纯化,可直接测定,但每次测定均应增加回收率实验,并用回收率对测定结果进行校正。
(4)若供试品严重干扰回收率和精密度时,应采用适宜方法(参见本项目第一法)纯化DNA以排除干扰,直至精密度和回收率试验均符合要求。
需要纯化DNA后再进行测定的供试品,每次测定均应从纯化步骤起增加回收率实验,并用回收率对测定结果进行校正。