安徽省中考化学总复习题型六实验探究题共42张
- 格式:pptx
- 大小:460.25 KB
- 文档页数:42


安徽中考化学历年实验题15、(20XX年安徽)(7分)实验室常用加热氯酸钾与二氧化锰混合物的方法制取氧气,写出反应的化学方程:。
小芳发现,氯酸钾与氧化铜混合加热,也能较快产生氧气,于是进行如下探究:【提出猜想】除MnO2、CuO外,Fe2O3也可以作KClO3分解的催化剂。
)由实验与实验(2)实验所用的三种金属氧化物,催化效果最好的是。
【反思】(1)若要证明Fe2O3是该反应的催化剂,还要验证它在化学反应前后的质量和不变;(2)同种催化剂,颗粒大小可能影响催化效果,请设计实验方案进行验证。
(3)同种催化剂,还有哪些因素可能影响催化效果,请你再探究(探究一种因素即可)14、(20XX年安徽)(7分)某研究小组在学习氧气的化学性质时发现:铁丝燃烧没有火焰,蜡烛燃烧却有明亮的火焰。
该小组同学进行了如下探究。
(1(2是由(填“固态”或“气态”)物质燃烧形成的。
(3由上表可知:物质燃烧能否产生火焰与其(填“熔点”或“沸点”)和燃烧时温度有关。
由此推测:钠在燃烧时,(填“有”或“没有”)火焰产生。
(4)木炭在氧气中燃烧没有火焰,但生活中木炭燃烧时会产生火焰,其原因可能是。
14.(20XX年安徽)(7分)酒糟灯是实验室中常用的加热仪器,某小组同学对酒精灯火焰温度进行如下探究。
(I)定性研究:甲同学取一根火柴梗,拿住一端迅速平放入酒精灯火焰中,l~2 s 后取出,观察到位于外焰的部分明显碳化。
(1)写出碳完全燃烧的化学方程式: 。
(2)由上述现象得出绩论:外焰温度最高,你认为原因是 。
(Ⅱ)定量研究:乙和丙同学在老师指导下,分别利用高温传感器测得酒精灯各层火焰平均温度如右表。
(3)由右表得出结论: (填“焰心”、“内焰”或“外焰”)温度最高 。
(4)结合定量研究结论,下列图示中加热方法(试管夹未画出)最合理的是 (填字母序号) 。
(Ⅲ)交流反思:不仅酒精灯的各层火焰温度不同,而且相同火焰层温度也有差异。
(5)造成乙、丙两同学所测相同火焰层温度差异的原因可能是(写出两点即可)① ,② 。

安徽省中考化学必考科学探究题《物质的性质或变化规律》1、兴趣小组的同学学习了碳酸钠的性质后,对碳酸氢钠的性质也进行探究。
【问题1】碳酸氢钠溶液与碳酸钠溶液的酸碱性【实验1】用pH试纸测定等浓度的碳酸氢钠和碳酸钠溶液的pH,分别为9和12;【结论1】两种溶液都呈碱性,它们的碱性强弱顺序为。
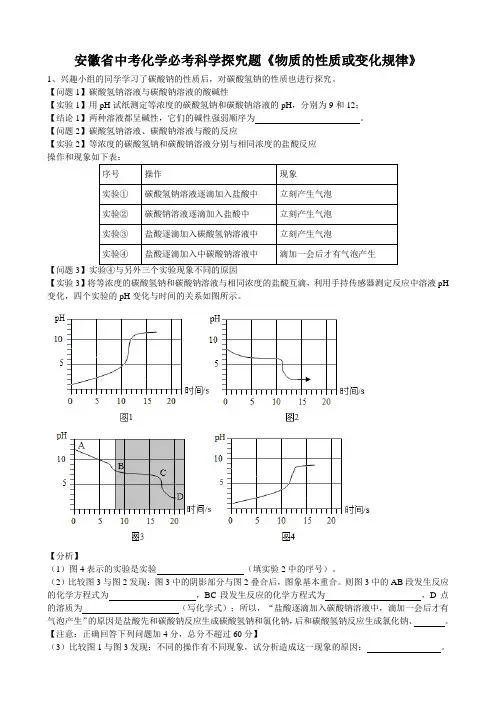
【问题2】碳酸氢钠溶液、碳酸钠溶液与酸的反应【实验2】等浓度的碳酸氢钠和碳酸钠溶液分别与相同浓度的盐酸反应操作和现象如下表:【问题3】实验④与另外三个实验现象不同的原因【实验3】将等浓度的碳酸氢钠和碳酸钠溶液与相同浓度的盐酸互滴,利用手持传感器测定反应中溶液pH 变化,四个实验的pH变化与时间的关系如图所示。
【分析】(1)图4表示的实验是实验(填实验2中的序号)。
(2)比较图3与图2发现:图3中的阴影部分与图2叠合后,图象基本重合。
则图3中的AB段发生反应的化学方程式为,BC段发生反应的化学方程式为,D点的溶质为(写化学式);所以,“盐酸逐滴加入碳酸钠溶液中,滴加一会后才有气泡产生”的原因是盐酸先和碳酸钠反应生成碳酸氢钠和氯化钠,后和碳酸氢钠反应生成氯化钠、。
【注意:正确回答下列问题加4分,总分不超过60分】(3)比较图1与图3发现:不同的操作有不同现象,试分析造成这一现象的原因:。
【应用】用稀盐酸来鉴别一瓶溶液是氢氧化钠还是碳酸钠时,应如何操作?。
【答案】解:【结论1】碳酸氢钠和碳酸钠溶液的pH,分别为9和12,说明两种溶液都呈碱性,它们的碱性强弱顺序为碳酸钠>碳酸氢钠。
故填:碳酸钠>碳酸氢钠。
[分析](1)由图中信息可知,图1表示向盐酸中滴加碳酸钠溶液,图2表示向碳酸氢钠溶液中滴加盐酸,图3表示向碳酸钠溶液中滴加盐酸,图4表示的实验是向盐酸中滴加碳酸氢钠溶液。
故填:实验①。
(2)比较图3与图2发现:图3中的阴影部分与图2叠合后,图象基本重合,则图3中的AB段是碳酸钠和盐酸反应生成碳酸氢钠和氯化钠,反应的化学方程式为:Na2CO3+HCl═NaCl+NaHCO3;BC段是碳酸氢钠和盐酸反应生成氯化钠、水和二氧化碳,发生反应的化学方程式为:NaHCO3+HCl═NaCl+H2O+CO2↑;D点的溶质为反应生成的氯化钠和过量的氯化氢,所以,“盐酸逐滴加入碳酸钠溶液中,滴加一会后才有气泡产生”的原因是盐酸先和碳酸钠反应生成碳酸氢钠和氯化钠,后和碳酸氢钠反应生成氯化钠、水和二氧化碳。

2015-2019年安徽省中考化学试题分类汇编第14题——实验探究题【2019年第14题】(7分)某兴趣小组对KClO 3分解反应的催化剂进行研究,在相同的加热条件下,用下图装置完成表中实验:(1)设置实验1的目的是___________________(2)表中所列3种催化剂的催化效果最佳的是______________ (3)写出KClO 3分解的化学方程式:_________________________(4)由实验1和实验4可知,KCl____(填“有”或“无”)催化作用。
维持加热条件不变,用实验1再继续收集收集50mLO 2,所需时间明显少于171s ,解释原因:_____________ (5)要比较KClO 3分解反应中不同催化剂的催化效果,除了测量收集50mLO 2所需时间外,还可以测量相同时间内_______________________________ 【解析】(1)设置实验1的目的与其他组实验对比,故填:对比实验 (2)收集50mLO 2所需时间越短说明催化效果越佳,故填:MnO 2(3)KClO 3分解的化学方程式:2KClO 3===== 2KCl+3O 2↑故填:2KClO 3===== 2KCl+3O 2↑(4)由表中数据可知,KCl 有催化作用,维持加热条件不变,用实验1再继续收集收集50mLO 2,所需时间明显少于171s 是因为氯酸钾分解生成KCl ,KCl 有催化作用,加快了反应,故填:有 ; 生成的KCl 加快了反应(5)还可以测量相同时间内收集气体的体积来比较反应速率,故填:收集气体的体积 故答案:(1)对比实验 (2)MnO 2(3)2KClO 3===== 2KCl+3O 2↑(4)有 生成的KCl 加快了反应 (5)收集气体的体积【2018年第14题】“蓝瓶子”实验是一个有趣的化学振荡实验:盛有氢氧化钠、亚甲蓝(C 16H 18N 3SCl )、葡萄糖混合液的试管,经振荡、静置后溶液颜色会出现反复变化(如图1)。



安徽中考化学必考题实验探究题《反应后物质成分的探究》一、历年中考真题:1、(2019•安徽)某兴趣小组为探究金属活动性强弱,分别做了镁、铝、铜与稀盐酸反应的实验。
(1)比较金属活动性强弱:铝比铜_________(填“强”或“弱”)。
写出镁与稀盐酸反应的化学方程式:_________________________________。
(2)小芳同学做镁与稀盐酸反应的实验时,发现试管中出现灰白色沉淀,该小组同学对灰白色沉淀的成分进行如下探究:【提出假设】假设一:含有氯化镁假设二:含有镁粉假设三:含有氢氧化镁……【查阅资料】①氯化镁易溶于水;②在一定条件下,镁可与冷水缓慢反应。
【设计并进行实验】各取少量灰白色沉淀加入2支试管中,进行如下实验:【得出结论】由实验1可知,假设___________不成立;由实验2可知,沉淀中不含________。
假设三__________(填“成立”“可能成立”或“不成立”)。
【实验反思】实验后同学们请教老师得知,灰白色沉淀的主要成分是碱式氯化镁,碱式氯化镁受热易分解产生氯化氢气体。
于是小芳再取少量灰白色沉淀于试管中加热,并将蘸有紫色石蕊溶液的滤纸条悬于试管口,预期的实验现象是________________ 。
注意:若答对第(3)小题奖励4分,化学试卷总分不超过60分。
(3)为探究镁与稀盐酸反应生成碱式氯化镁的条件,该小组同学进行了如下实验:在小烧杯中加入一定量稀盐酸和去除氧化膜的镁带,观察实验现象,并测量溶液pH的变化。
结果见下表:根据表中信息回答下列问题:①请描述溶液pH变化的规律并解释因:_______________________。
②请对生成碱式氯化镁的条件提出猜想,并设计实验证明猜想: ________________。
【解析】(1)由金属活动性顺序,铝比铜活动性强。
镁与稀盐酸反应生成氯化镁溶液和氢气。
(2)【设计并进行实验】在一定条件下,镁可与冷水缓慢反应,加入适量蒸馏水、搅拌,沉淀未见减少,说明不含易溶于水的氯化镁,则假设一不成立。


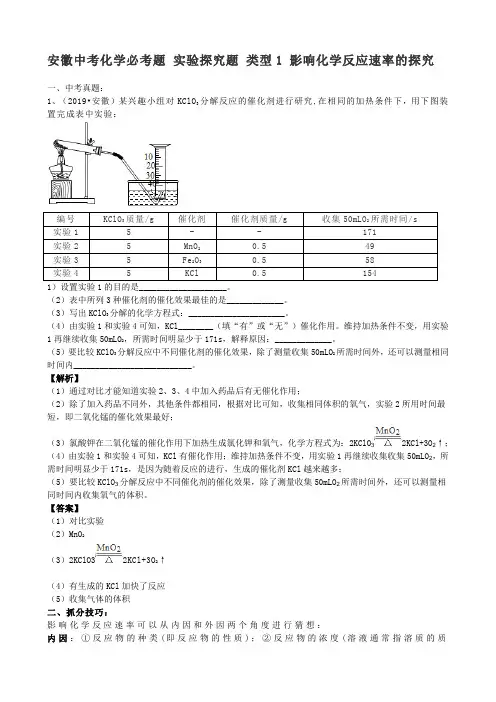
安徽中考化学必考题实验探究题类型1 影响化学反应速率的探究一、中考真题:1、(2019•安徽)某兴趣小组对KClO3分解反应的催化剂进行研究,在相同的加热条件下,用下图装置完成表中实验:编号KClO3质量/g 催化剂催化剂质量/g 收集50mLO2所需时间/s实验1 5 - - 171实验2 5 MnO20.5 49实验3 5 Fe2O30.5 58实验4 5 KCl 0.5 1541)设置实验1的目的是____________________。
(2)表中所列3种催化剂的催化效果最佳的是_____________。
(3)写出KClO3分解的化学方程式:______________________。
(4)由实验1和实验4可知,KCl________(填“有”或“无”)催化作用。
维持加热条件不变,用实验1再继续收集50mLO2,所需时间明显少于171s,解释原因:_____________。
(5)要比较KClO3分解反应中不同催化剂的催化效果,除了测量收集50mLO2所需时间外,还可以测量相同时间内___________________________。
【解析】(1)通过对比才能知道实验2、3、4中加入药品后有无催化作用;(2)除了加入药品不同外,其他条件都相同,根据对比可知,收集相同体积的氧气,实验2所用时间最短,即二氧化锰的催化效果最好;(3)氯酸钾在二氧化锰的催化作用下加热生成氯化钾和氧气,化学方程式为:2KClO32KCl+3O2↑;(4)由实验1和实验4可知,KCl有催化作用;维持加热条件不变,用实验1再继续收集收集50mLO2,所需时间明显少于171s,是因为随着反应的进行,生成的催化剂KCl越来越多;(5)要比较KClO3分解反应中不同催化剂的催化效果,除了测量收集50mLO2所需时间外,还可以测量相同时间内收集氧气的体积。
【答案】(1)对比实验(2)MnO2(3)2KClO32KCl+3O2↑(4)有生成的KCl加快了反应(5)收集气体的体积二、抓分技巧:影响化学反应速率可以从内因和外因两个角度进行猜想:内因:①反应物的种类(即反应物的性质);②反应物的浓度(溶液通常指溶质的质量分数、固体通常指纯度);③反应物的接触面积(通常指固体反应物的颗粒大小);④反应物的微观构成(离子构成)。
实验探究题考向1影响化学反应速率的因素的猜想(可以从内因和外因两个角度进行猜想:内因:①反应物种类(即反应物的性质);②反应物的浓度(溶液通常指溶质的质量分数、固体通常指纯度);③反应物间的接触面积(通常指固体反应物的颗粒大小)。
外因:温度、催化剂[通常指是否使用催化剂、催化剂的种类、催化剂的质量、催化剂的颗粒大小(即催化剂与反应物的接触面积)]、对于有气体参加的反应可以考虑气体压强例1同学们在用盐酸和大理石制取二氧化碳时,发现各组实验产生气泡的速率不一样,于是展开了探究。
所用盐酸浓度分别为10%、20%,大理石有细颗粒与粗颗粒两种规格,实验温度分别为20 °C、30 °C, 每次实验盐酸的用量为100 mL,大理石用量为10.0 go【提出问题】盐酸与大理石反应的快慢受哪些因素的影响呢?【猜想与假设】a.可能与盐酸浓度有关;b.可能与_________ 有关;c.可能与大理石规格有关。
方法指导从内因和外因两方面去分析,题中內因有:盐酸浓度、大理石规格(细颗粒与粗颗粒),外因有:实验温度。
考向2 反应后物质成分的猜想(10年4考:2019.15, 2015.15, 2014.14, 2011.15)通常为:A+B—C+DJ(或气体或水)充分反应后物质的成分猜想:第一步:首先正确书写反应的化学方程式;第二步:明确研究物质的状态,如果是溶液中的溶质成分,则难溶物和气体不需要考虑;第三步:从物质是否恰好完全反应和是否过量去考虑;反应后物质成分中一定有生成物,可能有未完全反应的反应物。
因此一般猜想有三种:①只有C(恰好完全反应);②A和C(A过量);③B和C(B过量)例2某实验小组的同学用氢氧化钙溶液和盐酸进行酸碱中和反应的实验。
向烧杯中的氢氧化钙溶液滴加一定量的稀盐酸后,发现忘记滴加指示剂,此时,他们停止滴加稀盐酸,并对烧杯内溶液中溶质的成分进行探究。
I .写出该中和反应的化学方程式: __________________________ oII .探究烧杯内溶液中溶质成分。