空气中氮氧化物的日变化曲线
- 格式:pdf
- 大小:690.03 KB
- 文档页数:15
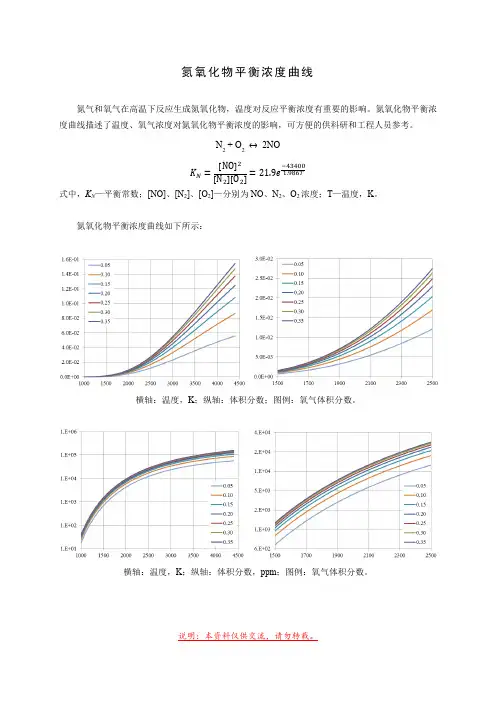
氮氧化物平衡浓度曲线氮气和氧气在高温下反应生成氮氧化物,温度对反应平衡浓度有重要的影响。
氮氧化物平衡浓度曲线描述了温度、氧气浓度对氮氧化物平衡浓度的影响,可方便的供科研和工程人员参考。
N 2 + O 2 2NO[ ][ ][ ]式中,K N —平衡常数;[NO]、[N 2]、[O 2]—分别为NO 、N 2、O 2浓度;T —温度,K 。
氮氧化物平衡浓度曲线如下所示:横轴:温度,K ;纵轴:体积分数;图例:氧气体积分数。
横轴:温度,K ;纵轴:体积分数,ppm ;图例:氧气体积分数。
说明:本资料仅供交流,请勿转载。
氮氧化物平衡浓度值如下表所示:(单位,ppm)温度/ K氧气体积分数0.05 0.10 0.15 0.20 0.25 0.30 0.351000 18 25 30 34 36 39 40 1100 49 68 81 91 98 104 108 1200 113 156 186 208 225 238 248 1300 228 314 374 419 453 480 499 1400 415 572 681 763 826 874 909 1500 697 961 1144 1282 1388 1469 1529 1600 1097 1512 1801 2019 2186 2314 2408 1700 1635 2256 2687 3012 3262 3453 3594 1800 2328 3215 3832 4296 4653 4926 5128 1900 3189 4410 5259 5898 6390 6765 7044 2000 4227 5855 6987 7839 8494 8995 9366 2100 5446 7558 9026 10131 10981 11630 12112 2200 6846 9520 11380 12780 13856 14679 15289 2300 8420 11738 14047 15784 17119 18141 18898 2400 10161 14204 17018 19134 20762 22007 22930 2500 12055 16904 20279 22818 24771 26265 27372 2600 14088 19822 23814 26818 29128 30895 32205 2700 16244 22939 27602 31111 33810 35874 37405 2800 18504 26234 31620 35674 38792 41177 42945 2900 20849 29685 35843 40479 44047 46775 48798 3000 23261 33267 40246 45501 49545 52638 54931 3100 25721 36959 44803 50711 55258 58736 61315 3200 28212 40738 49489 56082 61157 65039 67919 3300 30716 44582 54277 61586 67212 71517 74710 3400 33219 48470 59146 67197 73397 78141 81660 3500 35705 52382 64071 72890 79684 84884 88740 3600 38163 56301 69032 78643 86048 91718 95923 3700 40581 60209 74008 84432 92467 98619 103183 3800 42950 64093 78983 90239 98918 105565 110497 3900 45262 67938 83939 96044 105381 112534 117843 4000 47510 71734 88862 101830 111838 119508 125200 4100 49688 75470 93738 107583 118273 126467 132551 4200 51794 79136 98557 113290 124671 133398 139878 4300 53824 82727 103308 118938 131018 140285 147167 4400 55776 86236 107983 124517 137304 147116 154405说明:本资料仅供交流,请勿转载。

空气氮氧化物标准曲线
空气氮氧化物标准曲线的制作需要以下步骤:
1. 准备标准溶液:制备一系列浓度不同的氮氧化物标准溶液,通常使用盐酸萘乙二胺分光光度法或其他适当的方法制备。
2. 吸光度测定:使用分光光度计测定标准溶液的吸光度。
3. 绘制标准曲线:将吸光度与标准溶液浓度作为坐标系中的自变量和因变量,绘制标准曲线。
4. 样品测定:使用标准曲线,将空气样品中的氮氧化物浓度进行定量分析。
需要注意的是,在制作标准曲线时,应使用至少三个浓度点,并确保它们分布在整个曲线上。
此外,标准曲线的斜率和截距应该是显著的,并且应该进行线性回归分析以验证其线性性。
第1页/ 共1页。


实验一空气中氮氧化物的日变化曲线大气中氮氧化物(NO x)主要包括一氧化氮和二氧化氮,主要来自天然过程,如生物源、闪电均可产生NO x。
NO x的人为源绝大部分来自化石燃料的燃烧过程,包括汽车及一切内燃机所排放的尾气,也有一部分来自生产和使用硝酸的化工厂、钢铁厂、金属冶炼厂等排放的废气,其中以工业窑炉、氮肥生产和汽车排放的NO x量最多。
城市大气中2/3的NO x来自汽车尾气等的排放,交通干线空气中NO x的浓度与汽车流量密切相关,而汽车流量往往随时间而变化,因此,交通干线空气中NO x的浓度也随时间而变化。
NO x对呼吸道和呼吸器官有刺激作用,是导致支气管哮喘等呼吸道疾病不断增加的原因之一。
二氧化氮、二氧化硫、悬浮颗粒物共存时,对人体健康的危害不仅比单独NO x严重得多,而且大于各污染物的影响之和,即产生协同作用。
大气中的NO x能与有机物发生光化学反应,产生光化学烟雾。
NO x能转化成硝酸和硝酸盐,通过降水对水和土壤环境等造成危害。
一、实验目的1.掌握氮氧化物测定的基本原理和方法;2.绘制城市交通干线空气中氮氧化物的日变化曲线。
最后用比色法测定。
主要反应方程式为:三、预备实验所需仪器与试剂1.仪器(1)大气采样器:流量范围0.0--1.0L/min。
(2)分光亮度计。
(3)棕色多孔玻板吸收管。
(4)双球玻璃管(装氧化剂)。
(5)干燥管。
(6)比色管:10mL。
(7)移液管:1mL。
2.试剂(1)吸收液:称取5.0g对氨基苯磺酸于烧杯中,将50mL冰醋酸与900mL水的混合液,分数次加人烧杯中,搅拌,溶解,并迅速转人1000mL容量瓶中,待对氨基苯磺酸完全溶解后,加人0.050g盐酸蔡乙二胺,溶解后,用水定容至刻度。
此为吸收原液,贮于棕色瓶中,低温避光保存。
采样液用吸收由4份吸收原液和1份水混合配制。
(2)三氧化铬—石英砂氧化管:取约20g20-40目的石英砂,用(1:2)盐酸溶液浸泡一夜,用水洗至中性,烘干。

氮氧化物热力型产生曲线
氮氧化物热力型产生曲线是指在燃烧过程中,氧化剂(空气)与
燃料反应生成氮氧化物(NOx)的产生趋势曲线。
一般来说,氮氧化物
的生成与燃料的种类、燃烧温度和压力有关。
其中,高温、富氧和高
压环境对氮氧化物的生成有着较大的影响。
氮氧化物热力型产生曲线可以用一条表示NOx生成随燃烧温度变
化的曲线来表示。
这条曲线一般以温度为横坐标,NOx生成量为纵坐标,展示了在燃烧过程中,NOx生成量随温度的变化趋势。
曲线的特点是在一定温度范围内,NOx生成量随温度的升高而增加,但在一定温度以上变化趋势开始趋于平缓或饱和。
据此,可以通过控制燃烧温度来降低氮氧化物的生成量。
例如,
在工业生产和车辆尾气处理过程中,可以采用低温燃烧和催化还原等
方法来控制氮氧化物的生成。
同时,也可以通过调整燃料的种类和使
用SCR(选择性催化还原)等碳氮分离的技术来减少氮氧化物的排放量。


光化学烟雾的日变化曲线光化学烟雾的日变化曲线引言光化学烟雾是指由太阳光照射下,大气中的污染物与大气中的氮氧化合物相互作用产生的一种污染物。
它对人体健康和环境造成了严重的影响,因此对光化学烟雾的研究变得尤为重要。
其中,日变化曲线是一个有力的工具,可以帮助我们更好地了解光化学烟雾的生成和传播规律。
本文将以光化学烟雾的日变化曲线为主题,从简单到复杂,由浅入深地展开探讨。
第一部分:什么是光化学烟雾光化学烟雾是由太阳光、氮氧化合物和其他污染物相互作用产生的一种污染物。
太阳光照射下,大气中的氮氧化合物(如氮氧化物和挥发性有机化合物)会发生光化学反应,产生臭氧和其他有害物质。
这些有害物质对人体健康和环境造成了严重的危害。
第二部分:光化学烟雾的日变化规律光化学烟雾的生成和传播与太阳光的强度以及大气中的污染物浓度有关。
一般来说,光化学烟雾的浓度在一天中的时间分布呈现出明显的日变化曲线。
在清晨和傍晚太阳较低的时候,光化学烟雾的浓度较低。
而在正午太阳最高的时候,光化学烟雾的浓度最高。
这是因为太阳光的强度越高,光化学反应越剧烈,从而产生更多的光化学烟雾。
大气中的污染物浓度也会影响光化学烟雾的浓度。
当大气中的污染物浓度较高时,光化学烟雾的浓度也会相应升高。
第三部分:现有研究与应用光化学烟雾的日变化曲线已经成为研究者们研究和监测光化学烟雾的重要工具。
通过对不同时间点的光化学烟雾浓度进行监测并绘制日变化曲线,可以帮助我们了解光化学烟雾的生成和传播规律,为制定防治措施提供科学依据。
光化学烟雾的日变化曲线也可以用于预测和评估光化学烟雾的危害程度,以及制定合理的个人防护措施。
结论通过对光化学烟雾的日变化曲线的研究,我们可以更全面、深刻和灵活地理解光化学烟雾的生成和传播规律,从而为防治光化学烟雾提供科学依据。
光化学烟雾对人体健康和环境造成了严重的影响,因此我们应该加强光化学烟雾的监测和控制。
我们还需要进一步研究光化学烟雾的形成机制,以及制定更有效的防治策略。

《环境化学实验》报告实验考核标准及得分空气中氮氧化物的日变化曲线一、实验目的与要求1、了解氮氧化物的具体种类及其来源。
2、掌握氮氧化物测定的基本原理以及实验方法。
3.绘制城市交通干线空气中氮氧化物的日变化曲线。
二、实验方案1、实验仪器:大气采样器:流量范围0.2L/min、分光光度计(波长540nm)、多孔吸收玻管、比色管(两个)、移液管、洗耳球、比色皿、烧杯。
装置连接图见图1图1 实验装置图2、实验药品:氮氧化物吸收原液、蒸馏水、亚硝酸钠标准溶液。
3、实验原理:在测定氮氧化物时,先用三氧化铬将一氧化氮等低价氮氧化物氧化成二氧化氮,二氧化氮被吸收在溶液中形成亚硝酸,与对氨苯磺酸发生重氮化反应,再与盐酸萘乙二胺偶合,生成玫瑰红色偶氮染料,用比色法测定。
方法的检出限为0.01mg/L(按与吸光度0.01相应的亚硝酸盐含量计)。
限行范围为0.03-1.6mg/L。
当采样体积为6L时,氮氧化物(一二氧化氮计)的最低检出浓度为0.01ug/m³。
盐酸萘乙二胺盐比色法的有关反应式如下:4、实验步骤:实验步骤简图:(1)氮氧化物的采集:向一支多孔吸收玻管中加入4mL氮氧化物吸收原液和1mL蒸馏水,接上大气采样器,置于椅子上,以每分钟0.2L流量抽取空气30min。
记录采样时间和地点,根据采样时间和流量,算出采样体积。
把一天分成几个时间段进行采样7次,分别为10:00~10:30、11:00~11:30、12:00~12:30、13:00~13:30、14:00~14:30、15:00~15:30、16:00~16:30。
(2)标准曲线的绘制:吸取100mg/L的亚硝酸钠标准溶液5mL定容至100mL,再取7支比色管,按下表配制标准系列。
编 号0123456 NO2-标准溶液/mL0.000.50 1.00 1.50 2.00 2.50 3.00稀释后吸收原液/mL20.0020.0020.0020.0020.0020.0020.00水/mL 5.00 4.50 4.00 3.50 3.00 2.50 2.00 NO2-含量/μg0.00 2.50 5.007.5010.0012.5015.00标准溶液系列表1将各管摇匀,避免阳光直射,放置15 min,以蒸馏水为参比,用1cm比色皿,在540nm波长处测定吸光度。

《环境化学》教学大纲课程编号:097104课程名称:环境化学(Environment Chemistry)课程类型:专业课学时/学分:32/2先修课程:无机化学、分析化学和有机化学、物理化学适用专业:化学工程与工艺开课系或教研室:应用化学教研室一、课程的性质和任务1.课程性质:本课程为化学工程与工艺专业本科生开设的一门专业课程,为学生提供必要的环境化学的知识。
本课程的先修课程是无机化学、分析化学和有机化学。
2. 课程任务:本课程使学生重点掌握大气环境化学、水环境化学、土壤环境化学、生物体内污染物质的运动过程及毒性、典型污染在环境各圈层中的转归与效应等基本原理、基本知识和环境化学相关交叉学科的知识,掌握受污染环境的修复的基本知识和基本技能,了解绿色化学的基本原理和在现实中的典型应用。
二、课程教学的基本要求本课的教学环节包括:课堂讲授、学生自学、习题、答疑、期末考试。
通过上述环节,要求学生了解和掌握各类污染物质在大气、水、土壤以及生物机体内的迁移转化过程,产生效应的基本原理和防治的基本方法。
本课程课堂讲授32学时(具体按当年教学计划而定),考核方式为可采取闭卷考试、开卷考试、撰写课程论文的形式进行。
总评成绩:考试占90%、平时作业占10%三、课程教学内容(一)结论(2学时)环境问题,环境化学;环境污染物的类别,环境效应及其影响因素,环境污染物在环境各圈的迁移转化过程简介。
(二)大气环境化学(6学时)※1.大气温度层结,辐射逆温层,气绝热过程和干绝热递减率,大气稳定度,影响大气污染物迁移的因素;※2.光化学反应基础,大气中重要自由基的来源,氮氧化物的转化,碳氢化合物的转化※3.光化学烟雾型污染,酸性降水,大气颗粒物,温室气体和温室效应,臭氧层的形成与耗损。
(三)水环境化学(8学时)1.天然水的基本特征2.水中污染物的分布与存在形态,水中无机污染物的迁移转化※3.颗粒物与水之间的迁移,水中颗粒物的聚集,溶解和沉淀,氧化-还原,配合作用※4.水中有机污染物的迁移的分配作用,挥发作用,水解作用,光解作用,生物降解作用(四)土壤环境化学(6学时)1.土壤组成,土壤的粒级分组与质地分组※2.土壤吸附性,土壤酸碱性,土壤的氧化还原性※3.污染物在土壤-植物体系中的迁移,植物对重金属污染产生耐性的几种机制;土壤中农药的迁移,典型农药在土壤中的迁移转化(五)生物体内污染物质的运动过程及毒性(4学时)1.生物膜的结构,物质通过生物的方式※2.污染物质在机体内的吸收、分布、排泄、蓄积;污染物质的生物富集,生物放大,生物积累4.污染物质生物转化中的酶,若干重要辅酶的功能,生物氧化中的氢传递过程※5.耗氧有机污染物质的微生物降解,有毒有机污染物质生物转化类型,有毒有机污染物质的微生物降解,氮及硫的微生物转化,重金属元素的微生物转化,污染物质的生物转化速率※6.毒物,毒物的毒性,毒物的联合作用,毒作用的过程,毒作用的生物化学机制。

氮氧化物热力型产生曲线引言氮氧化物是一类对环境和健康有害的空气污染物,主要由汽车尾气、工业排放和燃烧过程中产生。
了解氮氧化物产生的机理和特点对于环境保护和空气质量改善具有重要意义。
本文将详细探讨氮氧化物热力型产生曲线,以期更好地理解和应对氮氧化物污染问题。
氮氧化物的组成和来源氮氧化物主要包括一氧化氮(NO)、二氧化氮(NO2)和氮氧化合物(NOx)。
它们的主要来源包括以下几个方面:1.汽车尾气:汽车燃烧产生的高温和高压条件下,氮气和氧气会发生反应生成一氧化氮和二氧化氮。
2.工业排放:许多工业过程中需要高温和高压条件,这些条件下也会产生大量的氮氧化物排放。
3.燃烧过程:包括燃煤、燃油和天然气燃烧等,这些燃烧过程中产生的高温和高压条件也会导致氮氧化物的生成。
氮氧化物的热力型产生曲线氮氧化物的热力型产生曲线是指在一定的温度范围内,氮氧化物的生成和消耗速率与温度的关系。
一般来说,氮氧化物的产生速率随温度的升高而增加,达到一个临界温度后开始减小,最后趋于稳定。
热力型产生曲线可以用以下图表表示:温度(℃)氮氧化物产生速率100 低200 逐渐增加300 达到峰值400 开始减小500 稳定从上表中可以看出,氮氧化物的产生速率在温度达到一定值后达到峰值,随后开始减小。
这是因为在高温条件下,氮氧化物的生成速率很快,但同时也有一些与氮氧化物相关的反应会加速,使氮氧化物被消耗。
当温度进一步升高时,氮氧化物的消耗速率开始超过产生速率,导致总的氮氧化物浓度下降。
影响氮氧化物产生曲线的因素氮氧化物的热力型产生曲线受到多个因素的影响,包括燃料类型、燃烧温度、燃烧风量和燃烧时间等。
燃料类型不同燃料的燃烧过程中产生氮氧化物的能力有所不同。
含氮量较高的燃料,如煤炭,产生的氮氧化物较多;而含氮量较低的燃料,如天然气,产生的氮氧化物相对较少。
燃烧温度燃烧温度是影响氮氧化物生成的重要因素之一。
一般来说,燃烧温度越高,氮氧化物的生成速率越快。

北京大气O3与NOx的变化特征安俊琳;王跃思;李昕;孙扬【摘要】以2004年8月-2005年7月北京市区近地层大气中臭氧(O3)和氮氧化物(NOx)体积分数观测资料,研究了北京大气中O3和NOx体积分数的变化特征.研究表明:北京市O3体积分数较高,并呈季节性波动,大气光化学污染以夏季最为严重.受太阳紫外辐射和城市交通的影响,城市O3体积分数呈单峰型分布,并在午后15:00出现峰值,造成大气强氧化性.NO2的光解速率夏季最大,在正午出现日最大值.受城市车流量变化的影响,周末NOx体积分数高于工作日,O3体积分数周末与工作日白天差异较小,而夜晚O3体积分数上作日高于周末.【期刊名称】《生态环境学报》【年(卷),期】2008(017)004【总页数】5页(P1420-1424)【关键词】臭氧;城市大气;光化学污染;周末【作者】安俊琳;王跃思;李昕;孙扬【作者单位】南京信息工程大学大气物理与大气环境重点实验室,江苏,南京,210044;中国科学院大气物理研究所,北京,100029;中国科学院大气物理研究所,北京,100029;中国科学院大气物理研究所,北京,100029;北京市环境保护局,北京,100044;中国科学院大气物理研究所,北京,100029【正文语种】中文【中图分类】工业技术牛态环境 2008,17(4):1420-1424EcologyandEnviromnent E-mail:editor@北京大气 03 与 NOx 的变化特征安俊琳L2 ,王跃思垆,李昕己 3 ,孙扬2 l南京信息工程大学大气物理与大气环境重点实验室,江苏南京 210044 ; 2中国科学院大气物理研究所,北京 100029 ; 3 北京市环境保护局,北京100044摘要:以 2004 年 8 , LJ-2005 年 7 月北京市区近地层大气中臭氧(03)和氮氧化物(NOr)体积分数观测资料,研究 r 北京人气中 0,和 NOx体积分数的变化特征。
空气氮氧化物标准曲线摘要:1.空气氮氧化物的概念及来源2.氮氧化物的危害3.标准曲线的意义4.制定空气氮氧化物标准曲线的过程5.我国空气氮氧化物标准曲线的规定6.如何在实际应用中使用标准曲线7.监测与控制空气氮氧化物的措施正文:空气氮氧化物(NOx)是指在空气中存在的以氮氧化物为主的氧化物,主要包括一氧化氮(NO)、二氧化氮(NO2)和四氧化二氮(N2O)等。
它们主要来源于燃烧过程,如交通运输、工业生产和取暖等。
此外,农业活动和自然界土壤中的微生物也会排放一定量的氮氧化物。
氮氧化物对人体和环境的危害不容忽视。
它们对人体呼吸系统、神经系统和心血管系统具有毒性作用,导致呼吸道疾病、神经系统损害和心血管疾病等。
同时,氮氧化物还具有强烈的致畸和致癌作用。
此外,氮氧化物还是形成光化学烟雾和酸雨的重要成分,对生态环境造成严重影响。
为了衡量空气中氮氧化物的污染程度,我们需要制定一个具有可操作性和实用性的标准。
标准曲线是一种有效的工具,它将氮氧化物的浓度与相应的污染程度联系起来,为监测和控制空气污染提供依据。
制定空气氮氧化物标准曲线的过程主要包括以下几个步骤:1.收集相关数据:包括空气中氮氧化物的浓度、气象参数、污染源信息等。
2.分析数据:对收集的数据进行统计分析,得出氮氧化物浓度与污染程度之间的关系。
3.拟合曲线:根据分析结果,选择合适的数学模型拟合氮氧化物浓度与污染程度的关系。
4.确定标准曲线:结合实际情况,制定出适用于监测和控制空气氮氧化物的标准曲线。
在我国,空气氮氧化物的标准曲线规定如下:1.短期暴露限值:日均浓度不超过40微克/立方米(μg/m),小时均浓度不超过60μg/m。
2.长期暴露限值:年均浓度不超过20μg/m。
在实际应用中,标准曲线有助于我们更好地监测和控制空气氮氧化物的排放。
相关部门和企业可以根据标准曲线采取相应的措施,如改进燃烧工艺、使用污染控制设备、调整能源结构等,以降低氮氧化物的排放量。
《环境化学》实验报告实验项目:空气中氮氧化物的日变化曲线实验考核标准及得分一、实验目的与要求1、了解氮氧化物的具体种类及其来源。
2、掌握氮氧化物测定的基本原理以及实验方法。
二、实验方案1、实验仪器:大气采样器:流量范围0.2L/min、分光光度计(波长540nm)、多孔吸收玻管、比色管(两个)、移液管、洗耳球、比色皿、烧杯。
2、实验药品:氮氧化物吸收原液、蒸馏水、亚硝酸钠标准溶液。
3、实验原理:在测定氮氧化物时,先用三氧化铬将一氧化氮等低价氮氧化物氧化成二氧化氮,二氧化氮被吸收在溶液中形成亚硝酸,与对氨苯磺酸发生重氮化反应,再与盐酸萘乙二胺偶合,生成玫瑰红色偶氮染料,用比色法测定。
方法的检出限为0.01mg/L(按与吸光度0.01相应的亚硝酸盐含量计)。
限行范围为0.03-1.6mg/L。
当采样体积为6L时,氮氧化物(一二氧化氮计)的最低检出浓度为0.01ug/m³。
盐酸萘乙二胺盐比色法的有关反应式如下:4、实验步骤:(1)氮氧化物的采集:向一支多孔吸收玻管中加入4mL氮氧化物吸收原液和1mL蒸馏水,接上大气采样器,置于椅子上,以每分钟0.2L流量抽取空气30min。
记录采样时间和地点,根据采样时间和流量,算出采样体积。
把一天分成几个时间段进行采样7次,分别为10:00~10:30、11:00~11:30、12:00~12:30、13:00~13:30、14:00~14:30、15:00~15:30、16:00~16:30。
(2)氮氧化物的测定:标准曲线的绘制:吸取100mg/L的亚硝酸钠标准溶液5mL定容至100mL,再取7支比色管,按下表配制标准系列。
编 号0123456 NO2-标准溶液/mL0.000.500.10 1.50 2.00 2.50 3.00稀释后吸收原液/mL20.0020.0020.0020.0020.0020.0020.00水/mL 5.00 4.50 4.00 3.50 3.00 2.50 2.00 NO2-含量/μg0.00 2.50 5.007.5010.0012.5015.00标准溶液系列将各管摇匀,避免阳光直射,放置15 min,以蒸馏水为参比,用1cm比色皿,在540nm波长处测定吸光度。
空气氮氧化物标准曲线摘要:I.引言- 氮氧化物对环境和人类健康的影响- 测定空气中氮氧化物浓度的意义II.盐酸萘乙二胺分光光度法- 方法原理- 试剂和仪器- 测定步骤III.标准曲线的绘制- 标准溶液的配制- 盐酸萘乙二胺分光光度法的测量范围- 标准曲线的斜率和截距- 标准曲线的不确定度IV.分析结果的误差来源- 样品处理过程中的误差- 测量过程中的误差- 标准曲线绘制中的误差V.结论- 盐酸萘乙二胺分光光度法在测定空气氮氧化物中的应用- 方法的优缺点- 未来改进的方向正文:引言氮氧化物是一类对环境和人类健康都有极大影响的大气污染物。
它们可以引起酸雨、光化学烟雾等环境问题,同时也会对人体呼吸系统、心血管系统等造成伤害。
因此,准确、快速地测定空气中氮氧化物的浓度,对于环境保护和人类健康具有重要意义。
盐酸萘乙二胺分光光度法盐酸萘乙二胺分光光度法是一种常用的测定空气中氮氧化物浓度的方法。
它基于氮氧化物与盐酸萘乙二胺发生化学反应,生成有色化合物,通过测量该化合物的吸光度,从而推算出空气中氮氧化物的浓度。
方法原理盐酸萘乙二胺分光光度法的原理是:在盐酸酸化的条件下,空气中的氮氧化物与盐酸萘乙二胺反应,生成有色化合物。
该化合物的吸光度与氮氧化物的浓度成正比。
通过测量吸光度,可以推算出空气中氮氧化物的浓度。
试剂和仪器- 盐酸:浓度为36%的盐酸溶液- 萘乙二胺:纯品- 氢氧化钠:浓度为0.1mol/L的氢氧化钠溶液- 盐酸酸化装置- 分光光度计测定步骤1.采集空气样品。
2.将样品中的氮氧化物用氢氧化钠溶液吸收。
3.将吸收液中的氮氧化物用盐酸酸化。
4.加入适量的萘乙二胺试剂。
5.用分光光度计测量吸光度。
6.根据吸光度和标准曲线推算出空气中氮氧化物的浓度。
标准曲线的绘制标准曲线的绘制是将不同浓度的标准溶液与对应的吸光度进行绘制,从而得到一条直线。
该直线的斜率和截距分别表示检测限和浓度单位。
1.配制一系列不同浓度的标准溶液。
空气中NO x的日变化一、实验目的与要求1.掌握氮氧化物测定的基本原理和方法。
2.了解空气氮氧化物的来源及其危害。
3.根据实验绘制空气中氮氧化物的日变化曲线并解释现象。
二、实验方案1.实验原理:在测定NO x时,先用三氧化铬将一氧化氮等等低价氮氧化物化成二氧化氮;二氧化氮被吸收在溶液中形成亚硝酸,与对氨苯磺酸发生重氮化反应,再与盐酸萘乙胺偶合,生成玫瑰红色偶氮染料,用比色法测定。
方法的检出限为0.01μg/mL。
线性范围为0.03-1.6μg/mL。
当采样体积为6L时,最低检出浓度为0.01μg/m3。
2.仪器:大气采样器、分光光度计、多孔吸收玻管、比色管、移液管等。
3.试剂(1)吸收液:称取5.0g对氨基苯磺酸于烧杯中,将50mL冰醋酸与900 mL 水的混合液,分数次加入烧杯中,搅拌,溶解,并迅速转入1000mL容量瓶中,待对氨基苯磺酸完全溶解后,加入0.05g盐酸萘乙二胺溶解后,用定容至刻度。
此为吸收原液,贮于棕色瓶中,低温避光保存。
采样液用吸收由4份吸收原液和1份水混合配制。
(2)亚硝酸钠标准溶液:准确称取0.1500g亚硝酸钠(预先在干燥器内放置24h)溶于水,移入1000mL容量瓶中,用水稀释至刻度,即配得100μg/mL亚硝酸根溶液,将其贮于棕色瓶,在冰箱中保存可稳定3个月。
使用时,吸取上述溶液25.00mL于50mL容量瓶中,用水稀释至刻度,即配得5μg/mL亚硝酸工作液。
4.实验步骤(1)空气中氮氧化学的采集:将4mL吸收原液和1mL水分别加入同一个多孔玻璃板采样管里面,同样做好另一个采样管后,连接入事先调好流量的空气采样器中,于10:00、11:00、12:00、13:00、14:00、15:00、16:00时刻开始采样,连续采样30min。
(2)氮氧化物的测定:每一时间段完成采样后,将采样管置于暗处静置15分钟后,倒出吸收液并在540nm波长处测定吸光度。
(3)标准曲线的绘制:取7支10mL比色管,按表1配制标准系列。