医疗器械设计和开发汇编ppt课件
- 格式:ppt
- 大小:108.50 KB
- 文档页数:15
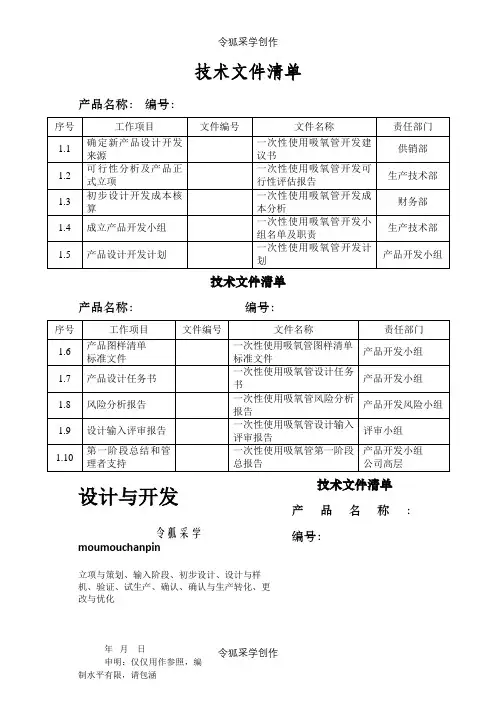
技术文件清单产品名称: 编号:技术文件清单产品名称: 编号:技术文件清单 产品名称:编号:设计与开发令狐采学moumouchanpin立项与策划、输入阶段、初步设计、设计与样机、验证、试生产、确认、确认与生产转化、更改与优化技术文件清单产品名称:编号:技术文件清单产品名称:编号:技术文件清单产品名称:编号:技术文件清单产品名称:编号:技术文件清单产品名称:编号:技术文件清单产品名称:编号:1.1 新产品开发建议书编号:1.2 设计评审记录编号:SOR-SK002-00记录人:1.3 新产品开发预算表编号:SOR-SK003-1.4 新产品开发小组名单及职责编号:项目组长:日期:1.5 产品开发计划编号:编制:日期:批准:日期1.6.1 图样清单产品名称:一次性使用吸氧管编号:1.6.2标准文件1.7 产品设计任务书编号:编制:日期:年月日批准:日期:1.8 一次性使用吸氧管风险管理报告一、产品概述:一次性使用吸氧管用于人体吸氧,该产品以无菌状态提供给用户仅一次性使用,可避免患者之间的交叉感染,产品采用医用级PVC加工制成,符合医用产品要求,产品经检验和试验均符合标准要求,使用后没有存在对用户产生不良影响的因素。
本产品的关键部件及装配包装等均在符合要求的10万级净化条件下生产,对每一位员工都进行相应的培训,同时每年对员工进行至少一次体检,为了确保环境符合要求,还制定了管理制度,减少对产品感染的机会,且产品包装后进行灭菌,保证其产品无菌。
二、影响安全性的特征1.预期用途和使用方法?用于患者吸氧,可有效避免患者之间的交叉感染,受到专业培训的临床医护人员对患者使用该器械。
2.与使用者接触方式?与患者的鼻腔接触,通常连续使用不超过30天,仅供一次性使用。
3.使用的材料和/或部件?主要材料:医用级PVC。
4.是否有能量施加患者和/或由患者身上吸收?没有。
5.是否有物质进入患者体内/或由患者身上抽取?没有。
6.生物材料是否由器械处理以便随后使用?不是。








设计与开发moumouchanpin立项与策划、输入阶段、初步设计、设计与样机、验证、试生产、确认、确认与生产转化、更改与优化年月日申明:仅仅用作参照,编制水平有限,请包涵技术文件清单技术文件清单技术文件清单技术文件清单技术文件清单技术文件清单技术文件清单技术文件清单技术文件清单1.1 新产品开发建议书1.2 设计评审记录记录人:1.3 新产品开发预算表编号:SOR-SK003-001.4 新产品开发小组名单及职责项目组长:日期:1.5 产品开发计划编制:日期:批准:日期1.6.1 图样清单1.6.2标准文件1.7 产品设计任务书编制:日期:年月日批准:日期:1.8 (产品名+型号)风险管理报告一、产品概述:(产品名+型号)用于人体吸氧,该产品以无菌状态提供给用户仅一次性使用,可避免患者之间的交叉感染,产品采用医用级PVC加工制成,符合医用产品要求,产品经检验和试验均符合标准要求,使用后没有存在对用户产生不良影响的因素。
本产品的关键部件及装配包装等均在符合要求的10万级净化条件下生产,对每一位员工都进行相应的培训,同时每年对员工进行至少一次体检,为了确保环境符合要求,还制定了管理制度,减少对产品感染的机会,且产品包装后进行灭菌,保证其产品无菌。
二、影响安全性的特征1.预期用途和使用方法?用于患者吸氧,可有效避免患者之间的交叉感染,受到专业培训的临床医护人员对患者使用该器械。
2.与使用者接触方式?与患者的鼻腔接触,通常连续使用不超过30天,仅供一次性使用。
3.使用的材料和/或部件?主要材料:医用级PVC。
4.是否有能量施加患者和/或由患者身上吸收?没有。
5.是否有物质进入患者体内/或由患者身上抽取?没有。
6.生物材料是否由器械处理以便随后使用?不是。
7.是否以无菌形式提供或准备由用户灭菌或使用其他的微生物的控制方法处理?本产品为一次性使用无菌医疗器械,所有产品均经环氧乙烷灭菌,经严格的微生物测试证明无菌,并且当环氧乙烷解析达标后,才予以交付使用。

医疗器械设计与开发资料医疗器械是现代医疗领域中不可或缺的一部分,它们的设计与开发对于人类健康和生命的保障具有重要意义。
本资料将介绍医疗器械设计与开发的相关概念、步骤以及在这个过程中需要考虑的关键因素。
一、医疗器械设计的概念医疗器械设计是指将科学的原理和先进的技术应用于医疗设备的创造过程。
它旨在满足医疗领域对于高效、安全和可靠医疗设备的需求,并且使其能够提供更好的诊断和治疗效果。
在医疗器械设计过程中,需要考虑到医生和患者的使用需求,以及设备本身的功能和性能。
二、医疗器械设计与开发的步骤1. 需求分析:在医疗器械设计与开发之初,需要明确产品的功能和性能要求。
通过与医生和患者的沟通以及市场需求分析,确定产品需要解决的问题和提供的价值。
2. 概念设计:在需求分析的基础上,进行创意思维,产生不同的设计概念。
这些概念可以通过手绘、草图或计算机辅助设计工具进行表达和展示。
关键是确定最佳的设计方案,满足需求和预期的目标。
3. 详细设计:在概念设计的基础上,进行详细的工程设计。
这个阶段需要考虑到产品的材料、制造工艺、结构布局以及性能参数等方面。
同时需要进行各种测试和验证,确保设计的可行性和可靠性。
4. 制造和生产:在详细设计完成后,需要制定制造流程和生产计划。
这包括原材料采购、制造设备配置、生产线布置以及质量控制等方面。
制造过程中需要遵循相关法规和标准,确保产品的安全和合规性。
5. 验证和认证:在产品制造完成后,需要进行验证和认证,以确保产品符合相关标准和规定。
这包括临床试验、功能测试、质量检测以及注册和认证等程序。
验证和认证是确保产品质量和安全性的重要步骤。
6. 市场推广:在通过验证和认证之后,可以将产品推向市场。
这包括制定市场推广策略、开展推广活动、与分销商合作以及与医疗机构建立合作关系等方面。
市场推广的目标是扩大产品的市场占有率并提高品牌知名度。
三、医疗器械设计与开发的关键因素1. 安全性:医疗器械的安全性是设计与开发过程中的首要考虑因素。

设计与开发moumouchanpin立项与策划、输入阶段、初步设计、设计与样机、验证、试生产、确认、确认与生产转化、更改与优化年月日申明:仅仅用作参照,编制水平有限,请包涵技术文件清单技术文件清单技术文件清单技术文件清单技术文件清单技术文件清单技术文件清单技术文件清单技术文件清单1.1 新产品开发建议书1.2 设计评审记录记录人:1.3 新产品开发预算表编号:SOR-SK003-001.4 新产品开发小组名单及职责项目组长:日期:1.5 产品开发计划编制:日期:批准:日期1.6.1 图样清单1.6.2标准文件1.7 产品设计任务书编制:日期:年月日批准:日期:1.8 (产品名+型号)风险管理报告一、产品概述:(产品名+型号)用于人体吸氧,该产品以无菌状态提供给用户仅一次性使用,可避免患者之间的交叉感染,产品采用医用级PVC加工制成,符合医用产品要求,产品经检验和试验均符合标准要求,使用后没有存在对用户产生不良影响的因素。
本产品的关键部件及装配包装等均在符合要求的10万级净化条件下生产,对每一位员工都进行相应的培训,同时每年对员工进行至少一次体检,为了确保环境符合要求,还制定了管理制度,减少对产品感染的机会,且产品包装后进行灭菌,保证其产品无菌。
二、影响安全性的特征1.预期用途和使用方法?用于患者吸氧,可有效避免患者之间的交叉感染,受到专业培训的临床医护人员对患者使用该器械。
2.与使用者接触方式?与患者的鼻腔接触,通常连续使用不超过30天,仅供一次性使用。
3.使用的材料和/或部件?主要材料:医用级PVC。
4.是否有能量施加患者和/或由患者身上吸收?没有。
5.是否有物质进入患者体内/或由患者身上抽取?没有。
6.生物材料是否由器械处理以便随后使用?不是。
7.是否以无菌形式提供或准备由用户灭菌或使用其他的微生物的控制方法处理?本产品为一次性使用无菌医疗器械,所有产品均经环氧乙烷灭菌,经严格的微生物测试证明无菌,并且当环氧乙烷解析达标后,才予以交付使用。
医疗器械设计与开发资料
一、医疗器械设计与开发
1.1项目概述
医疗器械设计与开发是指通过对医疗设备或系统的结构化分析和设计,确保其能够为医院提供安全有效的设备服务,实现患者安全性,有效性,
高效性,可靠性,可重复使用性,可控性和质量的要求。
医疗器械设计与
开发的目的是通过科学的方法确保医疗器械的性能,可靠性和有效性,保
证患者安全,确保治疗效果,实现全面有效的病人照顾。
1.2医疗器械设计与开发流程
1)需求分析
2)设计
根据收集的信息,根据患者的需求,根据技术要求,根据社会经济政策,设计符合要求,具有良好经济性和性能的医疗器械,并确定其机构结构。
3)制造
根据设计图纸,确定配件,根据要求选择材料,开始制造医疗器械,
分配工程进度,完成调试,检测和评定,确保质量合格。
4)测试
根据成品和安全标准,实施整体测试,确保医疗器械的功能,可靠性,可执行性,安全性。
全套医疗器械设计和开发资料医疗器械设计和开发资料一、引言二、需求分析1.产品概述在这一部分,应当对设计的医疗器械进行简单的概述,包括其主要功能、预期应用场景、使用对象等。
2.功能性需求在这一部分,应当明确产品所需具备的功能,例如测量、治疗、监测等。
3.性能参数需求这一部分应当明确产品所需具备的性能参数,例如精度、分辨率、测量范围等。
4.安全性需求这部分应当明确产品在使用过程中所需满足的安全性要求,例如电气安全、生物安全等。
5.可靠性需求这部分应当明确产品在使用过程中所需满足的可靠性要求,例如工作寿命、可靠性指标等。
三、概念设计1.概念设计概述这一部分应当对产品的概念设计进行简单的概述,包括主要设计思路、原理等。
2.设计方案选择在这一部分,应当描述从众多的设计方案中选择出的最佳设计方案,以及选择这个方案的原因。
3.关键技术参数的确定这一部分应当确定产品的关键技术参数,例如结构尺寸、工作电压等。
四、详细设计1.结构设计在这一部分,应当对产品的结构进行详细设计,包括主要部件的选材、连接方式、结构布局等。
2.电路设计这一部分应当对产品的电路进行详细设计,包括电路原理图、电路板设计、元器件选型等。
3.控制系统设计这一部分应当对产品的控制系统进行详细设计,包括控制算法的设计、控制器的选型等。
四、制造及测试1.制造工艺这一部分应当描述产品的制造工艺,包括零部件制造方式、装配工艺等。
2.测试方案这一部分应当描述产品的测试方案,包括对产品功能、性能、安全性等方面的测试方法和标准。
3.测试结果分析这一部分应当对测试结果进行详细的分析,明确产品是否满足设计要求。
五、验证与验证报告1.验证方案这一部分应当描述产品的验证方案,包括验证方法、验证标准等。
2.验证结果分析这一部分应当对验证结果进行详细的分析,明确产品是否满足预期需求。
3.验证报告这一部分应当总结验证结果,并给出相应的结论和建议。
六、技术文档1.产品说明书这一部分应当提供一份详细的产品说明书,包括产品的功能、性能、使用方法等。