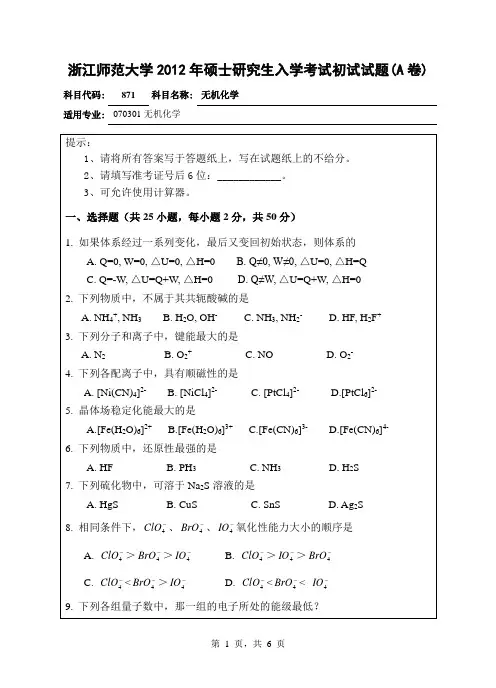
2012年浙江师范大学无机化学(906)考研试题
- 格式:pdf
- 大小:81.09 KB
- 文档页数:2


浙江师范大学硕士研究生入学考试初试科目考试大纲科目代码、名称: 906无机化学适用专业: 420106学科教学(化学)、045117科学与技术教育一、考试形式与试卷结构(一)试卷满分及考试时间本试卷满分为150分,考试时间为180分钟。
(二)答题方式答题方式为闭卷、笔试。
试卷由试题和答题纸组成;答案必须写在答题纸相应的位置上;答题纸一般由考点提供。
(三)试卷题型结构选择题:15小题,每小题3分,共45分完成并配平反应方程式:5小题,每小题4分,共20分简答题:共5小题,每小题10分,共50分制备题:共1小题,共15分计算题:共1小题,共20分二、考查目标(复习要求)全日制攻读教育硕士专业学位研究生入学考试《无机化学》科目考试,要求考生系统掌握无机化学中重要的基本概念和基础知识,掌握元素周期律、原子和分子结构、化学反应速率、化学平衡、化学热力学、电解质溶液、氧化还原反应和配位化学等基本理论,并用这些理论来解释无机化学中的实际问题,具有理论分析、科学思维和化学计算的能力。
掌握重要元素的单质及其化合物结构、性质、制备及用途,并用无机化学的相关理论进行解释。
三、考查范围或考试内容概要第一篇物质结构基础第1章原子结构与元素周期系1.道尔顿原子论2.相对原子质量(原子量)3.原子的起源和演化4.原子结构的玻尔行星模型5.氢原子结构(核外电子运动)的量子力学模型6.基态原子电子组态(电子排布)7.元素周期系8.元素周期性第2章分子结构1.路易斯结构式2.单键、双键和叁键—σ键和π键—价键理论(一)3.价层电子互斥模型(VSEPR)4.杂化轨道理论—价键理论(二)5.共轭大π键6.等电子体原理7.分子轨道理论8.共价分子的性质9.分子间力10.分子对称性第3章晶体结构1.晶体2.晶胞3.金属晶体4.离子晶体5.分子晶体与原子晶体第4章配合物1.配合物的基本概念2.配合物的异构现象与立体结构3.配合物的价键理论第二篇化学热力学与化学动力学基础第5章化学热力学基础1.化学热力学的研究对象2.基本概念3.化学热力学的四个重要状态函数4.化学热力学的应用第6章化学平衡常数1.化学平衡状态2.平衡常数3.浓度对化学平衡的影响4.压力对化学平衡的影响5.温度对化学平衡的影响第7章化学动力学基础1.化学反应速率2.浓度对化学反应速率的影响3.温度对化学反应速率的影响及阿仑尼乌斯公式4.反应历程5.碰撞理论和过渡态理论6.催化剂对反应速率的影响第三篇水溶液化学原理第8章水溶液1.溶液的浓度和溶解度2.非电解质稀溶液通性3.电解质溶液第9章酸碱平衡1.酸碱质子理论2.水的离子积和pH3.酸碱盐溶液中的电离平衡4.水溶液化学平衡的计算5.缓冲溶液6.酸碱指示剂第10章沉淀平衡1.溶度积原理2.沉淀与溶解第11章电化学基础1.氧化还原反应2.原电池3.实用电池4.有关电解的几个问题第12章配位平衡1.配合物的稳定常数2.影响配合物在溶液中的稳定性的因素3.配合物的性质第四篇元素化学(一)非金篇第13章氢和稀有气体1.氢2.稀有气第14章卤素1.卤素的通性2.卤素单质3.氟氯溴碘的化合物4.砹的化学第15章氧族元素1.氧族元素的通性2.氧及其化合物3.硫及其化合物4.硒和碲第16章氮磷砷1.元素的基本性质2.氮和氮的化合物3.磷及其化合物4.砷第17章碳硅硼1.通性2.碳3.硅4.硼5.碳化物、硅化物和硼化物第18章非金属元素小结1.非金属元素的结构和性质2.分子型氢化物3.含氧酸4.非金属含氧酸的某些性质5.p区元素的次级周期性第五篇元素化学(二)金属第19章金属通论1.概述2.金属的提炼3.金属的物理性质和化学性质4.合金第20章s区元素1.碱金属和碱土金属的通性2.碱金属和碱土金属的单质3.碱金属和碱土金属的化合物第21章p区金属1.p区金属概论2.铝镓分族3.锗分族4.锑和铋第22章ds区元素1.铜族元素2.锌族元素第23章d区金属(一)第四周期d区金属1.引言2.第一过渡系元素的基本性质3.钪4.钛5.钒6.铬7.锰8.铁、钴、镍参考教材或主要参考书:无机化学(上、下册,第四版),北京师范大学、南京师范大学、华中师范大学编,高等教育出版社,2002年版四、样卷一、选择题(共15小题,每小题3分,共45分)1.下列分子或离子与BF3互为等电子体,并具有相似结构的一种是()A.NO3-B.NF3C.气态AlCl3D.SO22.A与B发生反应,当A浓度为原来2倍时,反应速度增加为4倍,当B浓度增加为原来2倍时,反应速度增加为2倍,此反应的反应级数为()A.1级B.2级C.3级D.4级3.有两个平行反应A →B和A →C,如果要提高B的产率,降低C的产率,最好的办法是()A.增加A的浓度B.增加C的浓度C.控制反应温度D.选择某种催化剂4.最近意大利科学家用普通的氧分子和带正电荷的氧离子制造出了由4个氧原子构成的氧分子,并用质谱仪探测到了它存在的证据。
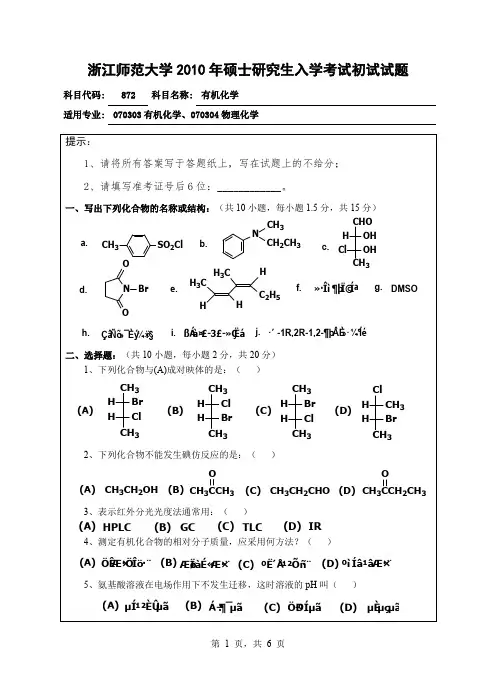






浙江师范大学《元素无机化学》考试卷(A)(2009~2010 学年第 2 学期)考试类别理科使用学生生化学院化学专业本科(09级)考试时间120分钟出卷时间2010 年 6 月12 日说明:允许使用计算器。
一. 选择题(每小题只有1个正确答案。
每小题2分,共30分)键的是()1.下列分子或离子中,存在Π64A.NO3-B.BI3C.H3O+D.HN32.下列有关离子浓度减小一半,其电极电势值增加的是( )A. Cu2+ + 2e- == CuB. Fe3+ + e- == Fe2+C. 2H+ + 2e- == H2D. I2 + 2e -== 2I-3.Fe3+与强场和弱场配体形成八面体配合物中未成对电子的数目分别是()A.5和1 B.1和5 C.3和1 D.5和04.下列哪组溶液中的离子不能共存()A.NH4+、Br-、Na+、NO3-;B.Fe3+、K+、Cl-、SO42-;C.Na+、SO32-、H+、Cr2O72-;D.Al3+、Cl-、K+、NH4+。
5.镧系收缩的后果之一是使下列哪组元素的性质更相似()A.Mn和Tc B.Nb和Ta C.Sc和La D.Ru、Rh、Pd 6.下列哪种物质不溶于王水,但能溶于HNO3—HF的混酸中()A.Ta B.Ti C.CdS D.HgS7. 下列化合物属于缺电子化合物的是()A. Na[Al(OH)4]B. H[BF4]C. [B(OH)4]-D. Al(CH3)28.下列物质中酸性最弱的是A.H3AsO4B.HClO4 C.H3PO4D.H4P2O79.单质F2特别活泼的主要原因是()A.F(g)电离能较小;B.F原子间孤对电子的排斥作用大;C.F-(aq)的水合热特别大;D.F的电子亲和能大。
10.CrO42-(aq) 呈黄色,其属于()A.d-d光谱B.f-f光谱C.荷移光谱D.拉曼光谱11.在普鲁士蓝KFe[Fe(CN3)6]中,Fe2+和Fe3+的配位方式是()A.CN-中的C原子和N原子分别与Fe2+和Fe3+形成配位键;B.CN-中的C原子和N原子分别与Fe3+和Fe2+形成配位键;C.CN-中的C原子和N原子均与Fe2+配位键;D.CN-中的C原子和N原子均与Fe3+配位键。

浙江师范大学《元素无机化学》考试卷 (A)(2009〜2010学年 第2学期)考试类别理科 使用学生生化学院化学专业丕科(09级) 考试时间120分钟 出卷时间 2010 年 6 月 12 日说明:允许使用计算器。
一.选择题(每小题只有1个正确答案。
每小题2分,共30分)A . NO 3- B. BI 3 C. H 3O +2.下列有关离子浓度减小一半,其电极电势值增加的是()A. Cu 2+ + 2e - == CuB. Fe 3+ + e - == Fe 2+C. 2H + + 2e - == H 2D. I 2 + 2e -== 2I3. Fe 3+与强场和弱场配体形成八面体配合物中未成对电子的数目分别是(C. CdSD. HgS (:C. [B(OH)4]-D. Al(CH 3)2C . H 3PO 4D . H 4P 2O 7()B . F 原子间孤对电子的排斥作用大; D . F 的电子亲和能大。
(:C.荷移光谱D.拉曼光谱 11 .在普鲁士蓝KFe[Fe(CN 3)6]中,Fe 2+和Fe 3+的配位方式是A . CN -中的C 原子和N 原子分别与Fe 2+和Fe 3+形成配位键;1 .下列分子或离子中,存在 n4键的是A . 5 和 1B . 1 和 54. 下列哪组溶液中的离子不能共存A. NH 4+、Br -、Na +、NO 3-; C. Na +、SO 32-、H +、Cr 2O 72-;5. 铜系收缩的后果之一是使下列哪组元素的性质更相似A . Mn 和 TcB. Nb 和 TaC. Sc 和 La6. 下列哪种物质不溶丁王水,但能溶丁 HNO3- HF 的混酸中C . 3 和 1D. 5 和 0(B. Fe 3+、K +、Cl -、SO 42-;D. Al 3+、Cl -、K +、NH 4+。
()D. Ru 、 Rh 、 Pd()A . Ta B. Ti7. 下列化合物届丁缺电子化合物的是A. Na[Al(OH) 4]B. H[BF 4]8. 下列物质中酸性最弱的是A . H 3AsO 4B . HClO 49. 单质F 2特别活泼的主要原因是A. F (g)电离能较小; C. F - (aq)的水合热特别大; 10. CrO 42-(aq)呈黄色,其届丁A . d-d 光谱 B. f-f 光谱B. CN-中的C原子和N原子分别与Fe3+和Fe2+形成配位键;C. CN-中的C原子和N原子均与Fe2+配位键;D . CN-中的C原子和N原子均与Fe3+配位键。
浙江师范大学硕士研究生入学考试初试科目考试大纲一、考试形式与试卷结构(一)试卷满分及考试时间本试卷满分为150分,考试时间为180分钟。
(二)答题方式答题方式为闭卷、笔试。
试卷由试题和答题纸组成;答案必须写在答题纸(由考点提供)相应的位置上。
(三)试卷题型结构选择题:共10小题,每小题3分,共30分简答题:共4小题,每小题10分,共40分制备题:共1小题,共10分计算题:共3小题,共50分论述题:共1小题,共20分二、考查目标(复习要求)全日制攻读教育硕士专业学位研究生入学考试《综合化学》科目考试,要求考生系统掌握无机化学、分析化学、有机化学和物理化学中重要的基本概念和基础知识,掌握元素周期律、原子和分子结构、化学平衡、化学热力学、电化学、化学动力学和配位化学等基本理论,并能用这些理论来解释生活中的实际问题,具有理论分析、化学计算、科学思维和化学应用的能力。
三、考查范围或考试内容概要第一篇无机化学和物理化学篇第1章气体、液体和溶液的性质1.理想气体状态方程2.克劳修斯-克拉贝龙方程3.稀溶液的依数性4.胶体的性质与应用第2章化学热力学基础与化学平衡1.热力学第一、二、三定律2.热化学3.化学平衡第3章酸碱理论与溶液中均、异相平衡1.酸碱理论(离子论、质子论、电子论)2.多元弱酸弱碱的分步电离3.酸碱盐溶液的电离平衡4.缓冲溶液5.盐类的水解6.水溶液的异相平衡——溶度积原理第4章氧化还原反应与电化学1.氧化数2.氧化还原的配平3. 可逆电池的电动势及其应用4. 电解与极化第5章化学动力学1.浓度与反应速率2.温度对反应速率的影响3.催化反应动力学4.化学反应的反应级数5.几种典型的复杂反应6.链反应7.几种反应理论8.光化学第6章原子结构和元素周期律1.氢原子光谱与波尔理论2.原子核外电子运动状态3.核外电子排布4.元素基本性质的周期性第7章化学键和分子、晶体构型1.经典共价键理论2.近代价键理论——VSEPR理论、分子轨道理论3.键参数——键能、键长、键角、键的极性4.分子间作用力5.金属键6.金属晶体7.离子键8.离子晶体第8章配位化合物1.配合物基本概念2.配合物的同分异构现象3.配合物的化学键理论4.配合物的稳定性5.配位催化6.反位效应——配合物异构体的合成第9章主族元素(Ⅰ)1.碱金属2.碱土元素3.硼族元素第10章主族元素(Ⅱ)1.零族元素2.卤族元素3.氧族元素4.氮族元素5.碳族元素第11章过渡元素(Ⅰ)1.铜锌分族2.钛分族3.钒分族4.铬分族5.锰分族第12章过渡元素(Ⅱ)1.铁系元素2.铂系元素第13章镧系元素和锕系元素1.镧系元素2.锕系元素第二篇分析化学篇第1章分析化学概论1.分析化学基本概念2.定量分析概论3.化学分析法和仪器分析法第2章分析化学中的误差与数据分析1.误差、准确度和精密度的基本概念2.随机误差的正态分布3.少量实验数据的统计处理4.分析质量保证和控制第3章酸碱滴定法1.酸碱滴定相关概念2.酸碱溶液pH的计算3.酸碱缓冲溶液酸碱滴定法的应用4.酸碱滴定法的应用第4章配位滴定法1.配位滴定相关概念2.配位平衡3.配位滴定的条件和滴定误差4.提高配位滴定选择性的方法第5章氧化还原滴定法1.氧化还原滴定相关概念2.氧化还原平衡及能斯特方程3.氧化还原滴定法原理4.常用的氧化还原滴定法第6章沉淀滴定法1.沉淀滴定相关概念2.确定终点的方法第7章重量分析法1.沉淀平衡2.沉淀条件选择2.重量分析结果计算第8章紫外—可见分光光度法1.光吸收定律2.紫外—可见分光光度计组件和测量3.分光光度测定法第9章定量化学分析中常用的分离方法1.定量化学分析中的重要概念2.沉淀分离法3.溶剂萃取分离法4.离子交换分离法5.色谱分离法第三篇有机化学篇第1章有机化学概论1.价键理论2.分子轨道理论3.有机化合物的分类4.有机化合物的异构现象5.有机反应类型第2章烷烃和环烷烃1.烷烃的通式与分类2.同系物3.同分异构现象4.烷烃和环烷烃的结构5.IUPAC命名6.卤代反应第3章烯烃1.烯烃的结构与通式2.顺、反异构体3.亲电加成反应4.烯烃与HBr的自由基加成第4章二烯烃和炔烃1.二烯烃的命名与结构2.共轭二烯烃的1,2-加成和1,4-加成3.炔烃的结构4.炔烃的化学反应第5章卤代烃1.卤代烃的取代反应— S N1和S N2反应机理2.消除反应3.与金属的反应及金属有机试剂第6章芳香烃1.休克尔规则2.苯的亲电取代反应3.Birch还原4.奈的反应第7章立体化学1.构造异构2.立体异构3.分子的对称性与分子手性第8章结构解析1.紫外光谱2.电子跃迁3.红外光谱4.核磁共振光谱5.质谱第9章醇酚醚1.醇羟基的取代反应2.醇的脱水消除反应3.酯化反应4.醇的制备5.酚的化学性质6.酚的制备7.醚的化学性质第10章醛酮醌1.醛酮的结构特点2.醛酮的化学性质3.醛酮的制备第11章羧酸及其衍生物1.羧酸的结构及其化学性质2.羧酸的化学性质3.羧酸的制备4.羧酸衍生物的结构及化学性质第12章胺及含氮化合物1.胺的结构与化学性质2.胺的制备第13章杂环化合物1.五元杂环化合物的结构与化学性质2.六元杂环化合物吡啶结构特点3.吡啶的化学性质4.稠杂环化合物5.重要杂环化合物的合成第14章周环反应1.周环反应的概念与特点2.周环反应与分子轨道对称守恒3.周环反应的分类第15章生物分子1.糖2.氨基酸3.多肽4.蛋白质5.核酸6.类酯7.萜类、甾类化合物参考教材或主要参考书:综合化学:无机化学·分析化学·有机化学/张祖德等编,中国科技大学出版社,2011年版物理化学:高等教育出版社,傅献彩等, 2005年第五版四、样卷无。
2012年浙江师范大学333教育综合真题亲爱的同学们,如果您准备考教育学,那么教育学考研真题是必不可少的内容,凯程老师特别把历年教育学考研真题整理如下,供同学们参考,更多年份的真题,同学们也不用费心去寻找,凯程官方网站就有免费提供,找客服索取即可。
凯程创建于2005年,已经有11年悠久历史,在教育学方面战绩辉煌,网站有很多学员经验谈视频,肯定对大家很有帮助,也是凯程辅导成果的展示,凯程开设有基本保录班、半年保录班、暑期集训营、百日冲刺集训营,飞翔标准班等课程。
下面发布的是2012年浙江师大333教育综合真题。
一、名词解释(共6小题,每小题5分,共30分)1、社会性发展2、学习的实质3、学习策略4、社会规范学习5、科举制度6、公学二、简答题(共4小题,每小题10分,共40分)1、教育的基本要素有哪些,他们再教育活动中发挥怎样的作用?2、教育的文化功能3、夸美纽斯教育思想的主要论点4、列举五种现代欧美教育思潮三、分析论述题(共4小题,每小题20分,共80分)1、结合实际,谈谈在教学过程中如何处理好间接经验与直接经验的关系2、请你针对我国当前学校道德教育中存在的某个问题,谈谈你的看法3、加德纳的多元智力理论及其教育含义4、论述洋务教育改革本文转载自凯程考研网凯程考研免费提供以下内容,到凯程网站找客服免费索取。
2007年教育学考研真题与答案2008年教育学考研真题与答案2009年教育学考研真题与答案2010年教育学考研真题与答案2011年教育学考研真题与答案2012年教育学考研真题与答案2013年教育学考研真题与答案2014年教育学考研真题与答案2015年教育学考研真题与答案2016年教育学考研真题与答案。
浙江师范大学2020112年硕士研究生入学考试年硕士研究生入学考试初初试试题试试题(A (A 卷) 科目代码科目代码:: 906 科目名称科目名称:: 无机化学
适用专业适用专业:: 045106学科教学(化学)
提示:
1、请将所有答案写于答题纸上,写在试题纸上的不给分;
2、请填写准考证号后6位:____________。
一、选择题
选择题(共15小题,每小题3分,共45分) 1.普通食盐常有潮解现象,原因是( )
A .NaCl 有吸潮性
B .NaCl 含有结晶水
C .食盐中含有MgCl 2杂质
D .NaCl 含有HCl
2.Be 、B 、Mg 、Al 四种元素的电负性大小顺序为( )
A .B>Be>Al>Mg
B .B>Al>Be>Mg
C .B>Be ≈Al>Mg
D .B<Al<Be<Mg
3.假定NH 3+基是呈平面的,并且有3个等价的氢原子,那么成键轨道的杂化方式是( )
A .sp 3
B .sp
C .sd 2
D .sp 2
4.下列晶体中,属于离子键的是( )
A .CO 2晶体
B .碘晶体
C .SiO 2晶体
D .CaO 晶体
5.下列物质呈固态时,属于分子晶体的是( )
A .Si
B .NaF
C .CCl 4
D .Fe
6.CaCO 3在下列溶液中溶解度较大的是( )
A .H 2O
B .Na 2CO 3溶液
C .KNO 3溶液
D .乙醇
7.石墨晶体中层与层之间的结合力是( )
A .金属键
B .共价键
C .范德华力
D .离子键
8.符合氧族元素氢化物酸性递变规律的是( )
A .H 2O<H 2S>H 2Se>H 2Te
B .H 2O<H 2S<H 2Se<H 2Te
C .H 2O>H 2S>H 2Se>H 2Te
D .H 2O<H 2S<H 2Se>H 2Te
9.在空气中长期放置后,会产生多硫化物的是( )
A .H 2S
B .Na 2S
C .Na 2SO 3
D .Na 2S 2O 4
10.保存白磷的方法是将其存放于( )
A .煤油中
B .水中
C .液体石蜡中
D .二硫化碳中
11.热稳定性最好的硫酸盐是( )
A.BaSO4B.FeSO4C.Fe2(SO4 )3D.Ag2SO4
12.除去N2O中微量NO的试剂是()
A.NaOH B.Na2CO3C.CuSO4D.FeSO4
13.王水是指以下哪种混合溶液()
A.HNO3+H2SO4(1:3)B.H2SO4+HCl(3:1)
C.HNO3+HCl(3:1)D.HCl+HNO3(3:1)
14.下面金属中延展性最好的是()
A.金B.银C.钠D.锡
15.单质碘在水中的溶解度很小,但在KI溶液中溶解度增大,这是因为()A.发生了解离反应B.发生了盐效应
C.发生了氧化还原反应D.发生了配位反应
完成并配平下列化学反应方程式(共5小题,每小题4分,共20分)
二、完成并配平下列化学反应方程式
1.H2S + I2===
2.SiO2 + HF ===
3.P + Br2 + H2O ===
4.PbS + H2O2 ===
5.PCl5 + H2O ===
三、简答题
简答题(共5小题,每小题10分,共50分)
1.为什么CCl4难溶于水而C2H5OH易溶于水?
2.钙在空气中燃烧生成什么物质?产物与水反应有何现象发生?并以化学反应方程式说明。
3.为什么不能用水,也不能用CO2来扑灭镁的燃烧?提出一种扑灭镁燃烧的方法。
4.用银和硝酸反应制取AgNO3,为了充分利用硝酸,问采用浓硝酸还是稀硝酸有利?说明原因。
5.试解释:(1)铝为较活泼金属,但却被用来制造水管(非饮用水)和某些化工设备。
(2)铝比铜活泼,但浓硝酸能溶解铜却不能溶解铝。
制备题(共1小题,共15分)
四、制备题
以氢氧化钙为原料,如何制备漂白粉、氢氧化钠、氨、氢氧化镁?分别用化学反应方程式表示之。
五、鉴别题
鉴别题(共1小题,共20分)
实验室中有5个试剂瓶,分别装有白色粉末状固体,它们可能是MgCO3、BaCO3、无水Na2CO3、无水CaCl2和无水Na2SO4,试鉴别之(以化学反应方程式表示),并简单说明。