标准溶液的配制与标定ppt课件
- 格式:ppt
- 大小:12.02 MB
- 文档页数:23





盐酸标准溶液的配制与标定资料课件一、实验目的1. 掌握盐酸标准溶液的配制方法;2. 掌握盐酸标准溶液的浓度计算方法;3. 掌握盐酸标准溶液的标定方法。
二、实验原理盐酸为无色液体,是一种强酸,可与水快速反应,放出大量的热。
盐酸溶液的浓度可以通过酸碱滴定法进行测定。
三、实验仪器酸碱分析仪、容量瓶、滴定管、移液管、烧杯、称量器等。
四、实验步骤1. 盐酸标准溶液的配制(1) 取适量的质量分数为36%的盐酸加入到容量瓶中;(2) 加入适量的去离子水,摇匀后加入至刻度线,混合均匀;(3) 最后用去离子水对瓶口擦拭干净,盖妥瓶塞,轻轻摇均,标记后存放。
2. 盐酸标准溶液的浓度计算盐酸标准溶液的浓度计算方法:C1V1=C2V2其中C1为盐酸标准溶液的浓度,V1为盐酸标准溶液的体积,C2为待测溶液的浓度,V2为待测溶液的体积。
根据浓度计算公式,可以算出盐酸标准溶液的浓度,以及待测溶液的浓度。
3. 盐酸标准溶液的标定(1) 取适量的盐酸标准溶液,加入烧杯中,并用甲基橙指示剂进行溶液颜色变化的观察;(2) 开始滴加待测溶液,直到溶液由黄色变成橙色,立即记录所滴加的待测溶液体积,此时盐酸标准溶液和待测溶液已达到化学计量反应;(3) 重复上述实验三次,求出平均值。
根据计算,可以得出盐酸标准溶液的浓度。
五、实验注意事项1. 制备盐酸标准溶液时要精确称量和计量;2. 滴定时要逐滴加入待测溶液,并搅动溶液,使反应均匀;3. 滴定过程中要注意读数的准确性;4. 实验完成后要注意清洗实验器材,保持实验室卫生。
六、实验数据处理根据实验数据,可以计算出盐酸标准溶液的浓度,如C1=0.1mol/L,此时可以根据需求来计算配制盐酸溶液的体积和质量。
七、实验结果分析本实验主要完成了盐酸标准溶液的配制和标定实验,进一步提高了我们在实验操作方面的技巧。
通过实验学习,我们可以掌握更多的化学实验技能,并且在实验数据分析中,更加了解了实验结果。
标准溶液的配制和标定标准溶液是用于滴定分析法测定化学试剂、化工产品纯度及杂质含量的已知准确浓度的溶液。
国家标准(GB 601-88)对滴定分析用标准溶液的配制和标定方法做了详细、严格的规定,配制和标定标准溶液时,必须严格执行。
实验室中最常用的是是物质的量浓度标准溶液,也有用滴定度标准溶液和质量体积表示的标准溶液,这里只介绍物质的量浓度标准溶液的配制和标定。
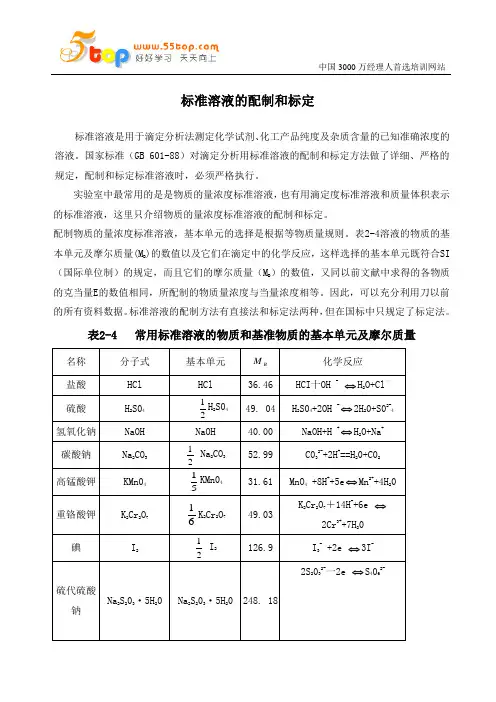
配制物质的量浓度标准溶液,基本单元的选择是根据等物质量规则。
表2-4溶液的物质的基)的数值以及它们在滴定中的化学反应,这样选择的基本单元既符合SI 本单元及摩尔质量(MB(国际单位制)的规定,而且它们的摩尔质量(M)的数值,又同以前文献中求得的各物质B的克当量E的数值相同,所配制的物质量浓度与当量浓度相等。
因此,可以充分利用刀以前的所有资料数据。
标准溶液的配制方法有直接法和标定法两种,但在国标中只规定了标定法。
表2-4 常用标准溶液的物质和基准物质的基本单元及摩尔质量一、标准溶液的配制方法1.直接法准确称取一定量基准化学试剂溶解后,移入一定体积的量瓶中,加水至刻度,摇匀即可。
然后由试剂质量和体积计算出所配标准溶液的准确浓度。
直接法配制标准溶液,必须使用基准试剂,它必须具备4个条件:(1)纯度高,要求杂质含量在万分之一以下;(2)组成与化学式相符,若含有结晶水,其含量也应与化学式相符。
如:Na2B47·1OH20,结晶水应恒定为10个;(3)性质稳定,干燥时不分解,称量时不吸潮,不吸收二氧化碳、不被空气氧化、放置时不变质;(4)容易溶解,最好具有较大的摩尔质量。
基准试剂由于在贮存过程中会吸潮、吸二氧化碳,因此,在使用前必须经过烘干或灼烧处理。
德信诚精品培训课程(部分)内审员系列培训课程查看详情TS16949五大工具与QC/QA/QE品质管理类查看详情 JIT>>>德信诚深圳培训中心 E-mail:55top@ 报名表下载>>> 公开课计划表2.标定法标定法是首先配制成接近于所需浓度的溶液,然后再用基准物质标定其准确浓度,或用另一种标准溶液对所配制标准溶液进行滴定,并计算出其准确浓度为比较法。





标准溶液的配制与标定(总6页)-CAL-FENGHAI.-(YICAI)-Company One1-CAL-本页仅作为文档封面,使用请直接删除一、氢氧化钠标准滴定溶液1、配制:称取110g氢氧化钠,溶于100ml无二氧化碳的水中,摇匀,注入聚乙烯容器中,密闭放置至溶液清亮。
按下表用量,用塑料管量取上层清液,用无二氧化碳的水稀释至1000mL,摇匀。
氢氧化钠标准滴定溶液的浓度C(NAOH)/(mol/L)氢氧化钠溶液的体积V/mL1540.5270.1 5.42、标定:按下表的规定量,称取于105℃~110℃电烘箱中干燥至恒量的工作基准试剂邻苯二甲酸氢钾,加无二氧化碳的水溶解,加2滴酚酞指示液(10g/L),用配制的氢氧化钠滴定至溶液呈粉红色,并保持30s。
同时做空白试验。
氢氧化钠标准滴定溶液的浓度C(NAOH)/(mol/L)工作基准试剂邻苯二甲酸氢钾的质量m/g无二氧化碳水的体积V/mL17.5800.5 3.6800.10.7550氢氧化钠标准滴定溶液的浓度[c(NaOH)],按式(1)计算:c(NaOH)= (1)式中:m—邻苯二甲酸氢钾质量,单位为克(g);V1—氢氧化钠溶液体积,单位为毫升(mL);V2—空白试验消耗氢氧化钠溶液体积,单位为毫升(mL);M—邻苯二甲酸氢钾的摩尔质量,单位为克每摩尔(g/mol)[M(KHC8H4O4)=204.22]二、盐酸标准滴定溶液1、配制:按下表规定量,量取盐酸,注入1000mL水中,摇匀。
盐酸标准滴定溶液的浓度c(HCl)/(mol/L)盐酸的体积V/mL1900.5450.192、标定按下表规定量,称取于270℃~300℃高温炉中灼烧至恒量的工作基准试剂无水碳酸钠,溶于50mL水中,加10滴溴甲酚绿-甲基红指示液,用配制的盐酸溶液滴定至溶液由绿色变为暗红色,煮沸2min,加盖具钠石灰管的橡胶塞,冷却,继续滴定至溶液再呈暗红色。
同时做空白试验。