铝的物理性质和用途
- 格式:wps
- 大小:25.00 KB
- 文档页数:4


铝及其化合物知识点总结(一)铝单质——Al(两性单质)1、物理性质:银白色金属,质较软,但比镁要硬,熔点比镁高,有良好的导电、导热性和延展性。
用途:铝有良好的导电、导热性和延展性,主要用于导线、炊具等,铝的最大用途是制合金。
铝合金特点:①密度小①强度高①塑性好①制造工艺简单①成本低①抗腐蚀力强2、化学性质:铝是较活泼的金属,自然界中没有铝单质(1)与非金属:4Al + 3O2 == 2Al2O3生成致密的氧化膜起保护作用。
(2)与酸的反应:2Al + 6HCl == 2AlCl3+ 3H2↑ 2Al + 6H+ == 2Al3+ + 3H2↑钝化:在常温下,铝与浓硝酸、浓硫酸反应,在表面生成致密的氧化膜,阻止进一步反应,保护铝。
(3)与碱的反应:2Al + 2NaOH + 6H2O == 2Na[Al(OH)4] + 3H2↑ 2Al + 2OH− + 6H2O == 2[Al(OH)4]− +3H2↑ (4)与某些盐溶液反应:如能置换出CuSO4、AgNO3等溶液中的金属。
(5)铝热反应:高温下铝与某些金属氧化物的反应(如Fe、Cr、Mn、V的氧化物)2Al + Fe2O3Al2O3 + 2Fe。
Al和Fe2O3的混合物叫做铝热剂(混合物)。
可用于焊接钢轨、冶炼金属。
(二)氧化铝——Al2O3(两性氧化物)白色固体,熔点高(2054①),常作为耐火材料和冶炼金属铝的原料。
两性氧化物:既能与强酸反应又能与强碱反应生成盐和水的氧化物。
1、与酸的反应:Al2O3 + 6HCl == 2AlCl3 + 3H2O Al2O3 + 6H+ == 2Al3+ + 3H2O2、与碱的反应:Al2O3 + 2NaOH + 3H2O == 2Na[Al(OH)4] Al2O3 + 2OH− + 3H2O == 2[Al(OH)4]−3、电解熔融的氧化铝制备金属铝:(三)氢氧化铝——Al(OH)3(两性氢氧化物)白色难溶于水的胶状沉淀,是两性氢氧化物,加热易分解。



《高中化学铝的知识点全解析》铝,作为高中化学中的重要元素之一,在化学学习中占据着重要的地位。
它具有丰富的化学性质和广泛的应用,让我们一同深入探索铝的世界。
一、铝的物理性质铝是一种银白色的金属,具有良好的导电性、导热性和延展性。
它的密度较小,约为 2.7g/cm³,是一种轻金属。
铝的熔点相对较低,为660℃,沸点为2327℃。
在常温下,铝的表面会形成一层致密的氧化膜,保护内部的金属不被进一步氧化。
二、铝的化学性质1. 与非金属单质的反应(1)与氧气反应:在常温下,铝表面的氧化膜能阻止铝进一步与氧气反应。
但在点燃或加热的条件下,铝能与氧气剧烈反应,生成氧化铝。
4Al + 3O₂ = 2Al₂O₃。
(2)与氯气反应:2Al + 3Cl₂ = 2AlCl₃,反应剧烈,产生白色的氯化铝固体。
2. 与酸的反应(1)与非氧化性酸反应:铝与稀盐酸、稀硫酸等非氧化性酸反应,生成铝盐和氢气。
2Al + 6HCl = 2AlCl₃ + 3H₂↑。
(2)与氧化性酸反应:常温下,铝在浓硫酸、浓硝酸中会发生钝化现象,即在表面形成一层致密的氧化膜,阻止反应的进一步进行。
但在加热条件下,铝能与浓硫酸、浓硝酸反应。
3. 与碱的反应铝既能与酸反应,又能与碱反应。
2Al + 2NaOH + 2H₂O =2NaAlO₂ + 3H₂↑。
在这个反应中,铝先与水反应生成氢氧化铝和氢气,氢氧化铝再与氢氧化钠反应生成偏铝酸钠。
4. 铝热反应铝粉和某些金属氧化物(如氧化铁、四氧化三铁等)在高温下发生剧烈反应,生成氧化铝和相应的金属单质,同时放出大量的热。
例如:2Al + Fe₂O₃ = Al₂O₃ + 2Fe。
铝热反应可用于焊接铁轨、冶炼难熔金属等。
三、铝的化合物1. 氧化铝(Al₂O₃)(1)物理性质:白色固体,难溶于水,熔点高,是一种良好的耐火材料。
(2)化学性质:①两性氧化物:既能与酸反应生成盐和水,又能与碱反应生成盐和水。
Al₂O₃ + 6HCl = 2AlCl₃ + 3H₂O,Al₂O₃ + 2NaOH =2NaAlO₂ + H₂O。




铝的性质和主要用途一、铝的主要性质纯度为99.99%的金属铝的主要物理性质是:密度(20℃)2.7g/cm3熔点660.1℃沸点2520℃平均比热(0-100℃)917J/(kg·K)熔化热10.47kJ/mol汽化热291.4(估算值)kJ/mol热导率(O~100℃)238W/(m·K)电阻率(20℃)2.67μΩ·cm铝的密度小,仅为水的2.7倍;铝的比强度(强度与重量之比)高,某些高强度铝合金的机械强度超过了结构钢;铝没有磁性,铝在低温下(-198℃)也不变脆,仍具有较好的机械性能;铝可以轧成薄板和箔,拉成细丝,挤压成各种复杂形状的型材,其延展性能很好;铝在空气中能与氧迅速化合,生成一层致密而坚硬的氧化铝薄膜,厚度为0.005~0.02微米,成为铝的天然保护层,阻止铝继续被氧化,因而具有好的抗蚀性能,还可以用阳极氧化或电镀的方法,在铝材和铝制品的表面生成彩色鲜艳的氧化膜;铝的导电、导热性好,导电率相当于国际标准退火铜的64.94%,铝的导电能力超过这两如果就相同的重量而言,约为银的一半,种金属;铝的导热性几乎比铁的导热率大3倍;铝的反光性能很强,反射紫外线比银还强,铝在碰击时不产生火花。
铝对氧的亲和力大,铝可以用作炼钢的脱氧剂和一些高熔点金属氧化物(如MnO2、Cr2O3)的还原剂。
铝与氮、硫和卤族元素在高温下发生反应生成如AIN、Al2S3、AlCl3之类的化合物,这些化合物(除AIN外)和铝在真空中加热到1000℃以上时,生成相应的低价铝化合物,这些低价化合物在低温下发生歧化反应,分解为金属铝及其化合物。
铝是两性元素,它与大多数稀酸可缓慢地反应,能迅速溶解于浓盐酸中。
但浓硝酸使铝钝化,铝与苛性碱溶液发生强烈反应,迅速溶解生成铝酸根离子。
二、铝的主要用途铝由于具有优良的物理性能,所以铝在国民经济各部门和国防工业中得到了广泛的应用。
铝作为轻型结构材料,重量轻,强度大,陆、海、空各种运载工具,特别是飞机、导弹、火箭、人造卫星等,均使用大量的铝,一架超音速飞机的用铝量占其自身重量的70%,一枚导弹用铝量占其总重量的10%以上。

铝的归纳总结铝是一种常见的金属元素,属于周期表中的13号元素,化学符号为Al,原子序数为13。
它的存在对我们的日常生活和工业生产都有着重要的作用。
以下是对铝的一些归纳总结。
1. 物理性质铝是一种银白色的金属,具有良好的延展性和导电性。
它的密度相对较低,为2.7克/立方厘米,但其强度却相对较高。
铝的熔点为660摄氏度,沸点约为2519摄氏度。
此外,铝是非磁性物质,对磁场没有反应。
2. 化学性质铝在常温下对氧气具有很高的亲和力,与氧反应会生成氧化铝,即Al2O3。
氧化铝形成了一层稳定的氧化膜,能够防止进一步的氧化反应。
这一氧化膜赋予了铝良好的耐腐蚀性。
此外,铝也能够与其他非金属元素反应,如硫、氯等。
3. 生产与应用铝是地壳中丰富的金属元素之一,其生产主要通过电解法来获得。
铝的高导电性和良好的导热性使得它在电力传输和散热领域得到广泛应用。
此外,铝也具有轻质、强度高、可塑性好的特点,被广泛用于航空、汽车、建筑等行业。
铝的良好耐腐蚀性使得它成为制造食品和药品容器的理想材料。
4. 环境意义铝是一种可回收利用的金属,其回收利用率较高。
回收铝不仅可以减少资源的消耗,还可以减少对环境的污染。
与从矿石提炼铝相比,回收铝可以节约大量的能源,减少二氧化碳等温室气体的排放。
因此,鼓励铝的回收利用对于环境保护具有重要意义。
5. 健康影响铝是一种广泛存在于环境中的金属,人体摄入铝主要通过饮食和饮水。
尽管铝在一定程度上对人体有害,但通过正常的饮食摄入并不会造成明显的健康问题。
然而,过量摄入铝可能对大脑和骨骼有一定的负面影响。
因此,合理控制摄入铝的量是很有必要的。
总结起来,铝是一种重要的金属元素,具有良好的物理性质和化学性质。
它的广泛应用使其在各个领域都发挥着重要作用。
同时,铝的回收利用和健康控制也是需要关注的问题。
通过科学合理地利用铝,我们可以最大程度地发挥其优点,同时减少其潜在的负面影响,为可持续发展做出贡献。
铝的性质及对应用途铝是周期表中的三价金属元素,其原子序数为13。
它是地壳中含量最丰富的金属元素之一,占地壳的8.3%,但是自然状态下很难得到纯铝。
在自然界中,铝与其他元素结合成氧化物、硅酸盐和其他矿物质存在。
在人类社会中,铝被广泛应用于许多方面,下面将对铝的性质及对应用途进行说明。
1. 物理性质铝是一种轻质、具有良好的导电性和导热性的金属,在纯度和强度方面具有良好的可塑性。
铝的密度为2.7克/立方厘米,比钢轻1/3,比铜轻2/3。
在室温下,铝是一种银白色金属,具有良好的反射性和吸收性,可用于制造反射镜、闪光灯等。
2. 化学性质铝是一种相对稳定的金属,不易被氧化。
在常温下,它与氧气反应缓慢,形成一层薄膜,该薄膜能够保护铝的表面不被进一步氧化。
这种膜状层也可以作为一种保护剂,可用于制造氧化铝层、耐蚀材料等。
铝在酸中也很稳定,但在强碱中会被溶解,因此不适用于碱性环境中。
3. 应用领域3.1 建筑行业铝在建筑行业中使用得非常广泛,主要用于制造门窗、幕墙、天花板、顶棚等。
这是因为铝具有轻便、耐腐蚀、加工易、使用寿命长等优点,而且密度小,强度高,可实现建筑重量降低,同时也可提高建筑的美观度。
3.2 包装行业铝是包装材料中非常受欢迎的一种,在食品、饮料、医药和化妆品行业得到广泛应用。
铝能够防潮、防氧化、隔热、保鲜、防止细菌侵入并提高产品的稳定性和保存期限。
铝包装也具有轻便、容易携带和回收利用等特点。
3.3 交通运输行业铝制品在交通运输行业中得到广泛应用,如铝合金车架,飞机、汽车的车身部分等。
这是因为铝具有高强度、轻重量、良好的可塑性和可焊性等特点。
使用铝合金可以使得搭载的载重增加,同时也可以降低燃油消耗和减少二氧化碳排放。
3.4 电子行业铝在电子行业中主要是用于制造电解电容器的正极板。
铝具有良好的导电性和耐腐蚀性。
铝制电解电容器具有频响特性好、容量稳定等特点。
3.5 照明和家居设备铝制品还常常用于照明和家居设备,如电器外壳、灯具壳体、家具等。
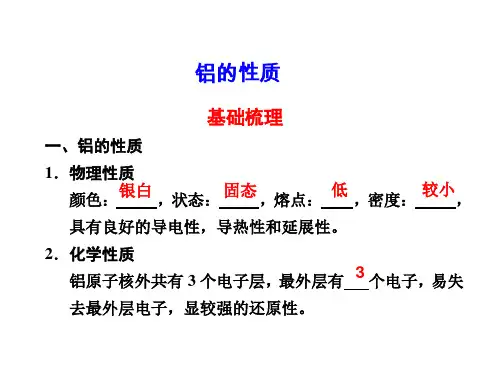
铝的化学知识点总结一、铝的性质1. 物理性质铝是一种银白色、柔软的轻质金属,在常温下具有良好的导电性和导热性。
纯铝的密度为2.7g/cm3,熔点为660°C,沸点为2467°C,具有一定的延展性和塑性,易于加工成各种形状的制品。
2. 化学性质铝是一种较活泼的金属,具有一定的化学活性。
在常温下,铝能与氧、氮、硫等非金属元素反应,在高温下能与氢、氨等元素发生反应。
铝在空气中易被氧化形成一层致密的氧化膜,这层氧化膜可以保护铝不被更多的氧气侵蚀,使铝具有较好的耐腐蚀性。
此外,铝还能与非金属元素形成盐类化合物,如氯化铝、硫酸铝等。
3. 与其他元素的化合物铝与氧形成的氧化铝是最常见的化合物,化学式为Al2O3。
氧化铝具有很强的耐火性和耐腐蚀性,被广泛应用于陶瓷、耐火材料、磨料等工业领域。
此外,铝还能与氯、硫、氮等元素形成不同的盐类化合物,这些化合物在工业生产和日常生活中也有着重要的应用。
二、铝的用途1. 工业领域由于铝具有较好的导电性、导热性和耐腐蚀性,被广泛应用于电力、电子、航空航天等工业领域。
铝及其合金在制造导线、散热器、飞机、汽车等方面有着重要的作用。
2. 包装材料铝具有轻质、不透水、不透气、耐高温等特点,被广泛应用于包装材料的制造。
铝箔、铝包装盒、铝罐等产品在食品、药品、化妆品等行业起着重要的包装保护作用。
3. 建筑领域铝及其合金在建筑领域有着广泛的应用,如制造铝门窗、铝合金型材、铝幕墙等。
铝制品具有轻质、耐腐蚀、美观等特点,能满足建筑材料的需求,受到建筑行业的青睐。
4. 化工领域氧化铝、硫酸铝、氯化铝等铝化合物在化工领域应用广泛,用于制造催化剂、吸附剂、电解铝等产品,具有重要的工业价值。
三、铝的生产铝的生产主要有两种方式,一种是电解法,另一种是氧化铝法。
1. 电解法电解法是目前铝的主要生产方式。
该方法首先需要从矿石中提取氧化铝,随后通过电解法将氧化铝转化为铝金属。
电解法具有生产效率高、产品质量稳定等优点,被广泛应用于工业生产中。
金属材料之铝的详细介绍铝是一种重要的金属材料,具有许多独特的特性和应用。
本文将详细介绍铝的各种属性,包括其化学性质、物理特性、制造工艺和用途。
一、化学性质铝是一种化学元素,原子序数为13,化学符号为Al。
它是地球上最常见的金属之一,它可以与多种元素发生化学反应,如氧化物、酸和碱。
铝也可以和大多数常见的金属形成合金,如镁、锰、铜、锌和镍。
和其他金属合金相比,铝的合金强度高,重量轻,不易腐蚀,具有一种非常好的可塑性。
二、物理性质铝是一种非常轻的金属,具有比重为2.7的密度,其熔点为660℃,沸点为2467℃。
铝的导热率很高,这使得它成为一种重要的导热材料,适用于制造导热器和散热器等设备。
此外,铝也是良好的电导体,因此广泛应用于电子、电气设备。
三、制造工艺铝的制造工艺始于铝矿石的提取和精炼。
铝矿石通常以红色泥土的形式存储在地下,然后开采和提取金属。
铝的精炼过程是循环工艺,包括熔炼、造粒、电解和铸造。
混合熔炼铝矾土和氢氧化铝,并将熔体在脱气、脱硼和除杂剂清除杂质的条件下升温熔炼,制成铝锭。
铝锭通常是以纯度和形状分类的,铝锭的形状多种多样,如板材、棒材、管材、线材和锭状材料等。
四、用途铝是一种非常重要的金属材料,具有多种不同的应用领域,包括建筑施工、运输、制造、电子、航空航天和生物医学等。
以下列举了一些常见的用途:1. 建筑施工:铝是轻质、易加工的金属,广泛应用于建筑施工行业,如门窗、天花板、幕墙、屋顶和桥梁等。
2. 运输:铝是一种轻质金属,广泛应用于汽车、火车、飞机和船舶制造。
汽车和卡车的大部分结构部件、处理电击几个压缩空气和振动减震器等都使用铝。
3. 制造:铝是一种高强度金属,易于加工成各种形式和尺寸。
因此,铝材料在数控机床、成型机械和各种加工设备中广泛应用。
4. 电子:铝是一种良好的导热和导电材料,因此可以用于电子和电气设备,如电线、线圈、变压器和电容器等。
5. 航空航天:铝是航空航天工业中最重要的材料之一。
铝及氧化铝的性质及应用铝元素是地壳中含量最多的金属元素,是生活中常见的金属,教科版小学科学六年级就有关于回收铝罐的教学内容,让学生认识到废旧金属具有回收利用的价值。
本讲简要介绍铝单质及氧化铝的物化性质及应用,以此增加大家化学知识的储备,并了解化学在日常生活中的应用。
铝(如图1)是自然环境中含量最丰富的金属元素,在地壳中它以铝硅酸盐形态存在,约占地壳总重的7.7%。
许多岩石、矿物和土壤中含有大量的铝。
图1 铝一、铝的性质1.物理性质铝是银白色的轻金属,有较强的韧性、延展性,有良好的导电、导热性,铝的硬度、强度较低。
2.化学性质(1)铝与氧气反应在常温下,铝能与空气里的氧气起反应,生成一层致密而又坚固的氧化物薄膜。
由于这层氧化物薄膜能阻止金属的继续氧化,所以,铝具有抗腐的性能。
4Al+3O=2Al O223(2)铝与稀盐酸反应:2Al+6HCl=2AlCl+3H↑32(3)铝与氢氧化钠溶液反应:2Al+2NaOH+2H O=2NaAlO+3H↑222二、铝在生活中的应用1.铝合金(如图2)铝是轻金属,密度仅为铁的1/3左右。
铝还耐腐蚀,可以抵御水、气及一些化学物质的腐蚀。
但同镁类似,纯铝较软,无法作为工业材料应用,若掺入少量铜、锌、锰、硅及镁等元素,则可以显著提高合金材料的强度,同时又保持了铝材的性能,因此铝合金成为当前应用最广泛的合金材料。
2.易拉罐(如图3)易拉罐作为金属铝的产品之一,是饮料开罐设计中的经典。
相较于塑料包装,铝罐的回收率更高,且二次加工成本也比较低,对环境造成的污染相对较小。
但易拉罐并非完全由纯铝制成,因为饮料内所含的物质还是会缓慢腐蚀铝材,所以易拉罐的内壁会添加一层涂层来保证大家的健康。
图2 铝合金图3 易拉罐3.锡箔纸(如图4)铝具有良好的延展性,它可以制成铝箔,也就是厨房常用的“锡箔纸”。
铝箔的主要用途之一就是盛装食物,且由于热传导性能良好,它常用于食物的烧烤等烹饪过程。
早年的锡箔纸确实由锡箔制成,但出于成本及健康的考虑,目前都已换成铝箔,只是仍延续了锡箔纸的叫法。
铝的物理性质和用途
铝是银白色的轻金属,较软,密度2.7g/cm3,熔点660.4℃,沸点2467℃,铝和铝的合金具有许多优良的物理性质,得到了非常广泛的应用。
1铝对光的反射性能良好,反射紫外线比银还强,铝越纯,它的反射能力越好,常用真空镀铝膜的方法来制得高质量的反射镜。
真空镀铝膜和多晶硅薄膜结合,就成为便宜轻巧的太阳能电池材料。
铝粉能保持银白色的光泽,常用来制作涂料,俗称银粉。
2纯铝的导电性很好,仅次于银、铜,在电力工业上它可以代替部分铜作导线和电缆。
铝是热的良导体,在工业上可用铝制造各种热交换器、散热材料和民用炊具等。
3铝有良好的延展性,能够抽成细丝,轧制成各种铝制品,还可制成薄于0.01mm 的铝箔,广泛地用于包装香烟、糖果等。
4铝合金具有某些比纯铝更优良的性能,从而大大拓宽了铝的应用范围。
例如,纯铝较软,当铝中加入一定量的铜、镁、锰等金属,强度可以大大提高,几乎相当于钢材,且密度较小,不易锈蚀,广泛用于飞机、汽车、火车、船舶、人造卫星、火箭的制造。
当温度降到-196℃时,有的钢脆如玻璃,而有些铝合金的强度和韧性反而有所提高,所以是便宜而轻巧的低温材料,可用来贮存火箭燃料液氧和液氢。
2铝对人体的危害
铝不是人体的必需元素,人体缺乏铝时,不会给人体带来什么损害,反之,铝盐能致人体中毒。
1.摄入过量的铝对骨骼有害。
铝能直接损害成骨细胞的活性,从而抑制骨的基质合成。
2.摄入过量的铝,能够对大脑造成损伤。
研究证实,脑组织对铝元素有亲和性,铝一旦进入人体,首先沉积在大脑内脑组织中的铝沉积过多,可使人记忆力减退、智力低下、行动迟钝、催人衰老。
如果随时间推移,铝在脑中逐渐积累,就会杀死神经原,使人的记忆力丧失。
近年来又发现老年痴呆症的出现也与平时过多摄入铝元素有关。
3.铝元素吸收多了,会积聚在肝、脾、肾等部位,当积聚量超过5~6倍时,就会对消化道吸收磷发生抑制作用,还会抑制胃蛋白酶的活性,妨碍人体的消化吸收功能。
因此,摄入过量的铝还会使人食欲不振和消化不良,影响肠道对磷、锶、铁、钙等元素的吸收。
3铝对动植物的危害
1可溶性铝化合物对大多数植物都是有毒的。
酸性土壤的水分里溶解的铝化合物,使一般作物难以正常生长。
通常当溶解的铝达到10-20PPM以上时,植物
就会出现铝毒症兆。
土壤中的铝能与可溶性磷酸盐结合生成不溶性磷酸铝,致植物缺磷而柘死。
铝还能使植物细胞原生质层脱水,然后破坏而死亡。
铝与细胞壁内的果胶结合,强化果胶的交联结构,有碍植物吸收水分和营养。
铝与植物中的钙磷等矿物质营养成分亦有密切关联。
它能抑制一般植物对钙磷的吸收与累积,也影响它们对钾镁铁锰铜锌等元素元素的吸收和累积。
2铝对水生动物亦有毒害,当PH值约为5时,以氢氧化铝形态沉积在鱼鳃内,使氧气难以进入血液中,且使鱼体内含盐浓度失调,致鱼于死地。
铝对水生动物毒害浓度一般为70微克/升以上。
水体中铝含量增加,将导致大量有机物凝聚,致水生动物因营养匮乏而死亡。
铝能使磷沉淀,严重威胁水生动物繁衍生息。
4人体中过量的铝的来源
1.铝制炊具的使用。
由于铝是热的良导体,所以很多炊具是铝制的,这就成了人摄入过多的铝的原因之一。
用铝制炊具烹调时,从炊具中渗入菜内的铝量一般能占每天摄入铝量的20%左右。
如果用铝制品存放酸性食品及菜肴(如以番茄为主的菜)过夜、用铝制容器储存或酿制酸性饮料(橘子水、柠檬汁、咖啡等),或长期与食盐接触都会使食物中的含铝量明显增多,也可通过食物及饮料将铝摄入体内。
特别是铝制炊具和铁制炊具的混用,例如炒菜时使用铝锅和铁铲,在盐、水、醋和热的作用下,再加上铲子的搅动和磨擦,更容易使铝元素进入食物。
2.食物中的铝。
(1)粉丝、油条中含铝。
传统粉丝制作过程中,加入了0.5%左右明矾。
明矾主要起凝固作用,可使粉丝、米粉不为条、不粘连、不浑汤。
明矾中含有铝,吃多了易在体内形成慢性积累,发生铝中毒,粉丝吃多了,其铝很难由肾脏排出。
为了使油条膨胀变脆,制做油条时也加入了一些明矾,油条吃多了,同样对身体健康造成威胁。
(2)发酵剂中含铝。
食物含铝高的最常见者是发酵剂,特别是磷酸铝钠盐发酵粉。
家庭做的面点、食品厂出的糕点、煎饼原料、冷面团都含有较多的铝,最后可使每份(只)成品食品含铝量达5~15毫克。
应用硫酸铝钠盐做发酵粉也很常见,每一茶匙可含铝70毫克。
如果用1~3茶匙发酵粉,最后做成的每份(只)食品可含铝5~15
毫克(相当于每天从普通饮食摄入铝量的1/4~3/4)。
美国1970年就生产了磷酸铝钠盐发酵粉1800万千克。
(3)腌菜用的固定剂(如含铝的硫酸盐及明矾)含铝
可明显污染腌菜,而使中等大小的一条黄瓜的含铝量达10毫克。
3.铝盐净化水。
广泛使用铝盐净化水可能导致脑损伤,造成严重的记忆力丧失,这是早老性痴呆症特有的症状。
4.药品中含铝。
许多药物中含大量的铝。
例如,治疗胃酸使用的“胃舒平”,主要成份是氢氧化铝。
治疗鼻炎的康鼻炎中也含有氢氧化铝。
氢氧化铝的含铝量是34.6%,长期服用胃舒平定会导致体内铝过量。
5.透析疗法使身体摄入过多的铝。
透析疗法是重要的治疗手段,血液透析、腹膜透析已广泛用于临床医疗。
但是有些患者在原有病变改善以后,却出现了语言障碍、精神运动失常、抑郁、幻觉、妄想狂、肌肉阵发性痉挛、智力减退,进行性痴呆,2/3的患者出现骨营养不良。
这引起人们的普遍关注,进行了不少研究。
后来发现本症致病原因是由血液透析用的水中含有较高浓度的铝引起。
一些长期口服铝凝胶的患者,引起血铝浓度增高,也出现了可逆性痴呆。
进一步证明,体内铝过多确实可以引起智力障碍而发生痴呆。
5铝中毒的预防
人人都知道“防患于未然”的重要性,对待铝中毒也同样适用这一准则。
虽然正常人一般有能力控制铝的吸收,也有能力将吸进体内的铝排泄出去,还能有效地阻止已入体内的进入大脑。
但是超过了一定的范围(如大量摄入)或因年老、肾功能衰竭和从透析液中渗入体内、脑内及骨内,发生危害作用。
在这些情况下,仅凭生理性屏障作用就不够了,必须采取其他有力的措施,以防止摄入及吸收的铝过多。
明确了人体内过量铝的来源,也就可以采取相应的措施来预防铝中毒。
1.减少从食物中摄入铝。
尽可能少地食用粉丝、油条以及用铝盐发酵粉制做的面食。
采用酵母菌来代替铝盐发酵粉发酵。
腌菜应避免或少用含铝的物质做固定剂。
2.减少自来水内的含铝量。
为避免铝污染水源,除保护环境外,尚需在沉淀水、做水壶及水管时少用含铝量多的物质;在沉淀和处理水时采用更好的方法。
3减少从药物摄入铝。
少用或不用含铝的抗酸剂,或用不含铝的其他抗酸剂治疗胃及十二指肠溃疡和胃酸过高等消化道疾病。
这样,一方面可以防止患者吸收大量的铝,也可以防止大量的铝随粪便排出体外,污染环境及农作物。
4.减少通过铝制炊具进入人体的铝量。
少用或不用铝制品烹调蔬菜、储存酸性饮料、蔬菜和食盐,更不能长期储放饮料、醋、盐类及蔬菜,对防止铝中毒及污染,是重要的措施之一。
5保护环境,防止铝污染。
铝本来就是地壳上含量最多的金属,又加上大力开采铝矿、炼铝、制铝、用铝做各种炊具、用具、玩具,以及方泛用铝制剂治疗胃肠疾病与用铝沉淀水,铝对环境的污染应当引起每个人的注意,采取上述措施,尽量减少铝对环境、农作物、食物、水源及空气的污染,以确保身体健康。
不食用含铝量多的食物。
少吃或不吃使用含铝食品添加剂制作的油饼、油条、糕点、面包及饼干等食物。
以吃油条为例,每根油条约含铝10mg,每天吃两根,一个月就摄入铝600mg,为正常人体中含铝量的10倍。
自来水中的铝元素含量极微少,符合国家卫生安全标准,可以放心饮用。
6常吃健脑食品和做健身活动。
一方面可多食核桃仁、芝麻、绿豆等健脑食品;另一方面,为了预防老年性痴呆症,还应加强健脑锻炼,多看书报、多思考、常下棋、多与人交谈,多参加适合老年人的体育活动等等。
7正确使用铝制炊具。
由于铝制炊具,质轻软,易刮伤,能与糖、盐、酸、碱、酒等发生缓慢的化学反应而溢出较多的铝元素,从而增加了人们摄入铝元素的机会。
因此用铝制炊具盛放盐、酸、碱类食物时间不要过久。
不使用铝铲、铝勺等用具,因为它们在炒菜、盛饭的长期刮擦中,产生肉眼看不见的铝屑,这些铝屑可随饭菜入口进入人体。
铝锅应用竹木勺或无毒塑料勺盛饭。
建议有条件的家庭不使用铝制炊具,除使用铁锅、砂锅外,一律使用不锈钢制炊具。
因为不锈钢制品金属性能稳定,而且对人体无害。
8不食用含铝量多的食物。
少吃或不吃使用含铝食品添加剂制作的油饼、油条、糕点、面包及饼干等食物。
以吃油条为例,每根油条约含铝10mg,每天吃两根,一个月就摄入铝600mg,为正常人体中含铝量的10倍。
自来水中的铝元素含量极微少,符合国家卫生安全标准,可以放心饮用。