第八章-金属腐蚀控制方法.
- 格式:ppt
- 大小:9.15 MB
- 文档页数:95




第八章氧化还原反应和电化学习题解答1.回答下列问题。
(1)怎样利用电极电势来确定原电池的正负极,并计算原电池的电动势?(2)怎样理解介质的酸性增强,KMnO 4的电极电势代数值增大、氧化性增强?(3)Nernst 方程式中有哪些影响因素?它与氧化态及还原态中的离子浓度、气体分压和介质的关系如何?(4)区别概念:一次电池与二次电池、可逆电池与不可逆电池。
(5)介绍几种不同原电池的性能和使用范围。
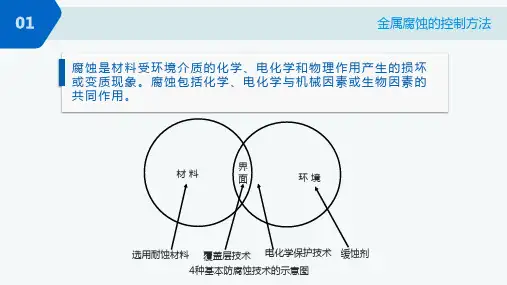
(6)什么是电化学腐蚀,它与化学腐蚀有何不同? (7)防止金属腐蚀的方法主要有哪些?各根据什么原理? 【解答】(1)电极电势值高的电极做正极,电极电势值低的电极做负极。
原电池的电动势等于正极的电动电势减去负极的电极电势。
(2)根据电极反应:-+-2+42M nO +8H +5e =M n +4H O2442284c(M n)0.0592M nO M nO c ()()lg M nM nc(M nO )5c(H )()cc+--ΘΘ++-ΘΘϕ=ϕ-+⋅由电极电势的能斯特公式可知,介质酸性增强时,H +浓度增大,42M nO ()M n-+ϕ代数值增大,电对中MnO 4-的氧化性增强。
(3)对于电极反应 -a(O x)+ze b(R ed) 电极电势的Nernst 方程为:bR e d aO x (c /c )R T (O x /R e d )(O x /R e d )lnzF(c /c )ΘΘΘϕ=ϕ-影响电极电势大小的因素:a )浓度对电极电势的影响 电对中氧化态的离子浓度(或气体分压)增大时,电极电势增加;还原态的离子浓度(或气体分压)增大时,电极电势降低。
b )酸度对电极电势的影响 对于有H +或OH -参加的电极反应,溶液酸度的变化会对电极电势产生影响,对于没有H +或OH -参加的电极反应,溶液酸度的变化对电极电势的影响很小。
(4)一次电池是指电池放电到活性物质耗尽只能废弃而不能再生和重复使用的电池。

《金属腐蚀原理》作业题绪论1、金属腐蚀按照腐蚀过程的特点可以分为几类?2、均匀腐蚀情况下金属腐蚀速度的衡量指标有哪几种?第一章金属电化学腐蚀倾向的判断1、什么是内电位、外电位、电化学位?2、什么是绝对电极电位、相对电极电位?两者有何区别?3、相间电位差产生的原因是什么?4、什么是金属的平衡电极电位?5、结合电位-pH图说明处于腐蚀状态的金属可以采取哪几种防腐蚀方法?第二章电化学腐蚀动力学1、什么是原电池的极化作用?什么是阳极极化、阴极极化?2、极化现象的本质是什么?3、掌握电化学极化时,极化电流与过电位之间的关系方程式。
4、熟练掌握稳态极化时的动力学公式,掌握强极化区和微极化区极化过电位和极化电流之间近似极化公式的推导过程。
5、什么是共轭体系?分析课本p61页图2-17中各点所对应的电流和电位的物理意义。
6、结合图2-19详细说明牺牲阳极保护法的基本原理。
7、结合活化控制的腐蚀体系极化公式(课本公式2-60)分析金属腐蚀速度测试的电化学方法都有哪些?8、腐蚀体系中,当电流处于强极化区时采用何种测试方法?微极化区采用何种测试方法?各有何适用条件?各自的原理和具体操作步骤是什么?弱极化区的测试方法有哪几种?掌握两点法和三点法的推导过程。
第三章氢去极化腐蚀和氧去极化腐蚀1、什么是氢去极化?什么是氧去极化?各自发生的条件是什么?2、什么是氢过电位?氢过电位的数值大小对氢去极化腐蚀有何影响?3、金属中具有不同氢过电位的杂质存在对基体金属腐蚀速度的影响情况是什么?4、什么是铂盐效应?以铁和锌在酸中的腐蚀速度为例说明氢过电位对于腐蚀速度的影响情况。
5、氧去极化腐蚀的影响因素有哪些?6、什么是氧浓差电池?在氧浓差电池中何者做阳极,何者做阴极?第四章金属的钝化1、什么是钝化作用?什么是化学钝化、电化学钝化?2、结合金属的钝化曲线分析钝化过程中的电化学参数,并说明阳极保护的基本原理是什么?3、阳极钝化曲线的测定和塔菲尔法测定金属腐蚀速度时的极化曲线各自采用什么方法测定?4、目前钝化理论主要包括哪几种?每种钝化理论所能够成功解释的问题是什么?第五章常见的局部腐蚀1、什么是电偶腐蚀?其原理是什么?2、什么是差异效应?什么是正差异效应、负差异效应?3、电偶序的排序理论依据什么?在实际应用中,对于构成电偶腐蚀的原电池如何判断其阴阳极?4、什么是小孔腐蚀?小孔腐蚀发生的条件是什么?小孔腐蚀的作用机理是什么?小孔腐蚀的电化学测试方法是什么?5、什么是缝隙腐蚀?缝隙腐蚀发生的原因是什么?与孔蚀相比较,缝隙腐蚀有什么不同?6、什么是晶间腐蚀?结合不锈钢说明晶间腐蚀发生的机理是什么?7、什么是应力腐蚀破裂?发生应力腐蚀破裂的条件是什么?8、什么是腐蚀疲劳?磨损腐蚀?选择性腐蚀?第八章腐蚀控制方法1、什么是阴极保护?阴极保护包括哪两种方法?这两种方法有何不同?2、什么是负保护效应?什么是阴极保护的最小保护电位?3、说明牺牲阳极保护法和外加阴极电流保护法的基本原理是什么?能够结合伊文思极化图进行分析。


第八章化学与可持续发展课件(共65张PPT)-高一化学课件(人教版2023必修第二册)(共65张PPT)第八章化学与可持续发展第一节自然资源的开发利用本节提纲01金属矿物的开发利用一、金属元素在自然界中的存在形式存在形式游离态(金、铂、银等)化合态(绝大多数金属)铂矿金矿铁矿铝矿铜矿二、金属的冶炼将金属从其化合物中还原出来的过程,工业上称之为金属的冶炼。
+ne-得电子,被还原Mn+M由化合态(化合物)制备游离态(单质)除去杂质提高金属的比例制备高纯度的金属二、金属的冶炼方法(1)物理法——游离态金属一万年前美人首饰侯王印,尽是沙中海底来。
二、金属的冶炼方法(2)热分解法——不活泼金属8000年前《天工开物》冶炼银的方法:银矿受热发生分解反应除了金、铂等极少数金属,绝大多数金属元素以化合物的形式存在于自然界。
化学要研究如何合理、高效地开发利用这些金属矿物,将其中的金属从其化合物中还原出来,用于生产各种金属材料,这一过程在工业上称为金属的冶炼。
根据金属活泼性的不同,可以采用不同的冶炼方法。
对一些不活泼金属,可以直接用加热分解的方法将它们从其化合物中还原出来。
例如:(2)热分解法——不活泼金属(3)热还原法——大部分金属1300年前炉火照天地,红星乱紫烟。
大部分金属的冶炼都是通过在高温下发生的氧化还原反应来完成的,常用的还原剂有焦炭、一氧化碳、氢气等,如我们在初中学过的用碳还原氧化铜和一氧化碳还原氧化铁。
一些活泼金属也可作还原剂,将相对不活泼的金属从其化合物中置换出来。
例如,铝热反应的原理是:(3)热还原法——大部分金属一些活泼金属也可作还原剂,将相对不活泼的金属从其化合物中置换出来。
例如,铝热反应的原理是:(3)热还原法——大部分金属铝热反应:铝和金属氧化物在高温下发生的剧烈并放出大量热的化学反应应用:冶炼难熔的较不活泼的金属,如Cr、V、Mn等;焊接钢轨镁条氯酸钾氧化铁和铝粉的混合物铝热反应铝+某些金属氧化物金属+氧化铝高温铝热剂:铝和某些金属氧化物(如Fe2O3、Cr2O3、V2O5)组成的混合物。
![[化学]第八章金属阳极过程与金属腐蚀](https://uimg.taocdn.com/18d2fd79453610661fd9f44d.webp)


第八单元《金属和金属材料》单元测试一、选择题1.俗话说“真金不怕火炼”,指的是()。
A.金的硬度大B.金在常温下与氧气反应,高温不反应C.金的熔点高,可以用火烧D.金的性质不活泼,在高温时也不与氧气反应考查目的:金属与氧气的反应答案:D解析:金的化学性质在自然条件下非常稳定,在自然界中多以单质的形式存在,即使在高温时也不与氧气反应。
2.市面上时有不法商贩使用颜色和外形与黄金十分相似的假黄金(铜锌合金)来蒙骗消费者。
请你利用所学的化学知识判断,下列方案不能区分真假黄金的是()。
A.放在稀硫酸中B.在空气中灼烧C.测密度D.认真观察外观考查目的:金属与氧气的反应,金属与盐酸或稀硫酸的反应答案:D解析:金的化学性质很稳定,不能与稀硫酸反应,而铜锌合金中的锌可与稀硫酸反应产生氢气,故A可区分真假黄金;金即使在高温下也不与氧气反应,而铜可与氧气在加热条件下反应生成黑色的氧化铜,现象明显,故B可区分真假黄金;金的密度较铜锌合金的密度大,故可通过测密度的方法区分真假黄金;铜锌合金与黄金的颜色十分相似,故D不能区分两种金属材料。
3.下列关于金属物理性质的描述正确的是()。
A.常温下所有金属都是固体B.铁丝可在氧气中燃烧产生黑色固体C.大多数金属具有优良的导电性、导热性、延展性D.金属都具有银白色金属光泽考查目的:金属的物理性质答案:C解析:常温下大多数金属都是固体,但汞是液体;金属铁与氧气发生反应是金属铁的化学性质而非物理性质;大多数金属具有银白色金属光泽,而铜呈紫红色,金呈黄色。
4.金属铜、镍、铝等常用作制作硬币,我国一元币为钢芯镀镍合金,五角币为钢芯镀铜合金,一角币为铝合金或不锈钢,在选择铸造硬币的材料时,不需要考虑的因素是()。
A.金属的耐腐蚀性B.金属的颜色C.金属的硬度D.金属价格与硬币面值的吻合度考查目的:物质的性质与物质的用途之间的关系答案:B解析:硬币作为货币的一种,使用环境复杂、使用范围较广、使用寿命不易过短,这就要求硬币应具有化学性质相对稳定不易被腐蚀、不易锈蚀的特点;同时不易变形、不易碎裂,因此所用金属还要有一定的硬度和强度;而作为货币,还要要求所使用的金属价格要与硬币面值相吻合,而与金属的颜色无太大关系。
第八章 金属和金属材料知识点一、金属材料姓名:1. 金属材料包括纯金属和合金两类。
金属属于金属材料,但金属材料不一定是纯金属,也可能是合金。
2. 金属制品是由金属材料制成的,铁、铜、铝及其合金是人类使用最多的金属材料。
金属材料的发展史商朝,人们开始使用青铜器;春秋时期开始冶铁;战国时期开始炼钢;铜和铁一直是人类广泛应用的金属材料。
在100多年前,又开始了铝的使用,因铝具有密度小和抗腐蚀等许多优良性能, 铝的产量已超过了铜, 位于第二位。
(1) 常见金属的物理性质① 共性:大多数金属都具有金属光泽,密度和硬度较大,熔沸点较高,具有良好的延展性和导电、 温下除汞为液体,其余金属均为固体。
② 特性:颜色:铁、铝等大多数金属都呈银白色,铜呈紫红色,金呈黄色 密度:大多数金属的密度大于水,锂、钠、钾等金属的密度小于水 导电性:银、铜的导电性较好,铝的导电性较差延展性:金的延展性较好,锰的延展性很差 注意:颜色和光泽一般是指金属在整块时表现出来的外观特性, (2) 常见金属的物理性质比较:导电性 Ag Cu Au Al Zn Fe Pb由优到良 密度 Au Pb Ag Cu Fe Zn Al由大到小 熔点 WFeCu Au Ag Al Sn 由高到低 硬度Cr FeAgCuAuAlPb由大到小物质的性质与物质的用途之间的关系:1. 物质的性质决定物质的用途,而物质的用途又反映出物质的性质。
2. 物质的性质很大程度上决定了物质的用途。
但这不是唯一的决定因素,在考虑物质的用途时,还需要考虑价格、资源、是否美观、使用是否便利,以及废料是否易于回收和对环紧的影响 等多种因素。
合金1.合金:在金属中加热熔合某些金属和非金属,形成具有金属特性的物质。
注意:(1)合金是金属与金属或金属与非金属的混合物。
(2) 合金的很多性能与组成它们的纯金属不同,使合金更容易适于不同的用途。
(3) 日常使用的金属材料,大多数为合金。
一、选择题1.化学与生产、生活、科技等密切相关,下列说法错误的是A.开发利用太阳能、风能和氢能等新能源代替化石能源,利于实现低碳经济B.利用膜材料将含油污水中的油水分离,发生的是化学变化C.研究人员在分子水平上了解新型冠状病毒的病理,研制抗毒疫苗D.屠呦呦从青蒿中提取青蒿素对治疗疟疾有特效2.下列化工产品不是以食盐为原料生产的是A.硫酸B.盐酸C.纯碱D.烧碱3.抗疫居家期间,同学们在参与家务劳动的过程中体会到化学知识无处不在。
下列劳动与所涉及的化学知识不相符的是选项家务劳动化学知识A餐后将洗净的铁锅擦干铁在潮湿环境中易生锈B使用白醋除去水壶中的水垢白醋可溶解碳酸钙等沉淀C使用含NaClO的84消毒液拖地NaClO具有还原性D用温热的纯碱溶液擦拭有油污的灶台油脂在碱性条件下发生水解反应A.A B.B C.C D.D4.下列不属于室内空气污染物质的是()A.CO B.苯C.重金属D.甲醛5.“绿色化学”提倡,设计制备物质的方案时,要从经济、环保和技术等方面考虑,以下由铜制取硝酸铜的四种方案中,比较符合“绿色化学”概念且可行的方案是A.Cu → Cu(NO3)2B.Cu → CuO →Cu(NO3)2C.Cu → CuCl2 →Cu(NO3)2D.Cu → CuSO4 →Cu(NO3)26.下列叙述不涉及氧化还原反应的是A.钢铁制品在空气中被腐蚀B.高炉炼铁C.用澄清石灰水检验二氧化碳D.电解氧化铝制备金属铝7.海洋中有丰富的食品、矿产、能源、药物和水产资源,下图为海水利用的部分过程。
下列说法正确的是A.步骤①是指蒸发结晶B.步骤⑤是先通CO2再通NH3C.在步骤②、③、④中,溴元素均被氧化D.制取NaHCO3的反应是利用其溶解度在常温下小于NaCl和NH4HCO38.下列说法不正确...的是A.相同质量的乙炔与苯分别在足量的氧气中完全燃烧,消耗氧气的物质的量相同B.相同质量的脂肪在人体内氧化所产生的热量比糖类或蛋白质都少C.农业废弃物和动物粪便等物质中蕴藏着丰富的生物质能D.许多蛋白质在水中有一定的溶解性,溶于水形成胶体9.绿色化学又称环境友好化学,它的主要特点之一是提高原子的利用率,使原料中所有的原子全部转化到产品中,实现“零排放”。