肿瘤的分级与分期
- 格式:ppt
- 大小:13.57 MB
- 文档页数:136


一甲状腺癌TNM临床分期原发肿瘤(T)在T分期中,所有的分期可再分为:(a)孤立性肿瘤,(b)多灶性肿瘤(其中最大者决定分期).TX 原发肿瘤无法评估T0 无原发肿瘤证据T1 肿瘤最大径≤2cm,局限于甲状腺内;T2 肿瘤最大径〉2cm,但≤4cm,局限于甲状腺内;T3 肿瘤最大径〉4cm局限于甲状腺内或任何肿瘤伴有最小限度的甲状腺外侵犯(如:胸骨甲状肌或甲状腺周围软组织);T4:肿瘤不论大小,超出甲状腺包膜T4a 任何大小的肿瘤侵扩展出甲状腺包膜侵犯皮下软组织、喉、气管、食管或喉反神经;T4b 肿瘤侵犯椎前筋膜或包绕颈动脉或纵隔血管;此外,所有的间变癌认为属T4肿瘤,进一步可分为:T4a 甲状腺内的间变癌-手术可切除T4b 甲状腺外的间变癌-手术不可切除区域淋巴结(N):区域淋巴结为颈正中部/颈侧和上纵隔淋巴结。
NX 区域淋巴结无法评估;N0 无区域淋巴结转移;N1区域淋巴结转移;N1a VI区转移(气管前、气管旁和喉前/Delphia淋巴结);N1b 转移至单侧、双侧或对侧颈部或上纵隔淋巴结;远处转移(M)MX 远处转移无法评估; M0 无远处转移; M1 有远处转移;分期44岁以下45岁以上1期任何TN,M0 T1N0M02期任何TN,M1 T2N0M0 ,T3N0M03期T4N0M0,任何TN1M04期任何TN,M1二乳腺癌临床分期乳腺癌T1mic≤0。
1cm<T1a≤0。
5cm<T1b≤1cm<T1c≤2cm<T2≤5cm<T3 分期TNMⅠT1N0M0Ⅱa T0N1M0,T1N1M0;T2N0M0; T4:a侵犯胸壁;b水肿,c:a+b;d炎性癌Ⅱb T2N1M0,T3N0M0;N1:同侧腋窝Ⅲa T0N2M0,T1N2M0,T2N2M0,T3N1M0,T3N2M0;N2:同侧融合或内乳转移;Ⅲb T4N0M0,T4N1M0,T4N2M0; N3:a同侧锁骨下;b同侧内乳和腋窝转移;Ⅲc 任何T,N3M0 c同侧锁骨上;Ⅳ任何T,任何N,M1三胃癌(AJCC)及UICC制定的胃癌TNM分期(2002年版本)原发肿瘤(T):Tx 原发肿瘤无法评估;T0 无原发肿瘤的证据;Tis 原位癌:上皮内肿瘤,未侵及固有层;T1 肿瘤侵犯固有层或粘膜下层;T2 肿瘤侵犯固有肌层或浆膜下层;T2a 肿瘤侵犯固有肌层;T2b 肿瘤侵犯浆膜下层;T3 肿瘤穿透浆膜(脏层腹膜)而尚未侵及邻近结构;T4 肿瘤侵犯邻近结构;区域淋巴结(N):Nx 区域淋巴结无法评估;N0 区域淋巴结无转移;N1 1~6个区域淋巴结有转移;N2 7~15个区域淋巴结有转移;N3 15个以上区域淋巴结有转移;远处转移(M):Mx 远处转移情况无法评估;M0 无远处转移;M1 有远处转移;分期T N MⅠa T1N0M0 0Ⅰb T1N1M0,T2N0M0 0ⅡT1N2M0,T2N1M0,T3N0M0 0Ⅲa T2N2M0,T3N1M0,T4N0M0 0Ⅲb T3N2M0 0ⅣT4N1~2M0,任何TN3M0,任何T任何NM1 1四结直肠癌分期(2003年TNM分期法和改良版DUKES分期法)原发肿瘤(T)分期Tx: 原发肿瘤无法评估;T0:没有原发肿瘤的证据;Tis:原位癌:上皮内癌或粘膜内癌未穿透粘膜肌层而达粘膜下层;T1:肿瘤侵及粘膜下层;T2:肿瘤侵及肠壁固有肌层;T3:肿瘤侵透固有肌层并侵达浆膜下,或原发病灶位于无浆膜层的结肠、直肠时、肿瘤已侵达结肠旁或直肠旁组织;T4:肿瘤已穿透腹膜或直接侵入其他脏器。


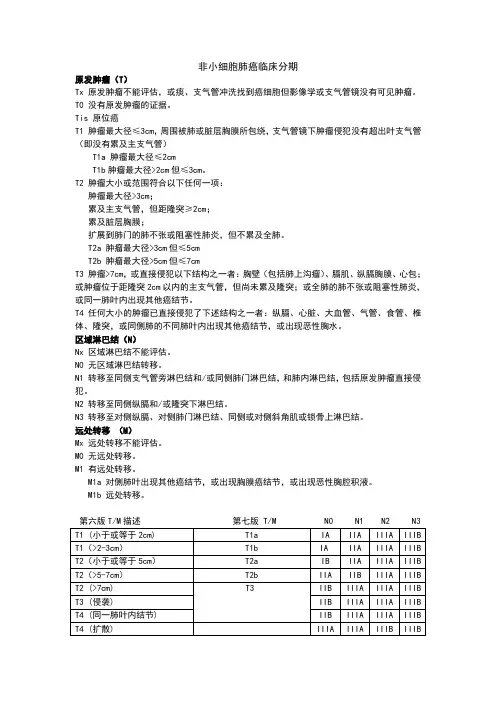
非小细胞肺癌临床分期原发肿瘤(T)Tx 原发肿瘤不能评估,或痰、支气管冲洗找到癌细胞但影像学或支气管镜没有可见肿瘤。
T0 没有原发肿瘤的证据。
Tis 原位癌T1 肿瘤最大径≤3cm,周围被肺或脏层胸膜所包绕,支气管镜下肿瘤侵犯没有超出叶支气管(即没有累及主支气管)T1a 肿瘤最大径≤2cmT1b肿瘤最大径>2cm但≤3cm。
T2 肿瘤大小或范围符合以下任何一项:肿瘤最大径>3cm;累及主支气管,但距隆突≥2cm;累及脏层胸膜;扩展到肺门的肺不张或阻塞性肺炎,但不累及全肺。
T2a 肿瘤最大径>3cm但≤5cmT2b 肿瘤最大径>5cm但≤7cmT3 肿瘤>7cm,或直接侵犯以下结构之一者:胸壁(包括肺上沟瘤)、膈肌、纵膈胸膜、心包;或肿瘤位于距隆突2cm以内的主支气管,但尚未累及隆突;或全肺的肺不张或阻塞性肺炎,或同一肺叶内出现其他癌结节。
T4 任何大小的肿瘤已直接侵犯了下述结构之一者:纵膈、心脏、大血管、气管、食管、椎体、隆突,或同侧肺的不同肺叶内出现其他癌结节,或出现恶性胸水。
区域淋巴结(N)Nx 区域淋巴结不能评估。
N0 无区域淋巴结转移。
N1 转移至同侧支气管旁淋巴结和/或同侧肺门淋巴结,和肺内淋巴结,包括原发肿瘤直接侵犯。
N2 转移至同侧纵膈和/或隆突下淋巴结。
N3 转移至对侧纵膈、对侧肺门淋巴结、同侧或对侧斜角肌或锁骨上淋巴结。
远处转移(M)Mx 远处转移不能评估。
M0 无远处转移。
M1 有远处转移。
M1a 对侧肺叶出现其他癌结节,或出现胸膜癌结节,或出现恶性胸腔积液。
M1b 远处转移。
第六版T/M描述第七版 T/M N0 N1 N2 N3小细胞肺癌临床分期小细胞肺癌分期包括局限期:肿瘤局限于一侧胸腔内,肿瘤被可耐受放疗的区域所包绕。
广泛期:肿瘤的发展超过同侧胸腔,包括恶性胸腔/心包积液,或血源性播散。
原发肿瘤(T)Tx 原发肿瘤不能评估,或痰、支气管冲洗找到癌细胞但影像学或支气管镜没有可见肿瘤。

肿瘤的分型、分级和分期发表者:杨军7782人已访问由于诸多因素的影响,全球恶性肿瘤发病率呈现持续升高态势,据推测到2020年前,全球恶性肿瘤发病率将增加50%,不仅如此,恶性肿瘤的死亡人数也在全球迅猛上升[1],而在我国等发展中国家,这一趋势将更为明显,并具有显著的年轻化趋势。
因此,加强恶性肿瘤的防治研究,准确、客观评价肿瘤生物学行为和预后、制定治疗方案显得更为迫切。
肿瘤的分型(classification)、分级(grading)和分期(staging)是目前评价肿瘤生物学行为和诊断的最重要的三项指标,其中分级和分期主要用于恶性肿瘤生物学行为和预后的评估。
近数十年来,得益于生命科学和医学技术的突破性进展,肿瘤个体化治疗相关靶标的检测及包括靶向治疗在内的个体化治疗药物的临床应用,不仅在很大程度上提高了早期肿瘤的检出率,也明显改善了许多肿瘤的预后。
传统肿瘤分型、分级和分期的临床价值和意义也随之产生不同程度的变化。
本文拟深入分析肿瘤的分型、分级和分期的生物学依据及临床价值,以期为肿瘤的个体化治疗提供更为精确的分子生物学信息、指导个体化治疗方案的制定和疗效监测。
一、恶性肿瘤的病理分类(分型)尽管,关于肿瘤起源的干细胞理论和去分化理论的争论仍在持续,但是,机体各器官和组织、细胞均可发生肿瘤的事实却不可否认。
肿瘤细胞与其来源组织的相似或接近于正常组织的程度是肿瘤病理学分类(分型)的重要诊断依据,例如,角化型鳞癌出现不成程度的角化、腺癌具有分泌功能、黑色素瘤能够合成黑色素、滑膜肉瘤具有双向分化特征等等。
因此,肿瘤的病理学分型是最能反映肿瘤来源组织细胞的生物学行为和形态学特征的重要参数。
不同组织类型的肿瘤具有不同的生物学行为和侵袭转移能力,例如,来源于消化道的粘液性癌粘液性癌(印戒细胞癌或粘液癌)较管状腺癌更易于发生淋巴结转移、预后更差,而乳腺粘液癌预后良好。
而从肿瘤细胞分化层面讲,低分化肿瘤较高分化肿瘤具有更强的侵袭转移能力、恶性程度更高。


肿瘤的分型、分级和分期发表者:杨军7782人已访问由于诸多因素的影响,全球恶性肿瘤发病率呈现持续升高态势,据推测到2020年前,全球恶性肿瘤发病率将增加50%,不仅如此,恶性肿瘤的死亡人数也在全球迅猛上升[1],而在我国等发展中国家,这一趋势将更为明显,并具有显著的年轻化趋势。
因此,加强恶性肿瘤的防治研究,准确、客观评价肿瘤生物学行为和预后、制定治疗方案显得更为迫切。
肿瘤的分型(classification)、分级(grading)和分期(staging)是目前评价肿瘤生物学行为和诊断的最重要的三项指标,其中分级和分期主要用于恶性肿瘤生物学行为和预后的评估。
近数十年来,得益于生命科学和医学技术的突破性进展,肿瘤个体化治疗相关靶标的检测及包括靶向治疗在内的个体化治疗药物的临床应用,不仅在很大程度上提高了早期肿瘤的检出率,也明显改善了许多肿瘤的预后。
传统肿瘤分型、分级和分期的临床价值和意义也随之产生不同程度的变化。
本文拟深入分析肿瘤的分型、分级和分期的生物学依据及临床价值,以期为肿瘤的个体化治疗提供更为精确的分子生物学信息、指导个体化治疗方案的制定和疗效监测。
一、恶性肿瘤的病理分类(分型)尽管,关于肿瘤起源的干细胞理论和去分化理论的争论仍在持续,但是,机体各器官和组织、细胞均可发生肿瘤的事实却不可否认。
肿瘤细胞与其来源组织的相似或接近于正常组织的程度是肿瘤病理学分类(分型)的重要诊断依据,例如,角化型鳞癌出现不成程度的角化、腺癌具有分泌功能、黑色素瘤能够合成黑色素、滑膜肉瘤具有双向分化特征等等。
因此,肿瘤的病理学分型是最能反映肿瘤来源组织细胞的生物学行为和形态学特征的重要参数。
不同组织类型的肿瘤具有不同的生物学行为和侵袭转移能力,例如,来源于消化道的粘液性癌粘液性癌(印戒细胞癌或粘液癌)较管状腺癌更易于发生淋巴结转移、预后更差,而乳腺粘液癌预后良好。
而从肿瘤细胞分化层面讲,低分化肿瘤较高分化肿瘤具有更强的侵袭转移能力、恶性程度更高。


.肿瘤得分型、分级与分期由于诸多因素得影响,全球恶性肿瘤发病率呈现持续升高态势,据推测到2020年前,全球恶性肿瘤发病率将增加50%,不仅如此,恶性肿瘤得死亡人数也在全球迅猛上升[1],而在我国等发展中国家,这一趋势将更为明显,并具有显著得年轻化趋势、因此,加强恶性肿瘤得防治研究,准确、客观评价肿瘤生物学行为与预后、制定治疗方案显得更为迫切。
肿瘤得分型(classification)、分级(grading)与分期(st aging)就是目前评价肿瘤生物学行为与诊断得最重要得三项指标,其中分级与分期主要用于恶性肿瘤生物学行为与预后得评估、近数十年来,得益于生命科学与医学技术得突破性进展,肿瘤个体化治疗相关靶标得检测及包括靶向治疗在内得个体化治疗药物得临床应用,不仅在很大程度上提高了早期肿瘤得检出率,也明显改善了许多肿瘤得预后、传统肿瘤分型、分级与分期得临床价值与意义也随之产生不同程度得变化。
本文拟深入分析肿瘤得分型、分级与分期得生物学依据及临床价值,以期为肿瘤得个体化治疗提供更为精确得分子生物学信息、指导个体化治疗方案得制定与疗效监测。
一、恶性肿瘤得病理分类(分型)尽管,关于肿瘤起源得干细胞理论与去分化理论得争论仍在持续,但就是,机体各器官与组织、细胞均可发生肿瘤得事实却不可否认、肿瘤细胞与其来源组织得相似或接近于正常组织得程度就是肿瘤病理学分类(分型)得重要诊断依据,例如,角化型鳞癌出现不成程度得角化、腺癌具有分泌功能、黑色素瘤能够合成黑色素、滑膜肉瘤具有双向分化特征等等。
因此,肿瘤得病理学分型就是最能反映肿瘤来源组织细胞得生物学行为与形态学特征得重要参数。
不同组织类型得肿瘤具有不同得生物学行为与侵袭转移能力,例如,来源于消化道得粘液性癌粘液性癌(印戒细胞癌或粘液癌)较管状腺癌更易于发生淋巴结转移、预后更差,而乳腺粘液癌预后良好、而从肿瘤细胞分化层面讲,低分化肿瘤较高分化肿瘤具有更强得侵袭转移能力、恶性程度更高。

肺癌的分期非小细胞肺癌T分期:T分级根据肺癌的大小,在肺内的扩散和位置,扩散到临近组织的程度。
Tis:癌症只限于气道通路的内层细胞。
没有扩散到其它的肺组织,这期肺癌通常也叫做原位癌。
l 非小细胞肺癌的N分级:N分期取决于癌症侵犯了附近的哪些淋巴结。
非小细胞肺癌的M分期:M分期取决于癌症是否转移到远处组织或者器官。
目前非小细胞肺癌的TNM分期采用国际肺癌研究协会〔IASLC〕2021年第七版分期标准〔IASLC 2021〕。
1. 肺癌TNM分期中T、N、M的定义。
〔1〕原发肿瘤〔T〕。
TX :原发肿瘤不能评估,或痰、支气管冲洗液找到癌细胞但影像学或支气管镜没有可见的肿瘤。
T0 :没有原发肿瘤的证据。
Tis:原位癌。
T1:肿瘤最大径≤3cm,周围被肺或脏层胸膜所包绕,支气管镜下肿瘤侵犯没有超出叶支气管〔即没有累及主支气管〕。
T1a:肿瘤最大径≤2cm。
T1b:肿瘤最大径>2cm且≤3cm。
T2:肿瘤大小或X围符合以下任何一项:肿瘤最大径>3cm; 但不超过7cm;累及主支气管,但距隆突≥2cm;累及脏层胸膜;扩展到肺门的肺不X或阻塞性肺炎,但不累及全肺。
T2a:肿瘤最大径≤5cm,且符合以下任何一点:肿瘤最大径>3cm;累及主支气管,但距隆突≥2cm;累及脏层胸膜;扩展到肺门的肺不X或阻塞性肺炎,但不累及全肺。
T2b:肿瘤最大径>5cm且≤7cm。
T3:任何大小的肿瘤已直接侵犯了下述构造之一者:胸壁〔包括肺上沟瘤〕、膈肌、纵隔胸膜、心包;或肿瘤位于距隆突2cm以内的主支气管,但尚未累及隆突;或全肺的肺不X或阻塞性肺炎。
肿瘤最大径>7cm;与原发灶同叶的单个或多个的卫星灶。
T4:任何大小的肿瘤已直接侵犯了下述构造之一者:纵隔、心脏、大血管、气管、食管、喉返神经、椎体、隆突;或与原发灶不同叶的单发或多发病灶。
〔2〕区域淋巴结〔N〕。
NX:区域淋巴结不能评估。
N0:无区域淋巴结转移。
骨肿瘤分期
良性肿瘤分期:
1级:静止性肿瘤,有完整的包囊;
2级:生长活跃,仍位于囊内或者为自然屏障所阻挡;
3级:具有侵袭性,可穿破皮质或者间隔;
分级(G):根据肿瘤的生长速度及侵袭性,良性肿瘤G0,低度恶性为G1,高度恶性G2 外科部位(T):完整的纤维组肿囊或者反应骨包绕T0;肿瘤位于囊外间隔内(肌间隔或者骨旁间隔及潜在的间隔内)T1;间隔外,肿瘤位于囊外,超过肿瘤的间隔或者起源于分界不清的间隔T2
转移(M):包括局部淋巴结转移和远处转移,无局部及远处转移为M0,有局部及远处转移为M1
恶性肿瘤分期:
IA(G1,T1,M0):低度恶性,间室内病变,无转移;
IB(G1,T2,M0):低度恶性,间室外病变,无转移;
IIA(G2,T1,M0):高度恶性,间室内病变,无转移;
IIB(G2,T2,M0):高度恶性,间室外病变,无转移;
IIIA(G1,T1,M1):间室内病变伴有转移的恶性肿瘤;
IIIB(G1或G2,T1或T2,M1):间室外病变伴有转移的恶性肿瘤。
.肿瘤的分型、分级和分期由于诸多因素的影响,全球恶性肿瘤发病率呈现持续升高态势,据推测到2020年前,全球恶性肿瘤发病率将增加50%,不仅如此,恶性肿瘤的死亡人数也在全球迅猛上升[1],而在我国等发展中国家,这一趋势将更为明显,并具有显著的年轻化趋势。
因此,加强恶性肿瘤的防治研究,准确、客观评价肿瘤生物学行为和预后、制定治疗方案显得更为迫切。
肿瘤的分型(classification)、分级(grading)和分期(staging)是目前评价肿瘤生物学行为和诊断的最重要的三项指标,其中分级和分期主要用于恶性肿瘤生物学行为和预后的评估。
近数十年来,得益于生命科学和医学技术的突破性进展,肿瘤个体化治疗相关靶标的检测及包括靶向治疗在的个体化治疗药物的临床应用,不仅在很大程度上提高了早期肿瘤的检出率,也明显改善了许多肿瘤的预后。
传统肿瘤分型、分级和分期的临床价值和意义也随之产生不同程度的变化。
本文拟深入分析肿瘤的分型、分级和分期的生物学依据及临床价值,以期为肿瘤的个体化治疗提供更为精确的分子生物学信息、指导个体化治疗方案的制定和疗效监测。
一、恶性肿瘤的病理分类(分型)尽管,关于肿瘤起源的干细胞理论和去分化理论的争论仍在持续,但是,机体各器官和组织、细胞均可发生肿瘤的事实却不可否认。
肿瘤细胞与其来源组织的相似或接近于正常组织的程度是肿瘤病理学分类(分型)的重要诊断依据,例如,角化型鳞癌出现不成程度的角化、腺癌具有分泌功能、黑色素瘤能够合成黑色素、滑膜肉瘤具有双向分化特征等等。
因此,肿瘤的病理学分型是最能反映肿瘤来源组织细胞的生物学行为和形态学特征的重要参数。
不同组织类型的肿瘤具有不同的生物学行为和侵袭转移能力,例如,来源于消化道的粘液性癌粘液性癌(印戒细胞癌或粘液癌)较管状腺癌更易于发生淋巴结转移、预后更差,而乳腺粘液癌预后良好。
而从肿瘤细胞分化层面讲,低分化肿瘤较高分化肿瘤具有更强的侵袭转移能力、恶性程度更高。