次氯酸及其盐、二氧化氯
- 格式:docx
- 大小:158.92 KB
- 文档页数:4

二氧化氯消毒原理二氧化氯消毒是一种常用的消毒方式,广泛应用于水处理、食品加工、医疗卫生等领域。
二氧化氯(ClO2)是一种强氧化性气体,其消毒原理主要与其氧化作用有关。
下面将详细介绍二氧化氯消毒的原理。
首先,二氧化氯可以杀灭细菌、病毒和其他微生物,这是因为它能与微生物细胞的蛋白质、氨基酸、核酸等重要生物分子发生氧化反应,破坏其细胞膜和内部结构。
在水中,二氧化氯通过与水中的溶解氧和水分子发生反应,生成次氯酸(HClO)和次氯酸根离子(ClO-)。
次氯酸是一种具有强氧化性的化合物,对细菌和病毒具有杀灭作用。
其次,二氧化氯还能通过氧化反应去除水中的有机物、异味物质和色素物质等污染物。
二氧化氯气体在水中溶解并与溶解氧反应,形成次氯酸和二氧化碳。
次氯酸和二氧化碳的生成过程需要一定的反应时间,所以二氧化氯消毒通常需要一定的接触时间。
此外,二氧化氯还能与亚硫酸盐等还原剂反应生成氯离子,进一步增强其消毒效果。
这种反应被称为亚硫酸盐法二氧化氯消毒法,常用于处理含有有机物质或氯消毒副产物超标的水。
亚硫酸盐在水中与二氧化氯反应生成亚硫酸氢钠和氯离子,亚硫酸氢钠能迅速中和二氧化氯,避免其过量残留。
最后,二氧化氯消毒的效果与其浓度、pH值、接触时间等因素有关。
一般来说,二氧化氯浓度越高、pH值越低,并且接触时间越长,其消毒效果越好。
根据不同的需求,可以通过调节二氧化氯的浓度、加药量和接触时间等参数来达到所需的消毒效果。
总之,二氧化氯消毒通过氧化作用杀灭微生物并去除有机污染物,是一种高效、广泛应用的消毒方式。
在实际应用中,需要根据具体情况调整相关参数,以确保消毒的效果和安全性。

自1811年英国化学家汉弗莱·戴维(Humphvy David)用硫酸将氯酸钾酸化制得二氧化氯气体以来,近两百年间,二氧化氯的制备与应用已进入了一个飞速发展的时期,它以其优良的氧化性与漂白性广泛地渗入了农产品加工、造纸、制革和纺织业、循环冷却水和废水处理,油类和燃气工业、水产养殖业以及医疗场所等领域中的应用在逐年增加。
在1881年以前,有不少人制备出了二氧化氯,如米隆,他于1843年用盐酸将氯酸钾酸化获得一种黄绿角气体,随即将这一气体吸收在碱性溶液中,获得亚氯酸盐(以及次氯酸盐),但制备出的气体中的二氧化氯并没有被识别。
直至1881年卡扎罗利﹒舍恩拉科才鉴别出这种气体是二氧化氯和氯气的混合物。
上世纪20年代,德国曾备出较纯的二氧化氯,德国生物学家艾里克·施米德(Eric Schmidt)于1921年在制备木片标本时,使用二氧化氯溶去木素而剩下碳水化合物后,发现木片标本被漂白了,于是二氧化氯作为纸浆的漂白剂有了初步的认识,但因制造工艺复杂、毒性大、成本高、产品不稳定、易爆炸、腐蚀性强,当时尚未大量工业应用。
直到1930年马蒂逊(Methieson)制碱公司研究成功工业生产二氧化氯的方法(以SO2做为还原剂还原用硫酸酸化的氯酸钠制备ClO2),1940在美国首次实现工业化生产二氧化氯,但生产的二氧化氯是用于生产亚氯酸钠,1946年加拿大和瑞典的纸浆厂开始用二氧化氯使用漂白剂漂白纸浆。
1946年加拿大拉普逊(Rapson)教授发明了制备二氧化氯新法(R1),并同年在加拿大魁北克和瑞典实现工业化生产。
R1法仍采用马蒂逊法的SO2还原NaClO3制备氯酸钠,与马蒂逊法不同的是拉普逊法没有向反应体系中加入硫酸,而是利用SO2被氧化氯后生成的硫酸来维持反应体系的酸平衡。
此法副反应多,产品不纯,其使用与推广受到了限制。
后来,教授又开发成功R2法,R2法的还原剂氯化钠还原用硫酸酸化后的氯酸钠,生成二氧化氯与氯气的混合气体,二氧化氯用冷冻水吸收,剩余的氯气用石灰乳吸收制备漂白液。

二氧化氯消毒剂与其它常用化学消毒剂的比较1、化学消毒剂的分类根据消毒剂对微生物的杀菌能力,可将消毒剂分为三类高效消毒剂:指可杀灭一切微生物,包括细菌、真菌、芽孢、病毒的消毒剂,这类消毒剂也称为灭菌剂。
有二氧化氯、双氧水、戊二醛等中效消毒剂:指不能杀死细菌芽孢,但能杀死细菌繁殖体、真菌和大多数病毒的消毒剂。
有乙醇、氯制剂等。
低效消毒剂:指可杀灭多数细菌繁殖体、部分真菌和病毒,但不能杀灭细菌芽孢、结核杆菌以及某些真菌和病毒的消毒剂。
有洗必泰、新洁尔灭等。
2、常用化学消毒种类以及作用机制和特点、过氧化物类:杀菌机理是释放出新生态原子氧,氧化菌体中的活性基团,杀菌特点是作用快而强,能杀死所有微生物。
包括:双氧水、臭氧、二氧化氯等。
该类消毒剂为灭菌剂。
广泛应用于医学消毒和工业灭菌。
、卤素类:杀菌机理是氧化菌体中的活性基团,与氨基结合使蛋白质变性。
杀菌特点是能杀死大部分微生物,性质不稳定,杀菌效果受环境条件影响大,消毒过程中易产生三致物质(治癌、致畸、致突变如三氯甲烷等),包括:漂白粉(次氯酸钠)、84消毒液、优氯净、三氯异氰尿素(钠)、碘伏等。
该类消毒剂为中效消毒剂。
其中含氯制剂主要应用于工业消毒。
、酚类:杀菌机理是蛋白质变性、沉淀或使酶系统失活;酚类能抑制和杀死部分细菌的繁殖体和亲脂病毒。
包括:苯酚、来苏水(甲酚)等。
该类消毒剂为低效消毒剂。
主要应用医学消毒。
、醛类:杀菌机理是蛋白质变性或烷基化;杀菌特点是对细菌、芽孢、真菌、病毒均有效应。
甲醛、戊二醛等。
可做灭菌剂使用。
主要应用医疗卫生的器械表面和空间消毒,不能用于食品领域的消毒。
、季铵盐类阳离子表面活性剂:杀菌机理是改变细胞膜透性,使细胞质外漏,妨碍呼吸或是蛋白质变性。
特点是能杀死细菌繁殖体,但对芽孢、真菌、病毒、结核杆菌作用差。
包括:苯扎溴铵(新吉尔灭)。
作中效消毒剂。
一般适于皮肤、粘膜、手术器械,污染的工作服的消毒。
、醇类:杀菌机理是使蛋白质变性,干挠代谢。

二氧化氯(ClO2)在饮用水处理中的应用摘要:消毒通常是传统饮用水处理工艺关键一步,从而保证了水质的安全可靠。
加入到水中消毒剂可以从根本上消除或是抑制传播水生疾病的病菌,就目前来说,氯气(cl2)以及次氯酸盐(clo-)是给水处理工业当中最常见的消毒剂。
由于认识到加氯消毒副产品的危害,现在研究人员越来越多的把目光投向了其他的替代消毒剂。
主要从水处理替代消毒剂二氧化氯(clo2)的制造,氧化方式,消毒效率以及副产物等方面进行论述。
关键词:饮用水处理、消毒、二氧化氯(clo2)、ph值1 二氧化氯(clo2)消毒1.1简介。
二氧化氯是一种含氯的中性化合物,由于其在化学反应中的单电子转移能力,二氧化氯通常在水消毒的过程中被用作高效率的氧化剂,氧化还原反应后的产物为亚氯酸根离子(clo2-)。
亚氯酸盐与亚氯酸根离子之间的电离平衡常数相对较小,这也与次氯酸(hocl)与其共轭碱对之间的电离平衡关系有着很大的不同,次氯酸的电离平衡反应多发生在中性的ph范围内,这就决定了在饮用水的应用范围内,水中的主要成分还是次氯酸根离子(clo-)。
根据werdehoff 和singer的研究,在使用二氧化氯进行给水消毒的过程中,大约有0%到70%的二氧化氯被转化成亚氯酸根离子(clo2-),还有30%左右的clo2被转化成氯酸根离子(clo3-)或氯离子(cl-)。
由于其超强的氧化能力,二氧化氯通常被用作初级或是二级消毒剂,并在对水中的气、味控制;含氯消毒副产品的消除;铁、锰离子的氧化,颜色调节以及硫化物和酚类物质的去处方面有着广泛的应用。
作为一种应用水处理中的替代消毒剂,二氧化氯对于病毒,细菌等微生物的抑制能力要超出氯气和氯氨类消毒剂。
1.2二氧化氯的制取。
因为二氧化氯具有较强的膨胀性并且在压力下容易发生爆炸,因此二氧化氯不可以被压缩或是简单的以气态的形式储存。
通常的情况下,二氧化氯多数是在现场制取。
在给水消毒的应用过程中,二氧化氯可以通过利用亚氯酸盐(如naclo2)分别与氯气(cl2)、次氯酸(hocl)或是盐酸(hcl)直接反应而生成二氧化氯。

二氧化氯与次氯酸钠消毒效果比选消毒是水处理工艺中的重要组成部分。
消毒方法大体可分为两类:物理方法和化学方法。
物理方法主要有加热、冷冻、辐照、紫外线和微波消毒等方法。
化学方法是利用各种化学药剂进行消毒,常用的化学消毒药剂有多种氧化剂如氯、臭氧、碘高锰酸钾等、某些重金属离子(银、铜等)及阳离子型表面活性剂等。
其中二氧化氯消毒、次氯酸钠消毒工艺属于化学方法消毒。
次氯酸钠为一种强氧化剂,在水溶液中生成次氯酸离子,通过水解反应生成次氯酸,具有与其他氯的衍生物相同的氧化和消毒作用,消毒效果不如Cl2强。
但是采用次氯酸钠消毒会产生较多的消毒副产物,如三氯乙酸、二氨乙酸、氯仿等。
次氯酸钠由于所含的有效氯易受阳光、温度的影响而分解,一般采用次氯酸钠发生器现场制取,操作简单。
次氯酸钠含有效氯6-11mg/mL。
每产生1kg有效氯,耗食盐量为3-4.5kg,耗电量为5-10kW小时,其成本低。
次氯酸钠具有原材料价格低,刺激味小的优点,但其氧化性较差,脱色过程投加量大,接触时间长。
二氧化氯易溶于水,不与水发生化学反应;其溶解度是氯的5倍而且不产生三卤甲烷等消毒副产物。
二氧化氯具有易爆炸,易挥发的特性,不宜储存,一般采用现场制取和使用。
二氧化氯不与氨氮等化合物作用而被消耗,故具有较高的余氯,杀菌消毒效果比氯更强。
Ph=6.5时,氯的灭菌效率比二氧化氯高,随着Ph提高,二氧化氯的灭菌效率将很快超过氯。
二氧化氯在较广泛的Ph范围内具有氧化能力,氧化能力为氯的二倍。
能比氯更快地氧化锰、铁,除去氯酚、藻类等引起的嗅味,具有强烈的漂白能力,可去除色度。
二氧化氯与次氯酸钠消毒与去除色度的优缺点见下表二氧化氯与次氯酸钠消毒方法的比较消毒方案二氧化氯消毒本工程处理水量Q=60000m3/d,加氯点设在清水池进水管,设计最大投氯量为10mg/L。
加氯间主要设备:自动高效复合二氧化氯发生器设备参数:Q=10.0kg/h,N=3.0Kw设备套数:4台,3用1备卸酸泵设备参数:N=1.50 Kw设备台数:1台化料器设备参数:N=1.5kw设备台数:1台。

臭氧、次氯酸钠、二氧化氯消毒剂的比较作者:佚名文章来源:本站原创点击数:240 更新时间:2006-9-16次氯酸钠、二氧化氯和臭氧的比较目前,从水体消毒的种类来说,有氯气、次氯酸钠、漂白粉、三氯异氰尿酸(二氯异氰尿酸钠)、二氧化氯、双氧水、臭氧等药剂和方式,此外还有紫外线消毒等一些手段。
由于氯气在运输、存储方面存在安全隐患;在定量投加方面,因氯气在水中的溶解度较低,氯气容易散失,使得水中留存余量难以达到标准;同时,氯气瓶气压不断变化,存在投加计量不够准确的问题;氯气具有极强的扩散性,对环境存在毒害作用;游离氯的高活性容易形成许多象四氯化碳一类的致癌物质,故而,在常规消毒领域,取消液氯的主张越来越多,也日益受到人们的关注。
就拿氯气的安全性来说,就始终是一个让人时时警觉的问题。
在我国,几乎每年都有氯气罐泄漏的安全事故发生。
氯气作为危险品受到各国安全机关的严格管制。
前些年,发生在福建三明火车站氯气瓶运输中的跑氯事件,造成几千人的紧急疏散;在北京有些游泳场由于操作人员不谨慎,三分钟的跑氯,就有37名孩子住进医院。
2005年3月29日18时50分,江苏省淮安市境内,一辆山东鲁H-00099装有液氯危险品的运输车,行至京沪高速公路上行线103KM+300M处,与一辆鲁QA0938货车相撞,导致鲁H-00099侧翻液氯泄漏。
截止3月31日8时,此事故已造成28人中毒死亡,285人被送往医院救治。
事故发生后,有关部门立即组织疏散村民群众近1万人,造成京沪高速公路宿迁至宝应段关闭20个小时。
我国的天津地区就明确规定公共娱乐场所禁用氯气进行消毒。
在国外许多发达国家,如美国、德国、日本等对氯气的使用有严格的限制,氯气主要用于污水处理。
而公用场所和中小型自来水厂一般不再使用液氯,而多使用次氯酸钠液体进行消毒。
当然,也可根据用水量的情况,采用其它消毒方法。
如小量饮用水的消毒就可以采用诸如紫外线、臭氧、双氧水等手段进行灭菌杀毒。

电厂补给水和循环水杀菌除藻中次氯酸钠和二氧化氯的比较河北乾元电力科技有限公司一、简述在火力发电厂补给水、循环水等水处理过程中,杀菌除藻是主要措施之一。
在90年代以前液氯作为主要的杀菌除藻剂广泛应用于电厂水处理,主要加氯设备为加氯机。
从90年代中期开始,次氯酸钠发生器开始进入电厂水处理领域,并广泛推广应用。
本世纪初二氧化氯作为新一代杀菌剂开始应用于电厂水处理。
二氧化氯作为新一代杀菌剂与次氯酸钠相比具有很大的优势。
为了使二氧化氯这一新技术在电厂尽快推广,下面就以DH系列二氧化氯发生装置和次氯酸钠发生器在技术性能上、运行方式上和经济性诸方面进行比较。
二、药剂杀菌除藻效果比较1、火力发电厂水处理系统杀菌除藻要求:杀菌效果强于传统的杀菌除藻剂;杀菌除藻效果不受PH值的影响;具有较长的维持杀菌消毒能力的时间;无毒无害,操作安全性高;2、杀菌机理与性能比较次氯酸钠溶液为淡黄色或无色液体,分子式为NaClO,有效氯含量为0.953。
其杀菌原理是在酸性或微酸性环境下,次氯酸钠在水中以次氯酸分子的形态存在,次氯酸分子极易穿透微生物细胞,具有较强的杀菌效果;次氯酸钠的杀菌过程以氯代反应为主。
二氧化氯溶液为黄色或淡黄色液体,分子式为ClO2,有效氯含量为2.63。
二氧化氯以分子态在水中存在,其分子以对微生物细胞的高穿透力和强氧化性迅速杀灭微生物。
二氧化氯作为第四代高效、广谱杀菌剂,杀菌过程为氧化还原反应,杀菌速率快,杀菌效果是次氯酸钠的4~5倍。
3、环境对杀菌效果影响次氯酸钠杀菌效果受PH值的影响很大,在碱性环境下NaClO以次氯酸根的形态存在,杀菌效果大幅度下降。
而电厂水处理水质一般均呈碱性,次氯酸钠杀菌效果较差已成为共识。
以分子态溶解于水中的二氧化氯,其杀菌效果基本不受水质PH值的影响。
在水质较差微生物含量较高或污染较严重的情况下,由于次氯酸钠杀菌速率较慢,杀菌效果也很差。
而二氧化氯由于氧化性强杀菌速度快,在水质差的情况下更凸现其杀菌的高效性能。
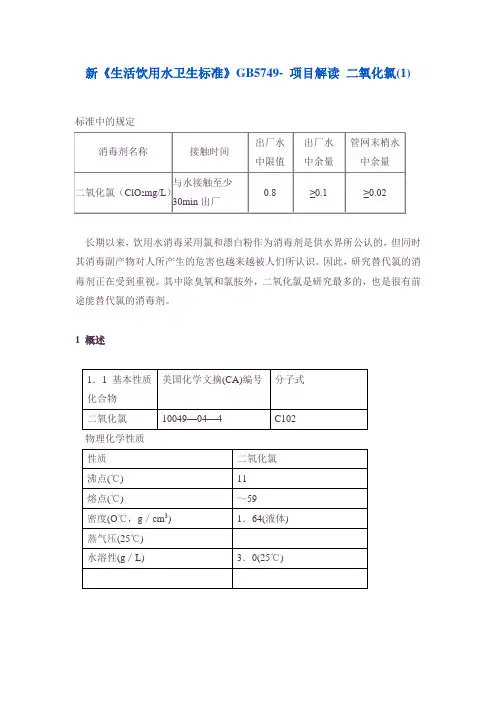
新《生活饮用水卫生标准》GB5749- 项目解读 二氧化氯(1)标准中的规定长期以来,饮用水消毒采用氯和漂白粉作为消毒剂是供水界所公认的,但同时其消毒副产物对人所产生的危害也越来越被人们所认识。
因此,研究替代氯的消毒剂正在受到重视。
其中除臭氧和氯胺外,二氧化氯是研究最多的,也是很有前途能替代氯的消毒剂。
1 概述物理化学性质二氧化氯为带有浅绿色的黄色有毒气体,其味道比氯更大。
在工作区域空气中的极限允许浓度(以蒸汽计)为0.1g/L(一级危险度),有刺激性,对呼吸道有刺激作用。
感官性质水中二氧化氯的味阈值和嗅阈值为0.4mg/L。
1.2 主要用途二氧化氯用于水的消毒及控制水的气味/味道;可用作纤维素、纸浆、面粉和油的消毒剂;亦可做皮革的清洗和去鞣剂。
二氧化氯的消毒应用历史也超过50年,但真正被重视和应用还是在上世纪70年代以后,即人们认识到有机卤代物的危害及氯化消毒副产物的产生以后。
二氧化氯具有广谱杀菌性,对绝大多数细菌和病原微生物均有很好的杀灭效果,尤其对芽孢和病毒效果更明显。
其杀菌活性在很宽的pH范围内都比较稳定(pH4--10),在水中的扩散速度比氯快、渗透能力比氯强,特别是在低浓度时。
除高效杀灭微生物作用外,它还有高选择性的优点,即几乎不与水中的有机物作用产生有害的卤代有机物,其有机副产物主要是低分子量的乙醛和羧酸,其无机副产物主要是次氯酸盐,其次是氯酸盐和氯化物。
2环境水平和人体摄入途径在处理水中二氧化氯可以很快的分解为亚氯酸盐、氯酸盐和氯离子,其中亚氯酸盐占多数。
碱性条件下分解速度会加快。
二氧化氯的摄入主要来源于饮用水。
在中性和碱性条件下ClO2能产生C102-和ClO3-:2Cl02+20H-→Cl02-+Cl03-+H20在酸性条件下:Cl02+e→Cl02-由于二氧化氯的不稳定性.使得商业上不便制成压缩气体或浓缩液,必须现场制备:为此人们开发出稳定性二氧化氯,其有效二氧化氯含量在2%以上(W/V)。


自来水消毒标准随着城市化进程的加快,自来水已成为人们生活中不可或缺的资源。
然而,在自来水输送过程中,可能会受到污染,威胁人体健康。
因此,自来水消毒已成为供水处理过程中必不可少的一个环节。
本文将详细介绍自来水消毒标准的各个方面。
一、消毒剂选择自来水消毒剂应具备高效、广谱、安全、稳定等特点,且对人体和环境不产生危害。
常用的自来水消毒剂包括氯气、次氯酸盐、二氧化氯、臭氧等。
其中,氯气和次氯酸盐是最常用的消毒剂,具有消毒效果好、成本低等优点,但会产生消毒副产物。
二氧化氯和臭氧则具有较高的氧化能力和杀菌能力,但成本较高,臭氧还有可能产生二次污染。
在实际应用中,应根据具体情况选择合适的消毒剂。
例如,对于大型自来水厂,可选用次氯酸盐或氯气进行消毒;对于小型自来水厂或农村地区,可选用氯气或漂白粉等成本较低的消毒剂。
二、投加量确定消毒剂投加量的计算主要考虑消毒剂的杀菌能力、自来水中细菌含量以及出水水质要求等因素。
一般而言,消毒剂的投加量应按照以下步骤确定:检测自来水中的细菌含量,如总大肠菌群数等指标。
根据细菌含量确定需要去除的细菌数量。
选择具有相应杀菌能力的消毒剂。
测定消毒剂的浓度和投加量。
根据实际情况调整投加量,确保出水水质达到国家标准。
具体计算方法可参考相关规范或手册。
例如,次氯酸钠溶液的投加量可按照公式:投加量(mg/L)=(需要去除的细菌数/消毒剂的杀菌率)/原水流量(L)进行计算。
三、消毒设备选型消毒设备主要有液氯消毒、次氯酸钠消毒、二氧化氯消毒、紫外线消毒、臭氧消毒等类型。
各类型设备的适用场景和优缺点如下:液氯消毒设备:设备简单、价格便宜、消毒效果良好,但存在安全隐患及副产物问题。
适用于大型自来水厂。
次氯酸钠消毒设备:设备简单、运行稳定、安全性高、无副产物,但存在成本较高、储存危险等问题。
适用于各类自来水厂。
二氧化氯消毒设备:具有氧化能力强、杀菌效果好、副产物少等优点,但设备成本高、运行维护复杂。
适用于对水质要求较高的自来水厂。

二氧化氯的消毒原理
二氧化氯是一种常用的消毒剂,其消毒原理主要是通过氯气的释放和氧化作用
来达到杀灭细菌、病毒和其他微生物的目的。
二氧化氯在水中溶解后会形成次氯酸和盐酸,这两种物质都具有强烈的氧化性,能够破坏微生物的细胞膜和蛋白质,从而达到消毒的效果。
首先,二氧化氯能够释放氯气,氯气是一种强氧化剂,具有很强的杀菌能力。
当二氧化氯与水接触时,会释放出氯气,氯气能够迅速氧化微生物的细胞膜和蛋白质,破坏其结构,导致微生物死亡。
此外,氯气还能与微生物的DNA和RNA发
生化学反应,阻断其生长和繁殖,从而达到消毒的效果。
其次,二氧化氯本身也具有一定的氧化性。
二氧化氯在水中会形成次氯酸和盐酸,其中次氯酸是一种强氧化剂,能够直接氧化微生物的细胞膜和蛋白质,使其失去活性。
盐酸则能够改变微生物的酸碱平衡,破坏其细胞内环境,导致微生物死亡。
此外,二氧化氯还具有一定的选择性。
相比于传统的氯气和次氯酸,二氧化氯
对人体和环境的刺激性更小,对水质的影响也更小。
因此,二氧化氯成为了很多场合的理想消毒剂,如饮用水消毒、游泳池消毒、食品加工消毒等。
总的来说,二氧化氯的消毒原理主要是通过释放氯气和产生次氯酸、盐酸等氧
化剂,破坏微生物的细胞结构和代谢过程,从而达到消毒的效果。
它具有杀菌效果强、消毒速度快、残留物少、对环境影响小等优点,因此在实际应用中得到了广泛的应用。
希望本文能够对二氧化氯的消毒原理有一个清晰的认识,以及对其在实际应用中的重要性有一个更深入的了解。
几种重要的无机氯系消毒剂张亨锦西化工研究院 辽宁葫芦岛 125000摘要:无机氯系消毒剂包括氯气、次氯酸、次氯酸盐类、亚氯酸钠、二氧化氯、氯化磷酸三钠等。
介绍了多种无机氯系消毒剂的物化性质、生产工艺和消毒杀菌应用情况。
关键词:无机氯系消毒剂;性质;工艺;用途 Several Important Inorganic Chloro-Based DisinfectantsZhang Heng(Jinxi Research Institute of Chemical Industry , Huludao , Liaoning 125000)Abstract:Inorganic chloro-based disinfectants include chlorine, hypochlorous acid,hypochlorite,sodium chlorite , chlorine dioxide , chlorinated sodium phosphate ,et al . The characters , production process and disinfection application situation of several inorganic chloro-based disinfectants have been introduced in this article.Key words:inorganic chloro-series disinfectant;character;process;application消毒剂[1]是指起消毒作用、杀菌作用和防腐作用的化学物质。
消毒作用可毁灭引起感染的病原微生物,但不一定能毁灭一切微生物或其芽孢;杀菌作用是指毁灭引起感染的病原微生物;防腐作用是指抑制感染性病原微生物的生长和繁殖,而不一定杀死它们。
消毒剂和防腐剂没有本质区别,在使用时仅是浓度有差异;消毒剂和杀菌剂在英文中原本就是同一个词。
氯及其化合物【十一大题型】【新高考通用】【知识点1氯气和含氯化合物的性质】【知识点2氯气的实验室制法】【知识点3卤素的性质 卤素离子的检验】【知识点4氯、溴、碘单质的制取】【题型1氯气的性质】【题型2氯水的性质】【题型3次氯酸及次氯酸盐】【题型4氯气的实验室制法】【题型5二氧化氯的性质和制备】【题型6含氯物质的转化和二维图】【题型7卤素单质性质探究】【题型8卤素的相关实验】【题型9卤素离子的检验】【题型10离子方程式与离子共存】【题型11卤素的提取与工艺流程】【过关测试】考点要求真题统计考情分析1.结合真实情境中的应用实例或通过实验探究,了解氯及其重要化合物的主要性质。
2.认识氯及其重要化合物在生产中的应用和对生态环境的影响。
结合实例认识氯水及其化合物的多样性。
3.认识氯及其化合物的转化、自然资源综合利用和环境保护中的重要价值。
4.结合真实情境中的应用实例或通过实验探究,了解氯、溴、碘及其化合物的主要性质、制备。
2024·安徽卷,3分;2024·辽宁卷,3分;2024·浙江卷,2分;2024·江苏卷,3分;2024·甘肃卷,3分;2023广东卷,T 13;2023北京卷,3分;2023上海卷,3分;2023重庆卷,3分;2023辽宁卷,3分;2023江苏卷,3分;2023北京卷,3分;2023辽宁卷,3分;2023全国乙,3分;2023北京卷,3分;2023上海卷,3分;2022广东卷,3分;2022北京卷,3分;2022广东卷,3分;2022山东卷,3分;2022全国甲,3分;2023年1月浙江,2分;2023年6月浙江,2分;2022年1月浙江,2分;近几年高考常结合实验或工艺流程考查Cl 2、HClO 、等的制备、性质及含量测定,以海水提溴、海带提碘、氯碱工业等为载体,考查物质的制备与提纯,具有一定的综合性与创新性。
预测2025年高考会结合新情境考查氯及其化合物的制备及性质,以溴、碘的制备为载体,考查微型实验或探究型实验,重点考查实验能力、解决问题的能力。
氯化物液态氯、次氯酸盐、无机氯胺、有机氯胺、二氧化氯都可作为杀菌剂,但它们的抗菌活性有所不同。
将氯气慢慢通入水中可形成具有抗菌作用的次氯酸盐(HOCl)。
液态氯是次氯酸钠溶液(NaOCl),作为杀菌剂次氯酸的效力是等浓度次氯酸盐离子的80倍。
但是氯作为抗菌剂的活性还没有得到充分的确定。
次氯酸是氯化物中活力最强的,它通过对在碳水化合物代谢中起重要作用的酶分子中的巯氢基团进行氯氧化作用,以抑制葡萄糖氧化反应的发生,从而杀死微生物细胞。
因为醛缩酶在新陈代谢中的重要性质,所以认为它是主要的被作用部位。
氯作用的其它方式可能是:(1)破坏蛋白质复合物;(2)氨基酸氧化脱羧形成亚硝酸和醛;(3)与核酸、嘌呤、嘧啶反应;(4)破坏关键酶造成不平衡新陈代谢;(5)诱导DNA损伤,造成DNA-转变的丧失;(6)抑制氧的吸收和氧化磷酸化,并且使某些大分子泄露;(7)胞嘧啶的毒性N-氯代衍生物的形成;(8)造成染色体畸变。
营养细胞吸收的是自由氯而不是结合氯,因此,细胞原生质中氯胺的形成不会引起内部的破坏,在有氯存在下使用32P显示出在微生物细胞膜中出现了破坏性的永久变化。
Camper和McFetters(1979)的研究证明了氯攻击细胞膜的功能性,特别是胞外营养物的运输,同时,标记过的碳水化合物和氨基酸不能被经氯处理过的细胞吸收。
Benarde 等(1965)曾采用14C-标记氨基酸,揭示了二氧化氯破坏大肠杆菌中的蛋白质合成物,但他并没有指出破坏程度。
氯的释放成分能刺激芽孢发芽,然后使萌芽的芽孢失活。
Kulikoosky 等(1975)研究认为,氯通过改变芽孢的外层覆盖物并释放出其中的Ca2+、吡啶二羧酸(DPA)、RNA和DNA来改变芽孢的渗透性。
颗粒状的氯杀菌剂是基于含有吸附在有机载体上可释放出离子的盐。
氯化异腈是一种高稳定性,快速溶解的氯载体,它可以释放出两个氯离子中的任一个,并在水溶液中形成NaOCl。
对这类产品,通过调节与固体氯载体混合的缓冲液的最适pH值来控制抗菌活性、腐蚀特征以及杀菌剂溶液的稳定性。
二氧化氯和次氯酸的关系
一、二氧化氯和次氯酸的关系
二氧化氯和次氯酸是一对有机化学中的重要物质,它们之间存在着密切的关系。
1、二氧化氯是次氯酸的前体物质。
次氯酸是一种有机酸,它是由二氧化氯和氢氧化钠反应生成的,即:2NaOH + Cl2 → NaClO + NaClO2。
2、次氯酸可以用来制备二氧化氯。
次氯酸可以通过电解反应制备二氧化氯,即:2NaClO2 → Cl2 + 2NaOH。
3、二氧化氯和次氯酸都可以用来消毒。
二氧化氯是一种有效的消毒剂,可以杀死细菌、病毒和真菌,而次氯酸也可以用来消毒,但它的消毒效果不如二氧化氯。
4、二氧化氯和次氯酸都可以用来防腐。
二氧化氯可以有效地抑制有害微生物的生长,而次氯酸也可以用来防腐,但它的防腐效果不如二氧化氯。
5、二氧化氯和次氯酸都可以用来清洗。
二氧化氯可以有效地去除污垢和污渍,而次氯酸也可以用来清洗,但它的清洗效果不如二氧化氯。
综上所述,二氧化氯和次氯酸之间存在着密切的关系,它们可以相互转化,并可以用来消毒、防腐和清洗。
试剂与水中的氯反应的原理试剂与水中的氯反应的原理涉及到水中氯化物离子(Cl-)和试剂之间的化学反应。
下面将详细介绍几种常见的试剂与水中氯反应的原理。
1. 亚硫酸氢钠(NaHSO3)反应原理:亚硫酸氢钠与水中的氯化物反应生成亚硫酸盐和盐酸。
反应式如下:2NaHSO3 + 2Cl- + H2O →Na2SO3 + 2HCl亚硫酸氢钠是一种还原剂,具有强还原性。
它可以将氯化物氧化为氯气,同时自身被氧化为亚硫酸盐。
这个反应在分析化学实验中常用于测定水样中氯离子的含量。
2. 二氧化锰(MnO2)反应原理:二氧化锰与水中的氯化物反应生成氧气和锰离子。
反应式如下:2MnO2 + 4Cl- + 4H+ →2Mn2+ + 2H2O + Cl2二氧化锰是一种氧化剂,具有很强的氧化性。
它可以将氯化物氧化为氯气,同时自身被还原为锰离子。
这个反应在分析化学实验中常用于检测水样中氯离子的含量。
3. 二氯化三碘化铁(FeCl3·6I3)反应原理:二氯化三碘化铁与水中的氯化物反应生成三碘化物离子和六氯代铁(III)离子。
反应式如下:FeCl3·6I3 + 3Cl- →6I- + FeCl6-这个反应是一种沉淀反应。
二氯化三碘化铁与氯化物反应后生成的FeCl6-离子具有显著的颜色变化,可通过光学方法进行检测。
这个反应在水样中氯离子的分析中常用于定性和定量分析。
4. 二氧化氯(ClO2)反应原理:二氧化氯与水中的氯化物反应生成次氯酸盐、次氯酸和盐酸。
反应式如下:ClO2 + Cl- + H2O →ClO- + HCl二氧化氯是一种强氧化剂,它可以将氯化物氧化为次氯酸盐和次氯酸。
这个反应在水处理过程中常用于消毒和氯化物去除。
总结:上述所列举的试剂与水中氯的反应原理涉及到氧化还原反应、沉淀反应和酸碱中和反应等。
通过这些反应原理,我们可以通过实验方法或分析方法来定量或定性分析水中氯离子的含量,同时也可以用于水处理过程中对氯化物的去除和消毒等操作。
次氯酸分解的离子方程式
次氯酸(HClO2)是一种强氧化剂,可以分解为氯化钾和二氧化氯。
其分解反应的离子方程式可以表示为:
2HClO2->2KCl+Cl2O2+H2O
该反应可以在酸性条件下进行,其中酸是次氯酸(HClO2)。
下面将详细解释该反应的步骤和原理。
首先,次氯酸(HClO2)在溶液中会完全离解为氢离子(H+)和次氯酸根离子(ClO2-):
HClO2->H++ClO2-
接下来,氢离子(H+)和次氯酸根离子(ClO2-)与氯化钾(KCl)反应,生成氯化钾和氯离子(Cl-):
2KCl+H++ClO2-->2K++Cl-+HClO2
然后,次氯酸(HClO2)进一步分解为氯化钾和二氧化氯(Cl2O2):2HClO2->2KCl+Cl2O2+H2O
最后,生成的氯化钾溶于水形成K+和Cl-离子,而二氧化氯溶于水形成二氧化氯酸(HClO2)和H2O:
KCl+H2O->K++Cl-+H2O
Cl2O2+H2O->HClO2+H2O
因此,次氯酸分解反应的完整离子方程式可写为:
2HClO2->2KCl+Cl2O2+H2O
综上所述,次氯酸在酸性条件下可以分解为氯化钾和二氧化氯。
该反应不仅可以用于氧化和漂白剂的制备,还可以用于研究和理解酸性条件下氧化剂的性质和反应机制。
次氯酸及其盐、二氧化氯(ClO 2)
1.次氯酸(HClO)
(1)不稳定性
次氯酸分解反应的化学方程式为2HClO=====光照
2HCl +O 2↑。
(2)强氧化性
①能将有色物质氧化为无色物质,作漂白剂。
②杀菌、消毒。
(3)弱酸性 向NaClO 溶液中通入少量CO 2,离子方程式为 ClO -
+CO 2+H 2O===HCO -
3+HClO 。
[注意] 向NaClO 溶液中通入CO 2(无论是少量还是过量),均生成HCO -
3和HClO 。
原因是酸性:H 2CO 3>HClO>HCO -
3。
2.次氯酸盐 (1)漂白液
(2)漂白粉
[注意] ①向Ca(ClO)2溶液中通入少量CO 2,发生的反应为Ca 2+
+2ClO -
+CO 2+H 2O===CaCO 3↓+2HClO 。
②向Ca(ClO)2溶液中通入SO 2,生成的是CaSO 4而不是CaSO 3。
③次氯酸盐(ClO -
)无论是在酸性、碱性还是中性条件下,均具有强氧化性,均能氧化I -
、
Fe 2+
、SO 2-
3、S 2
-等还原性离子。
3.二氧化氯(ClO 2)
ClO2为一种饮用水消毒剂,其原理是因为ClO2为强氧化剂。
ClO2易溶于水难溶于有机溶剂。
可以用NaClO2与Cl2反应制备。
[细练过关]
1.下列说法正确的是________(填序号)。
①次氯酸见光易分解,故氯水保存时要避光
②次氯酸的漂白和消毒体现了次氯酸强还原性
③氯水能漂白的原因是氯水中含有Cl2
④次氯酸钠溶液呈碱性的理由为ClO-+H2O HClO+OH-
⑤“84”消毒液的消毒原理与H2O2的相同,都是利用强氧化性
⑥漂白粉溶液在空气中失效的离子方程式:
ClO-+CO2+H2O===HClO+HCO-3
答案:①④⑤
2.用漂白粉溶液浸泡过的有色布条,如果晾置在空气中,一段时间后,其漂白效果会更好的原因可能是() A.漂白粉被氧化了
B.漂白粉跟空气中的CO2和水蒸气充分反应,生成了HClO
C.有色布条被空气中的氧气氧化了
D.漂白粉溶液蒸发掉部分水,其浓度增大
解析:选B漂白效果会更好,说明生成了HClO,即漂白粉溶液与空气中的CO2和水蒸气发生了反应:Ca(ClO)2+CO2+H2O===CaCO3↓+2HClO。
3.下列关于氯的化合物的说法正确的是() A.NaClO溶液中通入少量CO2反应的离子方程式为2ClO-+CO2+H2O===2HClO+CO2-3
B.ClO2具有还原性,可用于自来水的杀菌消毒
C.次氯酸盐具有氧化性,所以可用漂白粉漂白织物
D.漂白粉在空气中久置变质,原因是漂白粉中的CaCl2与空气中的CO2反应生成CaCO3解析:选C A项,酸性H2CO3>HClO>HCO-3,当通入少量CO2时,不能生成CO2-3,应生成HCO-3;B项,ClO2具有氧化性,能杀菌;D项,漂白粉变质是Ca(ClO)2与CO2、水蒸气反应变成CaCO3。
4.二氧化氯(ClO2)是一种新型的环保饮用水消毒剂,某课题小组拟选择如图所示部分装置制备并收集二氧化氯来探究其漂白性(装置不可重复使用)。
已知:①常温下,亚氯酸钠(NaClO 2)与氯气反应的生成物之一为二氧化氯;②常温常压下,ClO 2是一种易溶于水而难溶于有机溶剂的气体。
回答下列问题:
(1)制备干燥、纯净的氯气:气体发生装置是__________(填字母),反应的离子方程式为____________________________________________________________________________。
(2)制备二氧化氯:导管口连接顺序为a →______________→n →p →j 。
本实验选择装置I 而不选择装置H 的原因是____________________________________________________。
(3)写出装置G 中发生反应的化学方程式:________________________________________
____________________________________________________________________________。
(4)装置E 的作用是_________________________________________________________。
(5)请设计简易实验证明二氧化氯具有永久的漂白性: _____________________________ ___________________________________________________________________________。
(6)二氧化氯还会与H 2O 2和NaOH 的混合溶液反应,其产物之一是NaClO 2。
写出该反应的
化
学
方
程
式
:
________________________________________________________________
____________________________________________________________________________。
解析:(1)若用MnO 2作氧化剂制备Cl 2,则气体发生装置应选取装置A ,因该反应需加热;若用KMnO 4作氧化剂,则气体发生装置应选取装置B ,因该反应不需要加热。
反应的离子方程式分别为MnO 2+4H +
+2Cl -
=====△
Mn 2++Cl 2↑+2H 2O 、2MnO -4+16H ++10Cl
-
===2Mn 2+
+5Cl 2↑+8H 2O 。
(2)制备ClO 2的过程:制备Cl 2,除去Cl 2中HCl 杂质,用装置C 中的浓硫酸进行干燥,用装置G 中的NaClO 2与Cl 2反应生成ClO 2和NaCl ,用装置E 中的CCl 4除去多余的Cl 2,用装置F 收集ClO 2,用装置I 吸收有毒尾气,装置I 还起到防止空气中的水蒸气进入到装置F 中的作用。
故导管口的连接顺序为a →z →m →x →y →b →c →r →s →n →p →j 。
装置I 与装置H 的不同之处在于装置I 可防止空气中的水蒸气进入装置F 中,而装置H 中盛有烧碱溶液,其中的水蒸气可进入装置F 中,且可能会引起倒吸。
(3)装置G 中制备ClO 2发生反应的化学方程式为Cl 2+2NaClO 2===2ClO 2+2NaCl 。
(4)装置E 中的CCl 4可吸收ClO 2中的Cl 2,起到净化ClO 2的作用。
(5)可用品红溶液来验证二氧化氯的漂白性。
(6)由题意可知反应物为ClO 2、NaOH 、
H 2O 2,产物之一是NaClO 2,根据氧化还原反应原理及原子守恒可知其余的产物为O 2、H 2O ,故该反应的化学方程式为2ClO 2+2NaOH +H 2O 2===2NaClO 2+O 2+2H 2O 。
答案:(1)A MnO 2+4H +
+2Cl -
=====△
Mn 2++Cl 2↑+2H 2O(或B 2MnO -4+16H +
+10Cl
-
===2Mn 2+
+5Cl 2↑+8H 2O)
(2)z →m →x →y →b →c →r →s 装置H 中的水蒸气会进入装置F 中,且可能会引起倒吸 (3)Cl 2+2NaClO 2===2ClO 2+2NaCl (4)吸收二氧化氯中的氯气
(5)取少量品红溶液于试管中,通入二氧化氯,观察到品红溶液褪色,再加热已褪色的溶液,溶液不变红色
(6)2ClO 2+2NaOH +H 2O 2===2NaClO 2+O 2+2H 2O。