第五章 不对称环氧化
- 格式:pptx
- 大小:785.09 KB
- 文档页数:35



烯烃的不对称环氧化反应***** ********摘要本文主要论述了传统的烯烃环氧化反应的不足之处,并简述了Sharpless以及Jacobsen 等人在不对称环氧化反应发面的研究成果及其贡献。
并简要讨论了未来的研究方向。
关键词烯烃环氧化手性合成催化剂前言手性化合物具有十分重要的应用价值,然而其合成具有很大的难度。
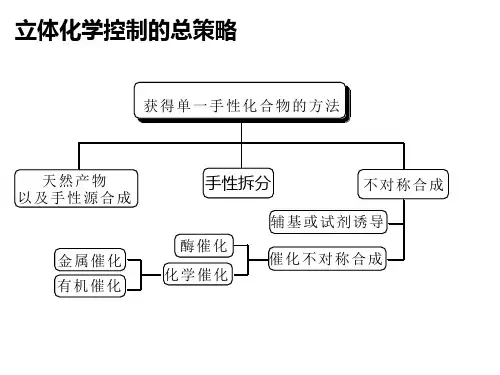
因此,目前有机合成化学家们在手性合成这一领域展开了大量的研究工作,新的不对称合成反应和合成路线不断涌现。
在不对称合成中最具有挑战性的是不对称催化反应,它是利用催化剂的不对称中心来诱导产生产物的手性。
研究类容及讨论通常在没有手性催化剂的条件下,实验室中常用有机过酸作环氧化试剂。
环氧化反应是顺势加成,所以环氧化合物的构型与原料烯烃的构型保持一致。
因为环氧化反应可以在双键平面的任一侧进行,所以当平面两侧空阻相同,而产物的环碳原子为手性碳原子时,产物是一对外消旋体。
当平面两侧的空阻不同时,位阻小的反应快,如此便能得到以某种构型为主的混合产物。
因该方法只能用于大量合成空间位阻较小的产物,并不能满足手性合成的需求,因此化学工作者们作出了进一步探究。
其中最著名的是20世纪80年代初Sharpless发展的不对称环氧化。
在该反应中D-酒石酸二乙酯作为手性源控制环氧化只从双键平面的一边进行。
如果在反应中用L-酒石酸二乙酯,那么环氧化将从双建平面的另一边进行。
只需要催化剂量的光学纯酒石酸二乙酯就可以实现高度对映选择性的环氧化。
【1】图2. Sharpless不对称环氧化反应Sharpless的不对称环氧化适用于双键α位上含羟基的底物——烯丙醇类化合物。
20世纪90年代初,Jacobsen开发了一类含C2对称轴的手性配体,这些配体与Mn(Ⅲ)形成的络合物可以高度对映选择性地催化非烯丙醇类烯烃双键的环氧化。
该反应迅速得到了广泛应用。
图4. Jacobsen不对称环氧化反应反应最常用的氧化剂为亚碘酰苯(用于有机溶剂)或次氯酸钠水溶液(用于水介质)。



sharpless不对称环氧化机理
Sharpless不对称环氧化是一种重要的不对称催化反应,它可以用来合成复杂的有机分子。
Sharpless不对称环氧化机理是由美国化学家K. Barry Sharpless在1980年提出的,它是
一种催化反应,可以用来合成复杂的有机分子。
Sharpless不对称环氧化机理的基本原理是,在一个有机反应体系中,一种特定的催化剂(如铂催化剂)可以诱导一种不对称的环
氧化反应,从而产生一种不对称的有机分子。
Sharpless不对称环氧化机理的催化反应可以分为三个步骤:第一步是催化剂的活化,第
二步是环氧化反应,第三步是催化剂的去活化。
在第一步,催化剂(如铂)被活化,从而
使它能够与有机物质发生反应。
在第二步,催化剂诱导有机物质发生环氧化反应,从而产
生不对称的有机分子。
在第三步,催化剂被去活化,从而结束反应。
Sharpless不对称环氧化机理的优点是,它可以用来合成复杂的有机分子,而且反应的速
度很快,可以在短时间内完成反应。
此外,Sharpless不对称环氧化机理的反应产物具有
高度的不对称性,可以用来合成复杂的有机分子。
总之,Sharpless不对称环氧化机理是一种重要的不对称催化反应,它可以用来合成复杂
的有机分子,而且反应的速度很快,可以在短时间内完成反应,反应产物具有高度的不对
称性。
因此,Sharpless不对称环氧化机理在有机合成中具有重要的应用价值。

不对称环氧化
不对称环氧化是一种化学反应,其中一个双键被氧化为环氧基团。
这种反应通常需要催化剂的存在,例如马来酸和金属催化剂。
不对称环氧化指的是将不对称的双键转化为环氧基团的反应。
这种化学反应具有广泛的应用价值。
例如,在药物合成中,不对称环氧化可以用于制备具有特定立体化学活性的分子。
在材料科学中,不对称环氧化可以用于制备具有不对称结构的聚合物。
此外,不对称环氧化还可以用于制备具有高度对称性的天然产物,例如类胡萝卜素。
总之,不对称环氧化是一种重要的化学反应,其应用广泛,对于化学和材料科学的发展具有重要意义。
- 1 -。


第五章不对称氧化反应氧原子直接与不对称碳原子相连的含氧取代基广泛存在于天然产物和药物中,同时也容易被其它基团如氨基,卤原子,硫原子甚至烷基等取代,成为所合成化合物重要的官能部分。
不对称氧化反应可以直接在反应物中引入含氧取代基,使所连接的碳原子具有手性,是极其重要的一类反应,对这类反应的研究,已经取得了引人瞩目的发展,但仍然是不对称合成研究的重点。
3.1 烯丙醇烯烃的不对称环氧化3.1.1 Sharpless反应及特点烯烃的环氧化最开始使用过酸作氧化剂来完成的,因此很早就有人使用手性的过酸来进行不对称环氧化,但e.e.值一般都低于20%,普遍认为这是由于手性中心离反应中心太远了。
后来发现了过渡金属催化的环氧化反应,因此很多手性配体的金属配合物用于不对称环氧化的研究,但结果都不是特别好。
Sharpless在经过10年多的潜心研究后,终于在1980年发展了高效的金属钛-酒石酸酯不对称环氧化催化剂,这种催化剂适用于非常广泛的烯丙醇类烯烃,具有能和生物酶比美的高的催化活性和对映体选择性,容易得到,价格便宜,自从发现以来广为人们用于合成手性的烯丙醇的环氧化物。
因此,Sharpless 获得了2001年的诺贝尔化学奖。
Sharpless不对称环氧化催化剂使用钛酸异丙酯中的钛作为催化中心,天然或者人工合成的作为手性配体,叔丁基过氧化氢(TBHB)为供氧剂,以无水的二氯甲烷为溶剂,在-20o C下对烯丙醇类烯烃进行环氧化,反应一般在24小时左右完成,产率70-90%,对映体选择性大于90%。
Me COOH, Ti(O-i-Pr)22o70 - 90%OR2R1R3OH >90% eeD-(-)-tartrateL-(+)-tartrate将等摩尔的钛酸异丙酯和酒石酸二异丙酯(DIPT)混合,即释放出2当量的异丙醇,同时生成Ti(O-i-Pr)2(DIPT)2配合物。
通过分子量测定,以及红外光谱和核磁共振谱分析,配合物Ti(O-i-Pr)2(DIPT)2是以二聚体的形式存在的。

Jacobsen不对称环氧化反应是有机合成领域中一种重要的反应,它可以有效地将不对称性引入到环氧化合物的合成中。
本文将从反应机理、应用领域和未来发展方向等方面进行详细介绍。
一、反应机理Jacobsen不对称环氧化反应是由美国化学家Jacobsen等人于20世纪90年代初首次提出的。
它的反应机理如下:手性金属配合物与碳碳双键发生配位作用,形成一个活性中间体。
过氧化物与金属配合物发生氧化还原反应,从而实现环氧化合物的合成。
在反应过程中,手性金属配合物起到催化剂的作用,使得环氧化合物具有不对称结构。
二、应用领域Jacobsen不对称环氧化反应在有机合成领域具有广泛的应用。
它可以用于合成医药领域中的药物分子。
由于手性分子在生物活性中起到重要作用,因此能够合成具有不对称结构的环氧化合物对于开发新型药物具有重要的意义。
Jacobsen反应还可以应用于材料领域,合成具有特定空间结构的高分子材料,从而拓展新型功能材料的应用范围。
Jacobsen不对称环氧化反应还在农药合成和天然产物全合成中得到了广泛的应用。
三、未来发展方向随着有机化学合成领域的不断发展,Jacobsen不对称环氧化反应也在不断进行改进和拓展。
未来,可以通过改变金属配合物的结构和配体,提高反应的催化效率和选择性。
另外,还可以探索新的反应底物和反应条件,进一步拓展该反应的应用范围。
结合计算化学和实验方法,研究反应机理,也是未来发展的重要方向之一。
Jacobsen不对称环氧化反应是有机合成领域中一种重要的反应,它可以有效地引入不对称结构,拓展了有机合成的方法和应用领域。
随着有机合成领域的不断发展,相信Jacobsen不对称环氧化反应在未来会有更广阔的应用前景。
四、改进方法为了提高Jacobsen不对称环氧化反应的效率和选择性,研究人员可以通过改进金属配合物的结构和配体,来优化反应条件。
通过设计合适的手性配体,可以提高金属配合物对底物的识别能力,提高反应的立体选择性。
不对称环氧化:
S h a r pless体系(仅对烯丙醇类底物有效)
分子筛存在下,钛酸四异丙酯(Ti(OiPr)4):酒石酸二乙酯(DET)(D或L)用量,,TBHP(叔丁基过氧化氢)。
手性Salen催化体系(催化顺式烯烃环氧化较高选择性):Salen-Mn(III)催化剂,NaClO水溶液、H2O2,亚碘酰苯,
Jacobsen 催化剂
Katsuki 催化剂
手性酮催化体系:
KHSO5为氧化剂,与手性酮原位生成dioxirane,后者可进行不对成环氧化烯烃,
手性金属卟啉催化体系:
负载手性催化体系:
不成熟方法:
手性亚胺盐催化剂
聚氨基酸催化剂
手性季铵盐催化剂
唐除痴周正洪《不对称反应概论》
《不对称催化反应.。