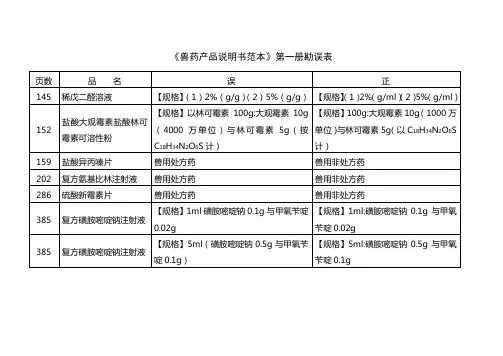
《国家药品标准(1~16)》药品说明书勘误表.xls
- 格式:xls
- 大小:109.50 KB
- 文档页数:32
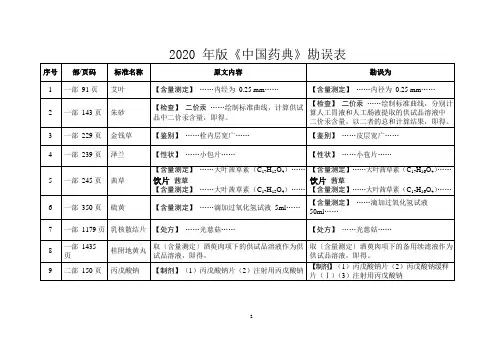
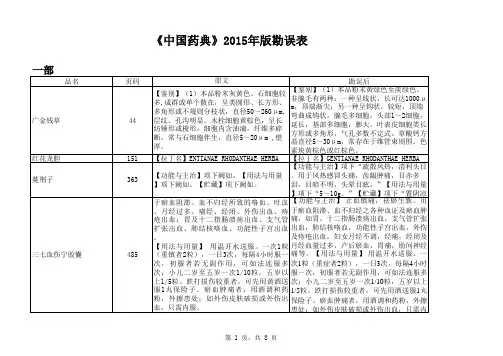
附 件:《中国药典》2015年版勘误表一 部二 部蒿甲醚1452附:杂质Ⅰ 化学名:(3a S,4R,6a S,7R,8S,10R,10a R)-8-甲氧基…….附:杂质Ⅰ 化学名:(3a S,4R,6a S,7R,8R,10R,10a R)-8-甲氧基…….雷贝拉唑钠肠溶胶囊1480英文名:Rabeprazole Sodium Enteric-coated Capsules英文名:Rabeprazole Sodium Enteric Capsules磷酸肌酸钠1568异常毒性 取本品,用注射用水溶解并制成每1ml中含磷酸肌酸钠60mg的溶液,依法检查(通则1141),应符合规定(供无菌分装用)。
异常毒性 取本品,用注射用水溶解并制成每1ml中含磷酸肌酸钠60mg的溶液,依法检查(通则1141),按静脉注射法缓慢给药,应符合规定(供无菌分装用)。
磷酸氢钙片1580【检查】其他 除崩解时限外,应符合片剂项下有关的各项规定(通则0101)。
【检查】其他 应符合片剂项下有关的各项规定(通则0101)。
依托度酸666【检查】有关物质【检查】有关物质雌二醇缓释贴片1507【检查】溶出度 分别取出溶出杯中全部溶液并即时加入温度为37.0℃±0.5℃的溶出介质1000ml,【检查】溶出度 分别取出溶出杯中全部溶液并即时加入溶出介质1000ml,水杨酸108【检查】有关物质各杂质峰面积的和不得大于对照溶液主峰面积(0.2%)。
【检查】有关物质各杂质的和不得大于0.2%。
三 部品 名页码原 文勘误后涂剂21【装量】……【装量】……【装量差异】 除另有规定外,生物制品照通则(0102)中装量差异项进行检查,应符合规定。
二氧化硅455【硫酸盐】……依法检查(通则0801)……【硫酸盐】……依法检查(通则0802)……乙交酯丙交酯共聚物(5050)(供注射用)446四 部第 11 页,共 11 页。

《中国药典》勘误表
摘要:
1.《中国药典》勘误表的背景和意义
2.《中国药典》勘误表的主要内容
3.《中国药典》勘误表的影响和作用
正文:
《中国药典》是我国药品和医疗器械领域的权威性标准,对药品的质量、安全性和有效性有着严格的规定。
然而,随着科学技术的发展和医学研究的深入,人们对药品的认识也在不断更新和完善。
因此,《中国药典》勘误表应运而生,旨在对《中国药典》中可能存在的错误或不完善之处进行修正和完善,以更好地保障公众用药安全。
《中国药典》勘误表的主要内容包括药品名称、剂型、规格、质量标准、检验方法等方面的勘误。
例如,对于药品名称,勘误表可能会对一些容易混淆的药品名称进行澄清,以避免在临床使用中发生误用药的情况。
对于剂型和规格,勘误表可能会对一些已经不再使用或已经淘汰的剂型和规格进行修订,以适应现代医学的发展。
对于质量标准和检验方法,勘误表可能会对一些已经不符合当前药品质量要求的标准和方法进行更新和完善,以确保药品的质量和安全性。
《中国药典》勘误表的影响和作用是深远的。
首先,它体现了我国药品监管部门对药品安全的高度重视和严谨态度,增强了公众对药品安全的信心。
其次,它为药品研发、生产、经营、使用等各个环节提供了科学、准确、可靠的依据,保障了药品的质量和安全。
最后,它推动了药品标准的不断完善和提
高,促进了药品产业的健康发展。
《中国药典》2015年版勘误表
大豆磷脂(供注射用)469【微生物限度】取本品,……每1g供试品
中除细菌、霉菌及酵母菌数不得过
100cfu,……
【微生物限度】取本品,……每1g供试品中
除需氧菌总数、霉菌及酵母菌数不得过
100cfu,……
油酸钠528【微生物限度】……,再用预热至45℃的
无菌氯化钠-蛋白胨冲洗液(pH7.0)冲洗
液冲洗二次,每次100ml,取膜,贴膜培养
检查细菌数;……
【微生物限度】……,再用预热至45℃的无
菌氯化钠-蛋白胨冲洗液(pH7.0)冲洗液冲
洗二次,每次100ml,取膜,贴膜培养检查
需养菌总数;……
粉状纤维素551
续表续表
硅化微晶纤维素559【鉴别】(3)……,缓缓加入钼酸铵溶液
(,……在搅拌下缓缓加入钼酸32ml与水
40ml的混合溶液中,……)2ml,……
【鉴别】(3)……,缓缓加入钼酸铵溶液
(,……在搅拌下缓缓加入硝酸32ml与水
40ml的混合溶液中,……)2ml,……
微晶纤维素605
续表
聚山梨酯80(供注射用)625【脂肪酸组成】……。
分别取肉豆蔻酸甲
酯、棕榈酸甲酯、棕榈油酸甲酯、硬脂酸
甲酯、亚油酸甲酯、亚麻酸甲酯以及油酸
甲酯对照品适量,加正庚烷溶解并制成每
1ml中各含0.1g的溶液,……
【脂肪酸组成】……。
分别取肉豆蔻酸甲酯
、棕榈酸甲酯、棕榈油酸甲酯、硬脂酸甲酯
、亚油酸甲酯、亚麻酸甲酯以及油酸甲酯对
照品适量,加正庚烷溶解并制成每1ml中各
含0.01mg的溶液,……。
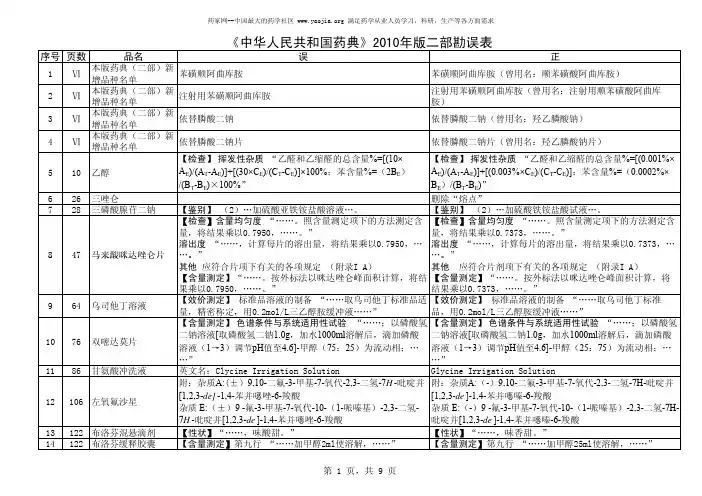
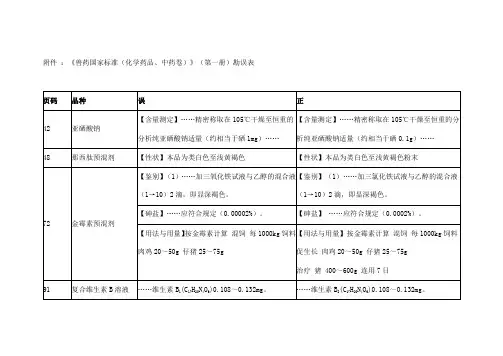
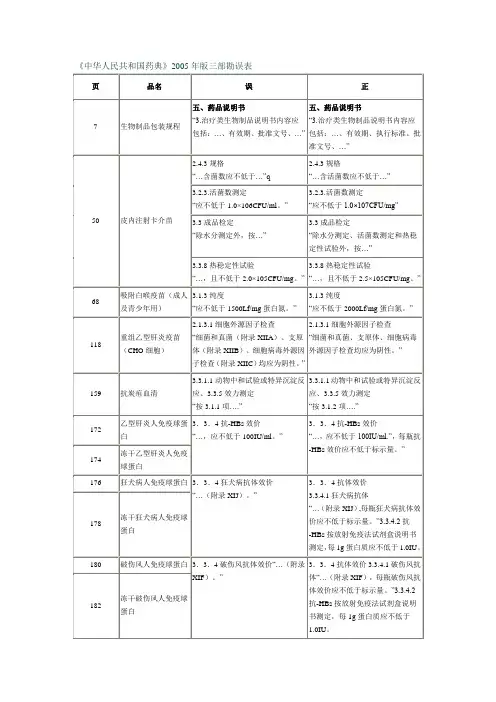
序号页数品名误正1Ⅵ本版药典(二部)新增品种名单苯磺顺阿曲库胺苯磺顺阿曲库胺(曾用名:顺苯磺酸阿曲库胺)2Ⅵ本版药典(二部)新增品种名单注射用苯磺顺阿曲库胺注射用苯磺顺阿曲库胺(曾用名:注射用顺苯磺酸阿曲库胺)3Ⅵ本版药典(二部)新增品种名单依替膦酸二钠依替膦酸二钠(曾用名:羟乙膦酸钠)4Ⅵ本版药典(二部)新增品种名单依替膦酸二钠片依替膦酸二钠片(曾用名:羟乙膦酸钠片)510乙醇【检查】挥发性杂质“乙醛和乙缩醛的总含量%=[(10×A E)/(A T-A E)]+[(30×C E)/(C T-C E)]×100%;苯含量%=(2B E)/(B T-B E)×100%”【检查】挥发性杂质“乙醛和乙缩醛的总含量%=[(0.001%×A E)/(A T-A E)]+[(0.003%×C E)/(C T-C E)];苯含量%=(0.0002%×B E)/(B T-B E)”626三唑仑删除“熔点”728三磷酸腺苷二钠【鉴别】 (2)…加硫酸亚铁铵盐酸溶液…。
【鉴别】 (2)…加硫酸铁铵盐酸试液…。
【检查】含量均匀度“……。
照含量测定项下的方法测定含量,将结果乘以0.7950,……。
”溶出度“……,计算每片的溶出量,将结果乘以0.7950,……。
”【检查】含量均匀度 “……。
照含量测定项下的方法测定含量,将结果乘以0.7373,……。
”溶出度 “……,计算每片的溶出量,将结果乘以0.7373,……。
”847马来酸咪达唑仑片。
其他 应符合片项下有关的各项规定 (附录I A)【含量测定】“……。
按外标法以咪达唑仑峰面积计算,将结果乘以0.7950,……。
”。
其他 应符合片剂项下有关的各项规定 (附录I A)【含量测定】“……。
按外标法以咪达唑仑峰面积计算,将结果乘以0.7373,……。
”964乌司他丁溶液【效价测定】 标准品溶液的制备 “……取乌司他丁标准品适量,精密称定,用0.2mol/L三乙醇胺缓冲液……”【效价测定】 标准品溶液的制备 “……取乌司他丁标准品,用0.2mol/L三乙醇胺缓冲液……”1076双嘧达莫片【含量测定】色谱条件与系统适用性试验 “……;以磷酸氢二钠溶液[取磷酸氢二钠1.0g,加水1000ml溶解后,滴加磷酸溶液(1→3)调节pH值至4.6]-甲醇(75:25)为流动相;……”【含量测定】色谱条件与系统适用性试验“……;以磷酸氢二钠溶液[取磷酸氢二钠1.0g,加水1000ml溶解后,滴加磷酸溶液(1→3)调节pH值至4.6]-甲醇(25:75)为流动相;……”1186甘氨酸冲洗液英文名:Clycine Irrigation Solution Glycine Irrigation Solution12106左氧氟沙星附:杂质A:(±)9,10-二氟-3-甲基-7-氧代-2,3-二氢-7H-吡啶并[1,2,3-de]-1,4-苯并 唑-6-羧酸杂质 E:(±)9 -氟-3-甲基-7-氧代-10-(1-哌嗪基)-2,3-二氢-7H-吡啶并[1,2,3-de]-1,4-苯并 唑-6-羧酸附:杂质A:(-)9,10-二氟-3-甲基-7-氧代-2,3-二氢-7H-吡啶并[1,2,3-de]-1,4-苯并 嗪-6-羧酸杂质 E:(-)9 -氟-3-甲基-7-氧代-10-(1-哌嗪基)-2,3-二氢-7H-吡啶并[1,2,3-de]-1,4-苯并 嗪-6-羧酸13122布洛芬混悬滴剂【性状】“……,味酸甜。

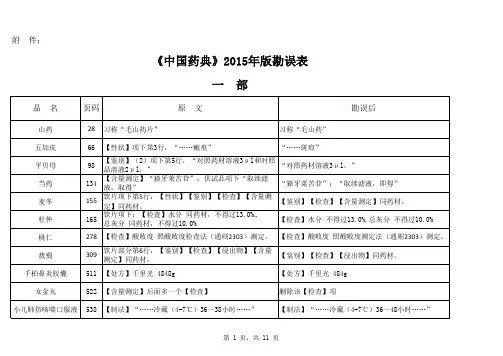
附 件:《中国药典》2015年版勘误表一 部二 部蒿甲醚1452附:杂质Ⅰ 化学名:(3a S,4R,6a S,7R,8S,10R,10a R)-8-甲氧基…….附:杂质Ⅰ 化学名:(3a S,4R,6a S,7R,8R,10R,10a R)-8-甲氧基…….雷贝拉唑钠肠溶胶囊1480英文名:Rabeprazole Sodium Enteric-coated Capsules英文名:Rabeprazole Sodium Enteric Capsules磷酸肌酸钠1568异常毒性 取本品,用注射用水溶解并制成每1ml中含磷酸肌酸钠60mg的溶液,依法检查(通则1141),应符合规定(供无菌分装用)。
异常毒性 取本品,用注射用水溶解并制成每1ml中含磷酸肌酸钠60mg的溶液,依法检查(通则1141),按静脉注射法缓慢给药,应符合规定(供无菌分装用)。
磷酸氢钙片1580【检查】其他 除崩解时限外,应符合片剂项下有关的各项规定(通则0101)。
【检查】其他 应符合片剂项下有关的各项规定(通则0101)。
依托度酸666【检查】有关物质【检查】有关物质雌二醇缓释贴片1507【检查】溶出度 分别取出溶出杯中全部溶液并即时加入温度为37.0℃±0.5℃的溶出介质1000ml,【检查】溶出度 分别取出溶出杯中全部溶液并即时加入溶出介质1000ml,水杨酸108【检查】有关物质各杂质峰面积的和不得大于对照溶液主峰面积(0.2%)。
【检查】有关物质各杂质的和不得大于0.2%。
三 部品 名页码原 文勘误后涂剂21【装量】……【装量】……【装量差异】 除另有规定外,生物制品照通则(0102)中装量差异项进行检查,应符合规定。
二氧化硅455【硫酸盐】……依法检查(通则0801)……【硫酸盐】……依法检查(通则0802)……乙交酯丙交酯共聚物(5050)(供注射用)446四 部第 11 页,共 11 页。
《中国药典》勘误表摘要:I.引言A.介绍《中国药典》B.勘误表的重要性II.勘误表的内容A.药品名称的错误B.药品规格的错误C.药品成分的错误D.药品生产过程的错误E.药品质量标准的错误III.勘误表的产生原因A.人为因素B.技术因素C.信息传递因素IV.勘误表的影响A.对药品生产的影响B.对药品销售的影响C.对患者用药的影响V.应对勘误表的措施A.建立完善的药品监管机制B.提高药品信息的准确性C.及时更新勘误表VI.结论A.总结全文B.强调勘误表的重要性正文:《中国药典》是我国药品行业的重要参考书籍,其中详细记录了各种药品的规格、成分、生产过程和质量标准等内容。
然而,由于各种原因,其中难免会出现一些错误。
为了确保药品的正确使用,及时发现和纠正这些错误就显得尤为重要。
勘误表正是为了达到这个目的而产生的。
通过对《中国药典》中的错误进行梳理和纠正,勘误表能够有效地指导药品生产、销售和用药。
从已公布的勘误表来看,其中包含了药品名称、规格、成分、生产过程和质量标准等多个方面的错误。
这些勘误表的产生原因多种多样,包括人为因素、技术因素和信息传递因素等。
其中,人为因素是最主要的,如编写过程中的疏忽、校对环节的遗漏等。
技术因素和信息传递因素则涉及到药品知识的专业性和复杂性,以及信息传递过程中的失真等。
勘误表的产生对药品生产、销售和用药都产生了影响。
对于药品生产,勘误表能够指导企业及时发现和改正生产过程中的错误,从而提高药品的质量和疗效。
对于药品销售,勘误表能够帮助商家了解药品的最新信息,避免因信息滞后而导致的销售问题。
对于患者用药,勘误表能够提醒医生和药师注意药品的正确使用,避免因错误用药而导致的患者健康问题。
为应对勘误表的产生,我国药品监管部门应采取一系列措施。
首先,应建立完善的药品监管机制,加强对药品信息的审核和管理,从源头上减少错误的出现。
其次,应提高药品信息的准确性,通过多种途径收集和整理药品信息,确保信息的真实性和可靠性。
关于勘误的通知
关于勘误《中国药典》2010年版有关内容的通知
国药典综发〔2010〕246号
各省、自治区、直辖市食品药品监督管理局(药品监督管理局):《中国药典》2010年版即将实施,我委陆续收到反馈意见,涉及执行问题,经审核,部分品种及附录因校对或印刷错误等诸多原因需要勘误。
为确保新版药典的顺利执行,现将勘误表(见附件)予以印发,请及时通知辖区内相关药品生产企业和有关单位遵照执行。
其相关勘误内容,我委将在《中国药典》2010年版第一增补本中予以收载,并尽快正式印发。
同时,我委网站及《中国药品标准》杂志予以公告。
特此通知
附件:《中国药典》2010年版勘误表(一部二部三部)
二〇一〇年九月二十八日
抄送:局药品注册司、药品安全监管司、稽查局,中国药品生物制品检定所、局药品审评中心、认证中心、评价中心、中保办,各省、自治区、直辖市药品检验所,总后卫生部药品仪器检验所。
《中国药典》勘误表摘要:1.《中国药典》勘误表的概述2.《中国药典》勘误表的意义3.《中国药典》勘误表的主要内容4.《中国药典》勘误表的使用方法5.《中国药典》勘误表的启示正文:《中国药典》勘误表是对《中国药典》这部药品规范进行修订和完善的重要工具,它记录了《中国药典》在编辑、出版和使用过程中出现的错误和不足,并提供了正确的信息以供参考。
《中国药典》是我国药品行业的最高规范,它的准确性和权威性对于药品的研发、生产、质量控制和临床使用具有重要的指导作用。
《中国药典》勘误表的意义主要体现在以下几个方面:首先,它保证了《中国药典》的准确性和权威性。
药品规范的准确性对于药品行业的健康发展至关重要,因为错误的规范可能会导致药品质量的下降,甚至危及患者的生命安全。
其次,它为药品行业的从业人员提供了一个重要的学习工具。
通过查阅《中国药典》勘误表,药品研发、生产、质量控制和临床使用的人员可以及时了解和掌握《中国药典》的最新动态,从而提高自己的专业水平。
《中国药典》勘误表的主要内容包括药品名称、规格、质量标准、检验方法等方面的错误和不足。
这些错误和不足可能是由于编辑、排版、印刷等原因造成的,也可能是由于科学技术的进步和药品研究的深入导致的。
无论是哪种情况,都需要通过《中国药典》勘误表来进行修正。
《中国药典》勘误表的使用方法比较简单,只需要在查阅《中国药典》时,同时查阅《中国药典》勘误表,就可以找到正确的信息。
在使用《中国药典》勘误表时,需要注意以下几点:第一,要仔细阅读《中国药典》勘误表的序言,了解《中国药典》勘误表的编排方式和查阅方法;第二,要准确理解《中国药典》勘误表的内容,避免误读和误解;第三,要及时更新《中国药典》勘误表,确保使用的是最新的版本。
通过对《中国药典》勘误表的研究,我们可以得到一些重要的启示。
首先,任何规范都不是完美的,都需要不断地修订和完善。
其次,规范的修订和完善需要及时、准确、公开,以保证规范的准确性和权威性。
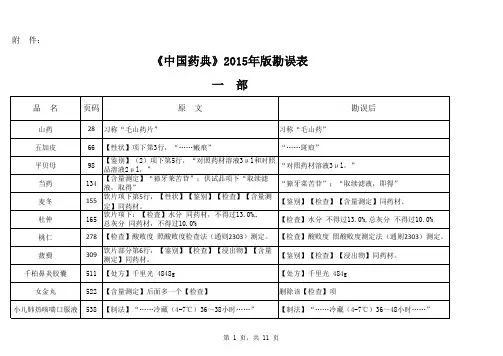
根据药智网药品标准在线查询数据库整理1.中国药典中国药典2010年版一部中国药典2010年版二部中国药典2010年版三部中国药典2010年版一部勘误表中国药典2010年版二部勘误表中国药典2010年版三部勘误表中国药典2005年版一部中国药典2005年版二部中国药典2005年版三部中国药典2005版勘误一部中国药典2005版勘误二部2005药典增补本(2006)二部2005年药典增补(2009)中国药典2000年版一部中国药典2000年版二部2000年版2002年增补本2000年版2004年增补本2.国监局单页标准国监局单页标准(2000年前)国监局单页标准(2000)国监局单页标准(2001)国监局单页标准(2002)国监局单页标准(2003)国监局单页标准(2004)国监局单页标准(2005)国监局单页标准(2006)国监局单页标准(2007)国监局单页标准(2008)国监局单页标准(2009)国监局单页标准(2010)药典委员会勘误国家药品标准修订件药品检验补充检验方法和项目化学药品地标升国标16册化学药品地标升国标16册(修订)国药典综发(2006)3.中成药标准汇编 (地标升国标)内科肾系分册内科心系分册内科肺系分册骨伤科分册口腔肿瘤儿科分册内科肝胆分册内科脾胃分册内科气血津液分册脑系经络肢体分册外科妇科分册眼科耳鼻喉科皮肤科分册4.进口药品标准进口药复核标准汇编(2003)进口药品复核标准汇编2001年进口药品复核标准汇编2000年进口药品复核标准汇编2002年进口药品单页标准(2003)进口药品单页标准(2004)进口药品单页标准(2005)进口药品单页标准(2006)进口药品单页标准(2007)5.卫生部药品标准卫生部药品标准(二部)第一册卫生部药品标准(二部)第二册卫生部药品标准(二部)第三册卫生部药品标准(二部)第四册卫生部药品标准(二部)第五册卫生部药品标准(二部)第六册生化药品89年版第一册抗生素药品第一册<八九年>化学药品及制剂第一册藏药第一册蒙药分册维吾尔药分册6.中药成方制剂第一册第二册第三册第四册第五册第六册第七册第八册第九册第十册第十一册第十二册第十三册第十四册第十五册第十六册第十七册第十八册第十九册第二十册第二十一册(中药保护) 7.新药转正标准新药转正标准1新药转正标准2新药转正标准3新药转正标准4新药转正标准5新药转正标准6新药转正标准7新药转正标准8新药转正标准9新药转正标准10新药转正标准11新药转正标准12新药转正标准13新药转正标准14新药转正标准15新药转正标准16新药转正标准17新药转正标准18新药转正标准19新药转正标准20新药转正标准21新药转正标准22新药转正标准23新药转正标准24新药转正标准25新药转正标准26新药转正标准27新药转正标准28新药转正标准29新药转正标准30新药转正标准31新药转正标准32新药转正标准33新药转正标准34新药转正标准35新药转正标准36新药转正标准37新药转正标准38新药转正标准39新药转正标准40新药转正标准41新药转正标准42新药转正标准43新药转正标准44新药转正标准45新药转正标准46新药转正标准47新药转正标准48新药转正标准49新药转正标准50新药转正标准51新药转正标准52新药转正标准53新药转正标准54新药转正标准55新药转正标准56新药转正标准57新药转正标准58新药转正标准59新药转正标准60新药转正标准61新药转正标准62新药转正标准63新药转正标准64新药转正标准65新药转正标准66新药转正标准67新药转正标准68新药转正标准69新药转正标准70新药转正标准71新药转正标准72新药转正标准73新药转正标准74新药转正标准75新药转正标准768.化药地标升国标化学药品地标升国标1册化学药品地标升国标2册化学药品地标升国标3册化学药品地标升国标4册化学药品地标升国标5册化学药品地标升国标6册化学药品地标升国标7册化学药品地标升国标8册化学药品地标升国标9册化学药品地标升国标10册化学药品地标升国标11册化学药品地标升国标12册化学药品地标升国标13册化学药品地标升国标14册化学药品地标升国标15册化学药品地标升国标16册。