肺部弥漫性磨玻璃阴影的CT诊断与鉴别诊断
- 格式:docx
- 大小:28.86 KB
- 文档页数:13





肺磨玻璃结节综合影像诊断与鉴别诊断研究进展近年来,肺磨玻璃结节(Ground-glass opacity,GGO)成为肺部影像学中的热点之一。
肺GGO表现为灰白色模糊的阴影,在高分辨率CT(HRCT)图像上可见,直径小于3cm。
由于其表现形式多样,临床上对GGO的综合影像诊断与鉴别诊断十分重要。
本文旨在对肺GGO的综合影像诊断与鉴别诊断的研究进展进行综述。
对于GGO的综合影像诊断,应结合CT影像特征、病史和病理结果进行综合分析。
根据CT影像特征,可将GGO分为单发或多发、周边或弥漫分布、纯磨玻璃样或伴地方实变等类型。
还需考虑GGO的边缘特征、密度变化、分布位置等因素。
病史方面,应了解患者是否有吸烟史、患有慢性病或炎性疾病等。
病理结果对于GGO的诊断非常重要,要通过活检或手术切除等方式获取。
综合分析这些因素,可以帮助医生判断GGO是否为良性病变还是恶性病变。
对于GGO的鉴别诊断,应与其他肺部疾病进行鉴别。
需要将GGO与真正的磨玻璃样密度进行区分。
真正的磨玻璃样影像往往是由小气道受阻引起的,而非病灶本身的实变。
需要与不同类型的肿块进行鉴别。
良性肿块通常表现为光滑的界限,边缘清楚,周围无实变。
而恶性肿块则通常表现为不规则的边缘,周围伴有实变。
还需与炎症性病变进行鉴别。
炎症性病变往往伴有病史的明显炎症指标升高,如血白细胞计数、C-反应蛋白等。
综合这些鉴别诊断方法,可以帮助医生准确判断GGO的原因。
对于肺GGO的综合影像诊断与鉴别诊断,医生需要结合CT影像特征、病史和病理结果进行综合分析。
还需与其他肺部疾病进行鉴别,以排除其他可能性。
未来,随着影像学技术的不断进步,肺GGO的诊断和鉴别将更加精确和准确。

肺磨玻璃结节综合影像诊断与鉴别诊断研究进展
肺磨玻璃结节是指肺部CT扫描图像上呈现出类似磨砂玻璃样的密度增高区域,它是一种临床常见的肺部病变。
磨玻璃结节通常可以分为两种类型:实质性磨玻璃结节和部分磨
玻璃结节。
实质性磨玻璃结节是指肺部出现较为均匀的模糊影像,而部分磨玻璃结节则是
指肺部仅部分区域出现模糊影像。
磨玻璃结节可能是一种良性病变,也可能是一种恶性病变。
近年来,随着医学影像技术和计算机技术的发展,肺磨玻璃结节的诊断和鉴别诊断研
究取得了一些进展。
目前,研究学者主要集中在两个方面:一是对肺磨玻璃结节的特征和
分类进行研究,二是通过应用计算机辅助诊断技术提高肺磨玻璃结节的诊断准确性。
对肺磨玻璃结节的特征和分类进行研究是基础性工作。
通过对大量的肺磨玻璃结节患
者的临床资料和影像资料进行分析,可以得出一些结论。
研究发现,实质性磨玻璃结节多
见于炎性病变、感染和出血性病变,而部分磨玻璃结节多见于肿瘤性病变。
还发现一些特
征性的磨玻璃结节,如单发结节、边缘光滑的结节、结节直径小于3cm等,这些特征有助
于对磨玻璃结节进行鉴别诊断。
计算机辅助诊断技术对提高肺磨玻璃结节的诊断准确性具有重要作用。
计算机辅助诊
断技术可以对磨玻璃结节进行自动化分析和识别,从而减轻医生的工作负担,提高诊断的
准确性。
目前,有一些基于机器学习和深度学习算法的计算机辅助诊断系统已经应用于临床。
这些系统通过对大量的影像数据进行训练,可以准确地判断磨玻璃结节的类型和性质,并给出相应的诊断建议。

肺磨玻璃结节综合影像诊断与鉴别诊断研究进展肺磨玻璃结节是指CT影像上呈现为透明度略高于周围肺组织的结节,其病理学类型复杂,诊断及鉴别诊断具有一定困难。
随着医学影像技术的不断发展,肺磨玻璃结节的诊断和鉴别诊断得到了更多的关注。
本文将就肺磨玻璃结节的综合影像诊断与鉴别诊断研究进展进行探讨。
一、背景与意义肺磨玻璃结节是指CT影像上显示为局限性、浸润性和实变性磨玻璃影,实质密度大致等于周围正常肺组织的肺内病变。
肺磨玻璃结节的病理学类型多种多样,包括原发性恶性病变、原发性良性病变、转移性病变以及炎症性病变等。
鉴别诊断具有一定困难,因此对肺磨玻璃结节的准确诊断和鉴别诊断具有重要意义。
随着医学影像技术的飞速发展,计算机断层扫描(CT)已成为评估肺部疾病的主要手段之一。
而随着CT技术的不断进步,磨玻璃影像的检测与诊断的灵敏度和特异度也得到了显著提高。
探讨肺磨玻璃结节的综合影像诊断与鉴别诊断的研究进展对于提高其诊断的准确性和临床应用的指导具有重要的意义。
二、研究进展1. 影像表现与病理学类型的关系磨玻璃结节在CT影像上的呈现包括局限性、浸润性和实变性三种类型。
磨玻璃结节的病理学类型多种多样,有全磨玻璃影像、局限性实变、多发性磨玻璃结节等。
不同类型的磨玻璃结节对应不同的病理学类型,包括良性肿块、恶性肿瘤、炎症性病变等。
通过分析不同类型磨玻璃结节的影像特征,可以有助于对其进行病理学类型的鉴别诊断。
2. 新技术在磨玻璃结节诊断中的应用随着医学影像技术的不断发展,磨玻璃结节的诊断和鉴别诊断也得到了新技术的应用。
人工智能技术在肺部肿瘤的诊断中取得了显著成果,通过深度学习等技术可以对磨玻璃结节进行自动分析和诊断,有助于提高诊断的准确性和效率。
PET-CT联合成像技术也可以提高对磨玻璃结节的诊断准确性,有助于筛选高危患者并指导治疗方案的选择。
3. 个体化诊断与治疗肺磨玻璃结节在临床上具有一定的难度,研究表明磨玻璃结节的临床转化风险受到多种因素的共同影响,个体化诊断和治疗成为临床工作中的重要任务。

磨玻璃密度
肺部磨玻璃密度影说明了什么?
答:肺部磨玻璃密度影出现在肺部CT检查的结果,顾名思义就是出现了类似圆形结节且外表像磨砂玻璃样,一般考虑是肿瘤疾病的前期,对于疾病的进一步判断需要做穿刺检查,这只是其中的一种情况。
还有一种肺部情况检查也会导致这种现,比如肺部出现炎症并且引起出血和纤维化,这种情况做检查也会出现磨玻璃密度影的情况,在肺病早期检查中出现这种情况需要尽快对病情进行诊断,对疾病预后有重要的作用。
在临床上这种情况并不代表具体的病变,只是一个参考,具体病情需要进一步检查。
肺部出现磨玻璃密度影,说明存在磨玻璃结节,需要进一步根据结节的大小和性质来综合判断。
如果磨玻璃影小于5mm多为慢性炎症改变,属于良性范围,不需要特殊治疗,只需要1年随访1次胸部高分辨CT就可以。
如果磨玻璃的密度影在6-8mm之间,尤其大于8mm,伴有短毛刺、分叶状、胸膜牵拉征、胸膜凹陷征等,需要进一步给予胸部增强CT检查。
必要时给予经皮肺穿刺细胞组织活检,以明确是否为早期肺癌。
如果为早期肺癌,可以请胸外科医生早期行手术切除治疗。
肺磨玻璃密度影,如果为慢性炎症改变,不需要特殊处理,也可以给予抗生素治疗。
如果磨玻璃密度影明显吸收、消散,说明为炎性结节的可能。
如果磨玻璃密度影呈生长性变化,尤其是大于8mm以上的磨玻璃结节需要引起高度重视,其容易发展为早期肺癌,尽早给予胸部增强CT检查,避免漏诊和误诊。

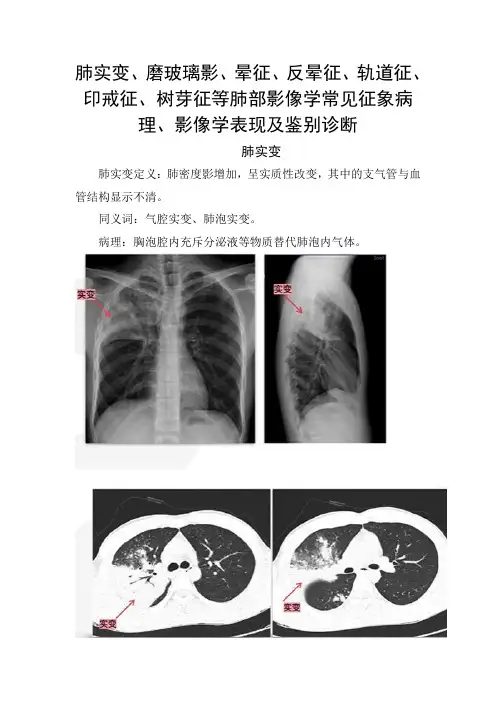
肺实变、磨玻璃影、晕征、反晕征、轨道征、印戒征、树芽征等肺部影像学常见征象病理、影像学表现及鉴别诊断肺实变肺实变定义:肺密度影增加,呈实质性改变,其中的支气管与血管结构显示不清。
同义词:气腔实变、肺泡实变。
病理:胸泡腔内充斥分泌液等物质替代肺泡内气体。
肺实变CT特点密度影增加;正常肺结构模糊(支气管、血管);可有支气管充气征;邻近可有腺泡结节;肺气肿时可有异质性实变(瑞士奶酪征);可为脂防密度影(脂质性肺炎);可为高密度影(胺碘酮肺毒性);主要鉴别诊断肺部感染(细菌、病毒与真菌);肺水肿;肺出血;嗜酸性肺疾病;新生物(肺、淋巴瘤)。
磨玻璃影GGO定义:肺密度影增加,其间支气管及血管影仍可见。
病理:GGO是肺泡渗出的过程,但也可是间质性疾病表现。
主要鉴别诊断GGO病因诊断流程晕征晕征定义:肺结节、团块或实变周围的GGO。
病理:以出血最为典型,但也可为炎症反应或新生物,出血原因为出血性梗死、血管炎、破碎的新生血管组织或坏死物。
主要鉴别诊断感染:血管侵袭性真菌,结核分枝杆菌,立克次体,病毒,脓毒症栓塞。
炎症性:肉芽肿性多血管炎,EP,COP,子宫内膜异位;新生物:Kaposi肉瘤,有鳞状特征的肺腺癌,血管性转移。
医源性:支气管镜活检后,导管诱发的肺假性动脉瘤反晕征反晕征的定义:中心为GGO,外周有同心圆状或新月状实变环绕。
同名词:环礁征。
病理:机化性肺炎。
环状或新月状外周实变,对应为机化性肺炎。
中心GGO为肺泡、间隔炎症与肺泡内细胞残破。
主要鉴别诊断机化性肺炎(OP);真菌感染:血管侵袭性曲霉,毛霉菌;其它感染:细菌性肺炎,结核,结节病;射频消融术后,淋巴样肉芽肿,肉芽肿性血管炎(GPA),肿痛,梗死。
树芽征树芽征定义:小叶中央型结节与分支影,类似于树芽。
未见于正常肺,常见于小气道(细支气管)疾病中,罕见于血管性疾病。
影像学表现:小叶中央型结节伴分支影,呈Y或V型,边缘模糊,特征性的胸膜下消散。
病理:次级肺小叶中心异常,细支气管气体被其它物质所替代而扩张,呈支气管播散。

[作者简介]雷志丹(1971-),男,四川丹棱人,在读硕士,主治医师。
研究方向:胸腹部影像学。
E -mail :leizhidan @ [通讯作者]葛英辉,河南省人民医院放射科,郑州,450003。
E -mail :cjr.geyinghui @ [收稿日期]2007-01-09 [修回日期]2007-06-05CT diagnosis and differential diagnosis of pulmonarydiffuse ground -glass opacityLEI Zhi -dan ,GE Y ing -hui*,S H I Da -peng(De partment of Radiology ,Henan Provincial Peop le 's Hospital ,Z hengz hou 450003,China )[Abstract ] Objective T o study the CT features of pulmo na ry disease s w ith diffuse g ro und -glass o pacity (DG GO ),and to improv e diagno stic and differential diag no stic accuracy of theses diseases.Methods T he clinical ,CT and high -re so lutio n CT (H RCT )ma te rials of 121cases 'DG GO which wer e pr oved by pa tho log y o r clinical comprehensive diagnosis w ere ret rospec -tively analy zed ,and its CT features wer e summarized.T he valuable diag no stic and differ ential diagno stic sig ns w ere investi -g ated.Results In these 121ca ses ,23cases w ere the diseases w ith abnor mity of inherent pulmo nary structur es ,including 18ca ses 'interstitial pneumo nia a nd 5cases 'co nnective tissue disease.T he DGG O had pe ripherally distributed with inter stitialthickening ,fibro sis ,t ractive bro nchiectasis o r honey comb shadow.T w enty cases were the disea ses with abno rmity of pul -mo na ry air -space 's filling state ,including 10ca ses 'aller gic pneumonia ,5ca ses 'pulmo nar y hemo r rhage ,3cases 'metastaic ne -o plasm and 2cases 'alveo lar cell carcino ma.T he DGG O had cent rally dist ributed w ith lobular centra l node ,acino se node o r mass.26ca ses we re the diseases w ith abno rmity of ex trav ascula r fluid ove rlo ad ,including 21cases 'pulmo nar y edema and 5ca ses 'co ntusio n of lung.T he DG GO had dist ributed pulmo na ry pendulous region or r elativ e pendulo us reg io n.15case s we re the diseases w ith abno rmity o f pulmo na ry blood 's no n -homo genous per fusio n ,including 11cases 'pulmonary embo lism and 4ca ses 'Behce t 's syndrome.T he DG GO had presented mo saic -fa shio n 's shado w or the DGG O had distributed throug ho ut one later al lung.37case s w ere the disea ses w ith two o r super -tw o king s o f abno rmity ,including 25cases 'chr onic o bstr uctive pulmo na ry disease ,7ca ses 'pulmo na ry alveo lar pr oteino sis and 5cases 'viral pneumonia.T he DGG O had pre sented mosaic -fashio n 's shado w o r g eog raphic change o r crazing paving pat te rn ,or the DGG O had centrally dist ributed with lobular central no de ,acinose node and inter stitial fibr osis.C onclusion DGG O may be seen in v ario us disea ses.T o analy ze the mor pho log y ,distribution ,co nco mitant sig ns and dy namic chang es of DGG O can preliminarily comprehend its pathological basis and patho -g enic mechanism.In combinatio n w ith clinical materials ,the r ang e of diag no stic po ssibilities can be shrinked.[Key words ] L ung disease ;G ro und -g lass o pacity ;T omog raphy ,X -ray computed肺部弥漫性磨玻璃阴影的CT 诊断与鉴别诊断雷志丹,葛英辉*,史大鹏(1.河南省人民医院放射科,河南郑州 450003)[摘 要] 目的 探讨以弥漫性磨玻璃阴影为主要表现肺部疾病的CT 特征,提高对本类型肺部疾病的诊断以及鉴别诊断水平。
磨玻璃结节的测量标准
磨玻璃结节是肺部CT影像学的描述性诊断,指的是CT上表现为密度轻度升高的淡薄云雾状阴影。
对于磨玻璃结节的测量标准,主要包括以下几个方面:
大小:磨玻璃结节的大小是通过CT扫描测量得到的。
一般而言,大于三厘米的结节称为肿块,而小于三厘米的则被称为结节。
此外,以五毫米大小为界,还可以进一步分类观察,如直径小于五毫米的结节和直径大于五毫米但小于一厘米的结节等。
边界:磨玻璃结节的边界通常比较清楚,但也可能出现不清楚的密度增高影。
边界的清晰度有助于判断结节的良恶性。
密度:磨玻璃结节的密度轻度升高,但并不会掩盖其中的支气管和血管影。
病灶的密度也是判断结节性质的重要指标之一。
需要注意的是,以上测量标准仅为一般性参考。
在实际临床操作中,医生会根据具体情况进行综合判断,并结合其他检查结果(如PET-CT、血液检查等)来确定结节的性质和治疗方案。
此外,对于磨玻璃结节的随访观察也非常重要。
根据结节的大小和其他特征,医生会制定相应的随访计划,通过定期的CT检查来观察结节的变化情况。
如果结节增大或出现实性成分增加等恶性转化迹象,医生可能会建议进行非手术活检或手术切除等进一步治疗措施。
肺部真菌感染的影像学诊断肺部真菌感染的影像学诊断引言影像学表现肺部真菌感染的影像学表现多种多样,常见的表现有以下几种:1. 磨玻璃影磨玻璃影是肺部真菌感染的常见影像学表现之一,其形态多样。
在病灶明显时,磨玻璃影可呈现为网格状、结节状或斑片状。
这种影像学表现通常与真菌侵袭支气管壁或血管壁有关。
2. 空洞肺部真菌感染引起的空洞是其特征性表现之一。
这些空洞一般为多发性、大小不一,并且常常伴有液平面。
空洞壁呈现不规则,可有厚度不均匀的壁结节或壁结石。
空洞周围的邻近肺组织常常呈现磨玻璃影、实变或不规则肿块。
3. 结节肺部真菌感染引起的结节一般为多发性、大小不一,并且呈现边界模糊、边缘毛糙的特点。
结节内部可有空泡或液体充填,也可伴有钙化。
结节周围的肺组织常常呈现磨玻璃影、实变或不规则肿块。
4. 实变肺部真菌感染引起的实变常常表现为局限性或弥漫性的实变区域。
实变区域密度增加,边界模糊,可伴有磨玻璃影、空洞或结节。
实变区域常常与邻近的肺叶或肺段无界限,有时还可累及纵隔。
诊断方法肺部真菌感染的影像学诊断主要依靠X线胸部片、CT和磁共振成像等影像学检查。
其中,CT是最常用的诊断工具,具有高灵敏度和特异性。
1. X线胸部片X线胸部片是最常用的初筛工具,可以检测出肺部真菌感染的一些常见影像学表现,如磨玻璃影、空洞和实变。
X线胸部片的分辨率有限,对于一些早期和轻度病变可能无法检测到。
2. CTCT是肺部真菌感染的主要影像学诊断方法,具有高分辨率和多平面重建的优势。
CT可以更加清晰地显示肺部真菌感染的病灶范围、形态特征和病变的严重程度。
CT还可以检测出一些X线胸部片无法显示的细小结节和病灶内的钙化。
3. 磁共振成像磁共振成像是一种非侵入性的无辐射检查方法,适用于对肺部真菌感染进行进一步分析和鉴别诊断。
磁共振成像对于一些CT无法清晰显示的结节和病灶内的微小出血有一定的优势。
肺部真菌感染是一种常见临床疾病,影像学诊断在其诊断和治疗中起着重要的作用。
肺部弥漫性磨玻璃阴影的CT诊断与鉴别诊断发表者:雷志丹6268人已访问[摘要] 目的探讨以弥漫性磨玻璃阴影为主要表现肺部疾病的CT特征,提高对本类型肺部疾病的诊断以及鉴别诊断水平。
方法回顾分析经病理证实以及临床综合诊断121例以弥漫性磨玻璃阴影为主要表现肺部疾病的CT、HRCT及临床资料,总结其各自CT特征,并寻求具有诊断及鉴别诊断价值的CT及HRCT征象。
结果 121例中,以肺固有结构异常为主的疾病主要为间质性肺炎18例和结缔组织病5例,磨玻璃影主要分布于中、下肺的外周部,且均伴有间质增厚及纤维化征象。
以肺气腔充气状态异常为主的疾病有过敏性肺炎10例、肺出血5例、肺转移瘤3例及肺泡癌2例,磨玻璃影按照肺叶、肺段分布,且伴有或不伴有小叶中心结节、腺泡结节或肿块性病变。
以肺内血管外体液量增加为主的疾病有肺水肿21例及肺挫伤5例,肺水肿性磨玻璃影具有沿下垂部分布的趋势,可伴有心影增大及胸腔积液;而肺挫伤性磨玻璃影与外伤部位相关,且在外伤区肺内也具有沿下垂部分布的趋势。
以血流灌注异常为主的疾病有肺栓塞11例和白塞氏综合征4例,磨玻璃影位于正常血管所属的高灌注区,而低密度区是栓塞血管所属的低灌注区,多发细小血管栓塞或多发细小动脉炎可形成马赛克样密度。
两种因素或两种以上因素异常的疾病有慢性阻塞性肺病25例、肺泡蛋白沉积症7例及病毒性肺炎5例,慢性阻塞性肺病为通气—血流障碍所致,其磨玻璃影与低密度区形成马赛克样改变,常伴有桶状胸;而肺泡蛋白沉积症及病毒性肺炎同时具有气腔和固有肺结构异常,其磨玻璃影是间质性病变与实质性病变共同作用的结果。
结论双肺弥漫性磨玻璃影见于多种疾病,通过对其形态、分布、伴随征象及疾病动态变化的分析,可以初步了解其发生的病理学基础和发病机制,结合临床可以缩小拟诊的范围。
[关键词]肺疾病;磨玻璃影;体层摄影术,X线计算机磨玻璃影(ground-glass opacity,GGO)是肺部多种疾病均可发生的一种CT征象,分为局限性及弥漫性两大类。
对于GGO的影像学意义及与疾病诊断的关系,国内文献屡有报道[1- 4],但依据肺部弥漫性磨玻璃影(diffuse ground-glass opacity,DGGO)的发病机制及病理学基础而加以论述者,笔者未见国内相关的大宗病例报道文献。
收集我院2001年1月~2006年12月近6年间经病理证实及临床综合诊断的以弥漫性磨玻璃阴影为主要表现的5大类13种共121例肺部疾病,并对其CT、HRCT及临床资料进行分析,探讨DGGO的发病机制及CT特征,以求提高本类型疾病的诊断与鉴别诊断。
1 资料与方法1.1 一般资料 121例DGGO患者,男83例,女38例,年龄19~73岁,平均47岁。
121例患者均有不同程度呼吸困难和限制性通气功能障碍。
①以肺固有结构异常为主的疾病23例:主要包括间质性肺炎18例和结缔组织病5例;18例间质性肺炎均经开胸肺活检证实,13例为普通性间质性肺炎(UIP),非特异性间质性肺炎(NSIP)4例,急性间质性肺炎(AIP)1例,均有不同程度的咳嗽、呼吸困难、Velcro啰音及限制性通气障碍;5例结缔组织病均具有较典型的症状、体征和肺功能异常,2例干燥综合征经唇腺活检证实,2例风湿性肺炎经血清学CCP检查证实,1例硬皮病经皮肤活检证实。
②以肺气腔充气状态异常为主的疾病20例:均有呼吸困难和肺功能异常,过敏性肺炎10例经血清学及治疗而综合诊断,5例肺出血病人经典型咯血病史及止血治疗好转而证实,3例肺转移瘤和2例肺泡癌均依据病史及支气管镜活检而证实。
③以肺内血管外体液量增加为主的疾病26例:包括肺水肿21例及肺挫伤5例,21例肺水肿患者均伴有心功能不全或肾功能不全且心功能或肾功能改善后DGGO消失而证实;5例肺挫伤患者的DGGO均与外伤部位相关且经短期治疗后病变消失而证实。
④以血流灌注异常为主的疾病15例:11例肺栓塞均具有典型的病史、症状、体征和肺功能异常,所有病例均经CTPA证实;4例白塞氏综合征均有口腔、生殖器、眼及肺部的典型症状与体征,2例行CTPA检查。
⑤两种因素或两种以上因素异常的疾病37例,25例慢性阻塞性肺病均有典型的慢性支气管炎病史;7例肺泡蛋白沉积症中,5例经支气管灌洗液PAS阳性及2例开胸肺活检而证实;5例病毒性肺炎依据病史、症状、体征、治疗及血清学而综合诊断。
1.2 检查方法本组所有患者均作胸部X线平片及常规CT检查,67例行HRCT检查,11例肺栓塞和2例白塞氏综合征行CTPA检查,83例患者有1~3次治疗后的胸部平片或/和CT复查资料。
胸部X线平片为常规或CR或DR胸片。
CT扫描采用公司Light Speed Plus 4型多层螺旋CT机。
平扫时层厚则为7.5mm,螺距系数1.5:1,重建间隔5mm,标准算法重建,矩阵512×512,范围自胸廓入口至肺底,以肺窗及纵隔窗观察。
HRCT检查应用常规高分辨率CT扫描59例和容积重组高分辨率CT(VHRCT)检查8例,常规HRCT层厚为1.25mm,层距10mm,骨算法图像重建,自主动脉弓水平至横膈,以肺窗观察;VHRCT 扫描层厚2.5mm,螺距系数3:1,薄层分解为1.25mm层厚和重建间隔,并以骨算法图像重建,以肺窗观察。
CTPA扫描层厚2.5mm,螺距系数3:1,薄层分解为1.25mm层厚和重建间隔,标准算法重建,矩阵512×512,造影剂选用碘海醇或优维显(300mg I/ml)100ml,经肘静脉高压注射器给药,注射流率3.0ml/s,扫描延迟时间为18-22s。
扫描范围自膈上2cm 至主动脉弓上2cm。
在工作站对扫描数据进行重建,如多平面重建(MPR)、最大密度投影(MIP)、表面遮盖法(SSD)、容积再现(VR)、血管内窥镜(VE)等。
1.3 分析方法 GGO表现为肺密度轻度增高,但没有遮盖肺血管和支气管的肺部阴影[1. 2],笔者将病变同时累及双肺或一侧肺的两个肺叶以上者称为DGGO。
同时将病变远离支气管血管束而分布于脏层胸膜下区者称为外围分布,而沿支气管血管束分布者称为中心分布或中2.2 DGGO的影像学特点及伴随征象①18例间质性肺炎中(图1),15例的DGGO分布于双侧中下肺的外围部,3例中心及外围均有分布但仍以外围部为主,18例病变均同时伴有网状阴影、小叶间隔增厚及牵拉性支气管扩张,13例伴有蜂窝影,1例见有气胸;2例风湿性肺炎表现为双侧中下肺部的DGGO,并伴有腺泡结节、小叶阴影、肺段阴影、网状阴影及间质纤维化;2例干燥综合征(图2)和1例硬皮病的DGGO分布于中下肺的肺叶中心及外围,但仍以外围部为主,同时伴明显的间质纤维化及轻度牵拉性支气管扩张。
②10例过敏性肺炎(图3a,b)表现为分布于肺叶中心及外围的DGGO,但以中心部为主,GGO 内可见散在分布的小叶中心结节及腺泡结节,结节边缘模糊,GGO的形态及位置可变;5例肺出血(图4a,b)的DGGO以分布于支气管血管束周围为主,边缘模糊,不伴随间质增厚及纤维化;3例肺转移瘤(图5)表现为双肺散在分布结节及肿块影,结节或肿块边缘模糊,其周围分布非叶段性的片状GGO;2例肺泡癌(图6)表现栓侧中下肺为著的以肺叶中心部为主的DGGO,同时GGO内见较多的粟粒结节、小叶中心结节,肺门及纵隔淋巴结肿大。
③肺水肿21例(图7a,b),均表现为双肺DGGO,阴影密度呈从上至下、从前至后逐渐增高表现,8例见下叶背段及后段实变阴影,19例见肺血管轻度增粗,18例见双侧少量胸腔积液,17例心影增大,4例心影正常而大血管增粗;5例肺挫伤(图8)DGGO 分布于受伤区域,3例在局部形成从上至下、从前至后的密度变化,3例见胸腔积液,1例见肋骨骨折。
④11例肺栓塞(图9a,b),7例DGGO呈马赛克样改变,4例主干及叶肺动脉栓塞的DGGO位于未栓塞肺动脉所属的肺叶,而栓塞的肺叶表现为低密度,伴随征象见10例为栓塞肺动脉增粗、7例心影增大、5例栓塞远端血管变细及4例远端肺动脉消失;4例白塞氏综合征(图10a,b)的DGGO也呈马赛克样改变,3例的中小肺动脉见大小不等的动脉瘤形成,1例见肺动脉呈不规则变细。
⑤25例慢性阻塞性肺病的DGGO密度较其他疾病的更低,表现为马赛克样改变,25例均有明显的肺气肿征象,17例有肺心病征象(图11);7例肺泡蛋白沉积症的DGGO呈地图样分布和“铺路石”样改变(图12);5例病毒性肺炎的DGGO呈中心及外围部分布,同时5例均见不同程度的间质增厚及纤维化,3在GGO内见小叶中心结节,2例见沿小叶中心散在分布的“树芽征”(图13)。
2.3 DGGO的动态变化 83例复查中,间质性肺炎9例,经吡非尼酮、激素等综合治疗后,6例UIP的网状阴影及周围DGGO基本消失,但蜂窝影及其周围的磨玻璃阴影仍存在,3例NSIP仅留有少许条索状影;2例干燥综合征和2例风湿性肺炎治疗后也仅残留纤维条索影。
8例过敏性肺炎经激素治疗和5例肺出血经止血治疗后DGGO消失。
21例肺水肿经强心、利尿等综合治疗随着心肾功能改善DGGO迅速吸收,5例肺挫伤病人经止血等治疗后短期吸收好转。
11例肺栓塞及4例白塞氏综合征经溶栓治疗后肺部DGGO逐步吸收。
10例慢性阻塞性肺病经抗感染、训练呼吸等治疗后DGGO变化不明显;3例肺泡蛋白沉积症经支气管肺灌洗等综合治疗后,肺部DGGO逐渐减少;3例病毒性肺炎经激素及抗病毒药物等综合治疗后,DGGO消失,仅残留少许纤维条索影。
3 讨论3.1肺密度改变的机制肺密度是由肺内气腔的密度、固有肺组织密度、肺内血管外体液量以及肺血容量四种因素构成。
因而任何疾病导致上述因素发生改变,必将造成肺密度的改变,但最为常见的是肺部疾病导致气腔密度、肺内血管外体液量及血容量的改变,这是肺密度改变的基本病理基础[5. 6]。
而本组疾病均分别使上述四种因素发生不同程度的改变,从而导致DGGO的形成。
3.2 DGGO的影像学特征、伴随征象与形成机制贺文将GGO的主要病因归为间质性疾病、实质性疾病及通气-血流障碍三大类[2],在较大程度上对肺部GGO的诊断与鉴别诊断上起到积极作用。
但依据本组以DGGO为主要表现肺部疾病的分布及影像学特点,仍有2大类疾病不能用上述病因解释。
为全面论述DGGO的形成机制,我们认为应以导致肺密度增高的4种因素为基础,从5大类疾病进行论证。
①本组中18例间质性肺炎和5例结缔组织病的DGGO分布于中下肺的外围部或以外围部为主,因而本类型的GGO主要分布在间质周围,并且伴有间质的增厚、纤维化甚至蜂窝形成,因此GGO的形成与间质性炎症有关。
间质性炎症的结果是间质炎性渗出和间质纤维化,渗出液致间质密度增高、直径增宽的同时可以进入肺泡腔形成气腔的部分充填,而间质的增厚及纤维化均可使肺固有结构的变形、破坏和固有肺组织密度增高,且肺固有结构的变形、破坏可以导致气腔的充气状态发生改变,以上三种病理改变均可导致肺密度轻度增高从而形成了GGO,因病变发生较广泛而产生肺的DGGO[7. 8]。