【化学】培优除杂分离和提纯辅导专题训练及答案解析
- 格式:doc
- 大小:251.50 KB
- 文档页数:16

一、中考初中化学除杂分离和提纯1.要除去氯化钠溶液中含有的少量碳酸钠,可采用的方法是①通入适量的二氧化碳②加入适量的氯化钡溶液③加入适量的稀盐酸④加入适量的石灰水()A.①或③B.②或③C.②或④D.③或④【答案】B【解析】【分析】【详解】①二氧化碳不和碳酸钠溶液反应,不能除去杂质,此项错误;②氯化钡能和碳酸钠反应生成碳酸钡沉淀和氯化钠,反应时不会带入新的杂质,故此项正确;③盐酸能和碳酸钠反应,且生成氯化钠,不会带入新的杂质,此项正确;④氢氧化钙溶液能和碳酸钠反应,但反应时会生成氢氧化钠,带入新的杂质,此项错误,故选B。
2.下表物质中含有少量杂质,其中除杂方法正确的是()A.A B.B C.C D.D【答案】D【解析】【分析】【详解】A、金属钙的活泼性太强,不能与氯化镁反应,直接与水发生了反应,故错误;B、氯化钾可以出去硝酸银杂质,但是反应后生成了新杂质硝酸钾,故错误;C、二氧化碳中含有少量的一氧化碳不能点燃,且通入氧气引入新杂质,故错误;D、氯化钾易溶于水,而二氧化锰难溶于水,故可以溶解过滤,除去二氧化锰,再蒸发获得氯化钾,故正确。
故选D。
3.除去下列物质中的少量杂质,所选用的试剂和操作方法都正确的是()A.A B.B C.C D.D【答案】D【解析】【分析】【详解】A、FeCl3溶液和CuCl2均能与铁粉反应,不但能把杂质除去,也会把原物质除去,不符合除杂原则,故选项所采取的方法错误。
B、二氧化碳和HCl都能与NaOH溶液反应,不但能把杂质除去,也会把原物质除去,不符合除杂原则,故选项所采取的方法错误。
C、碳酸钡难溶于水,K2SO4不能与BaCO3反应,不能除去杂质,不符合除杂原则,故选项所采取的方法错误。
D、H2SO4能与过量Fe2O3粉末反应生成硫酸铁和水,充分反应后,过滤,能除去杂质且没有引入新的杂质,符合除杂原则,故选项所采取的方法正确。
故选:D。
【点睛】根据原物质和杂质的性质选择适当的除杂剂和分离方法,所谓除杂(提纯),是指除去杂质,同时被提纯物质不得改变。

一、中考初中化学除杂分离和提纯1.下列实验方案能达到实验目的的是()A.A B.B C.C D.D【答案】D【解析】【详解】A、除去KCl溶液中的K2CO3,加入适量的硝酸钙溶液,硝酸钙与碳酸钾反应生成硝酸钾和碳酸钙沉淀,过滤可除去碳酸钙,但引入了新的杂质硝酸钾,故A不正确;B、除去BaCl2溶液中的HCl,加入过量Ba(OH)2溶液,除去了杂质但引入了新杂质Ba(OH)2(过量的),故B不正确;C、稀盐酸和稀硫酸都属于强酸,不能通过比较溶液的pH来区分,故C不正确;D、氢氧化钠固体加水溶解会放出大量的热,溶液温度升高;硝酸铵固体加水溶解会吸收热量,溶液温度降低,可鉴别二者,故D正确。
故选D。
2.下表中,除去物质所含少量杂质的方法和反应类型归类均正确的是A.A B.B C.C D.D【答案】A【解析】【分析】【详解】A、铜和氧气加热生成氧化铜,反应为化合反应,氧化铜和氧气加热不反应,可以除去铜粉,故A正确;B、一氧化碳和氧化铜反应生成铜和二氧化碳,反应不属于置换反应,故B不正确;C、盐酸和氢氧化钠反应生成氯化钠和水,反应类型为复分解反应,故C不正确;D、硫酸钾和硝酸钡反应生成硫酸钡和硝酸钾,引进新杂质硝酸钾,故D不正确。
故选A。
3.下列依据实验目的所设计的实验方案正确的是()A.A B.B C.C D.D【答案】C【解析】【分析】【详解】A、除去CO2中的HCl气体,将混合气体通入足量NaOH溶液中,NaOH不仅与杂质氯化氢反应,还与原物质二氧化碳反应,不符合除杂的“原物质不减少”原则,不能用于除氯化氢杂质,选项说法错误,故不符合题意;B、区分尿素CO(NH2)2、NH4Cl和NH4NO3,加熟石灰研磨闻气味,只能区分出尿素,NH4Cl 和NH4NO3都与熟石灰反应产生刺激性气味的氨气,无法区分,选项说法错误,故不符合题意;C、区分稀HCl( 酸性)、Na2CO3溶液(碱性)、NaCl溶液(中性),滴加紫色石蕊溶液,紫色石蕊遇稀HCl显红色,遇Na2CO3溶液显蓝色,遇NaCl溶液显紫色,可以通过观察颜色区分开,选项说法正确,故符合题意;D、除去KNO3溶液中的KCl,加入过量的AgNO3溶液,AgNO3只与KCl生成硝酸钾和沉淀氯化银,但AgNO3溶液是过量的,引入了新杂质,不符合除杂的“不引入新杂质”原则,不能用于除去KCl,选项说法错误,故不符合题意,故选C。

一、中考初中化学除杂分离和提纯1.下列除去杂质的方法中,不正确的是()A.①②B.②③C.③④D.②④【答案】D【解析】【分析】【详解】①氯化钠易溶于水,泥沙难溶于水,可采取加水溶解、过滤、蒸发的方法进行分离除杂,故选项所采取的方法正确;②二氧化碳能与氢氧化钠固体反应生成碳酸钠和水,氢氧化钠固体具有吸水性,不但能把杂质除去,也会把原物质除去,不符合除杂原则,故选项所采取的方法错误;③铁粉能与CuSO4反应生成硫酸亚铁和铜,再过滤除去不溶物,能除去杂质且没有引入新的杂质,符合除杂原则,故选项所采取的方法正确;④Na2CO3能与过量的Ca(OH)2溶液反应生成碳酸钙沉淀和氢氧化钠,能除去杂质但引入了新的杂质氢氧化钙,不符合除杂原则,故选项所采取的方法错误,故②④方法不正确,故选D。
【点睛】本题为除杂题,是中考的重点,也是难点,解决除杂问题时,抓住除杂的必需条件(加入的试剂只与杂质反应,反应后不能引入新杂质)是正确解题的关键。
2.下列实验方案不能达到实验目的的是()A.A B.B C.C D.D【答案】D【解析】【分析】【详解】A、Na2CO3+2HCl=2NaCl+H2O+CO2↑,选项A正确;B、NaCl溶于水溶液温度不变,NaOH固体溶于水溶液温度升高,选项B正确;C、CO2可以使澄清石灰水变浑浊,CO则不能,选项C正确;D、CaO和CaCO3都与稀盐酸反应,选项D不正确。
故选D。
3.除去下列物质中所含的杂质,所用的试剂和方法正确的是:A.A B.B C.C D.D【答案】C【解析】【分析】【详解】A、CO2和HCl气体均能与NaOH溶液反应,不但能把杂质除去,也会把原物质除去,不符合除杂原则,故选项所采取的试剂错误。
B、Ca(OH)2能与过量K2CO3溶液反应生成碳酸钙沉淀和氢氧化钾,能除去杂质且入了新的杂质碳酸钾(过量的),不符合除杂原则,故选项所采取的方法错误。
C、CaCO3固体高温煅烧生成氧化钙和二氧化碳,能除去杂质且没有引入新的杂质,符合除杂原则,故选项所采取的方法正确。
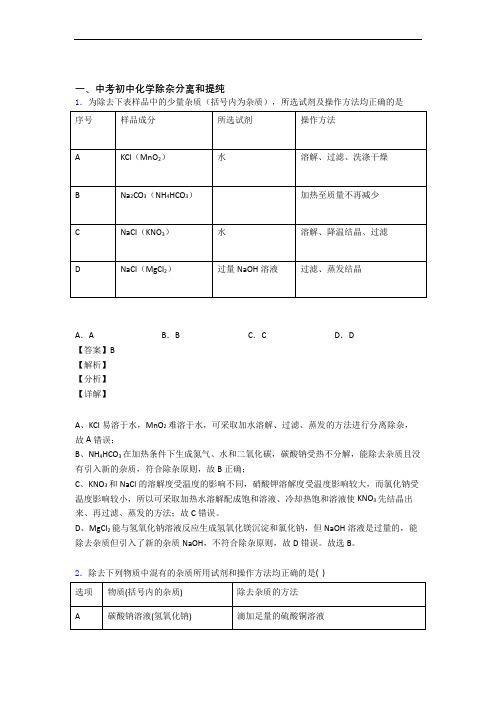
一、中考初中化学除杂分离和提纯1.为除去下表样品中的少量杂质(括号内为杂质),所选试剂及操作方法均正确的是A.A B.B C.C D.D【答案】B【解析】【分析】【详解】A、KCl易溶于水,MnO2难溶于水,可采取加水溶解、过滤、蒸发的方法进行分离除杂,故A错误;B、NH4HCO3在加热条件下生成氮气、水和二氧化碳,碳酸钠受热不分解,能除去杂质且没有引入新的杂质,符合除杂原则,故B正确;C、KNO3和NaCl的溶解度受温度的影响不同,硝酸钾溶解度受温度影响较大,而氯化钠受温度影响较小,所以可采取加热水溶解配成饱和溶液、冷却热饱和溶液使KNO3先结晶出来、再过滤、蒸发的方法;故C错误。
D、MgCl2能与氢氧化钠溶液反应生成氢氧化镁沉淀和氯化钠,但NaOH溶液是过量的,能除去杂质但引入了新的杂质NaOH,不符合除杂原则,故D错误。
故选B。
2.除去下列物质中混有的杂质所用试剂和操作方法均正确的是( )A.A B.B C.C D.D【答案】B【解析】【分析】除杂(提纯),是指除去杂质,同时被提纯物质不得改变。
【详解】A、氢氧化钠和硫酸铜反应生成氢氧化铜和硫酸钠,引入了硫酸钠杂质,故A不正确;B、铁粉与足量稀硫酸反应生成硫酸亚铁溶液和氢气,铜不能与稀硫酸反应,再过滤、洗涤、干燥,能除去杂质且没有引入新的杂质,符合除杂原则,故B正确;C、石灰水吸收二氧化碳的能力较弱,将气体依次通过盛有石灰水、浓硫酸的洗气瓶不能除去杂质,故C不正确;D、二氧化碳不能与氯化钙溶液反应,故D不正确。
故选B。
【点睛】除杂条件:①加入的试剂只能与杂质反应,不能与原物质反应;②反应后不能引入新的杂质。
3.除去下列物质中的少量杂质,所选用的试剂和操作方法均正确的是A.A B.B C.C D.D【答案】C【解析】【详解】A、氯化铜与铁反应生成氯化亚铁和铜,除去杂质氯化铜后会引入新杂质氯化亚铁,不符合除杂原则,选项错误;B、在加热的条件下,不但一氧化碳能与氧化铜反应,碳粉也能与氧化铜反应,该方法会将欲保留的物质反应掉,不符合除杂原则,选项错误;C、碳酸钙与稀盐酸反应生成氯化钙、水和二氧化碳,将杂质转化为欲保留的物质,且碳酸钙不溶于水,反应后过滤掉过量的碳酸钙,滤液中的溶质只有氯化钙,符合除杂原则,选项正确;D、碳酸钠与稀盐酸反应生成氯化钠、水和二氧化碳,将杂质转化为欲保留的物质,但蒸发时过量的盐酸挥发到空气中会污染空气,选项错误,故选C。

一、中考初中化学除杂分离和提纯1.下列除去杂质(在括号内)选用的试剂(在箭头右侧)不正确的是A.CO2(CO)→CuOB.CaCl2溶液(HCl)→碳酸钙C.NaCl(泥沙)→水D.NaOH溶液(Na2CO3)→稀盐酸【答案】D【解析】【分析】【详解】A、CO能与灼热的氧化铜反应生成铜和二氧化碳,能除去杂质且没有引入新的杂质,符合除杂原则,选项A正确;B、HCl能与碳酸钙反应生成氯化钙、水和二氧化碳,碳酸钙不溶于水,过量的碳酸钙可以采用过滤的方法除去,能除去杂质且没有引入新的杂质,符合除杂原则,选项B正确;C、氯化钠易溶于水,泥沙难溶于水,可采取加水溶解、过滤、蒸发的方法进行分离除杂,选项C正确;D、NaOH溶液和Na2CO3均能与稀盐酸反应,不但能把杂质除去,也会把原物质除去,不符合除杂原则,选项D不正确。
故选D。
2.下列依据实验目的所设计的实验方案正确的是()A.A B.B C.C D.D【答案】C【解析】【分析】【详解】A、除去CO2中的HCl气体,将混合气体通入足量NaOH溶液中,NaOH不仅与杂质氯化氢反应,还与原物质二氧化碳反应,不符合除杂的“原物质不减少”原则,不能用于除氯化氢杂质,选项说法错误,故不符合题意;B、区分尿素CO(NH2)2、NH4Cl和NH4NO3,加熟石灰研磨闻气味,只能区分出尿素,NH4Cl 和NH4NO3都与熟石灰反应产生刺激性气味的氨气,无法区分,选项说法错误,故不符合题意;C、区分稀HCl( 酸性)、Na2CO3溶液(碱性)、NaCl溶液(中性),滴加紫色石蕊溶液,紫色石蕊遇稀HCl显红色,遇Na2CO3溶液显蓝色,遇NaCl溶液显紫色,可以通过观察颜色区分开,选项说法正确,故符合题意;D、除去KNO3溶液中的KCl,加入过量的AgNO3溶液,AgNO3只与KCl生成硝酸钾和沉淀氯化银,但AgNO3溶液是过量的,引入了新杂质,不符合除杂的“不引入新杂质”原则,不能用于除去KCl,选项说法错误,故不符合题意,故选C。

一、中考初中化学除杂分离和提纯1.下表中除去物质中少量杂质的方法正确的是A.A B.B C.C D.D【答案】D【解析】【分析】【详解】A、炭粉在空气中加热会和氧气反应生成二氧化碳,会把炭粉除去,选项A错误;B、灼热的炭层能与O2反应生成二氧化碳气体,能除去氧气但引入了新的杂质二氧化碳,选项B错误;C、KCl易溶于水,MnO2难溶于水,可采取加水溶解、过滤、洗涤、干燥的方法进行分离除杂,过滤之后不需要蒸发,选项C错误;D、MgCl2能与适量氢氧化钠溶液反应生成氢氧化镁沉淀和氯化钠,再过滤,能除去杂质且没有引入新的杂质,选项D正确。
故选D。
2.下列选项中的除杂方法不能达到目的的是()A.A B.B C.C D.D【答案】D【分析】除杂(提纯),是指除去杂质,同时被提纯物质不得改变。
【详解】A、二氧化碳与氢氧化钠溶液反应生成碳酸钠和水,氧气不与氢氧化钠溶液反应,再通过浓硫酸干燥,得到氧气,符合除杂原则,故A正确;B、碳酸钠和稀盐酸反应生成氯化钠、水和二氧化碳,氯化钠的溶解度受温度的影响较小,充分反应后蒸发结晶得到氯化钠,故B正确;C、碳酸钠和氢氧化钙反应生成碳酸钙和氢氧化钠,充分反应后过滤,得到氢氧化钠,故C 正确;D、氧化铜和铁均与稀盐酸反应,把原物质除去了,不符合除杂原则,故D不正确。
故选D。
【点睛】除杂条件:①加入的试剂只能与杂质反应,不能与原物质反应;②反应后不能引入新的杂质。
3.下列除去杂质所用的药品或方法,不正确的是()A.A B.B C.C D.D【答案】A【解析】【分析】【详解】A、Na2SO4能与过量的BaCl2溶液反应生成硫酸钡沉淀和氯化钠,能除去杂质但引入了新的杂质氯化钡,不符合除杂原则。
A错误;B、CaCO3固体高温煅烧生成氧化钙和二氧化碳,能除去杂质且没有引入新的杂质,符合除杂原则。
B正确;C、氧气通过灼热的铜网时可与铜发生反应生成氧化铜,而氮气不与铜反应,能除去杂质且没有引入新的杂质,符合除杂原则。
一、中考初中化学除杂分离和提纯1.下列除去杂质(在括号内)选用的试剂(在箭头右侧)不正确的是A.CO2(CO)→CuOB.CaCl2溶液(HCl)→碳酸钙C.NaCl(泥沙)→水D.NaOH溶液(Na2CO3)→稀盐酸【答案】D【解析】【分析】【详解】A、CO能与灼热的氧化铜反应生成铜和二氧化碳,能除去杂质且没有引入新的杂质,符合除杂原则,选项A正确;B、HCl能与碳酸钙反应生成氯化钙、水和二氧化碳,碳酸钙不溶于水,过量的碳酸钙可以采用过滤的方法除去,能除去杂质且没有引入新的杂质,符合除杂原则,选项B正确;C、氯化钠易溶于水,泥沙难溶于水,可采取加水溶解、过滤、蒸发的方法进行分离除杂,选项C正确;D、NaOH溶液和Na2CO3均能与稀盐酸反应,不但能把杂质除去,也会把原物质除去,不符合除杂原则,选项D不正确。
故选D。
2.下列除去杂质所用的药品或方法,不正确的是()A.A B.B C.C D.D【答案】A【解析】【分析】【详解】A、Na2SO4能与过量的BaCl2溶液反应生成硫酸钡沉淀和氯化钠,能除去杂质但引入了新的杂质氯化钡,不符合除杂原则。
A错误;B、CaCO3固体高温煅烧生成氧化钙和二氧化碳,能除去杂质且没有引入新的杂质,符合除杂原则。
B正确;C、氧气通过灼热的铜网时可与铜发生反应生成氧化铜,而氮气不与铜反应,能除去杂质且没有引入新的杂质,符合除杂原则。
C正确;D、碳酸钠能溶于水形成溶液,碳酸钙难溶于水。
加水溶解后过滤,得到碳酸钠溶液,再将溶液蒸发即可得到纯净的碳酸钠晶体,符合除杂原则。
D正确。
故选A。
【点睛】除杂的原则:不除去原物质、不引入新的杂质、易于分离3.除去下列物质中的少量杂质,所选用的试剂和操作方法都正确的是( )物质杂质试剂操作方法A K2CO3溶液K2SO4BaCO3加适量BaCO3,粉末,充分反应后,过滤B MgCl2溶液HCl过量Mg(OH)2过滤C CO2水蒸气足量NaOH固体干燥D CaCO3CaO无高温煅烧A.A B.BC.C D.D【答案】B【解析】【分析】除杂条件是不引入新的杂质,加入的物质不和原物质反应。
一、中考初中化学除杂分离和提纯1.下列实验方案不能达到实验目的的是()A.A B.B C.C D.D【答案】D【解析】【分析】【详解】A、Na2CO3+2HCl=2NaCl+H2O+CO2↑,选项A正确;B、NaCl溶于水溶液温度不变,NaOH固体溶于水溶液温度升高,选项B正确;C、CO2可以使澄清石灰水变浑浊,CO则不能,选项C正确;D、CaO和CaCO3都与稀盐酸反应,选项D不正确。
故选D。
2.除去下列物质中的杂质,所选用的试剂和操作方法均正确的是A.A B.B C.C D.D【答案】A【解析】【详解】A、碱石灰中的火碱是氢氧化钠,生石灰是氧化钙。
氢氧化钠易潮解,生石灰能和水反应。
可以除去氢气中混有的水蒸气。
A正确;B、氢氧化钾和硫酸反应生成硫酸钾和水。
该反应中会引入新的杂质硫酸钾,不符合除杂的要求。
B错误;C、二氧化锰难溶于水,氯化钠易溶于水。
加水溶解后,过滤,烘干,即可得到二氧化锰。
蒸发结晶会得到溶于水的氯化钠,不符合除杂的要求。
C错误;D、稀硫酸和铁、氧化铁均能发生化学反应。
对原物质造成影响,不符合除杂的要求。
D 错误。
故选A。
3.下列实验操作中不能达到实验目的的是A.A B.B C.C D.D【答案】A【解析】【详解】A、溶解后过滤得到氯化钠溶液,再蒸发才能够得到氯化钠固体,该选项不能达到实验目的;B、加入氯化钡溶液和稀硝酸后,产生白色沉淀的是稀硫酸,无明显现象的是盐酸,该选项能够达到实验目的;C、高温条件下碳酸钙分解生成氧化钙和二氧化碳,该选项能够达到实验目的;D、加入熟石灰研磨,能够产生刺激性气味的是氯化铵,无明显现象的是硫酸钾,该选项能够达到实验目的。
故选:A。
4.下列根据实验目的所设计的实验方案中,不正确的是A.分离CO2和CO混合气体----先通入NaOH溶液再加稀硫酸B.区分铁粉、碳粉、氧化铜粉末 ---- 加入稀盐酸C.除去部分变质的NaOH中的杂质----加水溶解,滴加适量的CaCl2溶液D.除去CuSO4溶液中少量的H2SO4----加过量的氧化铜,再过滤【答案】C【解析】【详解】A、二氧化碳能与氢氧化钠溶液反应生成碳酸钠和水,一氧化碳不能,先通入NaOH溶液,能分离出一氧化碳;再加稀硫酸,碳酸钠能与稀硫酸反应生成二氧化碳,能分离出二氧化碳,故选项实验方案正确。
一、中考初中化学除杂分离和提纯1.除去下列物质中的杂质,所用试剂和方法不正确的是()A.A B.B C.C D.D【答案】D【解析】【分析】【详解】A、KC1易溶于水,泥沙难溶于水,可采取加水溶解、过滤、蒸发的方法进行分离除杂,选项A正确;B、CO2能与氢氧化钠溶液反应生成碳酸钠和水,CO不与氢氧化钠溶液反应,能除去杂质且没有引入新的杂质,符合除杂原则,选项B正确;C、盐酸能与过量的碳酸钙反应生成氯化钙、水和二氧化碳,再过滤除去过量的碳酸钙,能除去杂质且没有引入新的杂质,符合除杂原则,选项C正确;D、Ca(OH)2能与过量碳酸钠溶液反应生成碳酸钙沉淀和氢氧化钠,能除去杂质但引入了新的杂质碳酸钠(过量的),不符合除杂原则,选项D不正确。
故选D。
【点睛】除杂质至少要满足两个条件:①加入的试剂只能与杂质反应,不能与原物质反应;②反应后不能引入新的杂质。
2.下表中,除去物质所含少量杂质的方法和反应类型归类均正确的是A.A B.B C.C D.D【答案】A【解析】【分析】【详解】A、铜和氧气加热生成氧化铜,反应为化合反应,氧化铜和氧气加热不反应,可以除去铜粉,故A正确;B、一氧化碳和氧化铜反应生成铜和二氧化碳,反应不属于置换反应,故B不正确;C、盐酸和氢氧化钠反应生成氯化钠和水,反应类型为复分解反应,故C不正确;D、硫酸钾和硝酸钡反应生成硫酸钡和硝酸钾,引进新杂质硝酸钾,故D不正确。
故选A。
3.除去下列物质中含有的少量杂质,所用试剂或方法不正确的是()A.A B.B C.C D.D【答案】D【分析】除杂(提纯),是指除去杂质,同时被提纯物质不得改变。
【详解】A、CuO能与稀硫酸反应生成硫酸铜和水,再过滤,能除去杂质且没有引入新的杂质,符合除杂原则,故A正确;B、KCl易溶于水,MnO2难溶于水,可采取加水溶解、过滤、洗涤、烘干的方法进行分离除杂,故B正确;C、碳酸钠能与过量稀盐酸反应生成氯化钠、水和二氧化碳,盐酸具有挥发性,再蒸发除去盐酸,能除去杂质且没有引入新的杂质,符合除杂原则,故C正确;D、除去二氧化碳中的一氧化碳不能够点燃,当二氧化碳(不能燃烧、不能支持燃烧)大量存在时,少量的一氧化碳是不会燃烧的,故D不正确。
一、中考初中化学除杂分离和提纯1.下列除去杂质的方法中,不正确的是()A.①②B.②③C.③④D.②④【答案】D【解析】【分析】【详解】①氯化钠易溶于水,泥沙难溶于水,可采取加水溶解、过滤、蒸发的方法进行分离除杂,故选项所采取的方法正确;②二氧化碳能与氢氧化钠固体反应生成碳酸钠和水,氢氧化钠固体具有吸水性,不但能把杂质除去,也会把原物质除去,不符合除杂原则,故选项所采取的方法错误;③铁粉能与CuSO4反应生成硫酸亚铁和铜,再过滤除去不溶物,能除去杂质且没有引入新的杂质,符合除杂原则,故选项所采取的方法正确;④Na2CO3能与过量的Ca(OH)2溶液反应生成碳酸钙沉淀和氢氧化钠,能除去杂质但引入了新的杂质氢氧化钙,不符合除杂原则,故选项所采取的方法错误,故②④方法不正确,故选D。
【点睛】本题为除杂题,是中考的重点,也是难点,解决除杂问题时,抓住除杂的必需条件(加入的试剂只与杂质反应,反应后不能引入新杂质)是正确解题的关键。
2.下表列出了除去物质中所含少量杂质的方法,其中正确的是()A.A B.B C.C D.D【答案】D【解析】【分析】【详解】A、CaO能与水反应生成氢氧化钙,碳酸钙难溶于水,反而会把原物质除去,不符合除杂原则,故选项所采取的方法错误。
B、除去二氧化碳中的一氧化碳不能够点燃,这是因为当二氧化碳(不能燃烧、不能支持燃烧)大量存在时,少量的一氧化碳是不会燃烧的;故选项所采取的方法错误。
C、Na2CO3能与过量的氢氧化钙溶液反应生成碳酸钙沉淀和氢氧化钠,能除去杂质但引入了新的杂质氢氧化钙(过量的),不符合除杂原则,故选项所采取的方法错误。
D、氯化钠易溶于水,泥沙难溶于水,可采取加水溶解、过滤、蒸发的方法进行分离除杂,故选项所采取的方法正确。
故选:D。
【点睛】根据原物质和杂质的性质选择适当的除杂剂和分离方法,所谓除杂(提纯),是指除去杂质,同时被提纯物质不得改变.除杂质题至少要满足两个条件:①加入的试剂只能与杂质反应,不能与原物质反应;②反应后不能引入新的杂质。
一、中考初中化学除杂分离和提纯1.为除去下表样品中的少量杂质(括号内为杂质),所选试剂及操作方法均正确的是A.A B.B C.C D.D【答案】B【解析】【分析】【详解】A、KCl易溶于水,MnO2难溶于水,可采取加水溶解、过滤、蒸发的方法进行分离除杂,故A错误;B、NH4HCO3在加热条件下生成氮气、水和二氧化碳,碳酸钠受热不分解,能除去杂质且没有引入新的杂质,符合除杂原则,故B正确;C、KNO3和NaCl的溶解度受温度的影响不同,硝酸钾溶解度受温度影响较大,而氯化钠受温度影响较小,所以可采取加热水溶解配成饱和溶液、冷却热饱和溶液使KNO3先结晶出来、再过滤、蒸发的方法;故C错误。
D、MgCl2能与氢氧化钠溶液反应生成氢氧化镁沉淀和氯化钠,但NaOH溶液是过量的,能除去杂质但引入了新的杂质NaOH,不符合除杂原则,故D错误。
故选B。
2.除去下列物质中混有的杂质所用试剂和操作方法均正确的是( )A.A B.B C.C D.D【答案】B【解析】【分析】除杂(提纯),是指除去杂质,同时被提纯物质不得改变。
【详解】A、氢氧化钠和硫酸铜反应生成氢氧化铜和硫酸钠,引入了硫酸钠杂质,故A不正确;B、铁粉与足量稀硫酸反应生成硫酸亚铁溶液和氢气,铜不能与稀硫酸反应,再过滤、洗涤、干燥,能除去杂质且没有引入新的杂质,符合除杂原则,故B正确;C、石灰水吸收二氧化碳的能力较弱,将气体依次通过盛有石灰水、浓硫酸的洗气瓶不能除去杂质,故C不正确;D、二氧化碳不能与氯化钙溶液反应,故D不正确。
故选B。
【点睛】除杂条件:①加入的试剂只能与杂质反应,不能与原物质反应;②反应后不能引入新的杂质。
3.除去下列各物质中少量杂质,所选用的试剂和操作方法均正确的是()A.A B.B C.C D.D【答案】C【解析】【分析】【详解】A、CaCO3固体高温煅烧生成氧化钙和二氧化碳,反而会把原物质除去,不符合除杂原则,选项A错误;B、洗涤剂具有乳化作用,能将大的油滴分散成细小的油滴,振荡、搅拌后不能除去杂质,不符合除杂原则,选项B错误;C、铜粉在足量氧气中加热生成氧化铜,能除去杂质且没有引入新的杂质,符合除杂原则,选项C正确;D、KClO3在二氧化锰的催化作用下生成氯化钾和氧气,二氧化锰作催化剂,反应前后质量不变,能除去杂质但引入了新的杂质二氧化锰,不符合除杂原则,选项D错误。
故选C。
【点睛】除杂(或提纯),是指除去杂质,同时被提纯物质不得改变。
除杂质题至少要满足两个条件:①加入的试剂只能与杂质反应,不能与原物质反应;②反应后不能引入新的杂质。
4.除去下列物质中的杂质,除杂方法正确的是A.A B.B C.C D.D【答案】D【解析】【分析】根据原物质和杂质的性质选择适当的除杂剂和分离方法,所谓除杂(提纯),是指除去杂质,同时被提纯物质不得改变。
除杂质题至少要满足两个条件:①加入的试剂只能与杂质反应,不能与原物质反应;②反应后不能引入新的杂质。
【详解】A、Zn和Fe均能与过量稀硫酸反应,不但能把杂质除去,也会把原物质除去,不符合除杂原则,故选项所采取的方法错误。
B、氯化钠的溶解度受温度影响较小,氯化钠溶液中含有少量的硝酸钾,应用蒸发结晶的方法提纯氯化钠,故选项所采取的方法错误。
C、除去二氧化碳中的一氧化碳不能够通氧气点燃,这是因为除去气体中的气体杂质不能使用气体,否则会引入新的气体杂质(氧气),故选项所采取的方法错误。
D、过量铁粉能与CuCl2溶液反应生成氯化亚铁溶液和铜,再过滤,能除去杂质且没有引入新的杂质,符合除杂原则,故选项所采取的方法正确。
故选:D。
【点睛】物质的分离与除杂是中考的重点,也是难点,解决除杂问题时,抓住除杂质的必需条件(加入的试剂只与杂质反应,反应后不能引入新的杂质)是正确解题的关键。
5.除去下列物质中混有的少量杂质(括号内为杂质),所选用的操作方法正确的是A.炭粉(铁粉)-------- 将固体粉末在空气中灼烧B.CaO (CaCO3) -----------加水,过滤C.CO2 (CO) ---------------将气体点燃D.HNO3 [Ba (NO3) 2]----------------加入适量的 H2SO4溶液【答案】D【解析】【详解】A、炭粉在空气中灼烧会生成二氧化碳气体,反而会把原物质除去,故错误;B、CaO能与水反应生成氢氧化钙,碳酸钙难溶于水,反而会把原物质除去,不符合除杂原则,故错误;C、除去二氧化碳中的一氧化碳不能够点燃,这是因为当二氧化碳(不能燃烧、不能支持燃烧)大量存在时,少量的一氧化碳是不会燃烧的,故错误;D、硝酸钡与稀硫酸反应生成硫酸钡沉淀和硝酸,过滤将硫酸钡除去,符合除杂原则,故正确;故选:D。
【点睛】根据原物质和杂质的性质选择适当的除杂剂和分离方法,所谓除杂(提纯),是指除去杂质,同时被提纯物质不得改变。
除杂质题至少要满足两个条件:①加入的试剂只能与杂质反应,不能与原物质反应;②反应后不能引入新的杂质。
6.除去下列各物质中混有的少量杂质(括号内为杂质),所用试剂及操作方法均正确是()A.碳粉(Fe2O3)加入足量的稀盐酸,过滤B.NaCl溶液(MgCl2)加入过量的 NaOH溶液、过滤C.CO气体(CO2)通过灼热的氧化铁粉末D.NaOH 溶液(Ca(OH)2)加入适量的碳酸钾溶液【答案】A【解析】【详解】A、Fe2O3能与足量的稀盐酸反应生成氯化铁和水,木炭不与稀盐酸反应,能除去杂质且没有引入新的杂质,符合除杂原则,故选项所采取的方法正确。
B、MgCl2能与过量的NaOH溶液反应生成氢氧化镁沉淀和氯化钠,能除去杂质但引入了新的杂质氢氧化钠(过量的),不符合除杂原则,故选项所采取的方法错误。
C、CO能与灼热的氧化铁粉末反应生成铁和二氧化碳,反而会把原物质除去,不符合除杂原则,故选项所采取的方法错误。
D、Ca(OH)2能与适量的碳酸钾溶液反应生成碳酸钙沉淀和氢氧化钾,能除去杂质但引入了新的杂质氢氧化钾,不符合除杂原则,故选项所采取的方法错误。
故选:A。
【点睛】除杂至少要满足两个条件:①加入的试剂只能与杂质反应,不能与原物质反应;②反应后不能引入新的杂质。
7.除去下列物质中的杂质,所选试剂及操作方法均正确的是A.A B.B C.C D.D【答案】B【解析】【分析】【详解】A、二氧化碳不支持燃烧,一氧化碳无法点燃,A错。
B、氯化钠溶于水,泥沙不溶于水,通过溶解、过滤、蒸发结晶可去除泥沙得到氯化钠,B 正确。
C、稀硫酸不仅和碳酸钠反应,和氢氧化钠也会反应生成硫酸钠和水,故C错。
D、加入稀盐酸,稀盐酸和碳酸钙反应生成氯化钙和水,不符合题意,故D错。
故选:B。
8.除去下列各物质中的杂质,所选用的试剂、操作方法不能达到目的的是A.A B.B C.C D.D【答案】C【解析】【分析】【详解】A、食盐易溶于水,泥沙不溶于水,通过溶解、过滤、蒸发即可除去泥沙等到食盐,选项正确;B、铁与氯化铜反应生成氯化亚铁,所以向含有氯化铜的氯化亚铁溶液中加入足量铁,铁与氯化铜反应生成氯化亚铁,再过滤除去剩余的铁粉,得到氯化亚铁溶液,选项正确;C、氢氧化钙与盐酸反应生成氯化钙和水,加入过量的氢氧化钙后会有部分氢氧化钙微溶于水,引入新杂质,选项错误;D、将混合气体通过足量灼热Cu粉,氧气与铜在加热的条件下反应生成氧化铜,氮气不与铜反应,选项正确,故选C。
【点睛】除杂的原则:1、除杂剂只能与杂质反应,不能与欲保留的物质反应;2、不能引入新杂质;3、最佳的除杂方法是除杂剂与杂质反应生成欲保留的物质。
9.下列实验操作能达到实验目的的是选项物质目的主要实验操作()A.A B.B C.C D.D【答案】A【解析】【分析】【详解】A.蔗糖中滴加浓硫酸会变黑,并有刺激性气味,食盐滴加浓硫酸无明显现象,故用浓硫酸可以鉴别蔗糖和食盐,故A正确;B.Na2CO3和Na2SO4滴加BaCl2溶液,都会产生白色沉淀,故无法检验Na2CO3中含有Na2SO4,故B错误;C.CO和H2都能与灼热的氧化铜反应,故不能用灼热的氧化铜除掉CO中的H2,故C错误;D.NaCl和MgCl2溶液中加入过量NaOH溶液,所得固体为氢氧化镁,加入适量稀硫酸会生成硫酸镁,不能得到氯化镁,故D错误。
答案选A。
10.除去下列物质中的少量杂质(括号内为杂质),所选用试剂及操作方法均正确的是A.A B.B C.C D.D【答案】D【解析】【分析】除杂质至少要满足两个条件:①一般加入的试剂只能与杂质反应,不能与原物质反应;②反应后不能引入新的杂质。
【详解】A、生石灰能与水反应生成氢氧化钙,但生成的氢氧化钙能与二氧化碳反应生成碳酸钙和水,不但能把杂质除去,也会把原物质除去,不符合除杂原则,故选项错误;B、氢气、CO均能与灼热的氧化铜反应,不但能把杂质除去,也会把原物质除去,不符合除杂原则,故选项错误;C、NaOH能与硫酸反应生成硫酸钠和水,能除去杂质但引入了新的杂质硫酸钠,不符合除杂原则,故选项错误;D、KNO3和NaCl的溶解度受温度的影响不同,硝酸钾溶解度受温度影响较大,而氯化钠受温度影响较小,所以可采取加热水溶解配成饱和溶液、冷却热饱和溶液使KNO3先结晶出来、再过滤、烘干的方法,故选项正确。
故选D。
11.除去下列物质中的杂质,所选试剂及操作均正确的是A.A B.B C.C D.D【答案】A【解析】【分析】【详解】A、CuO 固体在氧气流中不反应,而碳粉可以与氧气充分反应生成CO2,达到除杂的目的,故A选项正确。
B、KOH与BaCO3不发生反应,因此加适量的BaCO3不能除去K2CO3溶液中的KOH,故B选项错误;C、HCl与CO2都可以与氢氧化钠溶液发生反应,因此通入足量的NaOH溶液不仅会消耗掉HCl,也会消耗掉CO2气体,故C选项错误;D、稀硫酸能与Na2CO3发生反应,但是会引进新杂质:硫酸钠,故D选项错误。
故本题选A。
【点睛】除杂应遵循:一不增(提纯过程中不增加新的杂质);二不减(不减少欲被提纯的物质);三易分离(被提纯物与杂质容易分离);四易复原(被提纯物质要复原)。
12.去下列各物质中混有的少量杂质,所用试剂及操作方法均正确的是()A.A B.B C.C D.D【答案】A【解析】【分析】【详解】A、硝酸银和氯化钠反应生成氯化银沉淀和硝酸钠,过滤得到硝酸钠溶液,该选项正确;B、碳酸钠和氯化钡反应生成碳酸钡沉淀和氯化钠,除去碳酸钠后引入氯化钡(过量)新杂质,该选项不正确;C、高温条件下铜和氧气反应生成氧化铜,该选项不正确;D、氧化钙和盐酸反应生成氯化钙和水,过量的氧化钙和水反应生成氢氧化钙,除去盐酸后引入新杂质氢氧化钙,该选项不正确。
故选:A。
二、中考初中化学计算题13.将Na2CO3和NaCl固体混合物32.9g放入烧杯中,此时总质量为202.9g,加入326.9g 盐酸,恰好完全反应,待没有气泡逸出后再次称量,总质量为521.0g.计算所得溶液中溶质的质量分数______(CO2的溶解忽略不计).【答案】10【解析】【分析】首先根据质量守恒定律:化学反应前后,物质的质量不变,可先求出产生的气体二氧化碳的质量=202.9g+326.9g-521.0g=8.8g,再根据化学反应方程式:Na2CO3+2HCl=2NaCl+H2O+CO2↑可知,反应后所得溶液中溶质是NaCl,但NaCl来自两部分,一是反应生成的,二是原固体混合物中含有的,生成的NaCl可通过化学方程式来求解,原固体混合物中含有的NaCl可通过混合物32.9g减去Na2CO3的质量【详解】解:根据质量守恒定律,反应生成的CO2质量=202.9g+326.9g-521.0g=8.8g设Na2CO3的质量为x,生成的NaCl的质量为y。