广东省河源中国教育学会中英文实验学校中考化学第三节溶液讲学稿1【精品教案】
- 格式:doc
- 大小:76.01 KB
- 文档页数:2
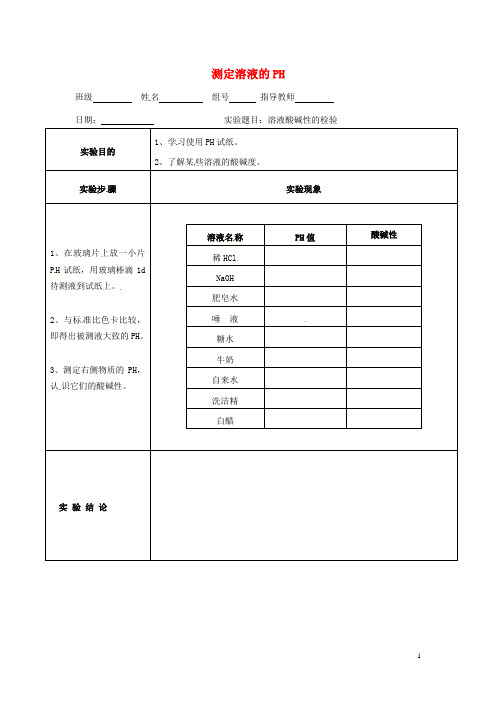
测定溶液的PH班级姓名组号指导教师日期:实验题目:溶液酸碱性的检验、学习使用、了解某些溶液的酸碱度。
骤待测液到试纸上。
、与标溶液名HCl河源中英文实验学校两段五环讲学稿(八数上)执笔审核教研组长授课时间:第18周班级八()班姓名课题:7.5三角形内角和定理(第一课时)第一段:【晚修自研课导学】3-4人小组长,组织学生,利用晚自习独立、安静完成。
一、【温故知新】请你先看课本p172至p177,然后解答下列问题。
会证明三角形内角和定理,并能利用三角形内角和定理解决简单的问题。
二、定向导学、合作交流、教师精讲一起组成一个平、4【教学后记】模块五:当堂训练 班级:八( )班 姓名: 检测内容:7.5三角形内角和定理(第一课时) ◆一、基础题1、在△ABC 中,已知∠A =67° ,∠C =38°,则∠B = 。
2、已知一个三角形三个内角度数的比是2∶3∶4,则其最大内角的度数为 。
3、在一个三角形中,最多有______个钝角,至少有______个锐角。
4、下列叙述正确的是( )A.钝角三角形的内角和大于锐角三角形的内角和;B.三角形中至少有两个锐角;C.三角形两个内角的和一定大于第三个内角;D.三角形中至少有一个锐角。
◆二、发展题5、在△ABC 中,∠A-∠B=35°,∠C=55°,则∠B 等于( ) A.50° B.55° C.45° D.40°6、关于三角形内角的叙述错误的是( )A.三角形三个内角的和是180°;B.三角形两个内角的和一定大于60°C.三角形中至少有一个角不小于60°;D.一个三角形中最大的角所对的边最长 7、如图,在正方形ABCD 中,已知∠AEF=30°,∠BCF=28°,求∠EFC 的度数。
EFDCB A◆三、提高题8、如图,一块梯形玻璃的下底及两腰的一部分被摔碎,量得∠A=120•°,•∠D=105°,你能否求出两腰的夹角∠P 的度数.PDCB A 9、请你利用“三角形内角和定理”证明“四边形的内角和等于360°”。



初中化学溶液教案试讲
目标:让学生了解溶液的定义、特点和分类,掌握溶解过程中的影响因素和常见溶液的性质。
一、概念引入
1. 引导学生回顾化学中的溶解现象,让他们想一想日常生活中常见的溶解现象。
2. 提出问题:你知道什么是溶液吗?
二、概念讲解
1. 溶液的定义:将溶质溶解在溶剂中所形成的 homogeneous mixture。
2. 溶液的特点:可见无色、均匀透明、不会因离心沉淀。
3. 溶液的分类:根据不同溶质和溶剂的组合,可分为气体溶液、液体溶液和固体溶液。
三、实验演示
1. 展示实验装置和所需物质:砂糖、水、试管、烧杯。
2. 操作步骤:将砂糖加入水中搅拌直至完全溶解。
3. 观察结果:砂糖完全溶解在水中,形成无色透明的液体。
四、讨论与思考
1. 讨论影响溶解速率的因素:温度、溶质颗粒大小、搅拌程度等。
2. 思考为什么在溶解过程中需要搅拌?
五、案例分析
1. 给出常见的溶液实例:盐水、酒精等。
2. 分析这些溶液的特点和应用。
六、小结与作业
1. 总结本节课所学内容:溶液的定义、特点和分类。
2. 布置作业:写一篇关于溶液的应用实例的小作文。
通过本课的学习,希望学生能够对溶液有一个全面的了解,掌握溶解过程中的基本知识和实验操作技巧。
同时,引导学生将化学知识与日常生活结合起来,更好地理解化学的真实意义。

学习目标:1、认识水的组成2、知道单质、化合物的区别及氧化物的含义3、了解并体验人类认识水的组成的过程和方法模块一:温故知新(独立进行)学习内容摘记1.水的净化方法有、、、,其中是净化程度最高的。
2.水是由构成的物质。
(填“分子”或“原子”),硬水与软水的一般用来区分。
3.生成其他物质的变化是。
4.混合物:。
例如等。
组成混合物的各种成分。
混合物没有化学符号。
纯净物:。
例如等。
纯净物有专门化学符号。
因此纯净物和混合物判断的依据是看哪一方面:模块二:自主学习(独立进行)学习内容摘记【自主探究一】氢气的性质氢气是一种无色、无味、溶于水、密度非常的气体。
在空气中燃烧时产生火焰。
由于点燃混有一定量空气或氧气的氢气时会发生爆炸,因此点燃氢气前一定要。
【自主探究二】水的组成(1)实验现象:通电后,电极上有产生。
通电一段时间后,两个试管里汇集了一些气体,与正极相连的试管内的气体体积小,是;与负极相连的试管内气体的体积大,是,体积比约为。
(2)结论:水是由组成的。
【自主探究三】单质和化合物⑴由组成的纯净物叫做单质。
如氧气(O2)、氢气(H2)、铁(Fe)、碳(C)等。
⑵由组成的纯净物叫做化合物。
如二氧化碳(CO2)、水(H2O)、高锰酸钾(KMnO4)等。
⑶由种元素组成的化合物中,其中一种元素是元素,这种化合物又叫氧化物。
如二氧化碳(CO2)、水(H2O)负氢正氧,氢二氧一谐音“父亲正痒”三人小组互评:(★五星评定)河源中英文学校两段五环日清卷 班级:九( ) 姓名: 检测内容:§课题3 水的组成 基础题: 1.通过对水这一节的学习,你认为其中错误的是( )A.水电解是分解反应B. 水在电解后产生了新物质,但没有产生新元素C.水是一种氧化物D.当电器着火,可以直接用水扑灭模块三:合作交流 (小组合作、 展示)研讨内容摘 记各小组根据要求交流研讨完成【合作探究】。
【合作探究一】氢气的性质1.根据氢气的物理性质推测实验室制取氢气时可采取的收集方法有哪些?2.在“电解水”的实验中,根据氢气的检验方法推测氢气有哪些化学性质?3.氢气具有可燃性,那么能不能随便点燃氢气呢,为什么?因此在点燃氢气前应该进行怎样的操作?【合作探究二】物质的分类结合前面所学内容试着对物质进行简单分类,并将分类结果填写如下:例:有下列物质:⑴水、⑵食盐水、⑶高锰酸钾、⑷河水、⑸氢气、⑹二氧化锰、⑺氧气、⑻氯酸钾、⑼铁、⑽二氧化硫、⑾空气。

模块一:自主学习(独立进行)学习目标与要求:详读书本初步认识初中化学中的常见仪器和操作方法学法指导(含时间安排)学习内容精讲点拨详读书本P18-23,完成右边的学习内容并小组内核对答案预时:30分钟一、会认初中化学常用仪器,详见讲学稿附后的练习:二、药品的取用:1.实验室药品取用规则(熟悉化学实验室药品的一些图标,见第18页图1-23)阅读P152药品取用规则:实验室里所用的药品,很多是____、____、____或____的。
因此,在使用时一定要严格遵照有关规定和操作规程,保证安全。
为此,要注意以下几点:(1)取用药品要做到“三不原则”:①不能用手____药品②不要把鼻孔______去闻药品(特别是气体)的气味。
(正确的方法如右图)③不得____任何药品的味道。
(2)注意节约药品。
应该严格按照实验______取用药品。
如果没有说明用量,液体取用_________,固体只需________。
(3)用剩药品要做到“三不一要”:①实验剩余的药品既不能______;②也不能随意______;③更不能_________;④要放入_________。
(4)实验中要注意保护眼睛。
2.固体药品的取用方法(1)使用仪器:药匙或镊子取用粉末状或颗粒状固体药品一般用____。
药匙的两端为大小两匙,取药品量__时用大匙,__时用小匙。
块状的药品(如石灰石等)可用____夹取。
(2)方法:①粉末状固体:“一斜二送三直立”.往试管里装入固体粉末时,为避免药品沾在____和____上,先使试管____,把盛有药品的药匙(或用小纸条折叠成的纸槽)小心地送入______,然后使试管____起来,让药品全部落到____。
②块状固体和密度较大的金属颗粒:“一横二放三慢竖”.把块状的药品或密度较大的金属颗粒放入玻璃容器时,应该先把容器____,把药品或金属颗粒放入____以后,再把容器________起来,使药品或金属颗粒缓缓地滑到容器的____,以免______。
课题第一节物质的变化及反应类型
学习目标:
1.化学变化、物理变化、化学性质、物理性质的判定;
2.常见的化学反应基本类型;
3、能运用金属活动性顺序表对有关的置换反应进行简单的判定。
模块一:自主学习
学习内容摘记
一、物质的变化和性质
1、概念:化学变化;物理变化。
化学性质;物理性质。
2、判定:化学变化与物理变化:。
化学性质与物理性质:;
常见的物理性质:颜色、状态、气味、熔点、沸点、硬度、密度、溶解性、挥发性、导电性;
二、化学变化的基本反应类型
用字母(如A、B、C、D)组合简单明了的表示常见的基本反应类型:
化合反应:;分解反应:;
置换反应:;复分解反应:;
注意:1、氧化反应、还原反应、中和反应不属于基本反应类型;
2、各反应的特点:化合反应----多变一;分解反应----一变多;
置换反应----一换一;复分解反应-----二换二;
三、金属的活动性
1、默写出常见金属在溶液中的活动性顺序
2、写出金属活动顺序表的一些判断依据:
A、;
B、;
C、;
四、完成中考总复习知识梳理与考点解读第80页至82页的
模块二:交流研讨
模块三:巩固内化
模块四:当堂训练
中考总复习83页---85页基础过关选择题第1至23题;。
广东省河源市中英文实验学校九年级化学下册《身边的化学物质》讲学稿新人教版模块一:自主学习(独立进行)学习目标与要求:全面回顾:1、氧气和二氧化碳的制取和性质 2、水的净化和保护及硬水和软水的区别。
3、溶液的组成、溶解度及有关溶质质量分数的计算。
学习内容随堂笔记①学生大声齐读学习目标与要求(用时1分钟)。
②认真阅读化学参考资料1页至17页的考纲解读。
一、独立完成基础过关指定题目:(用时19分钟)。
1、第1页:4题2、第2页:三、氧气的性质和用途和四、氧气的实验室制法3、第7页:2题电解水的实验、4题(2)、4题(3)、5题(2)、5题(3)4、第12页:1题、2题、3题(2)、5题、7题、8题、10题小组长检查、纠正小组内自学成果,用红笔互相给出等级评定。
评星模块二:交流研讨(小组合作、展示、精讲)学习目标与要求:通过习题重点掌握氧气的制取、性质、用途等研讨内容随堂笔记三人小组重点讨论,然后精讲(用时20分钟)一、先相互订正模块一中所完成的题目,然后再针对有问题的题目进行相互讨论。
二、中考真题演练精讲。
(1)写出仪器的名称:E 、F 。
(2)图A的实验室制氧气装置有两处错误,请改正错误;。
(3)装置A中反应的化学方程式为;把H与B组合,操作弹簧夹可以使反应停止或发生,还可以从“C至H”中选择仪器(填序号)组装一个可随时使反应发生或停止的装置;若用H2O2和O2,且能获得平稳的气流,应选E(或F)和组合。
(4)若用图I所示医用塑料袋排空气法收集H2,则H2导入端为(填“a”或“b”).(5)用图J所示矿泉水瓶可以证明CO2与NaOH溶液确实发生了反应,其现象是应作的对比试验是.模块三:练习训练(独立完成与合作交流相结合)学习目标与要求:巩固知识,运用知识训练内容随堂笔记先独立完成化学参考资料的中考热点部分1页至17页,然后相互订正答案。
(用时20分钟)【教学反思】日日清身边的化学物质(1—3):化学参考资料技能突破部分。
化学式与化合价第一段:【自研课导学】6-8人小组长组织学生,独立、安静完成。
一、复习化学式及化学式中数字的意义1、正确书写下列化合物的化学式五氧化二磷:二氧化硫:2、说出下列化学式中数字"2"表示的意义2CO:N2:二、预习书本87页,独立完成下面的内容。
1.相对分子质量(M r)是指:化学式中的总和。
2.先看例题再根据各物质的化学式,进行简单的计算:计算时可能用到的相对原子质量有: C-12 H-1 O-16 N-14 S-32元素种数每个分子所含原子总数各元素的原子个数比相对分子质量各元素的质量比带点元素的质量分数/%例:H2O. 2 3 2:1 18 1:8 88.9% C.H4K2MnO.4C2H.5OH.CO(N.H2)2注意:1、计算相对分子质量①相对分子质量:化学式中各原子的相对原子质量之和(相对原子质量可查表或考试时会写出来供参考)②元素符号之间用“+”号,元素符号与数字之间用“×”号2、计算物质组成某元素的质量某元素的质量=某元素原子的相对原子质量×化学式中相应的原子个数3、原子个数比和元素质量比都按化学式中各元素的顺序进行计算,且要化为最简单比,质量分数精确到0.1%第二段:【长课导学】一、学习目标与要求:1、会求:①元素的种类;②元素的质量比;③原子的个数;④原子的个数比;⑤化学式的相对分子质量。
⑥某元素的质量分数。
2、能根据化合物中某元素的质量分数求一定量化合物中某元素的质量。
二、定向导学、合作交流、教师精讲定向导学、合作交流、教师精讲【小组研讨内容】1、钙是人体生长发育、维持器官正常功能不可缺少的微量元素,青少年缺钙会得佝偻病,缺钙患者可在医生指导下通过服用葡萄糖酸钙保健食品来补钙。
已知葡萄糖酸钙的化学式为C12H22O14Ca,试求:(1)现有一支20ml的上述口服液,其中含葡萄糖酸钙43mg,则该口服液中钙的质量为多少毫克?(2) 现有一支20ml的上述口服液,其中含钙8mg,则该口服液中葡萄糖酸钙的质量为多少毫克?2.264kg硫酸铵和多少千克硝酸铵(NH4NO3)含氮量相等?(写出计算过程)【教师精讲】计算一定量化合物中某元素的质量公式的应用及其转换化合物中某元素质量=化合物的质量×化合物中该元素的质量分数三、当堂训练班级:姓名:可能用到的相对原子质量:C-12 H-1 0-16 N-14 S-32Ca-40基础题:1、已知丙烯胺的化学式为C3H5ON求:(1)丙烯胺的相对分子质量:。