九年级化学金刚石和石墨1
- 格式:ppt
- 大小:2.36 MB
- 文档页数:32


一克金刚石和一克石墨所含原子数在自然界中,金刚石和石墨是两种极具对比的物质。
它们的差异不仅体现在物理性质上,更体现在其原子结构上。
而要深入了解这一差异,首先需要了解一克金刚石和一克石墨所含原子数的差异。
1. 金刚石的原子结构金刚石是一种由碳原子组成的晶体结构,每个碳原子通过共价键与其他四个碳原子相连,形成了由无数碳原子组成的立方晶系结构。
据统计,一克金刚石所含原子数约为1.2 x 10^24。
这一巨大的原子数使金刚石具有极高的硬度和优异的导热性,成为珠宝和工业材料的首要选择。
2. 石墨的原子结构与金刚石不同,石墨同样由碳原子构成,但其原子结构却迥然不同。
石墨中的碳原子呈现层状排列,每个碳原子通过共价键与其他三个碳原子相连,形成了类似于石墨烯的结构,使其呈现出了优异的导电性和润滑性。
据统计,一克石墨所含原子数约为6.022 x 10^23。
3. 对比分析从上述的原子数数据可以看出,一克金刚石所含原子数约为1.2 x10^24,而一克石墨所含原子数约为6.022 x 10^23。
可以清晰地看出,金刚石的原子数要远远多于石墨的原子数。
这一差异不仅反映了两者在物理性质上的差异,更体现了两者在化学成分和原子结构上的差异。
4. 个人观点对于这一差异,我个人认为,金刚石和石墨之间的原子数差异凸显了它们之间的绝对性和相对性。
金刚石因其巨大的原子数而呈现出极高的硬度和热导性,成为了珠宝和工业领域中不可或缺的材料,而石墨则因其相对较少的原子数而表现出优异的导电性和润滑性。
这种绝对性与相对性的差异在化学与物理学的研究中屡见不鲜,正是这种对比与差异让我们更加全面、深刻地理解了物质的本质和特性。
总结回顾通过以上的分析,我们不仅了解了一克金刚石和一克石墨所含原子数的差异,更深入地理解了金刚石和石墨在原子结构上的差异带来的物理性质差异。
这种深入的了解不仅能帮助我们更好地认识物质,更能拓展我们对化学与物理学的认识,使我们能够更全面、深刻、灵活地理解相关的知识和现象。

九年级化学《金刚石和石墨》教案人教新课标版第一章:课程导入教学目标:1. 引起学生对金刚石和石墨的兴趣。
2. 引导学生思考金刚石和石墨之间的关系。
教学内容:1. 通过图片和实物展示,让学生初步了解金刚石和石墨的外观特征。
2. 引导学生思考金刚石和石墨的用途和价值。
教学活动:1. 展示金刚石和石墨的实物和图片,让学生观察和描述它们的外观特征。
2. 提问学生:你们认为金刚石和石墨之间有什么关系?它们有什么相同点和不同点?3. 引导学生思考金刚石和石墨的用途和价值,例如金刚石的切割、磨削用途,石墨的导电、润滑用途等。
第二章:金刚石的结构和性质教学目标:1. 让学生了解金刚石的结构特点。
2. 让学生掌握金刚石的主要性质。
教学内容:1. 金刚石的结构特点:碳原子通过共价键形成六边形的晶体结构。
2. 金刚石的主要性质:硬度大、熔点高、不导电、透明度高。
教学活动:1. 通过图片和模型展示,让学生了解金刚石的结构特点。
2. 讲解金刚石的主要性质,并通过实验或实物展示来加深学生的理解。
3. 进行小组讨论,让学生比较金刚石和其他物质的性质差异。
第三章:石墨的结构和性质教学目标:1. 让学生了解石墨的结构特点。
2. 让学生掌握石墨的主要性质。
教学内容:1. 石墨的结构特点:碳原子通过共价键形成六边形的层状结构。
2. 石墨的主要性质:硬度小、熔点高、导电性好、透明度低。
教学活动:1. 通过图片和模型展示,让学生了解石墨的结构特点。
2. 讲解石墨的主要性质,并通过实验或实物展示来加深学生的理解。
3. 进行小组讨论,让学生比较石墨和其他物质的性质差异。
第四章:金刚石和石墨的用途和价值教学目标:1. 让学生了解金刚石和石墨的用途和价值。
教学内容:1. 金刚石的用途和价值:切割、磨削、钻孔等。
2. 石墨的用途和价值:导电、润滑、高温材料等。
教学活动:1. 展示金刚石和石墨的实物和图片,让学生了解它们的用途和价值。
2. 讲解金刚石和石墨在不同领域的应用,例如工业、电子、航空等。



课题1 金刚石、石墨和C60知识导航课前引入“钻石恒久远,一颗永流传”。
钻石对得起它昂贵的价格吗?知识精讲金刚石、石墨和C60等都是由碳元素组成的不同单质。
由于碳原子的排列方式不同,即结构不同,导致它们的性质尤其是物理性质有很大差异。
一、金刚石1.外观:无色透明、正八面体状晶体(网状结构)2. 光泽:加工后璀璨夺目3. 硬度:天然存在的最硬的物质4. 导电性:不导电5. 导热性:良好6. 用途:装饰品——钻石;切割玻璃、大理石、做钻探机的钻头等。
二、石墨1.外观:深灰色、细鳞片状固体(层状结构)2. 光泽:有金属光泽3. 硬度:质地软,有滑腻感4. 导电性:良好5. 导热性:良好6. 用途:电极、铅笔芯、润滑剂等三、C601. 每个C60分子是由60个碳原子构成的。
2. C60分子形似足球,这种足球结构的C60分子(又叫足球烯)很稳定。
3. C60的独特结构决定了它具有一些特殊的物理和化学性质,有可能广泛应用于超导、催化、材料、医学及生物等领域。
总结归纳加工后璀璨夺目有金属光泽四、其他碳单质1. 木炭、焦炭、活性炭、炭黑等均是无定形碳,主要是由石墨的微小晶体和少量杂质构成的。
2. 活性炭、木炭具有疏松多孔的结构,可以吸附异味、色素等,具有吸附作用。
3. 焦炭常用于冶炼金属,炭黑用于制造黑色染料、油墨等。
4. 一些新形态的碳单质相继被发现,如碳纳米管、石墨烯等。
注意(1)只含一种元素的物质不一定是单质,也可能是几种单质组成的混合物。
(2)“碳”是元素名称,在书写含碳元素的物质的名称时使用,如二氧化碳;而“炭”表示物质,如“活性炭”。
对点训练题型一:同种元素组成的单质【例1】由同种元素组成的不同单质,可以互为“同素异形体”。
下列属于同素异形体的一组物质是A.氢气与液氢B.水银与银C.干冰与冰D.氧气与臭氧【答案】D【分析】由同种元素组成的不同单质,可以互为“同素异形体”,这里包含两个条件:一是不同的单质;二是由同一种元素组成,即组成元素相同。
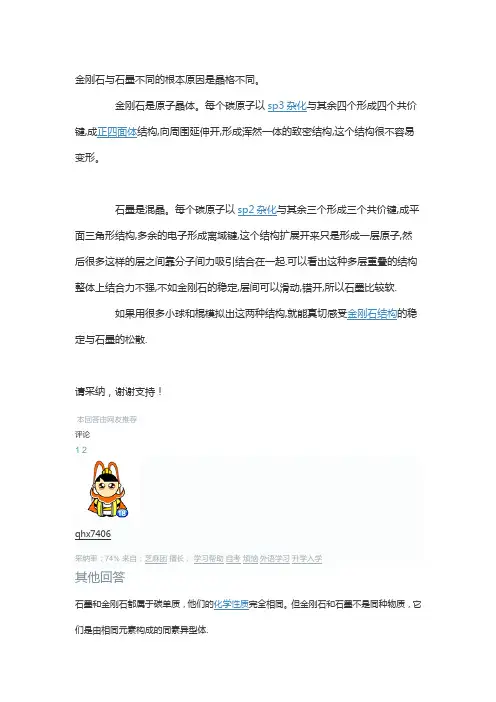
金刚石与石墨不同的根本原因是晶格不同。
金刚石是原子晶体。
每个碳原子以sp3杂化与其余四个形成四个共价键,成正四面体结构,向周围延伸开,形成浑然一体的致密结构,这个结构很不容易变形。
石墨是混晶。
每个碳原子以sp2杂化与其余三个形成三个共价键,成平面三角形结构,多余的电子形成离域键,这个结构扩展开来只是形成一层原子,然后很多这样的层之间靠分子间力吸引结合在一起.可以看出这种多层重叠的结构整体上结合力不强,不如金刚石的稳定,层间可以滑动,错开,所以石墨比较软.
如果用很多小球和棍模拟出这两种结构,就能真切感受金刚石结构的稳定与石墨的松散.
请采纳,谢谢支持!
本回答由网友推荐
评论
12
qhx7406
采纳率:74% 来自:芝麻团擅长:学习帮助自考烦恼外语学习升学入学
其他回答
石墨和金刚石都属于碳单质,他们的化学性质完全相同。
但金刚石和石墨不是同种物质,它们是由相同元素构成的同素异型体.。

课题1 金刚石、石墨和C60第1课时碳的单质教学目标【知识与技能】1.了解金刚石和石墨的物理性质及主要用途。
2.知道木炭和活性炭具有吸附性。
3.知道不同元素可以组成不同的物质,同一种元素也可以组成不同的物质。
【过程与方法】1.通过对金刚石、石墨和C60中碳原子排列方式及空间结构的分析,知道物质的结构、性质和用途之间的相互关系。
2.通过木炭(或活性炭)吸附作用演示实验的探究,让学生知道对比实验是研究问题的常用方法。
【情感·态度·价值观】通过对碳的不同单质具有不同用途的探究,树立物质的性质决定其用途的观点。
教学重难点【教学重点】金刚石、石墨和C60中碳原子排列方式的分析。
【教学难点】金刚石、石墨和C60的物理性质存在差异的原因。
教学过程一、导入新课铅笔伴你从小到大,你一定不陌生。
你们也许还见过名贵的钻石,但你知道它们其实是“一家人”吗?化学世界就是这么神奇!二、推进新课1.金刚石[提出问题]通过前面的学习,我们知道不同的元素可以组成不同的物质,如氧气是由氧元素组成的,氢气是由氢元素组成的,那么,同种元素可以组成不同的物质吗?[归纳总结]同种元素可以组成不同的物质,如氧气和臭氧(O3)都是由氧元素组成的,红磷和白磷都是由磷元素组成的。
[过渡]金刚石、石墨和C60是庞大的碳家族成员,其均是由碳元素组成的单质。
[投影展示][归纳总结]纯净的金刚石是无色透明、正八面体形状的固体。
金刚石是天然存在的最硬的物质,故其可用来裁玻璃、切割大理石、加工坚硬的金属等。
2.石墨[过渡]金刚石对光有折射和散射作用,但同样由碳元素组成的石墨,和金刚石相比外表要暗淡许多。
阅读教材第107页石墨的相关内容,归纳出石墨的相关性质。
[归纳总结]石墨是一种深灰色的有金属光泽而不透明的细鳞片状固体,质软,有滑腻感。
[提出问题]生活中可能会接触到木炭、活性炭、焦炭、炭黑等物质,这些物质的主要成分也是碳单质,它们的结构与石墨类似,它们都具有哪些主要性质呢?[演示实验]实验6-1,在盛有半瓶水的小锥形瓶里,加入一滴红墨水,使水略显红色。

第六单元碳和碳的氧化物课题1 金刚石、石墨和C60知识点一碳的单质不同元素可以组成不同的单质,而同一种元素也可以组成不同的单质。
几种常见元素的不同单质如下表所示:常见元素碳元素氧元素磷元素形成的单质金刚石、石墨和C60氧气(O2)和臭氧(O3)白磷(P4)和红磷(P)一、金刚石、石墨、C60的性质及用途1、金刚石A、物理性质:无色透明、正八面体形状的固体,不导电,经加工琢磨后有夺目光泽,是天然存在最硬的物质。
B、用途:雕琢作装饰品(钻石就是金刚石雕琢成的);制作钻头;制作玻璃刀、刻刀。
2、石墨A、物理性质:深灰色、不透明的细鳞片状固体,有金属光泽,质软,滑腻,导电性好,耐高温。
B、用途:用于制铅笔芯(不同型号的铅笔芯,石墨含量不同,“B”值越大,石墨含量越高)、石墨电极、电刷、耐高温的润滑剂等。
3、C60C60分子由60个碳原子构成,形似足球,很稳定。
目前应用于材料科学、超导体等方面的研究。
理解辨析1、金刚石、石墨和C60都是由碳元素组成的,为什么物理性质差异这么大?原子之间的排列顺序不相同4、不定形碳—木炭、焦炭、活性炭和炭黑木炭主要是由石墨的微小晶体和少量杂质构成的,它具有疏松多孔的结构。
焦炭、活性炭、炭黑等的构成和结构与木炭类似,通常称为无定形碳。
由于木炭、活性炭的结构疏松,因此它们具有吸附性。
利用这种性质可以吸附气体或溶液中的一些物质,可用作吸附剂,如木炭用来吸附食品工业里的色素和有异味的物质;活性炭用在防毒面具中吸附毒气。
理解辨析1、吸附性是物理性质吗?吸附性是物质的物理性质,吸附过程是物理变化。
吸附剂与物质的接触面积越大,吸附能力越强。
2、“碳”与“炭”有什么区别吗?1.碳是表示碳元素,炭是主要成分为碳的一些物质,如活性炭、木炭等2.碳是用于对化学式的命名,而炭往往是对一些物质命名的俗称里。
例题1、金刚石、石墨、C60的性质不同解释正确的是( B )A.碳原子的结构不同B.碳原子的排列方式不同C.由不同种元素组成的D.组成的原子数不同例题2、小刚要检验妈妈的钻石戒指是真还是假,下列方法你认为正确简便的是( D)A.铁锤砸毁B.火烧C.测密度D. 刻画玻璃例题3(1)金刚石可作玻璃刀,因为_____金刚石硬度大________________________________。


九年级化学《金刚石和石墨》教案人教新课标版一、教学目标1. 让学生了解金刚石和石墨的结构和性质,理解它们之间的异同。
2. 培养学生的实验操作能力和观察能力,提高学生的科学思维能力。
3. 激发学生对化学知识的兴趣,培养学生的创新意识和实践能力。
二、教学重点1. 金刚石和石墨的结构和性质。
2. 实验操作能力和观察能力的培养。
三、教学难点1. 金刚石和石墨的结构和性质的理解。
2. 实验结果的分析和解释。
四、教学方法1. 采用问题驱动的教学方法,引导学生通过实验和观察来探究金刚石和石墨的性质。
2. 使用多媒体教学手段,展示金刚石和石墨的结构和性质的图像和视频。
3. 采用小组合作学习的方式,培养学生的团队合作能力和交流表达能力。
五、教学过程1. 引入新课:通过展示金刚石和石墨的实物或图像,引导学生思考金刚石和石墨的结构和性质。
2. 探究金刚石和石墨的结构:让学生通过观察金刚石和石墨的实物或图像,分析它们的结构特点。
3. 探究金刚石和石墨的性质:让学生通过实验或观察,了解金刚石和石墨的物理性质,如硬度、导电性等。
4. 分析实验结果:引导学生通过实验结果来解释金刚石和石墨的性质差异。
5. 总结:让学生通过总结金刚石和石墨的结构和性质,加深对它们之间异同的理解。
6. 作业布置:让学生通过练习题目或实验报告,巩固对金刚石和石墨的学习。
六、教学评估1. 课堂问答:通过提问学生对金刚石和石墨的结构和性质的理解,评估学生对知识点的掌握程度。
2. 实验操作:观察学生在实验过程中的操作是否规范,结果是否准确,评估学生的实验操作能力和观察能力。
3. 作业批改:通过批改学生的练习题目或实验报告,评估学生对金刚石和石墨知识点的掌握程度。
七、教学反思1. 反思教学内容:根据学生的学习情况和反馈,调整教学内容,确保知识点讲解清晰、准确。
2. 反思教学方法:根据学生的参与度和学习效果,调整教学方法,提高教学效果。
3. 反思教学评估:根据学生的评估结果,分析问题所在,调整教学策略,提高教学质量。
第六单元 碳和碳的氧化物(教用)课题1 金刚石、石墨和C 60一、知识必备 知识点1 单质碳的性质与用途1. 金刚石、石墨的物理性质和用途化学式 颜色 形状 硬度 导电性 导热性 润滑性 熔点 用途 金刚石C无色透明 正八面体 最硬无 无 无 高 划玻璃、切割金属、钻探机钻头、制装饰品等 石墨 深灰色、有金属光泽、不透明 细鳞片状 最软之一 优良 良好 良好 电极、铅笔芯、润滑剂等 注:金刚石是天然存在的最硬的物质;在一定条件下,将石墨转化为金刚石的变化是化学变化。
2. 木炭、活性炭、焦炭和炭黑的性质与用途颜色、状态 制法 用途 木炭灰黑色的多孔性固体 木材隔绝空气加强热 燃料、黑火药、制活性炭、冶炼金属 活性炭 灰黑色多孔颗粒状固体 木炭在高温下用水蒸气处理净化多种气体和液体、作防毒面具 焦炭浅灰色多孔性固体 烟煤隔绝空气加强热 冶炼金属 炭黑 极细的黑色粉末 含碳物质不完全燃烧 墨、油墨、油漆、鞋油、燃料等,作橡胶制品的填料 注:木炭、活性炭具有吸附性(物理性质),活性炭的吸附性更强。
3. C 60:C 60分子是一种由60个碳原子构成的分子,它形似足球,这种足球结构的碳分子很稳定。
4. 金刚石、石墨、C 60性质不同的原因:碳原子的排列方式不同。
知识点2 碳的化学性质1. 稳定性:在常温下,碳的化学性质不活泼。
2. 可燃性:C+O 2CO 2(充分燃烧) 2C+O 22CO (不充分燃烧)碳在氧气中燃烧的现象:燃烧剧烈,发出白光;放热;生成能使澄清石灰水变浑浊的气体。
3. 还原性:C+2CuO 2Cu+CO 2↑ 2Fe 2O 3+3C 4Fe+3CO 2↑ 单质碳的还原性可用于冶金工业。
4. 木炭还原氧化铜的实验(见右图)【实验操作】① 把刚烘干的木炭粉末和氧化铜粉末混合均匀,小心地铺放进试管;② 将试管固定在铁架台上。
试管口装有通入澄清石灰水的导管;③ 集中加热;④ 过几分钟后,先撤出导气管,待试管冷却后再把试管里的粉末倒在纸上。