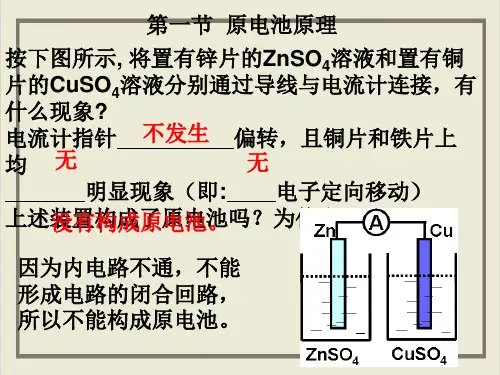
活动性较弱的金属或能导电的非金属作 正 极),并插入
电解质 溶液中,形成 闭合 回路。
二、原电池的设计
1.能设计为原电池的反应必须是自发进行的氧化还原反应。
2.用 还原性较强 的物质作负极反应物,向外电路提供电子;
用 氧化性较强 的物质作正极反应物,从外电路得到电子。
3.原电池输出电能的能力,取决于组成原电池的反应物的
目标素养
1.以锌铜原电池为例,了解原电池的工作原理及构成条件。
2.能正确判断原电池的正、负极并熟练书写电极反应式。
3.能列举常见的化学电源,并能利用相关的信息分析化学电源
的工作原理。
4.会书写常见化学电源的电极反应式。
5.能设计简单的原电池。
知识概览
一、原电池
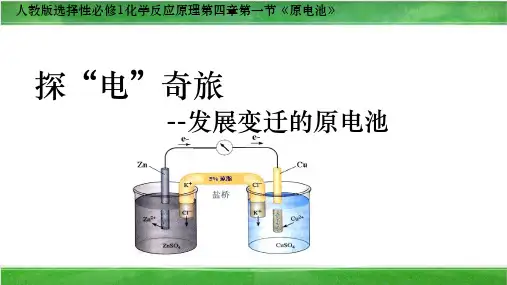
1.原电池的工作原理。
以锌铜原电池为例,盐桥中装有含
解析:该装置为原电池, a极上发生还原反应,b极上发生氧化
反应,电子由负极(b)流出经导线流向正极(a),该过程中能量由
化学能转化为电能、热能,其化学能转化成电能的转化率小
于100%。
2.Mg-AgCl电池是一种以海水为电解质溶液的水激活电池。
下列叙述错误的是(
)。
A.负极反应式为Mg-2e-══Mg2+
⑧ Cu2++2e-====Cu
⑨ 氧化 反应
⑩ 还原 反应
⑪ Zn+Cu2+ ====Zn2++Cu
K+移向⑫ CuSO4 溶液(⑬ 正 极区),Cl-移
向⑭ ZnSO4 溶液(⑮ 负 极区)
2.原电池工作的一般条件。
(1)有能自发进行的 氧化还原 反应。
(2)有两个活动性不同的电极(通常活动性较强的金属作 负 极,